Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 4, стр. 272-281
КРЫСА (Rattus norvegicus) КАК ОБЪЕКТ ИССЛЕДОВАНИЯ В МОДЕЛИ ОСТРОГО ОТРАВЛЕНИЯ ФОСФОРОРГАНИЧЕСКИМИ СОЕДИНЕНИЯМИ. 5. МОРФОФУНКЦИОНАЛЬНЫЕ ИЗМЕНЕНИЯ ПОЧЕК
В. Е. Соболев 1, 2, Е. А. Корф 2, Н. В. Гончаров 1, 2, *
1 ФГУП “НИИ гигиены, профпатологии и экологии человека” ФМБА России
188663 Ленинградская обл., г.п. Кузьмоловский, ст. Капитолово, корп. 93, Россия
2 ФГБУН Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, проспект Тореза 44, Россия
* E-mail: ngoncharov@gmail.com
Поступила в редакцию 31.07.2018
После доработки 01.02.2019
Принята к публикации 15.03.2019
Аннотация
В двух моделях острого отравления крыс параоксоном (РОХ) на фоне специфического и неспецифического подавления активности карбоксилэстеразы (КЭ) плазмы крови проведена оценка влияния РОХ на морфологию и функции почек крыс на протяжении от 1 сут до 6 нед после отравления. В течение первых 3 сут после отравления у крыс развивается транзиторная гликозурия, повышение экскреции с мочой кальбиндина и сульфатированных гликозаминогликанов. При неспецифическом подавлении активности КЭ через сутки после отравления наблюдается положительная реакция на белковые депозиты (AFOG+) в нисходящем и восходящем отделах петли Генле и собирательных трубочках. Через 2 нед после отравления наблюдается AFOG+ реакция в прямых проксимальных канальцах и десквамация эпителиальных клеток. Морфометрические исследования отдельных элементов нефрона почек крыс свидетельствуют об увеличении размеров почечного тельца и сосудистого клубочка капсулы Боумена через 3 сут, а также в более отдаленный период, через 2 нед после отравления, вне зависимости от способа ингибирования активности КЭ. Через 3 сут после отравления и во все последующие сроки наблюдений у отравленных крыс выявлено изменение диаметра просвета проксимальных канальцев и площади просвета собирательных трубочек. Изменения диаметра просвета дистальных канальцев наблюдаются через 3 сут, 4 и 6 нед после отравления.
ВВЕДЕНИЕ
Эффекты холинергической стимуляции мочевого пузыря фосфорорганическими соединениями (ФОС), проявляющиеся недержанием мочи и поллакиурией, были выявлены еще в 1961 г. Однако данных о нефротоксических эффектах ФОС за прошедший период появилось немного. В частности, при изучении токсического действия ФОС на организм грызунов были выявлены изменения абсолютного и относительного веса почек [1–3]. В экспериментах по субхроническому пероральному применению метилпаратиона крысам в течение 8 недель было отмечено умеренное повышение уровня диуреза в течение первой недели интоксикации, который, однако, в последующий период существенно уменьшался [4]. Эти и некоторые другие данные не давали ответ на вопрос о том, в какой степени выявленные нарушения могут быть характерны для человеческого организма, т.к. в экспериментальных исследованиях токсического действия ФОС, проводимых на грызунах, как правило, не учитывается наличие в их крови большого количества карбоксилэстеразы (КЭ), которая стехиометрически связывает ФОС, существенно модулируя состояние интоксикации и развитие отставленной патологии. Кроме того, одним из методологических отличий многих исследований было субхроническое (на протяжении 28–35 дней) пероральное введение грызунам низкотоксичных фосфорорганических пестицидов: метилпаратиона, малатиона, диазинона и диметоата.
Нами предложены две токсикологические модели острого отравления крыс высокотоксичным ФОС параоксоном (этилпараоксон, РОХ) после предварительного подавления КЭ плазмы крови малой дозой РОХ (группа РОХ2х) и более специфическим ингибитором CBDP (группа СВРОХ), проведен сравнительный анализ широкого ряда биохимических, гистохимических и электрофизиологических показателей в динамике на сроках до 3 мес. после отравления [5–7]. В наших более ранних исследованиях последствий острого отравления крыс высокотоксичными ФОС – зоманом и веществом типа VX – были впервые выявлены биохимические признаки отставленного поражения почек: повышение концентрации креатинина и мочевины в крови через 4 и 6 нед после отравления [8]. Отличия тех экспериментов, помимо использования высокотоксичных ФОС, состояли в том, что предварительное ингибирование КЭ плазмы крови крыс было исключительно неспецифическим, за счет использования относительно малых доз самих ФОС. В последующих экспериментах с применением РОХ и двух вариантов ингибирования КЭ, специфического и неспецифического, о поражении почек также свидетельствовали биохимические данные: это повышенные уровни креатинина, мочевины и мочевой кислоты в плазме крови крыс [5], а также гликозаминогликанов (ГАГ) в моче и тканях мочевого пузыря [9]. Сроки, на которых выявлены патологические отклонения, по сравнению с высокотоксичными ФОС были более ранними, до 2 недель после острого отравления, причем в группе СВРОХ более выражены изменения креатинина и мочевины, тогда как в группе РОХ2х – мочевой кислоты. Кроме того, выявлено повышение уровня ионов кальция и неорганического фосфата, а также активности щелочной фосфатазы (ЩФ) в плазме крови крыс группы СВРОХ. Поскольку перечисленные показатели в той или иной степени отражают функциональное состояние почек, на основании полученных нами данных клинической биохимии можно предполагать, что поражение почек является неотъемлемой составляющей последствий холинергического криза при остром отравлении ФОС. При этом, однако, возникает вопрос о том, насколько специфичны выявленные изменения биохимических показателей и какие органические изменения в почках им соответствуют (или их сопровождают).
Цель настоящей работы – исследовать морфофункциональные особенности почек крыс двух экспериментальных групп (РОХ2х и СВРОХ) в динамике после острого отравления РОХ на фоне предварительного подавления активности КЭ плазмы крови крыс. Помимо решения сугубо прикладных токсикологических проблем, данное исследование могло бы внести вклад в решение проблем фундаментального характера, связанных с методологией проведения эксперимента вообще и доклинических испытаний фармпрепаратов в частности. Особое положение занимают проблемы экспериментальной биологии и трансляционной медицины, масштаб которых слишком хорошо известен, чтобы на нем останавливаться подробно, а суть решения которых состоит в разработке новых и адекватном использовании имеющихся экспериментальных моделей, с тем чтобы более эффективно “транслировать” полученные данные в область практической медицины, имеющей дело с человеком. Методологические наработки эволюционной биохимии и физиологии здесь весьма ценны: как известно, человек не есть большая крыса.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
В работе применяли следующие реактивы: параоксон (O,O-диэтил-O-(п-нитрофенил)фосфат, POX, Sigma); 2-(о-крезил)-4Н-1,3,2-бензодиоксафосфорин-2-оксид (2-(O-cresyl)-4H-1,3,2-benzodioxaphosphorin-2-oxide, или CBDP), синтезирован в НИИ гигиены, профпатологии и экологии человека ФМБА России; диметилсульфоксид (ДМСО) и пропиленгликоль фирмы Вектон (Россия), набор для мультиплексного определения маркеров повреждения почек MILLIPLEX® MAP Rat Kidney Injury (Calbindin, KIM-1, TIMP-1) производства Merck Millipore (США).
Исследования проводили на крысах-самцах Rattus norvegicus аутбредной линии Вистар массой 200–240 г. Токсикологическая модель подробно описана в первой публикации по результатам серии исследований [5]. В рамках данного исследования почек крысы были разделены на три группы: 1) группа контроля, или интактные животные; 2) группа РОХ2х, животным вводили РОХ двукратно с интервалом 1 час (дозы 0.45 + 0.6ЛД50); 3) группа CBPOX, животным вводили РОХ (0.6ЛД50) через час после CBDP (3.3 мг/кг). Наблюдения за животными продолжались в течение 6 нед после отравления. Через 1, 3 сут, 1, 2, 4 и 6 нед после отравления проводили выборочную эвтаназию животных в каждой группе и отбор материала для биохимического и гистологического исследования. Гепаринизированную кровь получали после декапитации и центрифугировали 4 мин при 3000 об/мин (1500 g). Полученную плазму хранили при –70°С до проведения измерений. После декапитации животных почки быстро извлекали, взвешивали, после чего с помощью скальпеля в сегментальной плоскости вырезали кусочки для гистологического исследования. Полученные образцы ткани почек немедленно замораживали в жидком азоте и хранили до этапа криотомии при температуре –80°С. В камере криостата (Slee MEV Medical©, Germany) заливали кусочки в 9% охлажденный до 0–2°С водный раствор сахарозы и готовили гистологические срезы почек толщиной 7 микрон при температуре –16°С.
Изменения абсолютной и относительной массы почек, а также ряда других показателей определяли на трех временных точках, которые были выбраны как наиболее характерные для выявления динамики этих показателей: 3 сут, 2 и 6 нед после отравления.
Относительную массу почек определяли по формуле:
где RKW – относительная масса почек (Relative Kidney Weight), WOK – масса почки (Weight Of Kidney), WOR – масса тела крыс (Weight Of Rat).Анализ мочи выполняли с помощью анализатора Combilyzer 13 (Human GmbH, Germany). Использовали полоски Human-test Combina 13. Удельный вес мочи дополнительно контролировали с помощью Digital Hydrometer SBS-3500 (SBS©, USA). Гликозаминогликаны (ГАГ) в моче крыс определяли согласно разработанному нами методу [9]. Креатинин в плазме крови и моче крыс определяли ферментативным методом, адаптированным для 96-луночного планшета, на микропланшетном спектрофотометре Epoch (Biotek©, США). Использовали коммерческий набор реактивов фирмы Randox© (Англия). Мочу перед определением предварительно разбавляли деионизированной водой в соотношении 1:49. Эндогенный клиренс креатинина (ЭКК) рассчитывали по формуле: ЭКК = = ([UCr] × V)–([PCr] × Т × m, где [UCr] = концентрация креатинина в моче, V – суточный объем мочи, [PCr] – средняя концентрация креатинина в плазме крови, Т – время сбора мочи, m – средняя масса тела крыс, г. ЭКК выражали в формате: мл/мин/100 г массы тела крысы.
Определение биомаркеров повреждения почек проводили с помощью системы мультиплексного анализа MagPix®, Merсk Millipore Corporation, США. Использовали программное обеспечение xPONENT 4.2 для построения калибровочных кривых и определения концентраций каждого аналита.
Морфология почек. Гистологические срезы почек окрашивали гематоксилин-эозином. Для идентификации белковых депозитов в отделах нефрона производили окрашивание срезов методом AFOG (Acid Fuchsin orange G kit, Bio-Optica©, Италия). Cрезы просматривали под микроскопом при режимах увеличения 103×; 247× и 413×. Использовали микроскоп Axiostar plus (Karl Zeiss©, ФРГ) с устройством захвата изображения и монитором с объективами A-plan 10×/0,25, A plan 20×/0,45 ph 2, A plan 40×/0,65. На срезах фотографировали области коры и мозгового вещества почек и далее с помощью цифровой программы видеоизображения (Videotest Size 5.0 Akond, Россия) проводили измерения отдельных элементов нефрона. Измеряли площадь почечного тельца (мкм2), площадь сосудистого клубочка (мкм2), диаметр просвета проксимальных канальцев (мкм), диаметр просвета дистальных канальцев (мкм), а также площадь просвета собирательных трубочек на поперечных срезах мозгового вещества почки (мкм2).
Статистический анализ. Данные обрабатывали с использованием программы GraphPad Prizm 5.0. Проверку на нормальность распределения проводили с использованием тестов Колмогорова-Смирнова и Шапиро–Уилка. Данные с нормальным распределением сравнивали в однофакторном тесте ANOVA с поправкой Бонферони, в других случаях применяли непараметрический тест Крускала–Уоллиса для множественных сравнений с использованием критерия Данна. Отличия считались статистически значимыми при p < 0.05. Данные представлены в виде среднего ± стандартное отклонение (SD).
РЕЗУЛЬТАТЫ
В ранние сроки после отравления наблюдалось снижение не только массы тела крыс, но также абсолютной массы почек, наиболее выраженные в группе CBPOX (таблица 1). В последующие сроки наблюдений достоверных отличий по этим показателям у животных сравниваемых групп не установлено, хотя в группе CBPOX они стабильно ниже по сравнению с контролем. По результатам измерения относительной массы почек статистически значимых отличий не выявлено.
Таблица 1.
Изменение массы тела и почек крыс в разные сроки после отравления (M±SD)
| Показатель | 3 сут | 2 нед | 6 нед | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Контроль | POX2x | CBPOX | Контроль | POX2x | CBPOX | Контроль | POX2x | CBPOX | |
| Масса крыс, г | 242 ± 5.4 | 224 ± 3.5 | 220 ± 3.8** | 344 ± 15.6 | 312 ± 16.9 | 294 ± 16 | 430 ± 15.6 | 430 ± 13.3 | 395 ± 26.6 |
| Масса почек, г | 1.95 ± 0.07 | 1.74 ± 0.04 | 1.69 ± 0.05** | 2.41 ± 0.13 | 2.4 ± 0.12 | 2.17 ± 0.11 | 2.81 ± 0.18 | 2.85 ± 0.09 | 2.45 ± 0.18 |
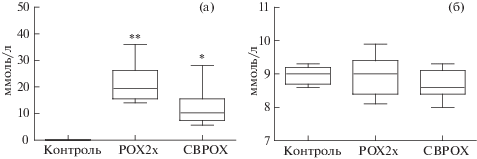
Изменения суточного объема выделяемой мочи, удельный вес и содержание сульфатированных ГАГ также оценивали на трех временных точках: 3 сут, 2 и 6 нед после отравления (табл. 2). У крыс группы СВРОХ объем выделяемой мочи и содержание в ней сульфатированных ГАГ увеличивается в ранние сроки, через 3 сут после отравления. У этих же животных через 6 нед после отравления наблюдается повышение уровня экскреции ГАГ в моче без изменения объема суточного диуреза. У крыс обеих экспериментальных групп через сутки после отравления наблюдается выраженная глюкозурия (рис. 1a), при этом содержание глюкозы в плазме крови животных сравниваемых групп не имеет значимых отличий (рис. 1б). Клиренс эндогенного креатинина, определенный по трем указанным выше трех временным точкам, межгрупповых отличий не имеет и варьирует в диапазоне 0.26–0.39 мл/мин/100 г массы тела.
Таблица 2.
Суточный объем мочи (V), удельная плотность мочи и содержание гликозаминогликанов (ГАГ) в моче крыс на разных сроках после отравления (M ± SD)
| Показатель | 3 сут | 2 нед | 6 нед | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Контроль | POX2x | CBPOX | Контроль | POX2x | CBPOX | Контроль | POX2x | CBPOX | |
| V, мл | 8.5 ± 1.2 | 9.6 ± 1.5 | 12.8 ± 1.5* | 18.0 ± 3.1 | 16.9 ± 2.6 | 16.7 ± 1.5 | 10.4 ± 1.6 | 13.6 ± 1.7 | 12.2 ± 2.3 |
| удельная плотность мочи | 1.017 | 1.019 | 1.016 | 1.014 | 1.016 | 1.014 | 1.018 | 1.018 | 1.014 |
| ГАГ в моче, мг/моль_креатинина | 6.1 ± 0.65 | 8.6 ± 1.8 | 8.3 ± 0.9* | 6.4 ± 0.7 | 6.1 ± 0.7 | 6.6 ± 0.6 | 4.6 ± 1.0 | 4.9 ± 0.5 | 7.6 ± 1.7* |
Рис. 1.
Уровень глюкозы (ммоль/л) через 24 ч после отравления: a) в моче крыс; б) в крови крыс. Различия по сравнению с контрольной группой статистически значимы: * – p ≤ 0.05; ** – p ≤ 0.01.
В таблице 3 представлены результаты содержания в моче крыс биомаркеров повреждения почек: кальбиндин, KIM-1 и TIMP-1. Результаты нормализованы по креатинину. Единственным статистически значимым отличием является повышение уровня экскреции с мочой кальбиндина у крыс группы CBPOX в ранние сроки (3 сут) после отравления. KIM-1 и TIMP-1, несмотря на значительную вариабельность их концентрации в моче отравленных животных, не демонстрируют достоверных отличий от показателей контрольной группы.
Таблица 3.
Биомаркеры повреждения почек в моче крыс в разные сроки после отравления, нг/моль_креатинина (M ± SD)
| Показатель | 3 сут | 2 нед | 6 нед | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Контроль | POX2x | CBPOX | Контроль | POX2x | CBPOX | Контроль | POX2x | CBPOX | |
| Кальбиндин | 4101 ± 333.6 | 6419 ± 1201 | 7383 ± 990.3* | 4569 ± 674.5 | 4633 ± 543.5 | 4784 ± 418.9 | 3699 ± 532.7 | 4303 ± 626.3 | 4891 ± 439.1 |
| KIM-1 | 21.85 ± 5.52 | 28.88 ± 6.02 | 24.06 ± 6.94 | 14.83 ± 1.19 | 14.23 ± 2.97 | 11.52 ± 2.33 | 14.05 ± 3.17 | 16.62 ± 2.48 | 12.81 ± 1.65 |
| TIMP-1 | 32755 ± 7830 | 13078 ± 9771 | 19174 ± 11596 | 26298 ± 10609 | 13076 ± 5111 | 13003 ± 4877 | 24603 ± 6055 | 17010 ± 4020 | 14857 ± 5258 |
Через 3 сут после отравления происходит увеличение площади почечного тельца и сосудистого клубочка у крыс группы CBPOX (рис. 2). Увеличение площади почечного тельца у животных группы POX2x наблюдается через 2 и 4 нед, тогда как увеличение площади сосудистого клубочка у животных этой группы выявлено через 3 сут и 2 нед после отравления. Следует отметить, что, несмотря на изменения этого показателя, мы не выявили патологических изменений почечного тельца и сосудистого клубочка на ранних сроках после отравления – через 1 и 3 сут. Однако через 2 нед после отравления в сосудистые клубочки крыс группы POX2x имеют больший диаметр по сравнению с показателями сравниваемых групп (рис. 3a–в). При этом отмечается отрицательная реакция при окраске методом AFOG (рис. 3г). Положительная реакция на депозиты белка у животных этой группы, сопровождающаяся десквамацией эпителиальных клеток, была установлена в прямых проксимальных канальцах (рис. 3д). В почках животных других групп подобные изменения не отмечаются (рис. 3д, е). Через 4 нед площадь почечного тельца увеличена у крыс группы POX2x (рис. 2a, б). Через 6 нед после отравления морфометрические показатели почечного тельца и сосудистого клубочка почек крыс сравниваемых групп не имеют статистически значимых отличий.
Рис. 2.
Морфометрические показатели почечного тельца и сосудистого клубочка, мкм2. a) площадь почечного тельца; б) площадь сосудистого клубочка. * – p ≤ 0.05; ** – p ≤ 0.01.
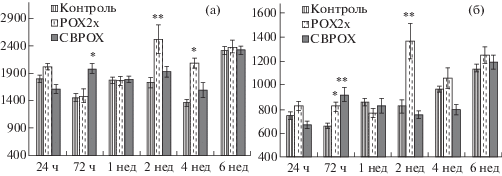
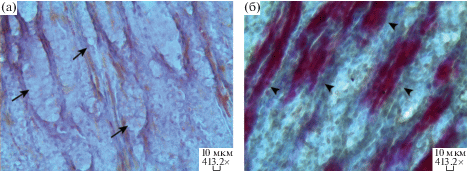
Рис. 3.
Гистология почек крыс через 2 нед после отравления (× 103.1) Черными длинными стрелками показаны сосудистые клубочки. a) корковое вещество почки крыс контрольной группы (H&E), б) корковое вещество почки крыс группы POX2x (H&E); в) корковое вещество почки крыс группы крыс группы CBPOX; г) корковое вещество почки крыс контрольной группы (AFOG-); д) положительная реакция (AFOG+) в коре почки крыс группы POX2x (маленькие стрелки). Белыми стрелками показана десквамация эпителия прямых проксимальных канальцев.
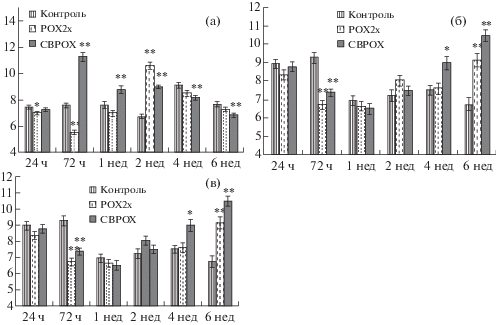
Наибольшие морфометрические изменения у отравленных крыс наблюдаются в извитых проксимальных канальцах и собирательных трубочках мозгового вещества почек (рис. 4a, в). У крыс групп POX2x и CBPOX на ранних сроках после отравления (1–3 сут) происходит сужение (группа POX2x) или расширение (группа CBPOX) извитых проксимальных канальцев и собирательных трубочек соответственно. Через 1 и 2 нед после отравления происходит несимметричное изменение диаметра проксимальных канальцев и собирательных трубочек у крыс обеих групп отравленных животных (рис. 4a, в). На этих сроках отмечено увеличение диаметра просвета проксимальных канальцев в группе CBPOX, тогда как в группе POX2x наблюдается значительное увеличение диаметра просвета собирательных трубочек через 1 нед после отравления (рис. 4a, в). С 4 до 6 нед после отравления наблюдается тенденция к уменьшению диаметра просвета проксимальных канальцев в обеих группах отравленных крыс (рис. 4a). Диаметр просвета собирательных трубочек у крыс групп POX2x и CBPOX через 4 нед после отравления значительно увеличен, а через 6 недель после отравления практически не отличается от показателей контрольной группы (рис. 4в). Дистальные извитые канальцы нефрона отравленных крыс менее подвержены изменениям (рис. 4б). В ранние сроки, через 3 сут после отравления происходит сужение просвета этих канальцев, а в период от 1 до 2 нед их размеры не отличаются от показателей контрольной группы. Однако в более поздние сроки, через 4 и 6 нед после отравления, происходит расширение просвета извитых дистальных канальцев нефрона у отравленых крыс, наиболее выраженное у крыс группы CBPOX (рис. 4б).
Рис. 4.
Морфометрические показатели канальцев и собирательных трубочек почек крыс. a) диаметр просвета извитых проксимальных канальцев, мкм; б) диаметр просвета извитых дистальных канальцев, мкм; в) Площадь просвета собирательных трубочек, мкм2. * – p ≤ 0.05; ** – p ≤ 0.01.
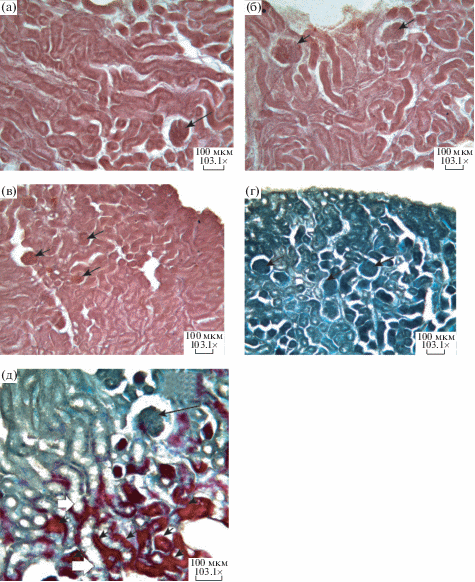
В морфологии отдельных элементов нефрона отравленных животных наблюдаются изменения, не свойственные их нормальному строению. В частности, через 3 сут после отравления в тонком нисходящем отделе петли Генле и собирательных трубочках нефрона крыс групп POX2x и CBPOX наблюдаются признаки гидропической дистрофии эпителиальных клеток, более выраженные у крыс группы POX2x (рис. 5a), проявляющиеся образованием в цитоплазме клеток мелких и крупных оптических пустот в виде вакуолей. Через 1 нед после отравления наблюдается положительная реакция на депозиты белка в канальцах и собирательных трубочках крыс группы POX2x (рис. 5б), которая сохраняется и через 2 нед после отравления (рис. 3д). На других сроках в группе РОХ2х и на всех сроках после отравления в группе CBPOX подобная реакция не наблюдается. Через 4 нед после отравления в сравнительной морфологии анализируемых элементов нефрона почек крыс сравниваемых групп отличий не наблюдается (данные не представлены), за исключением некоторых отличий в морфометрических показателях (рис. 4). Через 6 нед после отравления отличий в морфологии почек животных сравниваемых групп также не установлено.
ОБСУЖДЕНИЕ
В экспериментальных моделях, разработанных для изучения отставленных последствий острых отравлений фосфорорганическими соединениями (ФОС), часто не учитываются видовые особенности грызунов, наиболее важной из которых является наличие в плазме крови карбоксилэстеразы, выступающей в качестве естественной стехиометрической ловушки ФОС. Мы использовали одно из наиболее токсичных ФОС – параоксон, который водили однократно в сублетальных дозах на фоне предварительного неспецифического ингибирования КЭ либо самим РОХ (группа РОХ2х), либо специфическим ингибитором CBDP (группа СВРОХ). Такая постановка эксперимента служит более адекватной моделью для изучения на крысах отставленных последствий воздействия высокотоксичных ФОС, выявления новых критериев интоксикации, разработки более эффективных средств терапии острых отравлений и предупреждения их последствий.
В наших исследованиях установлено снижение массы тела крыс и абсолютной массы почек в ранние сроки, через 3 сут после отравления. Кроме того, выявлено повышение суточного диуреза у отравленных животных не только в ранние сроки, но и спустя 6 нед после острого отравления. Однако мы не обнаружили существенных отличий по удельному весу мочи крыс сравниваемых групп на протяжении 6-недельного периода наблюдений, что свидетельствует об отсутствии существенных нарушений концентрационной и выделительной функции почек. Следует отметить, что некоторые справочные руководства по биологии крыс приводят в качестве нормы значения удельного веса от 1.04 до 1.07 [11]. У здоровых крыс аутбредной линии Wistar, используемых в наших экспериментах, удельный вес мочи находится в пределах от 1.01 до 1.02, что практически совпадает с показателями здорового человека (1.01–1.03).
Гликозурия у крыс, наблюдаемая в наших исследованиях через сутки после отравления, не коррелирует с уровнем глюкозы в крови (нормогликемия, эугликемия), что указывает на ее почечное происхождение. Факты развития гликозурии без сопутствующей гипергликемии были отмечены у человека при отравлении органофосфатами [12–14]. Этиология подобной транзиторной гликозурии не вполне ясна, но повреждение почечных канальцев считается одним из факторов патогенеза [13]. Субхроническая пероральная интоксикация метилпаратионом крыс в дозе 0.56 мг/кг в течение 8 недель приводит к выраженной постоянной гипергликемии на сроках с 4 по 8 нед и гликозурии с 2 по 8 нед интоксикации [4]. В почках здоровых животных глюкоза практически полностью реабсорбируется в проксимальных канальцах. В апикальной мембране проксимального извитого канальца работает механизм вторичного активного транспорта с участием белка-переносчика SGLT2, который одновременно переносит Na+ и глюкозу. С помощью данного переносчика к концу проксимального извитого канальца у крысы реабсорбируется около 95% профильтровавшейся глюкозы [15].
Гликозаминогликаны (ГАГ) – сульфатированные или ацетилированные полисахариды, в норме являющиеся частью протеогликанов клеточных мембран. ГАГ, в особенности гепарансульфаты, выполняют защитную функцию, в почках они являются важнейшим компонентом гломерулярной базальной мембраны, препятствуя выходу альбумина и других белков из кровеносного русла за счет электростатического отталкивания [16, 17]. Синтез ГАГ осуществляют эндотелиальные клетки и подоциты [18, 19], а локализованы они в светлых пластинках (laminae rarae) базальной мембраны, образованной в результате слияния базальных пластинок подоцитов и эндотелиальных клеток [16, 17]. Роль ГАГ в патофизиологии почек, в том числе при интоксикации ФОС, изучена недостаточно. Помимо влияния на проницаемость крупных белков, ГАГ выполняют противовоспалительные и гемостатические функции за счет связывания цитокинов, факторов роста, протеаз и антитромбина III [18, 20, 21], и поэтому могут быть использованы в качестве терапевтического и профилактического средства [21–23]. В нашем исследовании установлено статистически значимое повышение уровня экскреции ГАГ с мочой у крыс группы CBPOX на 36% в течение первых трех суток после отравления и на 55% через 6–12 нед после отравления. По-видимому, отравление параоксоном приводит к изменению уровня синтеза и тканевой локализации ГАГ и может служить дополнительным свидетельством системного поражения эндотелиальных клеток при остром отравлении ФОС [24]. Отсутствие достоверных изменений уровня ГАГ в группе РОХ2х в ранние сроки после отравления, казалось бы, не согласуется с нашими опубликованными данными [9], однако более ранняя модель эксперимента с двойным введением РОХ существенно отличалась от последующей модели в том, что соотношение доз для первого и второго введения РОХ было обратным и аналогичное подавление КЭ плазмы крови, какое обеспечивает CBDP, было сопряжено со значительным ингибированием холинэстераз.
Из трех определяемых в настоящей работе специфических биомаркеров повреждения почек установлено повышение уровня экскреции с мочой кальбиндина в течение 1–3 сут после отравления, более выраженное в группе CBPOX. Уровень маркеров KIM-1 и TIMP-1 в течение всего периода наблюдений не имеет существенных отличий ни между группами отравленных животных, ни между этими группами, с одной стороны, и контролем, с другой стороны. Кальбиндин относится к группе кальций-связывающих белков, которые первоначально были описаны как витамин D-зависимые кальций-связывающие белки в кишечнике и почках, где они ассоциированы с каналами TRPV5 и участвуют в реабсорбции ионов Ca2+ [25]. Полагают, что кальбиндин является информативным биомаркером повреждения дистальных канальцев и собирательных трубочек почек [26]. Наши данные о влиянии РОХ на морфологию и морфометрические показатели почечных канальцев крыс (рис. 4), наряду с выявленным повышением концентрации кальбиндина в моче, свидетельствуют о морфофункциональных нарушениях в этих отделах нефрона при остром отравлении.
В течение всего периода наблюдений мы не выявили статистически значимых межгрупповых отличий клиренса эндогенного креатинина и концентрации креатинина в плазме крови и моче. Полученные результаты согласуются с результатами других исследований [27] и свидетельствуют о том, что клиренс креатинина и скорость клубочковой фильтрации при интоксикации ФОС – показатели не самые чувствительные для диагностики почечной патологии, генез которой связан, по-видимому, с поражением отдельных клеток нефрона, но не гибелью нефрона в целом, по крайней мере, в рамках данной модели интоксикации.
Влияние острой и субхронической интоксикации ФОС на морфологическое строение почек лабораторных животных было предметом ряда исследований [4, 28, 29], однако полученные результаты неоднозначны и во многом зависят от пути введения, дозы и длительности применения токсикантов. Так, однократное в/б введение морским свинкам малатиона в дозе 16.5 мг/кг (1/4 LD50) и диметоата в дозе 0.76 мг/кг приводило в течение 3 сут к сморщиванию клубочков, дегенерации проксимальных извитых канальцев и собирательных трубочек [29]. Субхроническое (30 дней) отравление крыс малатионом в дозе 100 мг/кг per os вызывает развитие отека сосудистых клубочков, расширение мочеточника, дегенеративные изменения в гломерулах, капсуле Боумена и сопряженных с ними канальцах [28]. Еще в одной работе изучено влияние интрагастрального отравления крыс метил-паратионом в дозе 0.56 мг/кг, который вводили раз в три дня в течение 8 нед. Через 2 и 4 нед после начала отравления клетки эпителия проксимальных канальцев набухали, в них появлялись ШИК-позитивные включения, тогда как щеточная кайма в некоторых сегментах исчезала полностью [4]. Во всех перечисленных исследованиях использовались стандартные методы гистологического окрашивания тканей (окраска гематоксилин-эозином и ШИК-реакция), но не проводился морфометрический анализ. В нашей работе дана морфометрическая оценка изменений отдельных элементов нефрона на протяжении 6 нед после острого отравления параоксоном на фоне специфического и неспецифического ингибирования КЭ. Результаты этих наблюдений не всегда коррелируют с гистологической картиной, но в совокупности с другими оцениваемыми параметрами достаточно информативны. В частности, нами установлено увеличение в размерах почечного тельца и сосудистого клубочка капсулы Боумена у крыс через 3 сут и 2 нед после отравления. Выраженные отклонения от контрольной группы по морфометрическим показателям элементов нефрона установлены в почечных канальцах и собирательных трубочках (рис. 4a–c): в извитых проксимальных канальцах и собирательных трубочках крыс обеих групп отравленных животных – в течение почти всего периода наблюдений, тогда как в дистальных канальцах – через 3 сут, 4 и 6 нед у крыс группы СВРОХ и лишь через 3 сут и 6 нед у крыс группы РОХ2х. Гистологическое исследование дополняет эти результаты положительной реакцией AFOG+ в прямых проксимальных канальцах и отделах петли Генле через 3 сут после отравления у животных группы POX2x (рис. 3e).
Отдельно следует упомянуть используемый в нашей работе метод гистохимической окраски AFOG. Положительное ярко-красное окрашивание (AFOG+), характерное в большинстве случаев для гломерулярных белковых депозитов, обнаружено нами и в почечных канальцах, отделах петли Генле и в собирательных трубочках. Этот факт говорит о необходимости проведения более тщательных исследований гистохимии белков в тканях почек после отравления ФОС, возможно, с применением более чувствительных и специфичных методов анализа.
Список литературы
Undeger U., Institoris L., Siroki O., Nehez M., Desi I. Simultaneous Geno- and Immunotoxicological Investigations for Early Detection of Organophosphate Toxicity in Rats. Ecotoxicol. Env. Safety. 45: 43–48. 2000.
Baconi D.L., Bârcă M., Manda G., Ciobanu A.M., Bălălău C. Investigation of the toxicity of some organophosphorus pesticides in a repeated dose study in rats. Rom J Morphol Embryol. 54 (2): 349–356. 2013.
Selmi S., Rtibi K., Grami D., Sebai H., Marzouki L. Malathion, an organophosphate insecticide, provokes metabolic, histopathologic and molecular disorders in liver and kidney in prepubertal male mice. Toxicol. Reports 5: 189–195. 2018.
Fuentes-Delgado V.H., Martínez-Saldaña M.C., Rodríguez-Vázquez M.L., Reyes-Romero M.A., Reyes-Sánchez J.L., Jaramillo-Juárez F. Renal damage induced by the pesticide methyl parathion in male Wistar rats. J Toxicol. Env. Health, Part A. 81(6): 130–141. 2018.
Гончаров Н.В., Терпиловский М.А., Шмурак В.И., Белинская Д.А., Авдонин П.В. Крыса (Rattus norvegicus) как объект исследования в модели острого отравления фосфорорганическими соединениями. 1. Биохимические аспекты. Ж. эвол. биохим. физиол. 2019. Т. 2 (в печати). [Goncharov N.V., Terpilovskij M.A., Shmurak V.I., Belinskaya D.A., Avdonin P.V. Rat (Rattus) norvegicus as a research object in the model of acute intoxication with organophosphorous compound. 1. Biochemical aspects. Journ. Evol. Biochem. Physiol [in press]. 2019. (in Russ)].
Кузнецов С.В., Гончаров Н.В. Крыса (Rattus norvegicus) как объект исследования в модели острого отравления фосфорорганическими соединениями. 2. Кардиореспираторные показатели. Ж. эвол. биохим. физиол. 2019. Т. 2 (в печати). [Kuznetsov S.V., Goncharov N.V. Rat (Rattus norvegicus) as a research object in the model of acute intoxication with organophosphorous compound. 2. Cardiorespiratory indices. Journ. Evol. Biochem. Physiol [in press]. 2019. (in Russ)].
Соболев В.Е., Шмурак В.И., Гончаров Н.В. Крыса (Rattus norvegicus) как объект исследования в модели острого отравления фосфорорганическими соединениями. 3. М1-холинорецепторы и эстеразная активность в гомогенатах головного мозга. Ж. эвол. биохим. физиол. 2019. (в печати) [Sobolev V.Е., Shmurak V.I., Goncharov N.V. Rat (Rattus) norvegicus as a research object in the model of acute intoxication with organophosphorous compound. 3. M1-cholinergic receptors and esterase activity in the brain homogenates. Journ. Evol. Biochem. Physiol [in press]. 2019. (in Russ)].
Шмурак В.И., Курдюков И.Д., Надеев А.Д., Войтенко Н.Г., Глашкина Л.М., Гончаров Н.В. Биохимические маркеры интоксикации фосфорорганическими отравляющими веществами. Токсикол. Вестн. 4: 30–34. 2012. [Shmurak V.I., Kurdyukov I.D., Nadeyev A.D., Voitenko N.G., Glashkina L.M., Goncharov N.V. Biomarkers of intoxication by organophosphorous toxic agents. Toksikol. vest. 4: 30–34. 2012. (in Russ)].
Sobolev V.E., Jenkins R.O., Goncharov N.V. Sulfated glycosaminoglycans in bladder tissue and urine of rats after acute exposure to paraoxon and cyclophosphamide. Exp Toxicol Pathol. 69 (6): 339–347. 2017.
Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под ред. Р.У. Хабриева. М. 2005. [Rukovodstvo po eksperimental’nomu (doklinicheskomu) izucheniyu novyh farmakologicheskih veshchestv [Guide for experimental (preclinical) studying of new pharmacological substances]/ R.U. Habriev ed. M.: 2005. (in Russ)].
Sharp P., Villano J. The laboratory rat. 2nd ed. CRC Press, Taylor & Francis Group. 2013.
Moore P.G., James O.F. Acute pancreatitis induced by acute organophosphate poisoning?. Postgrad. Med. J. 57: 660–662. 1981.
Shobha T.R., Prakash O. Glycosuria in organophosphate and carbamate poisoning. J. Assoc. Physicians India. 48(12): 1197–1199. 2000.
Malekirad A.A., Faghih M., Mirabdollahi M., Kiani M., Fathi A., Abdollahi M. Neurocognitive, mental health and glucose disorders in farmers exposed to organophosphorous pesticides. Arh. Hig. Rada Toksikol. 64(1): 1–8. 2013.
Bakris G.L., Fonseca V.A., Sharma K., Wright E.M. Renal sodium–glucose transport: role in diabetes mellitus and potential clinical implications. Kidney Int. 75: 1272–1277. 2009.
Miner J.H. Renal basement membrane components. Kidney Int. 56: 2016–2024. 1999.
McCarthy K.J., Wassenhove-McCarthy D.J. The glomerular basement membrane as a model system to study the bioactivity of heparan sulfate glycosaminoglycans. Microsc. Microanal. 18: 3–21. 2012.
Pyke C., Kristensen P., Ostergaard P.B., Oturai P.S., Romer J. Proteoglycan expression in the normal rat kidney. Nephron 77: 461–470. 1997.
Sorensson J., Björnson A., Ohlson M., Ballermann B.J., Haraldsson B. Synthesis of the sulfated proteoglycans by bovine glomerular endothelial cells in culture. Am. J. Physiol. Ren. Physiol. 284: 373–380. 2003.
Kanwar Y.S., Rosenzweig L.J. Clogging of the glomerular basement membrane. J. Cell Biol. 93: 489–494. 1982.
Gambaro G., Van der Woude F.J. Glycosaminoglycans: use in treatment of diabetic nephropathy. J. Am. Soc. Nephrol. 11: 359–368. 2000.
Striker G.E. Therapeutic uses of heparinoids in renal disease patients. Nephrol. Dial. Transpl. 14: 540–543. 1999.
Sobolev V.E. Effects of exogenous glycosaminoglycans on the histological structure of the rat bladder in experimental cystitis. Bull. Exp. Biol. Med. 154: 108–111. 2012.
Goncharov N.V., Nadeev, A.D., Jenkins R.O., Avdonin P.V. Markers and Biomarkers of Endothelium: When Something Is Rotten in the State. Oxidative Medicine and Cellular Longevity. 2017. https://doi.org/10.1155/2017/9759735
Lambers T.T., Mahieu F., Oancea E., Hoofd L., DeLange F., Mensenkamp A.R., Voets T., Nilius B., Clapham D.E., Hoenderop J.G., Bindels R.J. Calbindin-D28k dynamically controls TRPV5- mediated Ca2+ transport. Embo J. 25: 2978–2988. 2006.
Fuchs T.C., Hewitt P. Biomarkers for Drug-Induced Renal Damage and Nephrotoxicity – An Overview for Applied Toxicology. AAPS Journal. 13(4): 615–631. 2011.
Jafari M., Salehib M., Asgaric A., Ahmadid S., Abbasnezhade M., Hajihoosanie R., Hajigholamalie M. Effects of paraoxon on serum biochemical parameters and oxidative stress induction in various tissues of Wistar and Norway rats. Env. Toxicol. Pharmacol. 34: 876–887. 2012.
Al-Attar A.M. Physiological and Histopathological Investigations on the Effects of α-Lipoic Acid in Rats Exposed to Malathion. J Biomed Biotechnol. 8. 2010. https://doi.org/10.1155/2010/203503
Salama M.A. Histopatological changes in some organs exposed to malathion and dimethoate insecticides and its cytogenic effects on guinea pigs. Egypt J Med Sci. 33(1): 697–708. 2012.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии