Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 6, стр. 447-450
ВРЕМЕННАЯ ШКАЛА АДАПТАЦИИ ПРИ ОБРАБОТКЕ ЗВУКОВЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ НЕЙРОНАМИ ПЕРВИЧНОЙ СЛУХОВОЙ КОРЫ МЫШИ MUS MUSCULUS
М. А. Егорова 1, *, Г. Д. Хорунжий 1, А. Г. Акимов 1
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии
и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: ema6913@yandex.ru
Поступила в редакцию 04.03.2019
После доработки 15.04.2019
Принята к публикации 17.07.2019
Хорошо известно, что подавляющее большинство биологически значимых акустических сигналов, включая вокализации животных и речь человека, состоят из последовательно генерируемых звуковых событий [1, 2]. Очевидно, что при распознавании этих звуков принципиальную важность приобретает их временная структура, в частности, интервалы между звуковыми событиями. В качестве вероятного механизма, обеспечивающего способность слуховой системы группировать звуковые последовательности в единое слуховое событие, разделять их во времени и распознавать как биологически значимые, рассматривается постстимульная слуховая адаптация – одна из наиболее ярких форм пластичности мозга, непосредственно связанная с обработкой сенсорной информации [3]. В настоящее время интересы многих исследователей слуховой системы сфокусированы на раскрытии функциональной значимости адаптации в обработке широкого ряда динамических акустических сигналов и звуковых последовательностей. Однако вклад адаптации в группирование и разделение звуковых событий на уровне одиночных слуховых нейронов исследован недостаточно. В особенности это справедливо для высшего иерархического уровня слуховой системы млекопитающих – нейронов слуховой коры.
Настоящая работа является логическим продолжением проведенного нами исследования адаптации при обработке звуковых последовательностей одиночными нейронами слухового центра среднего мозга мыши [4, 5] и впервые представляет данные о временной динамике постстимульной адаптации одиночных нейронов первичных областей слуховой коры домовой мыши (Mus musculus) –первичного A1 и переднего AAF слуховых полей.
Работа выполнена на самках домовых мышей – гибридах F1 линий СBA и C57BL/6 в возрасте 8–15 нед. Ответы нейронов первичного и переднего полей слуховой коры регистрировали в условиях общей анестезии животного, поддерживаемой инъекциями смеси кетамина (кетавет, 35 мг/кг) и ксилазина (ромпун, 0.1 мг/кг) в соответствии с принципами Базельской декларации и правилами, рекомендованными Физиологической секцией Российского национального комитета по биологической этике. Методика подготовки животного к эксперименту и регистрации импульсной активности нейронов подробно описана ранее [6].
Временное шкалирование нейрональной адаптации исследовали при стимуляции животного звуковыми последовательностями, образованными четырьмя 100-мс тональными посылками, частота которых соответствовала характеристической частоте нейрона [6]. Интервал между тональными составляющими одной серии был одинаков, а в различных сериях варьировал от 0 до 1000 мс. Ответы нейронов на тональные последовательности регистрировали при межстимульных интервалах, равных 0, 2, 4, 10, 20, 50, 100, 200, 500, 700 и 1000 мс. Каждую серию предъявляли 20 раз с интервалом в 2 с. Подбор параметров последовательностей стимулов и межстимульных интервалов был произведен с учетом результатов психофизического исследования взаимосвязи звукопродукции и восприятия последовательностей коммуникационного сигнала мышей – крика дискомфорта мышат [2]. В естественных условиях мышата излучают крик дискомфорта в виде серий из 2–5 сигналов, при этом мыши-матери воспринимают естественный крик и его модели как значимые, если они следуют сериями из четырех сигналов с интервалами 100–400 мс.
Генерация серий звуковых сигналов осуществлялась при помощи цифро-аналогового преобразования D/A конвертером платы ТМS320С30, встроенной в PC (тактовая частота 200 кГц, разрешение по амплитуде 16 бит, программа TMS2, Германия). Для излучения звука использовали электродинамический излучатель Sonotrack (Metris, Голландия). Неравномерность частотной характеристики излучателя составляла ±5 дБ в диапазоне частот 3–65 кГц. Излучатель был расположен контралатерально стороне регистрации импульсной активности на уровне головы животного на расстоянии 60 см под углом 45° справа относительно сагиттальной плоскости.
Импульсную активность нейронов регистрировали внеклеточно, оцифровывали при помощи интерфейса СЕD1401plus и записывали на РС (программа Spike2). Вольфрамовые изолированные лаком микроэлектроды с сопротивлением кончика 3–8 мОм вводили ортогонально поверхности мозга в каудальную часть височной коры левого полушария, соответствующую расположению слуховой коры животного [7]. Ввиду выраженности у мышей индивидуальных топографических различий в локализации полей слуховой коры для определения их границ у каждого животного производили морфо-физиологическое картирование. Оно осуществлялось под визуальным контролем расположения электрода на поверхности коры мозга. Основным критерием локализации полей А1 и AAF служило наличие в этих структурах тонотопической организации с градиентом частот по ростро-каудальной оси, показанное в работе [7], выполненной методом нейрофизиологического картирования слуховой коры аналогичным примененному нами. В поле A1 характеристические частоты нейронов убывали в ростро-каудальном направлении, в поле AAF порядок частот инвертировался, т.е. они возрастали в ростро-каудальном направлении. Регистрацию ответов нейронов производили на глубине 300–600 мкм, что соответствовало расположению III–V слоев коры.
Подсчитывали число спайков в ответе нейрона на каждый из тональных сигналов, составляющих серию. Для оценки временной динамики адаптации строили зависимости числа спайков в ответе от интервала между сигналами (кривые восстановления ответа). Статистическая оценка показателей адаптации проводилась на основе пакета программ Anova. Оценка временных характеристик адаптации была выполнена для 69 нейронов с характеристическими частотами от 5.5 до 30.0 кГц, зарегистрированных у 11 мышей. 37 нейронов были локализованы в поле А1, 32 –в поле AAF.
Анализ полученных результатов продемонстрировал эффект адаптации в ответах всех исследованных нейронов первичной слуховой коры, выражавшийся в отсутствии или значительном снижении активности, вызванной следующими за 1-м компонентами серии звуков при относительно коротких интервалах между ними (0–100 мс, рис. 1а, 1б). Нормированные функции восстановления ответа на 2-й, 3-й и 4-й сигналы в серии возрастали с увеличением межстимульного интервала вплоть до полного восстановления ответа (рис. 1а, 1б). Однако они не всегда носили монотонный характер. Такая специфика кривых освобождения от адаптации была связана с высокой, нерегулярной, залповой спонтанной активностью большинства корковых нейронов. Причем спонтанная активность и ответы нейронов на последовательности стимулов носили конкурентный характер: нейрон либо генерировал залп спонтанной активности, либо отвечал на предъявляемый стимул.
Рис. 1.
Примеры нейронов первичного (AI, а) и переднего (AAF, б) полей слуховой коры мыши с различной динамикой временной постстимульной адаптации и суммарные функции восстановления ответов на 2-й, 3-й и 4-й компоненты серии, усредненные по всей популяции корковых нейронов (в). а, б: в верхней части каждого фрагмента –перистимульные гистограммы ответов нейронов, вызванных сериями тональных импульсов с различными межстимульными интервалами. Значение межстимульного интервала для каждой серии указано цифрами на диаграмме. Величина бина – 2 мс. По оси абсцисс – время, мс; по оси ординат – число спайков, N. Под каждой гистограммой приведена отметка стимула, представляющего собой серию из 4 тональных импульсов длительностью 100 мс каждый. В нижней части каждого фрагмента – зависимость величины ответа этих же нейронов на 2-й, 3-й и 4-й сигналы серии от межимпульсного интервала (кривые восстановления ответов). Величина ответа (число спайков) нейрона на каждый компонент нормирована относительно его ответа на 1-й сигнал серии, т.е. равна отношению числа спайков в ответе нейрона на соответствующий сигнал к числу спайков в ответе на 1-й сигнал. На в указаны стандартные отклонения средних величин ответов нейронов на соответствующие компоненты серии.
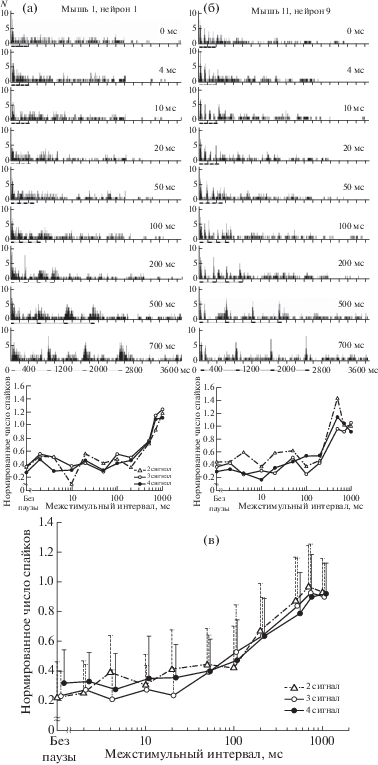
У разных нейронов восстановление ответов начиналось при различных межстимульных интервалах (10–200 мс) (рис. 1а, 1б). Преобладали нейроны с порогом восстановления, равным 50–100 мс (53 единицы, 77%). У нейрона поля А1, приведенного на рис. 1а, восстановление ответа начиналось при межстимульных интервалах 100 мс. При малых межстимульных интервалах ответы приведенного на рис. 1б нейрона поля AAF, вызванные 2-м–4‑м сигналами серии, не подавлялись полностью. Выраженное восстановление величины ответов начиналось при межстимульных интервалах 200 мс.
Полное восстановление ответов, когда их величина не отличалась от ответа на первый компонент серии, наблюдалось при межстимульных интервалах от 200 мс до 1000 мс. При этом у половины нейронов ответ полностью восстанавливался при межстимульном интервале, не превышавшем 500 мс, и почти у 90% нейронов – при межстимульном интервале, не превышавшем 700 мс.
Кривая восстановления ответа, усредненная по всем 69 нейронам, имела монотонный характер (рис. 1в). Статистический анализ временной динамики постстимульной адаптации по всей популяции исследованных нейронов показал, что при межстимульных интервалах 0–200 мс ответ на первый сигнал серии достоверно превышал ответы на 2-й, 3-й и 4-й сигналы (ANOVA on ranks, Dunn’s test, p < 0.01). Между собой ответы на 2-й, 3-й и 4-й сигналы в серии не различались. Начиная с межстимульного интервала 500 мс, ответы нейронов на все сигналы серии достоверно не различались. Таким образом, во временном интервале 0–500 мс наблюдалось явление адаптации активности исследуемых нейронов к повторяющимся сигналам, выражающееся в снижении ответов нейрона на сигналы, следующие за первым сигналом в серии.
Таким образом, полученные данные показали, что временной диапазон проявления адаптации к серии сигналов на уровне популяции нейронов первичной слуховой коры мыши соответствует временному диапазону интервалов (100–400 мс) в серии криков дискомфорта мышат, важному для запуска оптимального материнского поведения.
Выраженность эффекта адаптации, показанная у всех исследованных нейронов, обусловлена, по-видимому, особенностями разрядов корковых нейронов, имеющих только фазные компоненты ответов (фазные и пачечные разряды) в условиях использованной анестезии. Поздние компоненты ответов, включая off-ответ, у этих нейронов отсутствуют. Показанные нами ранее немонотонные функции восстановления ответа от адаптации у трети популяции нейронов слухового центра среднего мозга [4, 5] были непосредственно связаны с наличием поздних компонентов в ответах этих нейронов (тонические, фазно-тонические, паузные, позднелатентные разряды). При коротких межимпульсных интервалах окончание позднего компонента ответа или off-ответ на предыдущий сигнал у таких нейронов суммировался с on-ответом на последующий сигнал, маскируя таким образом проявление адаптации.
Список литературы
Bregman A.S. Auditory scene analysis. The Perceptual Organization of Sound. Cambridge, MA: MIT Press. 1990.
Gaub S., Ehret G. Grouping in auditory temporal perception and vocal production is mutually adapted: the case of wriggling calls of mice. J. Comp. Physiol. 191: 1131–1135. 2005.
Ulanovsky N., Las L., Farkas D., Nelken I. Multiple time scales of adaptation in auditory cortex neurons. J. Neurosci. 24: 10440–10453. 2004.
Малинина Е.С., Егорова М.А., Хорунжий Г.Д., Акимов А.Г. Временная шкала адаптации при обработке звуковых последовательностей нейронами слухового центра среднего мозга мыши. Докл. Акад. Наук. 470 (1): 112–116. 2016. [Malinina E.S, Egorova М.А., Khorunzii G.D., Akimov А.G. The Time scale of adaptation in tonal sequence processing by the mouse auditory midbrain neurons. Doklady Biological Sciences. 470 (1): 218–222. 2016. (in Russ).]
Егорова М.А., Малинина Е.С, Акимов А.Г., Хорунжий Г.Д. Адаптация различных типов нейронов слухового центра среднего мозга к последовательностям звуковых импульсов. // Ж. эвол. биохим. и физиол. 54 (6): 440–443. 2018. [Egorova М.А., Malinina E.S, Akimov А.G., Khorunzii G.D. Adaptation of different types of neurons in the midbrain auditory center to sound pulse sequencies. J. Evol. Biochem. Physiol. 54 (6): 482–486. 2018.]
Егорова М.А. Частотная настройка нейронов первичного слухового поля (А1) и переднего слухового поля (AAF) слуховой коры мыши (Mus musculus). Ж. эвол. биохим. и физиол. 41 (4): 379–382. 2005. [Egorova М.А. Frequency selectivity of neurons of the primary auditory field (A1) and anterior auditory field (AAF) in the auditory cortex of the house mouse (Mus musculus). J. Evol. Biochem. Physiol. 41 (4): 476–480. 2005.]
Stiebler I., Neulist R., Fichtel I., Ehret G. The auditory cortex of the house mouse: left-right differences, tonotopic organization and quantitative analysis of frequency representation. J. Comp. Physiol. A. 181: 559–571. 1997.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


