Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 1, стр. 55-61
ХАРАКТЕРИСТИКА НЕКОТОРЫХ БИОХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ ПЕЧЕНИ ТРЕХ ДОННЫХ ВИДОВ РЫБ ЧЕРНОГО МОРЯ
Т. Б. Сигачева 1, *, И. И. Чеснокова 1, Т. В. Гаврюсева 1
1 Институт морских биологических исследований им. А.О. Ковалевского РАН
Севастополь, Россия
* E-mail: mtk.fam@mail.ru
Поступила в редакцию 15.04.2019
После доработки 15.07.2019
Принята к публикации 24.07.2019
Аннотация
Проведен сравнительный анализ комплекса биохимических показателей печени трех донных видов рыб Черного моря (б. Александровская, г. Севастополь) – морского ерша Scorpaena porcus Linnaeus, 1758, бычка-кругляка Neogobius melanostomus (Pallas, 1814) и бычка-мартовика Mesogobius batrachocephalus (Pallas, 1814). Установлены межвидовые отличия показателей прооксидантно-антиоксидантной системы (активности антиоксидантных (АО) ферментов, показателей перекисного окисления липидов (ПОЛ) и окислительной модификации белков (ОМБ)) и других биомаркеров печени (активности аминотрансфераз, щелочной фосфатазы (ЩФ), содержания триглицеридов (ТГ)) рыб. Обсуждаются причины выявленных отличий.
ВВЕДЕНИЕ
В процессе эволюции костистых рыб, наряду с общими, сформировался ряд специфических адаптаций к действию неблагоприятных факторов среды, определяющих биохимический статус организма, разную чувствительность и устойчивость видов [1, 2]. В связи с этим изучение биохимических показателей у представителей разных таксономических групп рыб в условиях комплексного загрязнения среды их обитания имеет важное значение для выявления видовых особенностей механизмов биохимических адаптаций, а также для разработки системы оценки качества прибрежных акваторий, адаптированной для конкретного региона.
Подобного рода исследования проводились сотрудниками Карельского научного центра на водо-емах Северо-Запада России, характеризующихся разной степенью загрязнения бытовыми и промышленными стоками. Показано, что устойчивость и чувствительность исследованных видов гидробионтов к действию различных токсических веществ зависит как от функционирования ферментов биотрансформации ксенобиотиков, так и от состояния других систем клетки, участвующих в развитии “ответа” на уровне биохимических изменений [1, 2].
В Севастопольском регионе для решения природоохранных проблем и проведения биоиндикационных исследований прибрежных акваторий города ранее было предложено использование биохимических показателей трех донных видов – морского ерша Scorpaena porcus Linnaeus, 1758, бычка-кругляка Neogobius melanostomus (Pallas, 1814), бычка-мартовика Mesogobius batrachocephalus (Pallas, 1814), отвечающих требованиям объектов биоиндикации [3, 4]. Биомаркерная оценка включала показатели прооксидантно-антиоксидантной системы (активность антиоксидантных (АО) ферментов, показатели перекисного окисления липидов (ПОЛ) и окислительной модификации белков (ОМБ), а также содержание среднемолекулярных олигопептидов, активность аминотрансфераз, холинэстеразы (ХЭ; ацилхолин ацилгидролаза; Н.Ф. 3.1.1.8) и др. Однако исследования, посвященные сравнительной оценке комплекса биохимических показателей печени биоиндикаторных видов черноморского побережья Крыма, практически отсутствуют.
В связи с этим целью работы являлось изучение некоторых биохимических показателей печени трех донных видов рыб в условиях комплексного загрязнения бухты Александровская (Черное море, г. Севастополь).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Объектами исследований служили три донных вида рыб Черного моря: бычок-кругляк Neogobius melanostomus (Pallas, 1814) (n = 18), бычок-мартовик Mesogobius batrachocephalus (Pallas, 1814) (n = 8) и морской ерш Scorpaena porcus Linnaeus, 1758 (n = = 16). Рыб (самки в период нереста) отлавливали в весенне-летний период 2018 г. в бухте Александровская, донные отложения которой характеризуются как сильно загрязненные хлорорганическими соединениями [5] и относятся к III уровню загрязнения хлороформ-экстрагируемыми веществами и нефтяными углеводородами [6]. В каждую группу рыб одного вида отбирали взрослых половозрелых самок доминантных возрастных групп: бычок-кругляк (TL 12.3–15.2 cм, 3–4 года), бычок-мартовик (TL 18.7–22.2 cм, 3–5 лет), морской ерш (TL 14.9–19.7 cм, 3–6 лет (большинство особей в возрасте 5 лет)).
Материалом для биохимических исследований служила печень рыб. Печень несколько раз промывали холодным 0.85% физраствором, гомогенизировали и центрифугировали (10 000 g) 15 мин на холоде. Для дальнейшего анализа использовали супернатант.
В супернатантах анализировали активность каталазы (КАТ; НФ 1.11.1.6) (мкат/мг белка) по реакции разложения перекиси водорода [7] и пероксидазы (ПЕР; НФ 1.11.1.7) (опт. ед./мг белка/мин) – по реакции с бензидином [8].
Содержание окисленных форм белков (опт.ед./мг белка) определяли по реакции взаимодействия окисленных аминокислотных остатков белков с 2.4-динитрофенилгидразином. Образовавшиеся в результате реакции производные 2.4‑динитрофенилгидразона регистрировали при следующих длинах волн (λ): альдегидные и кетонные продукты нейтрального характера при 346 и 370 нм, соответственно, альдегидные и кетонные продукты основного характера при 430 и 530 нм [9].
По реакции с тиобарбитуровой кислотой (ТБК) регистрировали содержание вторичных продуктов ПОЛ – ТБК-активных продуктов (нмоль ТБК/мг белка) [10].
Активность аспартатаминотрансферазы (АСТ; НФ 2.6.1.1) (мкмоль/(мг белка × час)), аланинаминотрансферазы (АЛТ; НФ 2.6.1.2) (мкмоль/(мг белка × час)), щелочной фосфатазы (ЩФ; НФ 3.1.3.1) (нмоль/(мг белка × с)), содержание триглицеридов (ТГ) (ммоль/л на г сырой массы ткани) в супернатантах определяли с использованием стандартных наборов реактивов “ОЛЬВЕКС ДИАГНОСТИКУМ”.
Все определения проводили на спектрофотометре Specol-11 (Carl Zeiss, Iena, Germany). Биохимические показатели пересчитывали на мг белка сырой массы ткани, концентрацию которого определяли с использованием стандартного набора реагентов “ОЛЬВЕКС ДИАГНОСТИКУМ”.
Результаты обрабатывали статистически, вычисляли среднее арифметическое и стандартную ошибку средней. Нормальность распределения выборки проверяли с применением W-критерия Шапиро–Уилка. Достоверность различий между выборками проводили с применением U-критерия Манна–Уитни. Различия считали достоверными при p ≤ 0.05. Статистический анализ проводили с помощью компьютерных программ Past 3 и Microsoft Office Excel 2016.
РЕЗУЛЬТАТЫ
Сравнительный анализ показателей ОМБ (табл. 1) и ПОЛ (рис. 1) печени трех донных видов рыб позволил установить определенные различия. Уровень ОМБ (λ 356, 370, 430 нм) был достоверно выше (p ≤ 0.05) в печени бычка-кругляка и морского ерша (λ 370, 430 нм) (p ≤ 0.05) по сравнению с соответствующими показателями печени бычка-мартовика (табл. 1). Содержание окисленных форм белков в печени морского ерша и бычка-кругляка при всех длинах волн имело близкие значения и достоверно не отличалось (табл. 1.).
Таблица 1.
Содержание окисленных форм белков (опт. ед./мг белка) в печени трех видов черноморских рыб
| Вид | Продукты нейтрального характера | Продукты основного характера | ||
|---|---|---|---|---|
| альдегидные 356 нм | кетонные 370 нм | альдегидные 430 нм | кетонные 530 нм | |
| Морской ерш | 0.010 ± 0.001 | 0.011 ± 0.002 | 0.007 ± 0.001 | 0.002 ± 0.0004 |
| Бычок-кругляк | 0.013 ± 0.002 | 0.015 ± 0.003 | 0.008 ± 0.001 | 0.002 ± 0.0003 |
| Бычок-мартовик | 0.005 ± 0.0008* | 0.006 ± 0.0009*● | 0.003 ± 0.0004*● | 0.0008 ± 0.0006 |
Рис. 1.
Содержание ТБК-активных продуктов (нмоль ТБК/мг белка) в печени трех видов черноморских рыб. Обозначения: * – достоверность различий между содержанием ТБК-активных продуктов в печени морского ерша и бычка-кругляка при p ≤ 0.05.
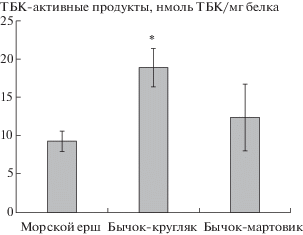
Согласно данным рис. 1, содержание ТБК-активных продуктов было достоверно выше (p ≤ ≤ 0.001) в печени бычка-кругляка по сравнению с аналогичным показателем морского ерша и не имело достоверных отличий у двух видов бычков.
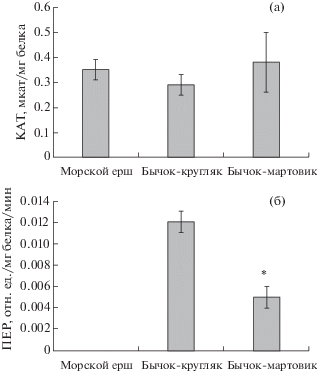
Активность АО ферментов печени трех видов рыб представлена на рис. 2. Активность КАТ у исследуемых видов рыб достоверно не отличалась. Активность ПЕР была достоверно ниже (p ≤ 0.05) в печени бычка-мартовика по сравнению с таковой у бычка-кругляка.
Рис. 2.
Активность антиоксидантных ферментов в печени трех видов черноморских рыб. Обозначения: a – активность КАТ, мкат/ мг белка; б – активность ПЕР, опт. ед./мг белка/мин. * – достоверность различий между активностью ПЕР в печени двух видов бычков при p ≤ 0.05.
Кроме того, исследованы показатели физиологического состояния печени указанных видов рыб (табл. 2).
Таблица 2.
Некоторые биохимические показатели печени трех видов черноморских рыб
| Вид | АЛТ, мкмоль/мг белка × час | АСТ, мкмоль/мг белка × час | ЩФ, нмоль/мг белка × с | ТГ, ммоль/л на г сырой массы ткани |
|---|---|---|---|---|
| Морской ерш | 0.53 ± 0.07 | 0.27 ± 0.05 | 781 ± 106 | 0.010 ± 0.0015 |
| Бычок-кругляк | 0.008 ± 0.003● | 0.047 ± 0.008● | 49 ± 6● | 0.032 ± 0.0043● |
| Бычок-мартовик | 0.018 ± 0.0022*● | 0.042 ± 0.009● | 1608 ± 418*● | 0.012 ± 0.0035* |
Активность обеих аминотрансфераз (АЛТ и АСТ) была достоверно выше (p ≤ 0.05) в печени морского ерша по сравнению с этими показателями у двух видов бычков. Активность АЛТ была достоверно выше (p ≤ 0.05) в печени бычка-мартовика по сравнению с таковой в печени бычка-кругляка, тогда как активность АСТ у этих видов рыб достоверно не различалась (табл. 2).
Активность ЩФ была достоверно выше (p ≤ ≤ 0.05) в печени бычка-мартовика и снижалась в ряду: бычок-мартовик → морской ерш → бычок-кругляк (табл. 2).
Содержание ТГ было достоверно выше (p ≤ 0.05) в печени бычка-кругляка по сравнению с таковым в печени морского ерша и бычка-мартовика (табл. 2).
ОБСУЖДЕНИЕ
Для контроля процессов окислительного повреждения клеточных структур эволюционно сформировалась многокомпонентная АО система, поддерживающая интенсивность свободнорадикальных реакций на оптимальном для клетки уровне. Соотношение процессов окисления биомолекул и антиоксидантной защиты не только отражает, но и во многом определяет интенсивность метаболизма, адаптационные возможности организма и риск формирования окислительного стресса [11]. В наших исследованиях накопление продуктов ОМБ (табл. 1) и ПОЛ (прямых показателей тканевого повреждения при окислительном стрессе) (рис. 1) в печени бычка-кругляка и ОМБ в печени морского ерша свидетельствует о смещении прооксидантно-антиоксидантного равновесия в сторону процессов свободнорадикального окисления (СРО) биомолекул. При этом активность ПЕР была достоверно выше в печени бычка-кругляка по сравнению с аналогичным показателем у бычка-мартовика, а активность КАТ у этих видов рыб достоверно не отличалась (рис. 2).
В более ранних наших исследованиях, посвященных изучению показателей прооксидантно-антиоксидантной системы крови морского ерша [12] и бычка-кругляка [13] из севастопольских акваторий с разным уровнем загрязнения, было установлено увеличение содержания окисленных форм белков в сыворотке этих видов из более загрязненных акваторий, тогда как отклики АО системы имели неоднозначный характер. В зависимости от уровня и характера загрязнения были установлены адаптивные ответные реакции, характеризующиеся повышением активности АО ферментов, и токсические, выражающиеся в ингибировании активности АО ферментов в тканях рыб из наиболее загрязненных акваторий [12, 13]. Сравнительный анализ вышеперечисленных показателей крови бычка-кругляка и морского ерша позволил установить разную чувствительность этих видов к уровню загрязнения среды обитания. Так, активность супероксиддисмутазы (СОД; НФ 1.15.1.1), глутатионредуктазы (ГР; НФ 1.8.1.7) и уровень ОМБ в крови бычка-кругляка из условно чистой бухты (Карантинной) были достоверно выше по сравнению с аналогичными показателями морского ерша [12, 13]. В экологически неблагополучной акватории (б. Мартынова), граничащей с б. Александровская, отмечена обратная зависимость – активность большинства АО ферментов (СОД, ГР, ПЕР) была достоверно ниже в эритроцитах крови бычка-кругляка, тогда как уровень ОМБ в сыворотке крови этих видов рыб значительно не отличался [12, 13]. Таким образом, установленное в настоящем исследовании более высокое содержание продуктов окисления белков и липидов в печени бычка-кругляка по сравнению с таковым у других видов рыб, может отражать как видовые особенности протекания окислительных процессов в их тканях, так и специфику функционирования АО защитной системы в условиях комплексного загрязнения б. Александровская.
В то же время, наряду с показателями прооксидантно-антиоксидантной системы, большое внимание уделяют изучению биомаркеров, характеризующих функциональное состояние печени рыб как основного органа детоксикации. С этой целью рекомендовано изучение комплекса показателей: ферментов трансаминаз (АСТ, АЛТ), выполняющих ключевую роль в метаболизме аминокислот и белков, а также ЩФ – фермента фосфорно-кальциевого обмена. Увеличение активности аминотрансфераз в сыворотке крови свидетельствует о повреждении гепатоцитов, что было показано у рыб при комплексном загрязнении среды обитания [14] и действии отдельных токсикантов в лабораторных условиях [15]. В печени активность аминотрансфераз зависит от скорости утилизации продуктов реакции и уровня клеточного повреждения [16, 17]. Увеличение активности ЩФ печени в период активного роста и созревания гонад обусловлено ее важной ролью в минерализации скелета гидробионтов и процессах созревания [18]. Однако увеличение активности этого фермента в сыворотке крови показано при повреждении клеточных мембран, нарушении их целостности и проницаемости [17]. В наших исследованиях активность обеих аминотрансфераз была достоверно выше в печени морского ерша по сравнению с таковой у бычка-мартовика и бычка-кругляка (АЛТ – в 29 и 66 раз выше, АСТ – почти в 6 и 6.5 раз выше соответственно) (табл. 2). Выявленные различия могут быть следствием видовых особенностей скорости утилизации продуктов реакции трансаминирования у представителей разных таксономических групп в период нереста. Увеличение активности обеих трансаминаз было показано и ранее в печени морского ерша в нерестовый период (летом) по сравнению с активностью этих ферментов в преднерестовый период [19]. У спикары Spicara flexuosa отмечена противоположная зависимость, а у ставриды Trachurus mediterraneus – активность трансаминаз в печени была высокой в преднерестовый и нерестовый периоды и достоверно не отличалась [19]. В то же время высокая аминотрансферазная активность в печени морского ерша, однако в меньшей степени, может быть следствием компенсаторного увеличения активности этих ферментов – поставщиков пирувата, при окислительном повреждении гепатоцитов в условиях комплексного загрязнения б. Александровская. Содержание ТБК-активных продуктов в печени морского ерша ниже, чем у бычка-кругляка (рис. 1), однако уровень ОМБ увеличен по сравнению с таковым у бычка-мартовика (табл. 1). В работе польских авторов при действии хлорамина на рыб трех видов были также установлены межвидовые различия, которые заключались в увеличении активности аминотрансфераз, содержания окисленных форм белков и пирувата, и снижении концентрации лактата в печени кумжи Salmo trutta и хариуса Thymallus thymallus, тогда как для радужной форели Oncorhynchus mykiss отмечена обратная зависимость [16]. Результаты исследований авторы объясняют значительной ролью аминотрансфераз и лактат-пируватной конверсии в образовании пирувата для поддержания гомеостаза в клетках печени и энергетическом их обеспечении при действии хлорамина [16].
Сравнительный анализ исследуемых биомаркеров печени двух видов бычков не показал достоверных различий в активности АСТ, при этом активность АЛТ (табл. 2) была более чем в 2 раза, а ЩФ (табл. 2) – в 32 раза ниже в печени бычка-кругляка при высоком уровне ПОЛ (рис. 1) и ОМБ (табл. 1). Высокая активность ЩФ (табл. 2) в печени бычка-мартовика в период нереста, на фоне низких значений показателей тканевого повреждения, объясняется участием этого фермента в процессе созревания гонад. Увеличение активности ЩФ в преднерестовый и/или нерестовый периоды было также показано в печени черноморской ставриды Trachurus mediterraneus ponticus, рулены Symphodus tinca и спикары Spicara flexuosa [20]. Обратная зависимость, отмеченная для биомаркеров печени бычка-кругляка, может отражать как видовую особенность функционирования ферментов фосфорно-кальциевого обмена в период нереста, так и свидетельствовать о срыве АО защитной системы и повреждении клеток печени. В более ранних работах, посвященных исследованию трансаминаз и ЩФ в гонадах трех черноморских видов рыб в период нереста, уже сообщалось о низкой активности этих ферментов в гонадах самок бычка-кругляка по сравнению с таковой у морского ерша и морского налима Gaidropsarus mediterraneus (Linnaeus, 1758) [21]. В то же время снижение активности ЩФ было установлено в печени и почках некоторых видов рыб при действии тяжелых металлов и других загрязнителей, что авторы связывали с нарушением целостности клеточных мембран и снижением скорости трансфосфорилирования [22, 23]. Вероятно, низкая активность АЛТ (табл. 2.), ЩФ (табл. 2) и высокое содержание продуктов ПОЛ (рис. 1) и ОМБ (табл. 1) в печени бычка-кругляка являются результатом окислительного повреждения гепатоцитов и “утечки” ферментов из органа, что отражает видовые особенности функционирования защитных систем организма в условиях комплексного загрязнения б. Александровская. Таким образом, полученные нами межвидовые различия активности аминотрансфераз и ЩФ обусловлены особенностями метаболических превращений в печени исследуемых видов рыб в период нереста, а для бычка-кругляка – и окислительным повреждением гепатоцитов.
Другим важнейшим показателем, характеризующим состояние липидного обмена, является содержание в тканях рыб триглицеридов (ТГ). Накопление и расходование жировых запасов, в том числе ТГ, определяются физиологическим состоянием особей и зависят от сезона года, уровня антропогенной нагрузки в среде обитания [24] и стадии репродуктивного цикла [25]. ТГ являются одними из важнейших компонентов, необходимых для процессов вителлогенеза и биосинтеза половых гормонов [26]. В наших исследованиях содержание ТГ в печени нерестящихся самок бычка-кругляка более чем в 2.5 и 3 раза выше по сравнению с таковым в печени бычка-мартовика и морского ерша соответственно (табл. 2). Выявленные различия, вероятно, в большей степени обусловлены биологией каждого вида, чем влиянием комплексного загрязнения в среде обитания. Бычок-мартовик и морской ерш относятся к видам с единовременным икрометанием. Перед нерестом их ястыки содержат одноразмерные желтковые ооциты. Для бычка-кругляка характерно порционное икрометание, когда икра созревает и выметывается порциями. К началу нереста в его ястыках содержится несколько групп разноразмерных желтковых ооцитов [27]. Исследование липидного состава тканей самок бычка-кругляка из Азовского моря на протяжении растянутого порционного икрометания показало преобладание фракции ТГ (54–78% от суммы липидов) в зрелой икре и снижение содержания ТГ и фосфолипидов в гонадах к концу нереста, тогда как в печени уровень ТГ оставался высоким на протяжении всего нереста [25]. В связи с этим высокое содержание энергоемких компонентов – ТГ в печени самок бычка-кругляка – отражает значительную их роль в процессах повторного созревания ооцитов, характерного для порционно нерестящихся видов.
ЗАКЛЮЧЕНИЕ
Анализ полученных данных позволил установить определенные межвидовые отличия, которые могут быть связаны с особенностями биологии каждого вида и метаболических процессов в печени рыб в период нереста. В то же время более высокое содержание окисленных форм белков и ТБК-активных продуктов в супернатантах печени бычка-кругляка по сравнению с аналогичными показателями у бычка-мартовика и морского ерша могут отражать как видовые особенности протекания окислительных процессов в тканях представителей разных таксономических групп рыб, так и специфику функционирования АО защитной системы в условиях комплексного загрязнения б. Александровская, что требует дальнейших исследований.
Список литературы
Немова Н.Н., Высоцкая Р.У. Биохимическая индикация состояния рыб. М.: Наука. 2004. [Nemova N.N., Vysotskaya R.U. Biohimicheskaya indikaciya sostoyaniya ryb. [Biochemical indication of fish state] M. Nauka. 2004. (in Russ)].
Немова Н.Н., Мещерякова О.В., Лысенко Л.А., Фокина Н.Н. Оценка состояния водных организмов по биохимическому статусу. Труды КарНЦ РАН. 5: 18–29. 2014. [Nemova N.N., Meshcheryakova O.V., Lysenko L.A., Fokina N.N. Ocenka sostoyaniya vodnyh organizmov po biohimicheskomu statusu. [Assessment of aquatic organisms by biochemical profile] Trudy KarNC RAN. 5: 18–29. 2014. (in Russ)].
Овен Л.С., Руднева И.И., Шевченко Н.Ф. Ответные реакции морского ерша Scorpaena porcus (Scorpaenidae) на антропогенное воздействие. Вопр. ихтиол. 40(1): 75–78. 2000. [Owen L.S., Rudneva I.I., Shevchenko N.F. Otvetnye reakcii morskogo ersha Scorpaena porcus (Scorpaenidae) na antropogennoe vozdejstvie. [Response of Scorpaena porcus (Scorpaenidae) to anthropogenic impact] Vopr. ichthyol. 40(1): 75–78. 2000. (in Russ)].
Экотоксикологические исследования прибрежной черноморской ихтиофауны в районе Севастополя. Под ред. И.И. Рудневой. М.: ГЕОС. 2016. [Ekotoksikologicheskie issledovaniya pribrezhnoj chernomorskoj ihtiofauny v rajone Sevastopolya. Pod red. I.I. Rudnevoj. [Ecotoxicological studies of nearshore Black Sea ichthyofauna in the Sevastopol area. I.I. Rudneva (ed).] Moscow. GEOS. 2016. (in Russ)].
Малахова Л.В., Скуратовская Е.Н., Малахова Т.В., Болтачев А.Р., Лобко В.В. Хлорорганические соединения в ерше Scorpaena porcus Linnaeus, 1758 в акватории Cевастополя (Черное море): пространственное распределение и биологический отклик на уровень накопления загрязнителей. Морской биологический журнал. 3(4): 51–63. 2018. [Malakhova L.V., Skuratovskaya E.N., Malakhova T.V., Boltachev A.R., Lobko V.V. Organochlorine compounds in scorpion fish Scorpaena Porcus Linnaeus, 1758 in the Sevastopol marine area (black sea): spatial distribution and biological response. Sea biological journal. 3(4): 51–63. 2018 (in Russ)].
Санитарно-биологические исследования прибрежных акваторий юго-западного Крыма в начале ХХI века. Под ред. О.Г. Миронова, С.В. Алёмова. Симферополь: ИТ “АРИАЛ”. 2018. [Sanitarno-biologicheskie issledovaniya pribrezhnyh akvatorij yugo-zapadnogo Kryma v nachale ХХI veka. Pod red. O.G. Mironova, S.V. Alyomova. [Sanitary and biological studies of coastal areas of south-western Crimea at the beginning of the XXI century. O.G. Mironov, S.V. Alyo-mov (Eds.)] Simferopol’: IT “ARIAL”. 2018. (in Russ)].
Королюк М.А., Иванова Л.И., Майорова И.Г., Токарев В.Е. Метод определения активности каталазы. Лабораторное дело. 1: 16–19. 1988. [Korolyuk M.A., Ivanova L.I., Majorova I.G., Tokarev V.E. Metod opredeleniya aktivnosti katalazy. [Method for determining catalase activity] Laboratornoe delo. 1: 16–19. 1988 (in Russ)].
Практикум по физико-химическим методам в биологии. Под ред. Ф.Ф. Литвина. М.: МГУ. 1981. [Praktikum po fiziko-himicheskim metodam v biologii. Pod red. F.F. Litvina. [Tutorial on Physical and Chemical Methods in Biology. F.F. Litvin (Ed.)] M.: MGU. 1981 (in Russ)].
Дубинина Е.Е., Бурмистов С.О., Ходов Д.А., Поротов И.Г. Окислительная модификация белков сыворотки крови человека, метод ее определения. Вопросы мед. химии. 1: 24–26. 1995. [Dubinina E.E., Burmistov S.O., Hodov D.A., Porotov I.G. Okislitel’naya modifikaciya belkov syvorotki krovi cheloveka, metod eyo opredeleniya. [Oxidative modification of proteins of human blood serum, method of its determination.] Voprosy med. chem. 1: 24–26. 1995 (in Russ)].
Стальная И.Д., Гаришвили Т.Г. Метод определения малонового диальдегида с помощью тиобарбитуровой кислоты. Современные методы в биохимии. М.: Медицина. 1977. [Stalnaya I.D., Garishvili T.G. Metod opredeleniya malonovogo dial’degida s pomoshch’yu tiobarbiturovoj kisloty. Sovremennye metody v biohimii. [Method of determining malonic dialdehyde with thiobarbituric acid. Modern methods in biochemistry] M.: Medicina. 1977 (in Russ)].
Меньщикова Е.Б., Зенков Н.К., Ланкин В.З., Бондарь И.А., Труфакин В.А. Окислительный стресс: патологические состояния и заболевания. Новосибирск: АРТА. 2008. [Menshchikova E.B., Zenkov N.K., Lankin V.Z., Bondar I.A., Truphakin V.A. Okislitelnyj stress: patologicheskie sostoyaniya i zabolevaniya. [Oxidative stress: pathological states and diseases]. Novosibirsk: ARTA. 2008 (in Russ)].
Скуратовская Е.Н. Состояние антиоксидатной ферментной системы крови черноморских рыб в условиях комплексного хронического загрязнения: автореф. дис. канд. биол. наук. Одесса. 2009. [Skuratovskaya E.N. Sostoyanie antioksidatnoj fermentnoj sistemy krovi chernomorskih ryb v usloviyah kompleksnogo hronicheskogo zagryazneniya. [State of the antioxidant enzyme blood system of Black Sea fish in conditions of complex chronic pollution. PhD thesis in Biol. Sciences]. avtoref. dis. kand. biol. nauk. Odessa. 2009 (in Russ)].
Ковыршина Т.Б. Применение биомаркеров бычка-кругляка (Neogobius melanostomus (Pallas, 1814)) для оценки экологического состояния прибрежных вод Черного и Азовского морей: автореф. дис. канд. биол. наук. Севастополь. 2017. [Kovyrshina T.B. Primenenie biomarkerov bychka-kruglyaka (Neogobius melanostomus (Pallas, 1814)) dlya ocenki ekologicheskogo sostoyaniya pribrezhnyh vod Chernogo i Azovskogo morej. [Application of biomarkers of Neogobius melanostomus (Pallas, 1814) for assessment of ecological state of coastal waters of Black and Azov seas. PhD thesis in Biol. Sciences]. avtoref. dis. kand. biol. nauk. Sevastopol. 2017. (in Russ)].
Ismail N.M., Ali S.E., Mohamed I.K. Biochemical and histological biomarker approaches in the assessment of the water pollution in some lined and unlined watercourses of Egypt. Int. J. Fish. Aquat. Stud. 5(3): 288–296. 2017.
Shirmohammadi M., Salamat N., Ronagh M.T., Movahedinia A., Hamidian G. Effect of phenanthrene on the tissue structure of liver and aminotransferase enzymes in yellowfin seabream (Acanthopagrus latus). Iranian Journal of Toxicology. 11(4): 33–41. 2017.
Tkachenko H., Kurhaluk N., Grudniewska J. Effects of chloramine-T exposure on oxidative stress biomarkers and liver biochemistry of rainbow trout, Oncorhynchus mykiss (Walbaum), brown trout, Salmo trutta (L.), and grayling, Thymallus thymallus (L.). Arch. Pol. Fish. 21: 41–51. 2013.
Dey S., Samanta P., Pal S., Mukherjee A.K., Kole D., Ghosh A.R. Integrative assessment of biomarker responses in teleostean fishes exposed to glyphosate-based herbicide (Excel Mera 71). Emerg. Contam. 2: 191–203. 2016.
Zikic R.V., Stajn S., Pavlovic Z., Ognjanovic B.I., Saicic Z.S. Activities of superoxide dismutase and catalase in erythrocytes and plasma transaminases of goldfish (Carassius auratus gibelio Bloch.) exposed to cadmium. Physiol. Res. 50(1): 105–111. 2001.
Дорохова И.И. Сезонные изменения активности аминотрансфераз в печени некоторых черноморских рыб. Біологічні системи. 4(4): 371–374. 2012. [Dorohova I.I. Sezonnye izmeneniya aktivnosti aminotrasferaz v pecheni nekotoryh chernomorskih ryb. [Seasonal changes in the activity of aminotrasferases in the liver of some Black Sea fish]. Biological system. 4(4): 371–374. 2012. (in Russ)].
Кузьминова Н.С. Зависимость активности щелочной фосфатазы от биоэкологических особенностей черноморских рыб. Вопр. ихтиол. 56(2): 217–222. 2016. [Kuzminova N.S. Dependence of alkaline phosphatase activity on bioecological parameters of Black Sea fish. Journal of Ichthyology. 56(2): 217–222. 2016. (in Russ)].
Дорохова И.И. Влияние антропогенного загрязнения акваторий на активность некоторых ферментов в гонадах нерестящихся рыб. Актуальные проблемы экологии и сохранения биоразнообразия России и сопредельных стран: Мат. Всерос. науч. конф. с Международным участием. Владикавказ. 11: 81–84. 2015. [Dorohova I.I. Vliyanie antropogennogo zagryazneniya akvatorij na aktivnost nekotoryh fermentov v gonadah nerestyashchihsya ryb. Aktualnye problemy ekologii i sohraneniya bioraznoobraziya Rossii i sopredel’nyh stran: Mat. Vseros. nauch. konf. s Mezhdunarodnym uchastiem. [The effect of anthropogenic pollution of water areas on the activity of some enzymes in the gonads of spawning fish. Current Problems of Ecology and Biodiversity Conservation of Russia and Neighbouring Countries: Proceedings of the All-Russian Scientific Conference with International Participation]. Vladikavkaz. 11: 81–84. 2015. (in Russ)].
Kumar R., Gupta A.K., Muni A., Ranjana Physiological dysfunction in a few tissues of Notopterus notopterus after chronic exposure of malathion. Pool. Res. 16 (3): 145–147. 1997.
Mir G.H., Tharani M., Hussain A., Ahmad Y., Rashid A. Variations in acid phosphatase (ACP) and alkaline phosphatase (ALP) activities in liver and kidney of a fresh water fish Labeo rohita expoxed to heavy metal concentrations. European Journal of Pharmaceutical and Medical Research. 3(3): 398–401. 2016.
Gaber H.S., Rizkalla E.H., Fahmy B.A.G. Comparative study on some histological and biochemical aspects in fishes from Qarun and Bardawil lakes. Egypt. J. Aquat Biot. & Fish. 8(4): 1–35. 2004.
Чепурнов А.В., Ткаченко Н.К. Изменения в составе липидов самок и самцов черноморского бычка-кругляка в период нереста и раннего онтогенеза. Биохимические и эколого-физиологические исследования рыб и беспозвоночных: материалы всесоюз. симпоз. по изученности Черного и Средиземного морей, использованию и охране их ресурсов. Севастополь: тез. докл. Киев, Ч. 2: 212–216. 1973. [Chepurnov A.V., Tkachenko N.K. Izmeneniya v sostave lipidov samok i samcov chernomorskogo bychka-kruglyaka v period neresta i rannego ontogeneza. Biohimicheskie i ekologo-fiziologicheskie issledovaniya ryb i bespozvonochnyh. Materialy vsesoyuz. simpoz. po izuchennosti Chernogo i Sredizemnogo morej, ispol’zovaniyu i ohrane ih resursov. [Changes in the composition of lipids of females and males of the Black Sea Neogobius melanostomus during the period of spawning and early ontogenesis. Biochemical and ecological-physiological studies of fish and invertebrates: Proceedings of the All-Union symposium on the study of the Black Sea and the Mediterranean Sea, the use and protection of their resources] Sevastopol. tez. dokl. Kiev, Part. 2: 212–216. 1973 (in Russ)].
Svoboda M., Kouřil J., Hamáčkova J., Kalab P., Savina L., Svobodova Z., Vykusova B. Biochemical profile of blood plasma of tench (Tinca tinca L.) during pre- and postspawning period. Acta vet. Brno. 70: 259–268. 2001.
Калинина Э.М. Размножение и развитие азово-черноморских бычков. Киев: Наук. думка. 1976. [Kalinina E.M. Razmnozhenie i razvitie azovo-chernomorskih bychkov. [Reproduction and development of Azov-Black Sea pigfish]. Kiev: Nauk. dumka. 1976 (in Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


