Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 4, стр. 299-302
ВОЗМОЖНАЯ ВЗАИМОСВЯЗЬ МЕЖДУ ПОЛИМОРФИЗМОМ ВНЕКЛЕТОЧНО РЕГИСТРИРУЕМЫХ ПОТЕНЦИАЛОВ ДЕЙСТВИЯ И ОРГАНИЗАЦИЕЙ Т-СИСТЕМЫ МИОЦИТОВ ЖЕЛУДОЧКОВ И ПРЕДСЕРДИЙ СЕРДЦА КРЫСЫ
И. В. Кубасов 1, *, М. Г. Добрецов 1, Д. Е. Бобков 2, А. А. Панов 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова
194223 Санкт-Петербург, Россия
2 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: kubasov_igor@mail.ru
Поступила в редакцию 28.01.2020
После доработки 16.03.2020
Принята к публикации 17.03.2020
В кардиомиоцитах желудочков и предсердий сократительные ответы обеспечиваются за счет механизма кальций-индуцированного освобождения кальция из внутриклеточных депо (саркоплазматического ретикулума) после деполяризации мембраны миоцита распространяющимися потенциалами действия (ПД). Т-система (сеть поперечных и продольных инвагинаций наружной плазматической мембраны в глубину миоцита) играет ключевую роль в быстрой и равномерной деполяризации сердечных миоцитов. На мембране поперечных инвагинаций (t-трубочек) локализованы потенциал-зависимые Ca2+-каналы L‑типа, обращенные в сторону рианодиновых рецепторов саркоплазматического ретикулума, а также Na+/Ca2+-обменник и ряд других ион-транспортирующих систем [1]. Регистрация электрогенеза в этом компартменте и его анализ представляет собой исключительно важную задачу не только в теоретическом, но и практическом плане, поскольку ряд сердечных заболеваний (ишемия, инфаркт миокарда, сердечная недостаточность и др.) сопровождается выраженными структурными изменениями в t-трубочках кардиомиоцитов [2]. Имеющиеся данные относительно характеристик ПД интактных миоцитов предсердий и желудочков весьма противоречивы [3, 4], поскольку использованные в этих и большинстве других исследований подходы не предоставляют информацию о вкладе электрогенеза Т-системы в формирование ПД кардиомиоцитов in situ. В этом отношении внеклеточная микроэлектродная регистрация (loose patch метод) выступает как перспективный неинвазивный метод, позволяющий решать широкий круг задач, недоступных при использовании большинства существующих электрофизиологических методов. В частности, как было показано нами ранее, он позволяет выявлять компоненты ПД, связанные с активностью электрогенных механизмов мембраны Т-системы интактных скелетных мышечных волокон и вентрикулярных кардиомиоцитов [5, 6]. Известно, что Т-система кардиомиоцитов предсердий развита значительно слабее, чем желудочков [7]. Учитывая, что токи через ионные каналы тубулярного компартмента вносят существенный вклад в формирование ПД, есть основание ожидать существенных различий между ПД предсердий и желудочков, регистрируемых с применением указанного метода. Такой подход важен и для понимания эволюционных аспектов морфофункциональных изменений электрогенеза Т-системы кардиомиоцитов, который у грызунов существенно отличается, по сравнению с более крупными млекопитающими, включая человека.
С целью проверки этого предположения нами было выполнено комплексное исследование, включающее электрофизиологические эксперименты (loose patch метод), конфокальную микроскопию и компьютерно-графическое моделирование. Электрофизиологические эксперименты и конфокальная микроскопия проводились на изолированных сердцах крыс в условиях ретроградной перфузии по Лангендорфу, как описано ранее [6]. Подавление сокращений сердца во время эксперимента обеспечивалось добавлением в перфузирующий раствор блокатора миозиновой АТФазы 2,3-бутандион моноксима (BDM, Sigma) в концентрации 20 мМ/л. В электрофизиологических экспериментах в каждом опыте было исследовано по 2–3 локуса, случайно выбранных на поверхности левого предсердия или желудочка и разделенных между собой расстоянием ≅2 мм. В пределах каждого локуса регистрировались ответы от 5 до 10 сайтов с шагом смещения кончика микроэлектрода 10–50 мкм. Перемещение микроэлектрода осуществлялось при помощи микроманипулятора NMH-21 (Narishige, Япония). Сигнал подавался на вход усилителя АM-1500 (National Instruments, США) и оцифровывался при помощи аналого-цифрового преобразователя NI USB-6211 (National Instruments, США). Обработка данных проводилась с использованием программных пакетов Clampfit и Origin 7.5. Данные были проверены на нормальность распределения (критерий Шапиро–Уилка). В соответствии с результатами этой проверки различия между значениями в контрольной и экспериментальной группах принимали как достоверные при p < 0.05, используя U-критерий Манна–Уитни. Представленные в тексте и на рисунке данные приведены в виде средних значений и их ошибок, сопровождаемые (в скобках через запятую) величинами нижнего и верхнего пределов 95%-го доверительного интервала.
Для оценки плотности устьев t-трубочек на поверхности интактных кардиомиоцитов использовался флуоресцентный краситель Di-8-ANEPPS (Santa Cruz Biotechnology Inc., США) в концентрации 20 мкМ/л. Изолированное сердце, загруженное красителем путем его добавления в перфузирующий раствор, размещалось в чашке Петри (Westfield Medical, Германия, #39389) на столике конфокального микроскопа Leica TCS SP5 (Leica, Германия). Цифровые фотографии поверхности левого желудочка и предсердия всех исследованных сердец были получены от 8–11 произвольно выбранных районов (400 × 400 мкм; 60× объектив).
Координаты устьев t-трубочек вычисляли с помощью функции Find Maxima программного пакета ImageJ (NIH, http://rsb.info.nih.gov/ij). Расчет вероятности распределения устьев t-трубочек под микроэлектродом проводился с использованием метода Монте-Карло и научных пакетов NumPy, SciPy и Pandas для языка программирования Python (Python Software Foundation, https://www.python.org).
На представленном рисунке приведены примеры полученных нами конфокальных изображений поверхности левого желудочка и предсердия (рис. 1а и 1b соответственно). Отчетливо видны множественные входы устьев t-трубочек на поверхности кардиомиоцитов желудочка и их крайне низкая плотность в кардиомиоцитах предсердия, что соответствует данным и других авторов [7].
Рис. 1.
Предполагаемая связь между разнообразием форм внеклеточно регистрируемых ПД и вероятностью локальной регистрации от районов поверхности кардиомиоцита содержащих разное количество устьев t-трубочек.
а, b – конфокальные изображения поверхности желудочка (а) и предсердия (b) изолированного сердца крысы. На вставках показаны примеры произвольно выбранных районов, подготовленных для дальнейшего Mонте-Карло анализа вероятности случайного позиционирования кончика регистрирующего электрода в районе клетки, содержащем 0, 1, 2 и т.д. устьев t-трубочек. c, d – гистограммы вероятности случайного контакта регистрирующего электрода с поверхностью желудочкового (c) или предсердного (d) кардиомиоцита в районе, содержащем определенное количество устьев t-трубочек (наружный диаметр кончика электрода – 5 мкм, оценочные величины его внутреннего диаметра и площади – 3.3 мкм и 9 мкм2 соответственно [6]). Распределения построены на основе усреднения результатов компьютерно-графического анализа полученных конфокальных изображений. На вставках – примеры основных форм внеклеточно регистрируемых ПД. Каждый трек – результат усреднения 6–20 нормированных регистраций, полученных в разных сайтах/экспериментах в соответствующих отделах сердца. По оси ординат – время, мс. Остальные пояснения – в тексте.
Fig. 1. Proposed relationship between the variability in forms of extracellularly recorded APs and the probability of local recording from the cardiomyocyte surface regions containing the different number of t-tubular mouths.
a, b – confocal images of the ventricular (a) and atrial (b) surface of the isolated rat heart. Insets exemplify arbitrarily selected regions processed for the subsequent Monte-Carlo analysis of the random positioning probability of the recording pipette tip in the cell surface region containing 0, 1, 2 and more t-tubular mouths. c, d – frequency distributions of the random recording probability from the surface region of the ventricular (с) or atrial (d) cardiomyocyte containing the predetermined number of t-tubular mouths (Monte Carlo simulation; pipette outer tip diameter – 5 µm; estimated inner tip diameter and area – 3.3 µm and 9 µm2, respectively [6]). Insets exemplify main forms of extracellularly recorded APs. Each track results from averaging 6–20 normalized recordings obtained in different sites/experiments in the respective cardiac regions. Ordinate – time, ms. See text for the other details.
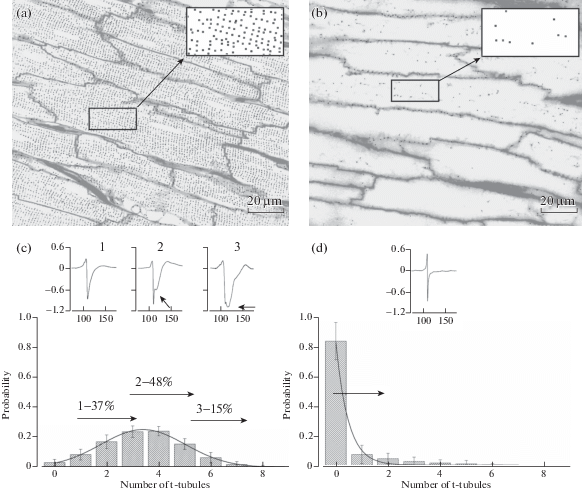
Внеклеточно регистрируемые ПД кардиомиоцитов левого желудочка сердца представляли собой полифазные сигналы с наиболее выраженной как по амплитуде, так и по форме негативной фазой. В 37% из общего количества 84-х регистраций эта фаза сигнала была представлена только одним пиком. Оставшаяся часть регистрируемых ПД (63%) характеризовалась наличием двух выраженных негативных компонентов: быстрого первичного пика и вторичного пика. Последний обычно уступал по амплитуде первому пику (48% всех регистраций), но мог быть и выше (15% всех регистраций). Эти варианты сигналов были условно классифицированы нами как ПД 1-го, 2-го и 3-го типов (см. вставки на рис. 1c). По всей выборке (5 сердец, 84 сайта) средние значения длительности восходящей фазы (Тв), и времени спада до 50 и 90% (T50 и T90) ПД вентрикулярных кардиомиоцитов составляли соответственно 2.6 ± 0.3 (2.0, 3.2), 9.9 ± 0.7 (8.5, 11.4) и 27.3 ± 3.3 (20.9, 33.8) мс. В контраст с описанным выше, все внеклеточно регистрируемые ПД от левых предсердий (5 сердец, 35 сайтов), представляли собой сигналы с одним негативным пиком (рис. 1d, вставка). В 15% регистраций небольшой перегиб на спаде первого негативного пика давал намек на присутствие второго негативного компонента сигнала, но ни в одной из регистраций этот компонент не был выражен как самостоятельный пик. Средние по всей выборке значения Tв, T50 и T90 ПД кардиомиоцитов предсердий составляли 1.0 ± 0.1 (0.7, 1.3), 1.9 ± 0.3 (1.4, 2.4) и 5.4 ± 0.7 (3.9, 6.9) мс соответственно. Это достоверно ниже аналогичных значений для ПД вентрикулярных кардиомиоцитов (критерий Манна–Уитни; р < 0.001).
Ранее нами было показано, что в кардиомиоцитах желудочков изолированного сердца крысы при использовании микроэлектродов диаметром 2–5 мкм отчетливо регистрируются двухпиковые ответы [6]. Выполненный в данной работе фармакологический анализ природы этих пиков дает основания полагать, что первый пик обусловлен активацией натриевых токов, распространяющихся по наружной плазматической мембране ПД, а второй пик связан с активацией кальциевых каналов в t‑трубочках. Однако за рамками выполненных исследований остался вопрос о природе существенной вариации формы ПД, регистрируемых от разных сайтов. Компьютерно-графическое моделирование (рис. 1c, 1d), проведенное в данной работе с использованием конфокальных изображений интактных кардиомиоцитов, позволяет высказать предположение, что природа такого полиморфизма ПД в значительной степени связана с вариацией в количестве устьев t-трубочек на поверхности миоцита под регистрирующим электродом. Действительно, в наших экспериментах с кардиомиоцитами желудочков встречаемость ПД 1-го типа (37% от всех отведений) представляется очень близкой к вероятности отведения от 1–3 выходов t-трубочек. Встречаемость ПД 2-го типа (48% всех ответов) соответствует вероятности отведения от 3–5 t-трубочек. Частота наблюдений сигналов 3-го типа (15%) предполагает локализацию под электродом 5–9 выходов t-трубочек. Наконец, в кардиомиоцитах предсердий, где Т-система развита слабо, регистрировались только быстрые однопиковые сигналы. Полученные данные не только подтверждают наше предположение о существовании различий между внеклеточно регистрируемыми ПД кардиомиоцитов предсердий и желудочков сердца крыс, но и дают возможный ответ на вопрос о природе вариаций формы этих ПД в пределах одного желудочка и отсутствия таковых в пределах предсердия. Таким образом, строение Т-системы представляется важнейшей детерминантой электрогенеза мембраны и формирования ПД кардиомиоцитов.
Список литературы
Brette F., Orchard C. T-Tubule Function in Mammalian Cardiac Myocytes. Circ. Res. V. 92: 1182–1192. 2003.
Ibrahim M., Gorelik J., Yacoub M.H., Terracciano C.M. The structure and function of cardiac t-tubules in health and disease. Proc. R. Soc. B. Biol. Sci. 278: 2714–2723. 2011.
Knollmann B.C., Schober T., Petersen A.O., Sirenko S.G., Franz M.R. Action potential characterization in intact mouse heart: steady-state cycle length dependence and electrical restitution. Am. J. Physiol. Heart Circ. Physiol. 292: 614–621. 2007.
Walden A.P., Dibb K.M., Trafford A.W. Differences in intracellular calcium homeostasis between atrial and ventricular myocytes. J. Mol. Cell. Cardiol. 46: 463–473. 2009. https://doi.org/10.1016/j.yjmcc.2008.11.003
Kubasov I.V., Dobretsov M. Two types of extracellular action potentials recorded with narrow-tipped pipettes in skeletal muscle of frog, Rana temporaria // J. Physiol. 590: 937–944. 2012.
Kubasov I.V., Stepanov A., Bobkov D., Radwanski P.B., Terpilowski M.A., Dobretsov M., Gyorke S. Sub-cellular Electrical Heterogeneity Revealed by Loose Patch Recording Reflects Differential Localization of Sarcolemmal Ion Channels in Intact Rat // Front. Physiol. 2018. https://doi.org/10.3389/fphys.2018.00061
Smyrniasa I., Maira W., Harzheima D., Walkera S.A., Rodericka H.L., Bootman M.D. Comparison of the T-tubule system in adult rat ventricular and atrial myocytes and its role in excitation–contraction coupling and inotropic stimulation // Cell Calcium. 47: 210–223. 2010.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


