Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 1, стр. 53-62
ВОЗРАСТ-ЗАВИСИМЫЕ ИЗМЕНЕНИЯ РОЛИ КАЛИЕВЫХ КАНАЛОВ В ДИЛАТАЦИИ ПИАЛЬНЫХ АРТЕРИЙ НА АЦЕТИЛХОЛИН У КРЫС WKY И SHR
О. П. Горшкова *
Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: o_gorshkova@inbox.ru
Поступила в редакцию 27.06.2020
После доработки 10.09.2020
Принята к публикации 28.09.2020
Аннотация
Изучалось изменение роли BKCa-каналов и NO в опосредованной ацетилхолином (АХ) дилатации пиальных артериальных сосудов крыс при старении в отсутствие и в условиях длительно текущей АГ. С использованием метода прижизненной микрофотосъемки (×470) проведена сравнительная оценка реакций пиальных артерий на ацетилхолин хлорид (АХ, 10–7 М, 5 мин) в отсутствие и на фоне блокады ВКCa-каналов (тетраэтиламмоний хлорид, 2 мМ) и NO (L-NAME, 10–3 М) у нормотензивных крыс Wistar-Kyoto (WKY) и спонтанно гипертензивных крыс SHR в возрасте 4 и 20 мес. Об изменении роли ВКСa-каналов и NO в дилатации сосудов судили по изменению числа и степени дилатации артерий в ответ на действие АХ после применения блокаторов, измеряя ширину потока эритроцитов в 3 отдельных группах артерий: мелких (диаметр менее 20 мкм), средних (20–40 мкм) и крупных (более 40 мкм). Установлено, что у крыс WKY старение приводит к подавлению роли ВКСа-каналов в АХ-опосредованной дилатации пиальных артериальных сосудов всех диаметров. Аналогичные процессы обнаружены в пиальном сосудистом русле молодых крыс SHR. Изменения роли BKСа-каналов в дилататорных ответах сосудов у стареющих крыс WKY и молодых крыс SHR во многом сопряжены с нарушением системы синтеза оксида азота и изменением роли NO-опосредованных механизмов в дилатации. Старение у крыс SHR сопровождается усилением вклада NO-зависимого механизма в регуляции АХ-опосредованных дилататорных реакций мелких пиальных артериальных сосудов.
ВВЕДЕНИЕ
Смертность от заболеваний сердечно-сосудистой системы у пожилых людей составляет более 40% [1]. Понимание механизмов, лежащих в основе возрастных изменений сосудистых реакций, открывает перспективы для снижения этого показателя. Частота встречаемости артериальной гипертонии (АГ), являющейся фактором риска развития различного вида цереброваскулярной патологии [2, 3], в группах людей старшего возраста составляет около 60% [4]. В экспериментальных работах, проведенных с использованием спонтанно гипертензивных крыс, и клинических исследованиях показано, что при развитии АГ происходит разрежение микрососудистой сети в ткани головного мозга, ремоделирование сосудистого русла и нарушение регуляции тонуса церебральных сосудов [5, 6]. АГ во многом связана с дисбалансом между вазодилататорными и вазоконстрикторными механизмами. В изучении изменений регуляции сосудистого тонуса, развивающихся при различных формах АГ, большое значение придается исследованию прессорных механизмов. Гораздо меньше внимания уделяется вазодилатации. Выявление возрастных изменений вазодилататорных механизмов сосудов головного мозга может способствовать пониманию процессов, лежащих в основе возникновения осложнений АГ, связанных с локальным сужением или закрытием мелких мозговых сосудов и развитием эпизодов очаговой ишемии. Важнейшими элементами, определяющими состояние сосудистого тонуса, являются ионные каналы, экспрессируемые как в эндотелиальных, так и в сосудистых гладкомышечных клетках (ГМК). Для системы контроля АД большое значение играет вазодилататорный механизм, основанный на активации кальций-чувствительных калиевых каналов большой проводимости (BKCa). Согласно современным представлениям эти каналы играют ключевую роль в интеграции и передаче генерируемой в эндотелии химической сигнализации к нижележащим ГМК сосудов [7]. Одним из основных вазодилататоров, влияющих на активность BKCa-каналов, является оксид азота. В сосудах головного мозга NO может активировать BKCa-каналы либо непосредственно [8], либо через PKG-зависимые механизмы [9, 10]. Также NO может стимулировать чувствительные к рианодину запасы Са2+ в саркоплазматическом ретикулуме, вызывая дискретные кальциевые токи, активирующие соседние кластеры каналов BKCa [8]. Изменение активности BKCa-каналов, в свою очередь, может стимулировать или ограничивать NO-зависимую дилатацию сосудов [11]. Возникновение возрастной эндотелиальной дисфункции (ЭД), лежащей в основе возникновения и развития АГ, часто связывают со снижением продукции и/или биодоступности NO [12]. Но особенности NO-опосредованной вазорелаксации при старении, а также в условиях длительно текущей АГ, и роли кальций-чувствительных K+ каналов в этих процессах изучены мало.
Целью данной работы было сравнительное изучение изменения роли BKCa-каналов в NO-опосредованной дилатации мозговых сосудов при старении в отсутствие и в условиях длительно текущей АГ. В качестве модели АГ использовались спонтанно гипертензивные крысы (SHR) как наиболее приемлемая биологическая модель эссенциальной гипертонии у человека, отражающая нарушения механизмов сосудистой регуляции, нормотензивным контролем к которым служат крысы Wistar-Kyoto (WKY) [13]. В задачи исследования входило изучение роли BKCa-каналов и NO в опосредованной ацетилхолином (АХ) дилатации пиальных артериальных сосудов у крыс WKY и SHR в возрасте 4 и 20 мес.
МАТЕРИАЛЫ И МЕТОДИКА
В исследовании использовались самцы нормотензивных крыс WKY (возраст: 4 мес (n = 14, масса 240 ± 35 г) и 20 мес (n = 12, масса 340 ± 20 г)) и спонтанно гипертензивных крыс SHR (возраст: 4 мес (n = 14, масса 245 ± 15 г) и 20 месяцев (n = 14, масса 350 ± 35 г)) из ЦКП “Биоколлекция ИФ РАН”. Работа выполнена в соответствии с “Правилами проведения работ с использованием экспериментальных животных”, принятыми Европейской конвенцией 19.07.2014 г., и требованиями Комиссии по контролю над содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова РАН. Животных содержали в стандартных условиях вивария при свободном доступе к воде и пище по 6 особей в клетках Т4 на стандартной лабораторной диете в условиях искусственного освещения (цикл: 12 ч свет/12 ч темнота).
Перед началом эксперимента у ненаркотизированных животных с помощью прибора для неинвазивного измерения АД (“Систола”, Netrobotics, Россия) на хвосте измерялось среднее АД. При проведении исследования крыс наркотизировали хлоралгидратом (43 мг/100 г массы тела, внутрибрюшинно). На протяжении всего времени эксперимента у наркотизированных крыс среднее АД измеряли инвазивным методом через катетер в бедренной артерии, соединенный с датчиком DTXPlusTM (Argon Critical Care Systems, Сингапур), подключенным к компьютеру, работающему с оригинальной программой визуализации значений АД, разработанной в нашей лаборатории. Данные по измерению АД у крыс WKY и SHR представлены в табл. 1.
Таблица 1.
Показатели среднего артериального давления у крыс SHR и WKY, мм рт ст.
| WKY | SHR | |||
|---|---|---|---|---|
| 4 мес (n = 14) | 20 мес (n = 12) | 4 мес (n = 14) | 20 мес (n = 14) | |
| Ненаркотизированные крысы | 115.5 ± 2.1 | 107.8 ± 3.6 | 143.6 ± 2.4 | 157.1 ± 2.4 |
| Наркотизированные крысы | 107.6 ± 1.1 | 105.9 ± 3.3 | 122.6 ± 2.4 | 123.8 ± 2.2 |
Для исследования пиальных сосудов в теменной области черепа животного высверливали отверстие площадью 2 см2, твердую мозговую оболочку в пределах которого удаляли. Визуализацию сосудов (×470) проводили с помощью оригинальной установки, включающей стереоскопический микроскоп MC-2ZOOM (“Микромед”, Россия), цветную камеру – видеоокуляр для микроскопа DCM-510 (Scopetek, Китай) и персональный компьютер. У каждого животного фиксировали фоновое изображение сосудов в стандартных условиях при непрерывном орошении поверхности мозга раствором Кребса (t = 37°С) и реакцию на воздействие. При проведении эксперимента крысы разделялись на 8 отдельных групп. У первых 4 групп (крысы в возрасте 4-х – WKY n = 6; SHR n = 7 и 20 мес – WKY n = 6; SHR n = 8) исследовали реакции сосудов на орошение поверхности головного мозга раствором ацетилхолин хлорида (Sigma, 10–7 М, 5 мин) в отсутствие и на фоне блокады ВКСa-каналов раствором тетраэтиламмоний хлорида (ТЕА, “Вектон”, Россия, 2 мМ, предварительное орошение поверхности мозга в течение 5 мин с последующим добавлением АХ в раствор блокатора). В 4 других группах (крысы в возрасте 4-х -WKY n = 8; SHR n = 7 и 20 мес -WKY n = 6; SHR n = 6) исследовали реакции сосудов на воздействие АХ в отсутствие и на фоне блокады eNOS раствором метилового эфира нитро-L-аргинина (L-NAME, ICN Biomed. Inc, 10–3 М). Для проведения блокады поверхность мозга в течение 10 мин предварительно орошали раствором L-NAME, после чего в раствор блокатора добавляли АХ. После регистрации реакции сосудов на воздействие АХ на фоне блокады eNOS, в реакционную среду вводили ТЕА, дополнительно блокируя ВКСa-каналы. Это позволило исследовать реакцию сосудов на воздействие АХ как на фоне блокады eNOS, так и на фоне совместного действия обоих блокаторов. Фоновую реакцию на воздействие АХ анализировали по всему массиву сосудов у 4-месячных (WKY n = 14; SHR n = 14) и по всему массиву сосудов у 18-месячных (WKY n = 12; SHR n = 14) крыс. Проверка по критерию Краскела–Уоллиса показала отсутствие значимых различий между отдельными животными в фоновых реакциях на воздействие АХ у крыс одного возраста. Общая продолжительность эксперимента составляла 60–90 мин, после чего животных усыпляли передозировкой раствора хлоралгидрата.
Диаметр измеряли на статических изображениях с помощью компьютерной программы для цитофотометрии “Photo M” (авторская разработка А. Черниговского, http://www.t_lambda.chat.ru), измеряя ширину потока эритроцитов, соответствующую внутреннему диаметру сосуда. Об изменении роли ВКСa-каналов и NO в дилатации сосудов судили по изменению числа дилатированных сосудов и степени их дилатации в ответ на воздействие АХ до и после применения блокаторов. Изменение количества расширившихся и сузившихся сосудов на воздействие выражалось в процентах относительно общего числа исследованных сосудов в группе. Степень дилатации ΔД оценивали как разность между значениями диаметра после (Д2) и до (Д1) воздействия АХ относительно диаметра сосуда Д1 перед воздействием АХ, %:
Изменения диаметра в покое не превышали 5.0 ± 0.5%, поэтому при таких значениях считали, что реакция на воздействие отсутствует.
У каждой крысы было измерено от 40 до 60 участков сосудов. Для последующего анализа измеренные сосуды были разделены на группы в соответствии с их диаметрами: мелкие сосуды (диаметром от 9 до 20 мкм), сосуды среднего диаметра (от 20 до 40 мкм) и крупные сосуды (более 40 мкм). Данные по отдельной группе сосудов усреднялись для каждого животного и использовались для статистических сравнений. Статистический анализ данных проводили с использованием пакета статистических программ Microsoft Excel 2019 и программы InStat 3.02 (“GraphPad Software Inc.”, США). Данные представляли в виде среднего арифметического значения и его ошибки. Применяли U-критерий Манна–Уитни (при сравнении 2 групп) и критерий Краскела–Уоллиса (при сравнении более 2 групп). Достоверным уровнем отличий считали вероятность не менее 95% (р < 0.05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование показало, что у крыс WKY количество расширенных на воздействие АХ пиальных артериальных сосудов в процессе старения снижается. Орошение поверхности головного мозга раствором АХ у молодых крыс WKY вызывало дилатацию в среднем 36.5 ± 2.7% сосудов (табл. 2).
Таблица 2.
Реакция пиальных артериальных сосудов на воздействие ацетилхолина, % от общего числа исследованных сосудов в каждой группе, M ± m
| Группы крыс | WKY | SHR | ||
|---|---|---|---|---|
| 4 мес (n = 14) | 20 мес (n = 12) | 4 мес (n = 14) | 20 мес (n = 14) | |
| Дилатация | 40.2 ± 2.1 | 25.6 ± 3.5* | 42.3 ± 1.8 | 21.9 ± 2.7### |
| Констрикция | 40.3 ± 3.6 | 54.4 ± 1.2* | 39.5 ± 1.6 | 64.9 ± 2.4### |
| Отсутствие реакции | 23.3 ± 1.8 | 20.1 ± 2.5 | 18.1 ± 1.1* | 13.2 ± 0.4 |
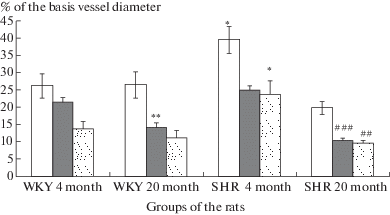
Преимущественно расширялись артерии средних диаметров (20–40 мкм). В этой группе АХ вызывал расширение 43.5 ± 2.7% артерий. В 2 других группах расширилось в среднем около 30% сосудов (рис. 1). Степень дилатации сосудов снижалась в направлении от мелких к более крупным (критерий Краскела–Уоллиса KW = 12.3, р < 0.001, рис. 2). В группе мелких пиальных артериальных сосудов в ответ на воздействие АХ диаметр увеличивался на 26.4 ± 3.5%, в группе крупных артерий – на 13.9 ± ± 2.1% (рис. 2).
Рис. 1.
Дилататорная реакция пиальных артериальных сосудов различных диаметров на воздействие АХ. Белая заливка – мелкие артерии диаметром до 20 мкм; темная заливка – средние артерии диаметром 20-40 мкм; точечная штриховка – крупные артерии диаметром более 40 мкм. * – Различия достоверны по отношению к соответствующим значениям у молодых крыс WKY; # – различия достоверны по отношению к соответствующим значениям у молодых крыс SHR; *(#)p < 0.05, **(##)p < 0.01 (U – критерий Манна–Уитни).
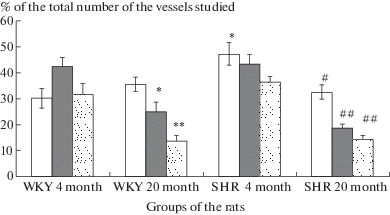
Рис. 2.
Амплитуда дилататорной реакции пиальных артериальных сосудов различных диаметров на воздействие АХ. По оси абсцисс – группы крыс, по оси ординат – % от исходного диаметра сосуда. Белая заливка – мелкие артериальные сосуды диаметром менее 20 мкм, серая заливка – средние артерии диаметром 20–40 мкм, точечная штриховка – крупные артерии диаметром более 40 мкм. * – Различия достоверны по отношению к соответствующим значениям у молодых крыс WKY; # – различия достоверны по отношению к соответствующим значениям у молодых крыс SHR; *(#)p < 0.05, **(##)p < 0.01, ***(###)p < 0.001 (U – критерий Манна–Уитни).
Применение ТЕА у молодых крыс WKY уменьшало количество расширившихся на воздействие АХ артерий всех диаметров (рис. 3а). Наибольшее уменьшение отмечалось у сосудов средних диаметров (с 43.5 ± 2.7 до 8.9 ± 0.7%). В этой группе артерий также достоверно снижалась и степень дилатации (рис. 4а). Количество крупных и мелких сосудов, расширившихся в ответ на воздействие АХ, на фоне ТЭА уменьшилось соответственно с 31.8 ± 2.2 до 9.5 ± 1.3 и с 30.4 ± 2.8 до 20.3 ± 2.4% без достоверного уменьшения степени реакции (рис. 3а, 4а). Следовательно, механизм АХ-опосредованной вазодилатации, связанный с активацией ВКса-каналов, у молодых крыс WKY преимущественно выражен в группе пиальных артериальных сосудов диаметром 20–40 мкм.
Рис. 3.
Изменение числа дилатированных пиальных артериальных сосудов различных диаметров на воздействие АХ в отсутствие и на фоне применения блокаторов у крыс разного возраста: a – крысы WKY, б – крысы SHR. По оси абсцисс – группы сосудов различных диаметров, по оси ординат – % от общего числа исследованных сосудов. Изменения значимы по сравнению с соответствующими данными при воздействии чистого АХ (*р < 0.05, **p < 0.01, ***p < 0.001, U-критерий Манна–Уитни).
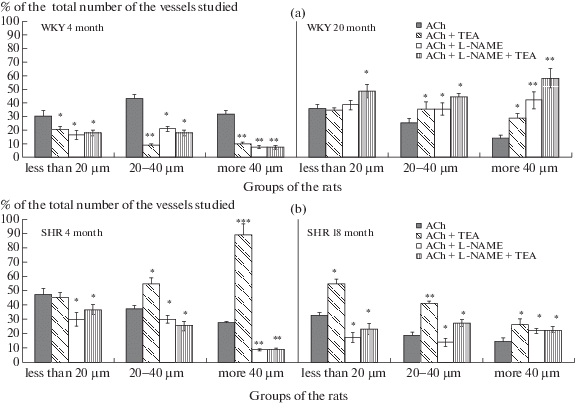
Рис. 4.
Изменение диаметра пиальных артериальных сосудов различных диаметров на воздействие АХ в отсутствие и на фоне применения блокаторов у крыс разного возраста: a – крысы WKY, b – крысы SHR. По оси абсцисс – группы сосудов различных диаметров, по оси ординат – диаметр артерий после воздействия АХ, % относительно их диаметра до воздействия АХ. Изменения значимы по сравнению с соответствующими данными при воздействии чистого АХ (*р < 0.05, **p < 0.01, U-критерий Манна–Уитни).
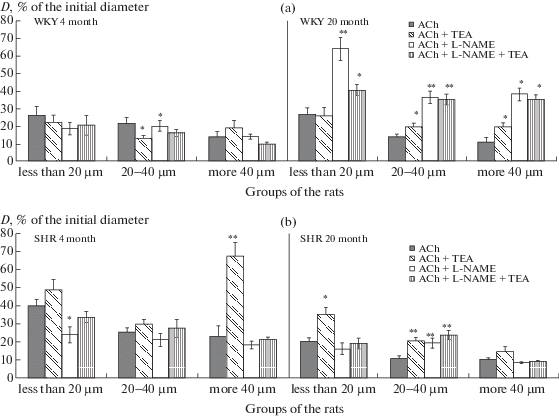
Блокада eNOS у 4-месячных крыс WKY уменьшала количество дилатаций на воздействие АХ во всех 3 группах сосудов без достоверного изменения степени реакции (рис. 3а, 4а). Наибольшее снижение количества расширившихся сосудов наблюдалось в группе крупных артерий (до 7.3 ± 0.6%). Количество дилатированных сосудов средних диаметров уменьшилось примерно в 2 раза; мелких – в среднем на 39.9%, и достоверно не отличалось от значений, полученных при применении блокатора ВКса-каналов (рис. 3а). При совместном применении L-NAME и ТЕА у молодых крыс WKY снижение количества расширившихся на воздействие АХ сосудов средних диаметров соответствовало данной величине при воздействии только одного блокатора eNOS, но было достоверно меньше значений, полученных в случае применения только блокатора ВКса-каналов (p = 0.01, U = 428, U-критерий Манна–Уитни, рис. 3а). Уменьшение количества и степени дилатации артерий мелких и крупных диаметров при одновременной блокаде eNOS и ВКса-каналов достоверно не отличалась от значений, полученных при применении каждого из блокаторов в отдельности (рис. 3а, 4а). Полученные данные указывают на ведущую роль механизма, связанного с активацией ВКса-каналов, в регуляции АХ-опосредованных дилататорных реакций сосудов средних диаметров у молодых крыс WKY. В группах пиальных сосудов мелких и крупных диаметров оба из исследованных механизмов выражены примерно в равной степени.
У 20-месячных крыс WKY по сравнению с более молодыми животными общее количество расширивших на воздействие АХ сосудов уменьшалось и составляло 25.6 ± 3.5% (табл. 2). Сопоставление реакций сосудов различных диаметров показало, что старение уменьшает количество расширившихся сосудов только в группах артерий средних и крупных диаметров (в среднем на 42.5 и 57.1% соответственно; (рис. 1)). В группе артерий 20–40 мкм также снижается степень дилатации (рис. 2).
Применение ТЭА у нормотензивных крыс в возрасте 20 мес достоверно не изменяло характер дилататорной реакции мелких сосудов, что свидетельствует о подавлении роли ВКСа-каналов в дилататорном ответе этих сосудов на воздействие АХ у стареющих животных. В группах артерий средних и крупных диаметров ТЕА, напротив, достоверно увеличивал количество расширившихся на воздействие АХ сосудов и степень их расширения (рис. 3а, 4а). В литературе имеются сведения о том, что у старых животных по сравнению с молодыми особями открыто больше K+-каналов [14]. Сверхактивация каналов может уменьшать миоэндотелиальную электрическую проводимость и снижать вазодилататорную реакцию [15, 16], что, вероятно, и является одной из причин обнаруженного нами уменьшения количества расширившихся на воздействие АХ сосудов в группах артерий средних и крупных диаметров. Блокада К+-каналов (таких как ВKСa, чувствительные к напряжению K+-каналы и др.) может приводить к деполяризации и восстановлению электрической проводимости до значений, не отличающихся от значений, наблюдаемых у молодых особей [14, 15, 17]. В группах сосудов средних и крупных диаметров в ответ на воздействие АХ на фоне применения ТЕА расширилось в среднем на 35.6 ± 4.5 и 28.6 ± 3.3% соответственно. Это достоверно не отличалось от значений, полученных на сосудах тех же групп у молодых крыс WKY без применения блокаторов (рис. 3а). Следует отметить, что используемый в наших экспериментах ТЕА не является селективным ингибитором ВKса-каналов и может воздействовать также и на другие группы калиевых каналов. Таким образом, полученные данные могут указывать на изменение активности калиевых каналов у 20-ти месячных крыс WKY, вероятно, лежащее в основе снижения уровня АХ-опосредованной дилатации пиальных артериальных сосудов средних и крупных диаметров.
На фоне блокады синтеза NO у крыс WKY в возрасте 20 мес количество расширившихся в ответ на воздействие АХ мелких сосудов достоверно не изменялось. Что свидетельствует о незначительной роли этого механизма сосудистой регуляции в осуществлении дилатации мелких пиальных артериальных сосудов у стареющих нормотензивных крыс. Количество расширившихся артерий средних и крупных диаметров и степень их расширения на фоне блокады eNOS возрастали (рис. 3а, 4а). Развитие ЭД при старении во многом связывают с повышением уровня эндотелиального супероксидного аниона (${\text{O}}_{2}^{ - }$), приводящим к снижению количества NO [18]. В основе возможных механизмов избыточного образования ${\text{O}}_{2}^{ - }$ могут лежать возрастная аномальная экспрессия и активность синтаз оксида азота [18–21]. Повышение чувствительности к АХ после применения L-NAME может быть связано с подавлением активности eNOS, что приводит к торможению процессов образования супероксид анионов [18, 22], тем самым увеличивая количество и доступность NO. Наибольшее увеличение количества расширившихся сосудов и степени их расширения, в среднем примерно в 3 раза, в наших экспериментах наблюдалось в группе крупных артерий (рис. 3а). У сосудов диаметром 20–40 мкм количество расширившихся сосудов возрастало в среднем на 40%, амплитуда также увеличивалась (рис. 3а, 4а). При этом количество расширившихся средних и крупных сосудов на фоне предварительной блокады NO у 20-месячных крыс WKY соответствовало значениям, полученным у молодых крыс WKY без использования блокаторов. То есть блокада eNOS у 20-месячных крыс WKY в этих группах сосудов, также как и в случае блокады ВКса-каналов, не просто усиливала дилатацию, а восстанавливала ее до уровня, наблюдаемого у молодых животных.
Совместное применение L-NAME и ТЕА у 20‑месячных крыс WKY приводило к достоверно большему увеличению количества расширившихся сосудов средних и крупных диаметров, по сравнению с применением каждого из блокаторов в отдельности (рис. 3а). Следовательно, у крыс WKY в возрасте 20 мес в АХ-опосредованных реакциях этих сосудов в равной степени нарушаются оба исследованных механизма регуляции сосудистого тонуса. Обращает на себя внимание также и то, что на фоне одновременной блокады eNOS и ВКСа-каналов увеличение числа дилатаций отмечалось и у сосудов мелких диаметров. В то время как применение каждого из блокаторов в отдельности в этой группе сосудов достоверно не изменяло количество АХ-опосредованных дилатаций. Полученные данные могут служить подтверждением гипотезы о существовании связи между активностью ВKCa-каналов и эндотелиальными сигнальными путями NO [23].
Сравнение реакций у нормотензивных и спонтанно гипертензивных крыс показало отсутствие достоверных отличий общего количества расширившихся в ответ на воздействие АХ сосудов и степени их расширения у этих животных (табл. 2). Однако наибольшее количество расширившихся сосудов у крыс SHR отмечалось в группе мелких артерий – 47.3 ± 4.3%, что достоверно превышало значения у крыс WKY. В группах артерий средних и крупных диаметров расширилось 37.3 ± 2.1 и 27.6 ± 1.1% сосудов соответственно. Эти показатели не отличались от значений в группах соответствующего диаметра у нормотензивных крыс (рис. 1).
Предварительная блокада ВKСа-каналов у молодых крыс SHR, в отличие от WKY, достоверно не изменяла количество расширившихся на воздействие АХ мелких сосудов (рис. 3b). А в группах артерий средних и крупных диаметров – увеличивала количество дилатаций в среднем на 26.3% и в 3.2 раза соответственно (рис. 3b). Полученные данные указывают на значительное снижение роли ВKСа-каналов в дилатации пиальных артериальных сосудов у молодых спонтанно гипертензивных крыс, в основе которого может лежать наблюдаемое при АГ уменьшение их чувствительности к внутриклеточному местному току Са2+ [24–26]. Повышение чувствительности к АХ после применения блокатора в группах пиальных артерий средних и крупных диаметров, вероятно, связано со способностью ТЕА, применяемого нами в качестве ингибитора калиевых каналов, увеличивать внутренний ток Са2+ в ГМК клетках сосудов, что может повышать активность BKCa-каналов и усиливать дилатацию артерий этих групп, обладающих развитой мышечной оболочкой [27, 28].
Блокада eNOS раствором L-NAME у молодых крыс SHR в наших экспериментах снижала количество расширившихся в ответ на воздействие АХ сосудов и амплитуду дилатации во всех группах исследованных сосудов. В группе артерий крупных диаметров количество расширившихся сосудов снизилось на 76.93%, что достоверно не отличалось от показателей у молодых крыс WKY. Изменение степени дилатации в этой группе сосудов также соответствовало значениям у нормотензивных крыс (рис. 3а, 3b; 4а, 4b). Уменьшение количества дилатаций артерий мелких и средних диаметров у молодых крыс SHR по сравнению с WKY того же возраста было менее значительным (на 37.2 и 31.1% соответственно у SHR, по сравнению с 46.1 и 54.1% у WKY) (рис. 3а, 3b). Изменения степени дилатации не отмечалось (рис. 4а, 4b). Таким образом, у 4-месячных крыс SHR по сравнению с крысами WKY того же возраста наблюдалось снижение роли NO в АХ-опосредованной дилатации пиальных артерий мелких и средних диаметров. При совместном применении L-NAME и ТЕА у молодых крыс SHR снижение количества расширившихся артерий всех групп соответствовало данной величине при воздействии только одного блокатора eNOS (U‑критерий Манна–Уитни; рис. 3b). Что может указывать на ведущую роль NO в дилатации пиальных артериальных сосудов всех диаметров у молодых крыс SHR.
Также как и у нормотензивных крыс, у SHR старение уменьшало общее количество расширившихся на воздействие АХ сосудов (с 43.2 ± 3.8% у молодых SHR до 21.9 ± 2.7% у 20-месячных SHR; табл. 2). В отличие от крыс WKY, у которых снижение количества АХ-опосредованных дилатаций было отмечено только в группах пиальных артерий средних и крупных диаметров, у крыс SHR при старении количество расширившихся сосудов снижалось во всех исследованных группах (рис. 1, 2). Количество дилатаций сосудов мелких и средних диаметров уменьшилось на 31.1 и 50.1% соответственно. Снижение количества расширившихся крупных артерий составило 54.1%, что достоверно не отличалось от значений, полученных при старении в этой группе сосудов у нормотензивных крыс (рис. 1).
ТЕА увеличивал количество расширившихся сосудов у 20-месячных крыс SHR во всех группах. Количество расширившихся мелких сосудов увеличилось на 67.9%, а средних – в 2.2 раза (рис. 3b). Что достоверно превышало значения у более молодых крыс SHR. Увеличение количества расширившихся в ответ на воздействие АХ крупных артерий (в среднем на 80.2%) у 20-месячных крыс SHR по сравнению с молодыми было менее значительным (рис. 3b). Степень дилатации сосудов всех групп также увеличивалась (рис. 4b).
На фоне блокады eNOS у крыс SHR в возрасте 20 мес уменьшение количества АХ-опосредованных расширений сосудов мелких диаметров составило в среднем 46.9% и достоверно превышало значения, полученные у более молодых крыс SHR. Снижение количества расширившихся сосудов средних диаметров было менее значительным: на 24.9% – у 20-месячных SHR, 31.1% – у SHR в возрасте 4 мес (рис. 3b). В группе крупных сосудов количество расширившихся на воздействие АХ артерий при старении увеличивалось в среднем в 1.5 раза (рис. 3b). Полученные данные свидетельствуют о возрастании при старении у крыс SHR роли NO-зависимых механизмов в АХ-опосредованной дилатации мелких пиальных артериальных сосудов, вероятно, связанном с наблюдаемым у них возрастным повышением уровня NO в результате увеличения экспрессии/активности индуцибельной NO-синтазы (iNOS) [4, 12]. Однако повышенная экспрессия iNOS является одним из факторов, способствующих возникновению окислительного/нитрозативного стресса, приводящего к уменьшению eNOS-зависимой продукции NO [19, 29, 30]. Ингибирование iNOS, в свою очередь, может усиливать eNOS-зависимую продукцию NO и восстанавливать ее до уровня, наблюдаемого у молодых крыс [30]. Экспрессия iNOS происходит как в эндотелии, так и в миоцитах. Поэтому ее действие более выражено в артериях, имеющих развитую мышечную оболочку [31]. Именно с этим может быть связано наблюдаемое нами у крыс SHR повышение чувствительности к АХ в группе крупных сосудов после применения L-NAME, являющегося неселективным ингибитором NOS.
Одновременное применение L-NAME и ТЕА у 20-месячных крыс SHR приводило к уменьшению количества расширившихся на воздействие АХ сосудов только в группе мелких пиальных артерий. Количество дилатаций уменьшалось в среднем на 28.7%, что достоверно не отличалось от значений, полученных с применением только одного блокатора eNOS (рис. 3b). Количество дилатаций артерий средних и крупных диаметров увеличилось. В группе средних артерий количество расширившихся сосудов возросло в среднем на 46.4% (рис. 3b). Увеличение количества дилатаций крупных артерий составило в среднем 53.2% и достоверно не отличалось от значений, полученных при применении каждого из блокаторов в отдельности. Полученные данные указывают на ведущую роль NO-зависимого механизма в регуляции дилататорных реакций мелких пиальных артериальных сосудов у 20-месячных крыс SHR. В группах сосудов средних и крупных диаметров оба из исследованных механизмов вовлечены в осуществление АХ-опосредованной дилатации в равной степени.
Таким образом, в ходе исследования было установлено, что старение приводит к изменению вклада ВКСа-каналов в осуществление АХ-опосредованной дилатации пиальных артериальных сосудов. У нормотензивных и спонтанно гипертензивных крыс эти изменения имеют свои особенности.
У нормотензивных крыс старение сопровождается снижением вклада ВКСа-каналов в осуществлении АХ опосредованной дилатации пиальных артериальных сосудов всех диаметров. Эти изменения во многом сопряжены с нарушением системы синтеза оксида азота и изменением роли NO-опосредованных механизмов в дилатации. Обнаруженная сосудистая дисфункция может служить предрасполагающим фактором развития гипертензии, поскольку аналогичными процессами также сопровождается формирование АГ у молодых спонтанно гипертензивных крыс.
Старение в условиях длительно текущей АГ не приводит к значительным изменениям вазодилататорного механизма, основанного на активации кальций-чувствительных калиевых каналов большой проводимости. Однако в возрасте 20 месяцев у крыс SHR наблюдается усиление вклада NO-зависимого механизма в регуляции АХ-опосредованных дилататорных реакций мелких пиальных артериальных сосудов. Это может служить проявлением сосудистых адаптационных механизмов, направленных на поддержание нормальной церебральной перфузии в условиях длительно текущей артериальной гипертензии.
Список литературы
Ungvari Z., Kaley G., de Cabo R., Sonntag W.E., Csiszar A. Mechanisms of vascular aging: new perspectives. J. Gerontol. A Biol. Sci. Med. Sci. 65: 1028–1041. 2010. https://doi.org/10.1093/gerona/glq113
Earley S., Brayden J. E. Transient receptor potential channels in the vasculature. Physiol. Rev. 95 (2): 645–690. 2015. https://doi.org/10.1152/physrev.00026.2014
Forouzanfar M.H., Liu P., Roth G.A., Ng M. Global burden of hypertension and systolic blood pressure of at least 110 to 115 mm Hg, 1990-2015. JAMA. 317 (2): 165–182. 2017. https://doi.org/10.1001/jama.2016.19043
Nikkari S.T., Määttä K.M., Kunnas T.A. Functional inducible nitric oxide synthase gene variants associate with hypertension: a case-control study in a finnish population-the TAMRISK study. Medicine (Baltimore). 94 (46): e1958. 2015. https://doi.org/10.1097/MD.0000000000001958
Соколова И.Б., Рыжак Г.А., Хавинсон В.Х. Функциональная кумуляция влияния пептидного биорегулятора сосудов на микроциркуляцию в коре головного мозга у спонтанно гипертензивных крыс. Успехи геронтол. 30 (5): 671–675. 2017. [Sokolova I.B., Ryzhak G.A., Havinson V.H. Funkcional’naya kumulyaciya vliyaniya peptidnogo bioregulyatora sosudov na mikrocirkulyaciyu v kore golovnogo mozga u spontanno gipertenzivnyh krys. Uspekhi gerontol. 30 (5): 671–675. 2017. (In Russ)].
Pires P., Ramos C., Matin N., Dorrance A. The effects of hypertension on the cerebral circulation. Amer. J. Physiol. Heart Circ. Physiol. 304: H1598–H1614.2013. https://doi.org/10.1152/ajpheart.00490.2012
Tanaka Y., Koike K., Toro L. Maxi K channel roles in blood vessel relaxations induced by endothelium-derived relaxing factors and their molecular mechanisms. J. Smooth Muscle Res. 40 (4–5): 125–153. 2004. https://doi.org/10.1540/jsmr.40.125
Yuill K.H., McNeish A.J., Kansui Y., Garland C.J., Dora K.A. Nitric oxide suppresses cerebral vasomotion by sGC-independent effects on ryanodine receptors and voltage-gated calcium channels. J Vasc Res. 47 (2): 93–107. 2010. https://doi.org/10.1159/000235964
Robertson B.E., Schubert R., Hescheler J., Nelson M.T. cGMP-dependent protein kinase activates Ca-activated K channels in cerebral artery smooth muscle cells. Am. J. Physiol. Cell Physiol. 265: C299–C303. 1993. https://doi.org/10.1152/ajpcell.1993.265.1.C299
Tykocki N.R., Boerman E.M., Jackson W.F. Smooth muscle ion channels and regulation of vascular tone in resistance arteries and arterioles. Compr. Physiol. 7 (2): 485–581. 2017. https://doi.org/10.1002/ cphy.c160011
Schmid J., Müller B., Heppeler D., Gaynullina D., Kassmann M., Gagov H., Mladenov M., Gollasch M., Schubert R. The unexpected role of calcium-activated potassium channels: limitation of NO-induced arterial relaxation. J. Am. Heart Assoc. 7 (7): e007808. 2018. https://doi.org/10.1161/JAHA.117.007808
Puzserova A., Ilovska V., Balis P., Slezak P., Bernatova I. Age-related alterations in endothelial function of femoral artery in young SHR and WKY rats. Biomed. Res. Int. 2014 (1): 658479. 2014. https://doi.org/10.1155/2014/658479
Bernatova I. Endothelial dysfunction in experimental models of arterial hypertension: Cause or consequence? BioMed Research International. Article ID 598271. 14p. 2014. https://doi.org/10.1155/2014/598271
Behringer E.J., Shaw R.L., Westcott E.B., Socha M.J., Segal S.S. Aging impairs electrical conduction along endothelium of resistance arteries through enhanced Ca2+-activated K+ channel activation. Arterioscler. Thromb. Vasc. Biol. 33 (8): 1892–1901. 2013. https://doi.org/10.1161/ATVBAHA.113.301514
Beleznai T.Z., Yarova P.L., Yuill K.H., Dora K.A. Smooth muscle Ca2+-activated and voltage-gated K+ channels modulate conducted dilation in rat isolated small mesenteric arteries. Microcirc. 18: 487–500. 2011. https://doi.org/10.1111/j.1549-8719.2011.00109.x
Behringer E.J., Hakim M.A. Functional interaction among KCa and TRP channels for cardiovascular physiology: modern perspectives on aging and chronic disease. Int. J. Mol. Sci. 20 (6): 1380. 2019. https://doi.org/10.3390/ijms20061380
Behringer E.J., Segal S.S. Tuning electrical conduction along endothelial tubes of resistance arteries through Ca2+-activated K+ channels. Circ. Res. 110: 1311–1321. 2012.https://doi.org/10.1161/CIRCRESAHA.111.262592
Парахонский А.П. Сосудистые эффекты липопротеинов и оксида азота. Современные проблемы науки и образования. 8: 120–122. 2008. [Parakhonsky A.P. Vascular effects of lipoproteins and nitric oxide. Modern problems of science and education. 8: 120–122. 2008 (In Russ)].
Cau S.B., Carneiro F.S., Tostes R.C. Differential modulation of nitric oxide synthases in aging: therapeutic opportunities. Front Physiol. 3: 218. 2012. https://doi.org/10.3389/fphys.2012.00218
Liguori I., Russo G., Curcio F., Bulli G., Aran L. Oxidative stress, aging, and diseases. Clin. Interv. Aging. 13: 757–772. 2018. https://doi.org/10.2147/CIA.S158513
Montesanto A., Crocco P., Tallaro F., Pisani F., Mazzei B., Mari V., Corsonello A., Lattanzio F., Passarino G., Roseet G. Common polymorphisms in nitric oxide synthase (NOS) genes influence quality of aging and longevity in humans. Biogerontology. 14: 177–186. 2013. https://doi.org/10.1007/s10522-013-9421-z
Fichtlscherer S., Dimmeler S., Breuer S., Busse R., Zeiher A.M., Fleming I. Inhibition of cytochrome P450 2C9 improves endothelium-dependent, nitric oxide-mediated vasodilatation in patients with coronary artery disease. Circulation 109: 178–183. 2004. https://doi.org/10.1161/01.CIR.0000105763.51286.7F
Feher A., Broskova Z., Bagi Z. Age-related impairment of conducted dilation in human coronary arterioles. Am. J. Physiol. Heart Circ. Physiol. 306: H1595–H1601. 2014. https://doi.org/10.1152/ ajpheart.00179.2014
Amberg G.C., Bonev A.D., Rossow C.F., Nelson M.T., Santana L.F. Modulation of the molecular composition of large conductance Ca (2+) activated K (+) channels in vascular smooth muscle during hypertension. J. Clin. Invest. 112 (5): 717–724. 2003. https://doi.org/10.1172/JCI18684
Amberg G.C., Santana L.F. Downregulation of the BK channel β1 subunit in genetic hypertension. Circ. Res. 93: 965–971. 2003. https://doi.org/10.1161/01.RES.0000100068.43006.36
Yang Y., Li P.- Y., Cheng J., Mao L., Wen J., Tan X.-Q., Liu Z.-F., Zeng X.-R. Function of BKCa channels is reduced in human vascular smooth muscle cells from han chinese patients with hypertension. Hypertension. 61: 519–525. 2013. https://doi.org/10.1016/j.ejca.2010.10.025
Gokina N.I., Wellman T.D., Bevan R.D., Walters C.L., Penar P.L., Bevan J.A. Role of Ca2+-activated K+ channels in the regulation of membrane potential and tone of smooth muscle in human pial arteries. Circul. Res. 79: 881–886. 1996. https://doi.org/10.1161/01.res.79.4.881
Khavandi K., Baylie R.A., Sugden S.A., Ahmed M., Csato V., Eaton Ph., Hill-Eubanks D.C., Bonev A.D., Nelson M.T., Greenstein A. S. Pressure-induced oxidative activation of PKG enables vasoregulation by Ca2+ sparks and BK channels. Sci. Signal. 9 (449): ra100. 2016. https://doi.org/10.1126/scisignal.aaf6625
Feletou M., Kohler R., Vanhoutte P.M. Nitric oxide: Orchestrator of endothelium-dependent responses. Annals of Medicine. 44: 694–716. 2012. https://doi.org/10.3109/07853890.2011.585658
Santhanam L., Lim H.K., Lim H.K., Miriel V., Brown T., Patel M., Balanson S., Ryoo S., Anderson M., Irani K., Khanday F., Costanzo L.D., Nyhan D., Hare J. M., Christianson D.W., Rivers R., Shoukas A., Berkowitz D.E. Inducible NO synthase–dependent S -nitrosylation and activation of arginase1 contribute to age-related endothelial dysfunction. Circ. Res. 101 (7): 692–702. 2007. https://doi.org/10.1161/ CIRCRESAHA.107.157727
Chertok V. M., Kotsyuba A. E. Changes in inducible NO synthase in the pial arteries of different diameters in hypertensive rats. Bull Exp. Biol. Med. 152: 258–261. 2011. https://doi.org/10.1007/s10517-011-1502-x
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


