Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 1, стр. 44-52
МОРФОФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ ЦЕРКАЛЬНЫХ ОРГАНОВ СВЕРЧКОВ
А. М. Луничкин 1, *, М. И. Жуковская 1
1 Институт эволюционной физиологии и биохимии им. И.М.Сеченова
Санкт-Петербург, Россия
* E-mail: BolverkDC@mail.ru
Поступила в редакцию 19.08.2020
После доработки 25.09.2020
Принята к публикации 26.09.2020
Аннотация
Проведено сравнительное исследование вклада церков в запуск двигательных ответов на звук у имаго сверчка Phaeophelacris bredoides, лишившегося в ходе эволюции тимпанального органа, и личинок последнего возраста сверчка Gryllus bimaculatus, с неполностью сформированным тимпанальным органом. Выполнено морфометрическое исследование расположенных на церках нитевидных сенсилл у обоих видов. На одном церке У Ph. bredoides преобладают сенсиллы с волосками от 800 до 1850 мкм, их общее число составляет 1110 ± 16. У личинок G. bimaculatus число на одном церке 845 ± 27 нитевидных сенсилл, из них больше всего коротких, с волосками менее 200 мкм. Частотный диапазон сигналов, воспринимаемых церкальным органом, инициирующих двигательный ответ имаго Ph. Bredoides, смещается в сторону высоких частот, тогда как у личинок G. bima-culatus – расширяется при увеличении интенсивности звука. Полученные данные свидетельствуют о том, что при запуске моторного ответа работа церкального органа имаго Ph. bredoides взаимодополняется работой других механосенсорных органов. Ответы сенсилл церкального органа личинок G. bimaculatus необходимы для моторного ответа и не компенсируются другими органами при физиологических интенсивностях звука.
ВВЕДЕНИЕ
Дистантная механосенсорная чувствительность формирует поведение насекомых в онтогенезе, обеспечивая внутри- и межвидовую коммуникацию, ориентацию в пространстве. Представители надсемейства Сверчковые (Grylloidea) – классические объекты изучения дистантной механорецепции. Они обладают развитой системой генерации и детекции механосенсорных стимулов, простым и четко выраженным набором поведенческих реакций, неприхотливы в содержании [1–3].
Основные органы дистантной механорецепции сверчковых: тимпанальный [4, 5], церкальный [6, 7] и подколенный [8, 9]. Эти органы специализируются на разных типах сигналов и служат для решения различных задач. Тимпанальный орган воспринимает звуковое давление, организуя половое и агрессивное поведение [10, 11]. Церкальный – смещение воздушных потоков, обеспечивая запуск реакции бегства в ответ на появление хищника [7, 12]. Подколенный – вибрации субстрата, участвуя во внутривидовой коммуникации [13, 14]. Все три органа могут воспринимать звук, но их частотные диапазоны значительно различаются [15–18]. Механические колебания в диапазоне от 1 до 50 кГц воспринимаются тимпанальным органом [11, 17, 19], 0.2–2 кГц – подколенным [20, 21] и 0.01–1 кГц – церкальным [7, 16]. Расположенный в педицелуме антенн Джонстонов орган у сверчковых практически не исследован, однако, поскольку он реагирует на движения флагеллума антенны, его роль в детекции колебаний звуковых частот не может быть значительной у насекомых с длинными жгутиковидными антеннами.
Показано, что органы механорецепции сверчковых работают не независимо, а дополняют друг друга, организуя двигательное поведение [17, 22]. Характер поведенческой реакции, определяемой одним органом, может изменяться в зависимости от информации, поступающей с другого сенсорного входа. Например, пороги реакции убегания в ответ на воспринимаемый церкальным органом толчок воздуха и направление, в котором она реализуется, модифицируются звуковым стимулом [12, 23].
Тимпанальный орган сверчковых окончательно формируется и начинает функционировать только после линьки на взрослую стадию – имаго. У личинок последнего возраста в голени передней ноги уже присутствуют полностью сформированные сенсорные элементы органа – хордотональные сенсиллы, однако, отсутствуют тимпанальные мембраны, проводящие звуковые колебания в систему трахей, на которых расположены сенсиллы [24–26].
Представители рода Phaeophilacris (Grylloidea: Phalangopsidae), например сверчок Ph. bredoides, лишены характерных для сверчковых акустического призывного сигнала и тимпанальных органов [27–29]. Внутривидовая коммуникация обеспечивается специализированной механосенсорной сигнализацией, опосредованной динамикой воздушных потоков и вибрацией субстрата [28, 30].
Нитевидные сенсиллы церкального органа способны детектировать низкочастотный звук: их длинный кутикулярный волосок, отклоняясь под действием механического стимула, возбуждает сенсорный нейрон [31, 32]. От длинны волоска зависит частота стимула, которую может воспринимать сенсилла: более короткие сенсиллы воспринимают более высокие частоты. Наилучшая чувствительность к звуку лежит в области 0.1–0.5 кГц [7, 16, 18, 33], однако, в ряде работ показано, что церкальный орган может воспринимать более высокочастотные стимулы [16, 34]. При интенсивности сигнала 90 дБ сенсиллы с длинными волосками (1500–1600 мкм) могут воспринимать частоты от 0.4–0.5 кГц, со средними (500–600 мкм) – до 0.8–0.9 кГц, с короткими (150–200 мкм)б до 2 кГц [34].
Ранее было показано, что имаго Ph. bredoides и личинки G. bimaculatus, несмотря на отсутствие действующих тимпанальных органов, могут воспринимать звуковые стимулы и генерировать в ответ на них двигательные реакции, а также высказано предположение о работе органов дистантной механорецепции двух видов в составе пластичного комплекса органов [35, 36]. Однако вклад церкального органа в обеспечение моторного ответа на звук не был определен экспериментально.
Таким образом, целью настоящей работы было изучение сенсорного вклада церкальных органов имаго Ph. bredoides и личинок G. bimaculatus в формирование моторного ответа насекомого на звуковые стимулы.
МАТЕРИАЛЫ И МЕТОДЫ
Животные. В работе были использованы взрослые особи сверчка Phaeophilacris bredoides Kaltenbach, 1986, возрастом от 14 до 35 суток после линьки на стадию имаго и личинки Gryllus bimaculatus Deg, 1773, возрастом от вторых суток после линьки на последний (шестой) личиночный возраст, содержавшиеся в лабораторной культуре при температуре 26°C, относительной влажности воздуха 60% и фоторежиме 12 : 12 (свет : темнота) [37].
Сканирующая электронная микроскопия. Сверчков наркотизировали CO2, затем отрезали церки и подготавливали их для сканирующей электронной микроскопии. Было использовано по 2 церка самца и 2 церка самки имаго Ph. bredoides и личинок G. bimaculatus. Препараты Ph. bredoides изучали при помощи сканирующего электронного микроскопа Zeiss Evo-40 (напыление образцов золотом проводилось техперсоналом РГПУ им. А.И. Герцена), G. bimaculatus – микроскопа FEI – Quanta 250 (напыление образцов платиной проводилось техперсоналом ЗИН РАН). Размеры нитевидных сенсилл определяли в программе PhotoM 1.31. Число нитевидных сенсилл, размеры волоска и чаши определяли как среднее со стандартной ошибкой.
Двигательные ответы на стимуляцию звуком. Частотно-пороговые диапазоны, в которых обнаруживаются двигательные ответы имаго Ph. bredoides и личинок G. bimaculatus, на звук определяли этологическим методом регистрации позы закрепленного животного.
В качестве стимулов использовали тоновые звуковые сигналы 0.1–10.0 кГц, длительностью 1 с и фронтами нарастания и убывания амплитуды по 50 мс. Стимулы генерировались в программе Adobe Audition 3.0 и выводились через динамический мониторный громкоговоритель M-AUDIO Studiophile DX4 (частотный диапазон работы 0.07–20 кГц). Уровень звука измеряли, как описано ранее [35, 36]. Были изучены двигательные ответы при интенсивностях звуковых стимулов: 70, 80, 90, 100 и 110 дБ УЗД.
Экспериментальная установка представляла собой звукозаглушенную, темную анэхоидную камеру объемом 349 000 см3 (коэффициент звукопоглощения (αW) = 0.65; реверберационный коэффициент звукопоглощения (αs) – 0.1–0.2 кГц = 0.13; 0.3–0.4 кГц = 0.35; 0.5–0.7 кГц = 6.9; >0.8 кГц = 0.9). В ходе эксперимента в ней поддерживалась температура 26°С. Животное подвешивали при помощи держателя, опора для конечностей отсутствовала. Оба модельных объекта не способны к полету и такое закрепление животного не вызывало двигательные реакции без предъявления дополнительных стимулов. Источник сигнала располагался сзади от сверчка, на расстоянии 15 см от церкального органа. Ответные реакции регистрировали при помощи помещенной сбоку от животного инфракрасной видеокамеры Genius e-Face 2025 и программы CrazyTalk CamSuite PRO.
Стимулы предъявляли последовательно от низких частот к высоким с шагом 0.1 кГц. Звуки каждой тестируемой частоты подавали животному по 5 раз с интервалом 10 с. Между предъявлением разных по интенсивности и частоте стимулов проходило 60 с. Двигательные ответы представляли собой резкие “вздрагивания” животного, сопровождающиеся движениями конечностей и антенн, сходные у обоих видов. Медленные ритмические сокращения брюшка, которые периодически наблюдали при отсутствии сигнала, двигательным ответом на звук не считали.
Инактивацию церкального органа проводили методом нанесения на него глицерина [38–42].
Тестировали 10 особей (5 самцов и 5 самок) Ph. bredoides с интактными церками, после чего их помещали обратно в одиночный садок и спустя 5 дней этих же особей тестировали после инактивации церкального органа. Длительное нахождение без опоры личинки G. bimaculatus приводило к исчезновению любых двигательных реакций. Поэтому для тестирования интактных животных и животных с инактивированным церкальным органом использовали разных особей. Тестировали по 10 животных (5 самцов и 5 самок) в каждом опыте. Разные интенсивностих сигналов тестировали на разных животных. Всего использовано 50 (25 самцов и 25 самок) особей Ph. bredoides и 100 (50 самок и 50 самцов) особей G. bimaculatus.
Уровень двигательной активности каждого животного определяли как число ответов на 5 последовательных предъявлений стимула. Для выборки из 10 животных рассчитывали медиану этой величины. Вклад церкального органа вычисляли как разницу уровней двигательной активности животных с интактными и инактивированными церками.
Обработка данных. Первичную обработку результатов, построение графиков и гистограмм выполняли в программе MS Excel 14 (©Microsoft, 2010). Данные проверяли на нормальность распределения при помощи теста Колмогорова–Смирнова. Данные по уровню двигательной активности и вкладу церкального органа в запуск движения сглаживали методом скользящего среднего по трем точкам. Сравнение выборок интактных животных и животных с инактивированным церкальным аппаратом для имаго Ph. bredoides проводили по W-критерию Вилкоксона, для личинок G. bimaculatus по U-критерию Манна–Уитни. Различия между самцами и самками обоих видов оценивали с помощью U-критерия Манна–Уитни.
РЕЗУЛЬТАТЫ
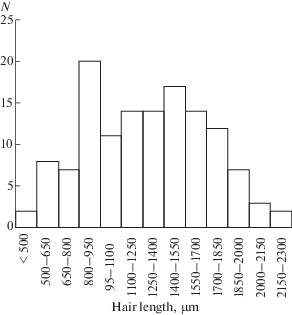
Морфометрия нитевидных сенсилл. Нитевидные сенсиллы Ph. bredoides обладают всеми характерными для этого типа сенсилл элементами внешнего строения – длинным кутикулярным волоском, окружающей его кольцевидной кутикулярной чашей и сочленовной мембраной. Их общее число составляет 1110 ± 16 (n = 4). Нитевидные сенсиллы обнаруживаются на всем церке, но большинство располагается у его основания. Минимальный диаметр чаши 12 мкм, максимальный – 40 мкм (23 ± ± 0.4 мкм, n = 290). Длина волосков колеблется в пределах от 450 до 2200 мкм (n = 130). Преобладают сенсиллы с волосками от 800 до 1850 мкм. При переходе от основания церка к его вершине увеличивается доля более коротких волосков. Распределение длин волосков нитевидных сенсилл по длине соответствует нормальному (рис. 1).
Рис. 1.
Распределение нитевидных сенсилл имаго Ph. bredoides по длине волоска. По оси абсцисс: длина волосков нитевидных сенсилл, μm. По оси ординат: N – число сенсилл.
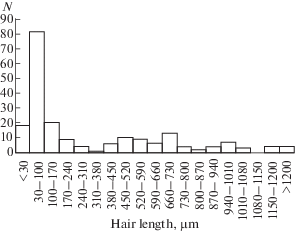
В среднем, число нитевидных сенсилл на одном церке личинки последнего возраста G. bimaculatus составляет 845 ± 27 (n = 4). Размеры волосков нитевидных сенсилл варьируют от 20 до 1310 мкм (n = 205), наблюдается тенденция их увеличения в направлении от вершины церка к его основанию. Размеры чаш от 9 до 83 мкм (n = 166). Распределение длин волосков показало, что преобладают сенсиллы с волосками менее 200 мкм. Наблюдается небольшое увеличение числа волосков в промежутке от 380 до 730 мкм (рис. 2).
Рис. 2.
Распределение нитевидных сенсилл личинок последнего возраста G. bimaculatus по длине волоска. Обозначения как на рис. 1.
Вклад церкального органа в запуск двигательной реакции. Двигательные ответы как имаго Ph. bredoides, так и личинок G. bimaculatus не имели достоверных отличий между полами (p > 0.05, U-критерий Манна–Уитни), поэтому для дальнейших подсчетов данные полученные для самцов и самок объединяли.
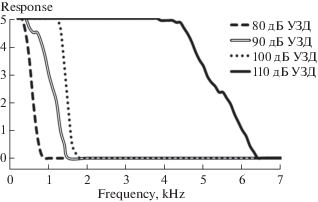
У имаго Ph. bredoides двигательных ответов на стимулы интенсивностью 70 дБ УЗД обнаружено не было. Начиная с 80 дБ УЗД в низкочастотной области, при всех интенсивностях стимула наблюдался уровень двигательной активности, равный 5. С повышением частоты звука величина двигательной активности снижается до полного исчезновения. Диапазон, в котором возникали ответы, расширялся с увеличением интенсивности звука в направлении более высоких частот (рис. 3).
Рис. 3.
Зависимость вызванных двигательных реакций имаго Ph. bredoides (n = 10) от частоты звукового стимула разной интенсивности. По оси абсцисс: частота стимула, кГц. По оси ординат: уровень двигательной активности.
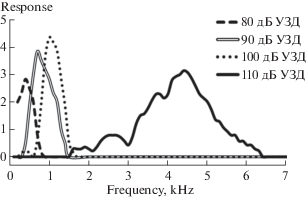
После инактивации церкального органа двигательные ответы имаго Ph. bredoides в высокочастотной области снижаются (p < 0.05, W-критерий Вилкоксона), а в низкочастотной области сохраняются. При интенсивности стимула 110 дБ УЗД ответы наблюдались во всем диапазоне, однако их уровень снижался, начиная c 3.3 кГц. Разница в ответах сверчков с интактными и инактивированными церками, отражающая вклад церкального органа в запуск двигательного ответа имаго Ph. bredoides, выглядит в виде пиков с максимумами на 0.4 кГц при 80 дБ УЗД, 0.9 кГц при 90 дБ УЗД, 1 кГц при 100 дБ УЗД, и порядка 4.5 кГц при 110 дБ УЗД (рис. 4).
Рис. 4.
Вклад церкального органа имаго Ph. bredoides (n = 10) в запуск двигательного ответа на звук. Обозначения как на рис. 3.
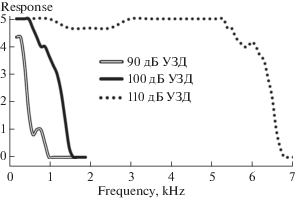
У личинок G. bimaculatus, в отличии от имаго Ph. bredoides, двигательных ответов на стимулы интенсивностью менее 90 дБ УЗД не было. Как и у Ph. bredoides, с повышением интенсивности стимула диапазон, в котором регистрируются ответы, расширяется до 0.8 кГц при 90 дБ УЗД, 1.4 кГц при 100 дБ УЗД, 6.6 кГц при 110 дБ УЗД. Наблюдается сходная с Ph. bredoides динамика двигательной активности: на низких частотах высокий уровень ответов, с повышением частоты их число снижается вплоть до полного исчезновения (рис. 5).
Рис. 5.
Зависимость вызванных двигательных реакций личинок G. bimaculatus (n = 10) от частоты звукового стимула. Обозначения как на рис. 3.
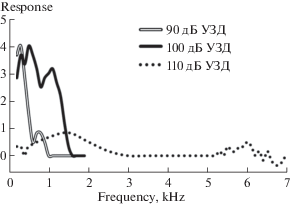
После инактивации церкального органа у личинок G. bimaculatus обнаруживается статистически достоверное падение ответов вплоть до полного исчезновения на стимулы интенсивностью 90 и 100 дБ УЗД во всем диапазоне частот, запускающих движение (p > 0.05, U-критерий Манна–Уитни). Инактивация церкального органа практически не меняет величину двигательных ответов личинок G. bimaculatus при интенсивности стимула 110 дБ УЗД (p < 0.05, U-критерий Манна–Уитни). Вклад церкального органа в запуск двигательного ответа личинок последнего возраста G. bimaculatus на тоновый сигнал обнаруживается в области до 0.8 кГц при 90 дБ УЗД и расширяется до 1.4 кГц при 100 дБ УЗД. При интенсивности 110 дБ УЗД наличие церкального органа не является необходимым для запуска движения (рис. 6).
Рис. 6.
Вклад церкального органа имаго G. bimaculatuss в запуск двигательного ответа на звук (n = 10). Обозначения как на рис. 3.
ОБСУЖДЕНИЕ
У Ph. bredoides подавляющее большинство нитевидных сенсилл обладает длинными волосками (>800 мкм, n = 130), что указывает на приспособление к рецепции низкочастотных механических стимулов. Это согласуется со сложной динамикой воздушных потоков, производимых самцами посредством крыловых махов [30]. Для близкого вида Ph. spectrum показано, что его крыловые махи формируют смещения молекул воздуха с частотой 8–12 Гц [43]. Поскольку размер и форма надкрылий обоих видов Phaeophilacris сходны, внутривидовые сигналы Ph. bredoides, вероятно, обладают близкими параметрами, а многочисленные нитевидные сенсиллы с длинными волосками, детектирующими низкие частоты, являются адаптацией, обеспечивающей восприятие этих сигналов. Минимальный размер волоска, обнаруженный у имаго Ph. bredoides, составлял 450 мкм, что может указывать на преимущественное восприятие церкальным органом сигналов частотой до 1 кГц. Данные, полученные с помощью инактивации церков, показывают, что это справедливо для относительно тихих звуков (80 дБ УЗД). Однако при повышении интенсивности звуки, для восприятия которых необходим интактный церкальный орган, сдвигаются в область более высоких частот.
Распределение длин волосков нитевидных сенсилл на церкальном органе личинок G. bimaculatus сходно с таковым у взрослых особей [7]. Преобладают сенсиллы с короткими волосками, которых нет у имаго Ph. bredoides. Наоборот, у имаго Ph. bredoides обнаруживаются крупные волоски, отсутствующие у личинки G. bimaculatus. Таким образом, церкальный орган личинок G. bimaculatus обладает потенциальной возможностью воспринимать более высокочастотные звуки, в сравнении с имаго Ph. bredoides.
Несмотря на то что Ph. bredoides лишились тимпанального органа в ходе эволюционного процесса, а у личинок G. bimaculatus его работа ограничена отсутствием тимпанальных мембран, оба модельных объекта способны воспринимать звук и отвечать на него двигательной реакцией. Это согласуется с данными, полученными для имаго G. bimaculatus, которые в условиях инактивации тимпанального органа сохраняли двигательные ответы на звук частотой до 5 кГц [17]. В детекции звука участвуют другие механосенсорные системы, и, прежде всего, церкальный и подколенный органы, а у личинок G. bimaculatus вероятно участие хордотональных сенсилл формирующегося тимпанального органа.
Двигательные ответы не обнаруживают межполовых различий у обоих видов, их характер одинаков для всех изученных интенсивностей, что свидетельствует в пользу их защитной функции. Можно предположить, что у животного, находящегося на твердом субстрате, ответ проявится в форме отрицательного фонотаксиса – в виде бега или прыжка от источника сигнала.
Церкальный орган личинок G. bimaculatus почти полностью определяет запуск двигательного ответа на звук при интенсивности 90–100 дБ УЗД. При увеличении интенсивности наблюдается расширение диапазона работы церков. Такая закономерность характерна для работы большинства сенсорных органов животных – с увеличением интенсивности сигнала расширяется диапазон детектируемых стимулов [44]. У имаго Ph. bredoides c увеличением интенсивности стимула диапазон работы церкального органа сдвигается в более высокочастотную область, при этом его вклад в запуск двигательного ответа увеличивается. Исходя из морфологических характеристик нитевидных сенсилл, очевидно, что церкальный орган Ph. bredoides способен детектировать низкочастотные звуки, однако его чувствительность в этой области перекрывается с другими механосенсорными органами. При увеличении интенсивности стимула вклад этих органов в запуск двигательного ответа растет, маскируя роль церков. Рост вклада подколенного органа с усилением звука, помимо расширения диапазонов ответов рецепторных клеток, может быть связан с увеличением проникновения звуковых колебаний через кутикулярные покровы ноги сверчка.
Особого внимания заслуживает значительный вклад церкальной системы Ph. bredoides в ответ на высокочастотные стимулы с максимумом в области 4.5 кГц при максимальной интенсивности стимула – 110 дБ. Поскольку коротких нитевидных сенсилл с близкой резонансной частотой колебаний у этих насекомых нет, логично предположить, что возбуждаются рецепторные клетки более длинных сенсилл. Работа нитевидных сенсилл имеет сложный характер, их чувствительность описывается достаточно широкими кривыми и учитывает направление стимула [28], его скорость и ускорение [7, 16, 46]. Моделирование колебаний волосков под действием потоков воздуха с использованием уравнения Эйлера–Бернулли выявило дополнительные резонансные частоты колебаний, причем следующая, после основной, частота примерно в 6 раз больше, а амплитуда колебаний на порядок меньше [45]. В нашем случае ответы на звуки 3–6 кГц будут давать те же сенсиллы, которые чувствительны к звуку 0.5–1 кГц меньшей интенсивности.
В сравнении с личинками G. bimaculatus, имаго Ph. bredoides обладают более низкими порогами чувствительности и более широкими частотными диапазонами сигналов, запускающими движение. Увеличение чувствительности подколенного и церкального органа, по-видимому, связано с утратой акустической сигнализации и развитием новых специфических форм внутривидовой коммуникации, использующих вибрацию субстрата и смещение воздушных потоков [28, 30].
ЗАКЛЮЧЕНИЕ И ВЫВОДЫ
Вклад церкального органа в запуск ответного движения на звук имаго Ph. bredoides растет с увеличением интенсивности стимула. Его инактивация в определенной степени может быть компенсирована другими механосенсорными органами. Функционирование церкального органа личинок G. bimaculatus критично для запуска ответного движения на звук. Его вклад преобладает во всем диапазоне частот, вызывающих ответ, и только при экстремально высокой интенсивности звука возможно участие хордотональных сенсилл формирующегося тимпанального органа.
Источники финансирования. Работа выполнена за счет средств госбюджета, программа АААА-А18-118013090245-6.
Соблюдение этических стандартов. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены. Настоящая статья не содержит результатов каких-либо исследований с участием людей в качестве объектов исследований.
Вклад авторов. А.М. Луничкин: планирование эксперимента, сбор данных, обработка данных, написание и редактирование манускрипта; М. И. Жуковская: обработка данных, написание и редактирование манускрипта.
Благодарности: авторы выражают благодарность Б.Ф. Грибакину, физфак СПбГУ, за помощь в интерпретации ответов церков пещерного сверчка на высокочастотные стимулы при самой высокой интенсивности звуковой стимуляции.
Список литературы
Alexander R.D. Aggressiveness, Territoriality, and Sexual Behavior in Field Crickets (Orthoptera: Gryllidae). Behav. 17 (23): 130–223. 1961. https://www.jstor.org/stable/4532972
Ronacher B., Hennig R.M., Clemens J. Computational principles underlying recognition of acoustic signals in grasshoppers and crickets. J. Comp. Physiol. A. 201 (1): 61–71. 2015. https://doi.org/10.1007/BF00605455
Horch H.W., Mito T., Popadic A., Ohuchi H., Noji S. The Cricket as a Model Organism. Springer, Tokyo. 376: 1–376. 2017. https://doi.org/10.1007/978-4-431-56478-2
Hoy R.R., Robert D. Tympanal hearing in insects. Annu. Rev. Entomol. 41 (1): 433–450. 1996. https://doi.org/10.1146/annurev.en.41.010196.002245
Strauß J., Stumpner A. Selective forces on origin, adaptation and reduction of tympanal ears in insects. J. Comp. Physiol. A. 201 (1): 155–169. 2015. https://doi.org/10.1007/s00359-014-0962-7
Shimozawa T., Kumagai T., Baba Y. Structural scaling and functional design of the cercal wind-receptor hairs of cricket. J. Comp. Physiol. A. 183 (2): 171–186. 1998. https://doi.org/10.1007/s003590050245
Magal C., Dangles O., Caparroy P., Casas J. Hair canopy of cricket sensory system tuned to predator signals. J. Theor. Biol. 241 (3): 459–466. 2006. https://doi.org/10.1016/j.jtbi.2005.12.009
Dambach M., Huber F. Perception of substrate-vibration in crickets. Symposium Mechanoreception. – VS Verlag für Sozialwissenschaften, Wiesbaden: 263–280. 1974. https://doi.org/10.1007/978-3-663-01719-6_19
Yack J.E. The Structure and Function of Auditory Chordotonal Organs in Insects. Microsc. Res. Tech. 63 (4): 315–337. 2004. https://doi.org/10.1002/jemt.20051
Kleindienst H.U., Wohlers D.W., Larsen O.N. Tympanal membrane motion is necessary for hearing in crickets. J. Comp. Physiol. A. 151 (4): 397-400. 1983. https://doi.org/10.1007/BF00605455
Lankheet M.J., Cerkvenik U., Larsen O.N., van Leeuwen J.L. Frequency tuning and directional sensitivity of tympanal vibrations in the field cricket Gryllus bimaculatus. J. Royal. Soc. Interface. 14 (128): 2017.0035. 2017. https://doi.org/0.1098/rsif.2017.0035
Fukutomi M., Ogawa H. Crickets alter wind-elicited escape strategies depending on acoustic context. Scien. Rep. 7 (1): 1–8. 2017. https://doi.org/10.1038/s41598-017-15276-x
Loher W., Dambach M. Reproductive behavior. In Cricket Behavior and Neurobiology, Ithaca, New York: Cornell University Press. (Ed. by F. Huber, T. Moore & W. Loher): 43–82. 1989.
Cokl A., Virant-Doberlet M. Vibrational communication. In Encyclopedia of insects (eds VH Resh, RT Carde), Amsterdam, The Netherlands: Academic Press: 1034–1038. 2009. https://doi.org/10.1590/S1519-566X2004000200001
Eibl E. Morphology of the sense organs in the proximal parts of the tibiae of Gryllus campestris L. and Gryllus bimaculatus deGeer (Insecta, Ensifera). Zoomorphology 89 (3): 185–205. 1978. https://doi.org/10.1007/BF00993947
Shimozawa T., Kanou M. Varieties of filiform hairs: range fractionation by sensory afferents and cercal interneurons of a cricket. J. Comp. Physiol. A. 155 (4): 485–493. 1984. https://doi.org/10.1007/BF00611913
Князев А.Н. Исследование влияния различных механосенсорных систем сверчка Gryllus bimaculatus De Geer на запуск двигательных реакций. Ж. Эвол. Биохим. Физиол. 22 (3): 284–293. 1986. [Knyazev A.N. Study of the influence of various mechanosensory systems of the cricket Gryllus bimaculatus De Geer on the triggering of motor reactions. J. Evol. Biochem Physiol. 22 (3): 284–293. 1986. (In Russ)].
Rozhkova G.I., Vedenina V.Y., Kamper G. Frequency-intensity characteristics of cricket cercal interneurons: broadband units. J. Comp. Physiol. A. 184: 161–167. 1999. https://doi.org/10.1007/s003590050315
Hoy R., Nolen T., Brodfuehrer P. The neuroethology of acoustic startle and escape in flying insects. J. Exp. Biol. 146 (1): 287–306. 1989. https://jeb.biologists.org/content/146/1/287.short
Čokl A., Kalmring K., Rössler W. Physiology of atympanate tibial organs in forelegs and midlegs of the cave-living Ensifera, Troglophilus neglectus (Rhaphidophoridae, Gryllacridoidea). J. Exp. Zool. 273: 376–388. 1995. https://doi.org/10.1002/jez.1402730503
Peljhan N.S., Strauß J. The mechanical leg response to vibration stimuli in cave crickets and implications for vibrosensory organ functions. J. Comp. Physiol A. 204 (7): 687–702. 2018. https://doi.org/10.1007/s00359-018-1271-3
Knyazev A.N. Interaction of mechanoreceptor systems as a basic for acoustic communication in insect. Sensory Systems and Communication in Arthropods. Adv. in Life Sciences, Birkhauser Verlag Basel: 265–270. 1990. https://doi.org/10.1007/978-3-0348-6410-7_45
Fukutomi M., Someya M., Ogawa H. Auditory modulation of wind-elicited walking behavior in the cricket Gryllus bimaculatus. J. Exp. Biol. 218 (24): 3968–3977. 2015. https://doi.org/10.1242/jeb.128751
Ball E., Young D. Structure and development of the auditory system in the prothoracic leg of the cricket Teleogryllus commodus (Walker) II. Postembryonic development. Cell. Tissue. Res. 147 (3): 313–324. 1974. https://doi.org/10.1007/BF00307467
Klose M. Development of leg chordotonal sensory organs in normal and heat shocked embryos of the cricket Teleogryllus commodus (Walker). Roux’s. Arch. Dev. Biol. 205 (7–8): 344–355. 1996. https://doi.org/10.1007/BF00377214
Nishino H., Domae M., Takanashi T., Okajima T. Cricket tympanal organ revisited: morphology, development and possible functions of the adult-specific chitin core beneath the anterior tympanal membrane. Cell Tiss. Res. 377 (2): 193–214. 2019. https://doi.org/10.1007/s00441-019-03000-2
Desutter-Grandcolas L. Toward the knowledge of the evolutionary biology of phalangopsid crickets (Orthoptera: Grylloidea: Phalangopsidae). Data, questions and evolutionary scenarios. J. Orth. Res. 4: 163–175. 1996. https://doi.org/10.2307/3503472
Heidelbach J., Dambach M. Wing-flick signals in the courtship of the african cave cricket, Phaeophilacris spectrum. Etology. 103 (10): 827–843. 1997. https://doi.org/10.1111/j.1439-0310.1997.tb00124.x
Gorochov A.V. New and Little Known Phalangopsinae (Orthoptera, Gryllidae): 9. The African Genus Phaeophilacris. Entomol. Rev. 95 (8): 1112–1124. 2015. https://doi.org/10.1134/S0013873812010071
Lunichkin A.M., Zhemchuzhnikov M.K., Knyazev A.N. Basic elements of behavior of the cricket Phaeophilacris bredoides Kaltenbach (Orthoptera, Gryllidae). Entomol. Rev. 96 (5): 537–544. 2016. https://doi.org/10.1134/S0013873816050031
Shimozawa T., Murakami J., Kumagai T. Cricket Wind Receptors: Thermal Noise for the Highest Sensitivity Known. In: Barth F.G., Humphrey J.A.C., Secomb T.W. (eds) Sensors and Sensing in Biology and Engineering. Springer, Vienna: 145–157. 2003. https://doi.org/10.1007/978-3-7091-6025-1_10
Miller J.P., Krueger S., Heys J.J., Gedeon T. Quantitative characterization of the filiform mechanosensory hair array on the cricket cercus. PloS one. 6 (11). 2011. https://doi.org/10.1371/journal.pone.0027873
Cummins B., Gedeon T., Klapper I., Cortez R. Interaction between arthropod filiform hairs in a fluid environment. J. Theor. Biol. 247 (2): 266–280. 2007. https://doi.org/10.1016/j.jtbi.2007.02.003
Князев А.Н., Попов А.В. Реакция одиночных церкальных механорецепторов сверчка на звуковую и синусоидальную механическую стимуляцию. ДАН СССР. 232: 1211–1214. 1977 [Knyazev A.N., Popov A.B. Response of single cercal mechanoreceptors of cricket to sound and sinusoidal mechanical stimulation. DAN USSR 232: 1211–1214. 1977 (In Russ)].
Lunichkin A.M., Knyazev A.N. Involvement of the mechanosensory complex structures of the cricket Phaeophilacris bredoides in triggering of motor responses to sound. J. Evol. Biochem. Physiol. 53 (6): 480–492. 2017. https://doi.org/10.1134/S0022093017060059
Lunichkin A.M., Knyazev A.N. Involvement of Mechanosensory Complex Structures of the Cricket Gryllus bimaculatus Larvae (Orthoptera, Gryllidae) in Triggering of Motor Responses to Sound. J. Evol. Biochem. Physiol. 54 (2): 137–148. 2018. https://doi.org/10.1134/S0022093018020072
Lunichkin A.M., Zhemchuzhnikov M.K., Knyazev A.N. Ontogeny of the cricket Phaeophilacris bredoides Kaltenbach (Orthoptera, Gryllidae). Entomol. Rev. 93 (1): 19–29. 2013. https://doi.org/10.1134/S0013873813010041
Knyazev A.N., Chudakova I.V. Effect of allatectomy on phonotaxis in the cricket Gryllus bimaculatus De Geer. J. Evol. Biochem. Physiol. 26 (6): 695–701. 1990.
Knyazev A.N., Ivanov V.P., Vorobyeva O.N. Interaction of distant mechanoreceptor systems under conditions of presentation of non-specific sound signals to normal and allatectomized female crickets Gryllus bimaculatus. J. Evol. Biochem. Physiol. 35 (6): 289–294. 1999. https://doi.org/10.1023/A:1017535007233
Knyazev A.N., Ivanov V.P., Vorobyeva O.N. Interaction of distant mechanoreceptor Systems under conditions of presentation of conspecific sound signals to normal and allatectomized male crickets Gryllus bimaculatus. J. Evol. Biochem. Physiol. 36 (6): 760–766. 2000. https://doi.org/10.1023/A:1017535007233
Zhemchuzhnikov M.K., Knyazev A.N. Development of sexual and protective behavior of female crickets Gryllus argentinus Sauss. at the prereproductive and reproductive periods of imaginal ontogenesis. J. Evol. Biochem. Physiol. 47 (6): 565–570. 2011. https://doi.org/10.1134/S0022093011060081
Луничкин А.М., Баулин Ю.А., Жуковская М.И., Князев А.Н. Оценка метода инактивации церкальных сенсилл сверчка с помощью электроцеркограммы. Сенсор. Cист. 33 (4): 351–354. 2019. [Lunichkin A.M., Baulin Y.A., Zhukovskaya M.I., Knyazev A.N. Evaluation of the method of inactivation of cricket cercal sensilla using electrocercogram. Sens. Sys. 33 (4): 351–354. 2019 (In Russ)].
Heidelbach J., Dambach M., Böhm H. Processing Wing flick-generated air-vortex signals in the african cave cricket, Phaeophilacris spectrum. Naturwissenschaften. 78 (6): 277–278. 1991.
Альтман Я.А., Вартанян И.А., Горлинский И.А., Бигдай Е.В., Самойлов В.О., Ноздрачев А.Д., Алексеев Н.П. Физиология сенсорных систем и высшей нервной деятельности. Т. 1. Физиология сенсорных систем. Издательский Центр “Академия”. 2009 [Altman Y.A., Vartanyan I.A., Gorlinskiy I.A., Bigday E.V., Samoylov V.O., Nosdrachev A.D., Alekseev N.P. Physiology of sensory systems and higher nervous activity. Т. 1. Physiology of sensory systems. “Academy”. 2009. (In Russ)].
Slinker K., Kondash C., Dickinson B.T., Baur J.W. High-Bandwidth and Sensitive Air Flow Sensing Based on Resonance Properties of CNT-on-Fiber Hairs. J Carbon Res. 3 (1): 6. 2017. https://doi.org/10.3390/c3010006
Roddey J.C., Jacobs G.A. Information theoretic analysis of dynamical encoding by filiform mechanoreceptors in the cricket cercal system. J. Neurophysiol. 75 (4): 1365–1376. 1996. https://doi.org/10.1152/jn.1996.75.4.1365
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


