Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 1, стр. 17-32
ТУЧНЫЕ КЛЕТКИ В ГОЛОВНОМ МОЗГЕ ПОЗВОНОЧНЫХ – ЛОКАЛИЗАЦИЯ И ФУНКЦИИ
И. П. Григорьев 1, *, Д. Э. Коржевский 1
1 Федеральное государственное бюджетное научное учреждение “Институт экспериментальной медицины”
Санкт-Петербург, Россия
* E-mail: iemmorphol@yandex.ru
Поступила в редакцию 12.02.20
После доработки 19.03.20
Принята к публикации 11.04.2020
Аннотация
В обзоре представлены сведения о тучных клетках (мастоцитах), которые присутствуют в ЦНС у различных представителей млекопитающих, птиц, пресмыкающихся, земноводных и рыб. Подробно рассмотрено их распределение в мозге различных видов животных. У млекопитающих они располагаются чаще всего в сосудистом сплетении, мозговых оболочках, таламусе, медиальном ядре поводка, гипоталамусе и циркумвентрикулярных органах, причем, как правило, в непосредственной близости от сосудов и часто вблизи ликвороносных пространств. Количество их непостоянно и меняется в ходе постнатального онтогенеза и под действием гормональных и иммунных факторов. Описаны различные способы выброса медиаторов из цитоплазматических гранул мастоцитов, которые обеспечивают точечное или диффузное действие на окружающие клетки. Тучные клетки обладают большим числом рецепторов к иммуноглобулинам, многим нейромедиаторам и гормонам, что делает их высокочувствительными к изменениям внешней и внутренней среды организма. Множество медиаторов, содержащихся в мастоцитах, позволяют им вызывать воспалительный, противовоспалительный, иммуно-, васкуло-, глиоцито- и/или нейрономодулирующий эффект, интенсивность и направленность которого зависит от состава и количества экскретируемых медиаторов и способа их выброса, что, в свою очередь зависит от того, какие именно рецепторы на тучных клетках активируются. Тучные клетки контролируют проницаемость гемато-энцефалического и гемато-ликворного барьеров, участвуют в ангиогенезе и, совместно с глиальными клетками, участвуют в регуляции нейровоспаления (которое является ведущим фактором патогенеза ряда нервных и психических заболеваний) и защите ЦНС от патогенных факторов. Тучные клетки мозга играют роль нейроиммунных центров с афферентными и эфферентными функциями, которые связывают периферические органы со специализированными клетками ЦНС и активно участвуют в поддержании гомеостаза ЦНС в физиологических условиях и при действии патологических факторов.
ВВЕДЕНИЕ
В последние десятилетия появились многочисленные данные о влиянии иммунной системы на различные функции нервной системы. Одной из популяций иммунных клеток, которые постоянно присутствуют в центральной нервной системе (ЦНС) являются тучные клетки, или мастоциты. Уже в силу своей локализации они могут быть и действительно являются посредниками влияний иммунной системы на нервную. Однако этим, по-видимому, их роль в ЦНС не ограничивается. В настоящем обзоре рассмотрены имеющиеся на сегодня данные о механизмах участия тучных клеток в функционировании ЦНС.
Общая характеристика. Тучные клетки были впервые описаны Паулем Эрлихом в 1878 г. в соединительной ткани человека и с тех пор были обнаружены во многих органах позвоночных животных и человека. Выделяют два типа тучных клеток: слизистые, или мукозные и соединительнотканные, или серозные. Их названия отражают преимущественную локализацию в организме: мукозные мастоциты чаще встречаются в слизистой оболочке кишечника и дыхательных путей, а соединительнотканные – в коже, подслизистом слое кишечника и небных миндалинах. Помимо локализации два типа тучных клеток различаются по имеющимся у них протеазам: в серозных мастоцитах человека, мышей и крыс содержится триптаза (КФ 3.4.21.59) и химаза (КФ 3.4.21.39), в мукозных – только триптаза у человека, только химаза – у крыс и мышей. Имеются различия и по составу некоторых других химических соединений, синтезируемых и секретируемых этими клетками [1].
Методы выявления. В головном мозге человека тучные клетки были выявлены еще в конце XIX века при некоторых нервных заболеваниях. Позже, однако, присутствие мастоцитов в центральной нервной системе либо отрицалось, либо, вплоть до 1970 г., они упоминались в исследованиях лишь эпизодически – их находили редко и в малом числе. Такая ситуация была связана с несовершенством использовавшегося гистохимического метода окраски препаратов анилиновыми красителями (такими, как толуидиновый синий, альциановый синий, крезиловый фиолетовый и ряд других), предложенного еще Эрлихом. Он показал, что при использовании анилиновых красителей цитоплазматические гранулы тучных клеток окрашиваются метахроматически, т.е. отлично от цвета самого красителя, что и позволяет выявлять мастоциты в ткани. Гистохимический метод метахроматического окрашивания используют для выявления тучных клеток по настоящее время, однако выявляемость тучных клеток существенно варьирует при использовании разных анилиновых красителей, различных способах фиксации, зависит от типа тучных клеток, состояния исследуемой ткани, вида животного и т.п.
В настоящее время для выявления тучных клеток на гистологических препаратах мозга чаще используют иммуногистохимическую реакцию на ферменты триптазу, химазу и некоторые другие протеазы, считающиеся специфическими маркерами мастоцитов. Определенная проблема в выявлении тучных клеток в головном и спинном мозге с помощью иммуногистохимической реакции на протеазы заключается в том, что протеазы у человека и животных обладают видоспецифичностью, а набор протеаз тучных клеток у человека и животных различается [2]. В связи с этим при проведении исследования необходима верификация пригодности иммуногистохимического подхода для каждого отдельного вида животных. Что касается человека, то для визуализации тучных клеток в ЦНС иммуногистохимическая реакция на триптазу оказалась наиболее эффективной [3–5]. С помощью иммуногистохимического метода было установлено, что в головном мозге человека встречаются преимущественно тучные клетки соединительнотканного типа (содержащие триптазу и химазу), а клетки мукозного типа (только с триптазой) наблюдаются реже [6, 7].
Структура и биохимическая специфичность. Ультраструктура тучных клеток была подробно описана с помощью электронной микроскопии. Наиболее характерной особенностью мастоцитов является наличие в цитоплазме, наряду с другими органеллами, многочисленных неоднородных мембранных гранул с аморфным и мелкозернистым электронноплотным материалом и вкраплениями кристаллоидных структур. Каких-либо отличий ультраструктуры мастоцитов в головном мозге от таковых в других органах не было обнаружено [8–13].
Цитоплазматические гранулы тучных клеток являются секреторными гранулами, в которых хранится множество различных биологически активных веществ (табл. 1) [14–18]. Следует отметить, что набор медиаторов, которые имеются в тучных клетках, разнится не только в зависимости от органа, в котором они находятся [1], но и в пределах одного и того же органа. Так, в головном мозге в трети тучных клеток не обнаружен гистамин, а во многих не выявлен серотонин [9, 11, 12, 19, 20].
Таблица 1.
Основные медиаторы тучных клеток
| Класс веществ | Медиатор |
|---|---|
| Биогенные амины | Гистамин, серотонин, дофамин, полиамины |
| Специфичные для тучных клеток протеазы | Триптаза (КФ 3.4.21.59), химаза (КФ 3.4.21.39), карбоксипептидаза А3 (КФ 3.4.17.1) |
| Неспецифичные для тучных клеток протеазы | Гранзим B (КФ 3.4.21.79), катепсин B (КФ 3.4.22.1), катепсин C (КФ 3.4.4.9), катепсин D (КФ 3.4.23.5), катепсин E (КФ 3.4.23.34), катепсин L (КФ 3.4.22.15), арилсульфатаза А (КФ 3.1.6.1), бета-глюкуронидаза (КФ 3.2.1.31), гепараназа (КФ 3.2.1.166) |
| Цитокины | IL-1β, IL-4, IL-5, IL-6, IL-8, IL-15, IL-16, IL-17, IL-31, IL-33, фактор некроза опухолей-альфа (ФНО-альфа) |
| Факторы роста | Фактор роста нервов, фактор роста фибробластов-2, васкулярный эндотелиальный фактор роста, трансформирующий фактор роста-бета, нейротрофин-3 |
| Протеогликаны | Серглицин |
| Мукополисахариды | Гепарин, хондроитинсульфат |
| Нейропептиды | Гонадотропин-рилизинг-гормон, кортикотропин-рилизинг-гормон, мелатонин, эндорфин, субстанция П, вазоактивный интестинальный пептид, эндотелин-1 |
| Липидные медиаторы | Простагландины D2 и Е2, лейкотриены В4 и С4 |
| Прочие | Окись азота |
Высвобождение секрета. Содержимое секреторных гранул под действием различных внешних факторов выделяется наружу, причем механизмы этого выброса достаточно многообразны и имеют ряд интересных особенностей. Наиболее известен выброс секрета из гранул путем экзоцитоза, который в данном случае называют дегрануляцией [8, 13, 18] и который развивается в течение периода от полуминуты до несколько минут после стимуляции [21]. Показано, что выброс секрета происходит очень локально – только со стороны действия стимула на тучную клетку, тогда как с другой стороны клетки дегрануляции не наблюдается [22]. Обнаружен также так называемый избирательный (дифференцированный) выброс медиаторов, когда в ответ на определенный стимул изливается не все содержимое гранул, а только некоторые его компоненты, например, только цитокин IL-6, или только васкулярный эндотелиальный фактор роста, или только серотонин и т.д. [5, 16, 23]. Механизмы такого избирательного экзоцитоза пока не изучены.
Кроме этого, в ЦНС обнаружен феномен трансгрануляции, который характеризуется переносом части цитоплазмы мастоцита, содержащей гранулы, непосредственно в цитоплазму прилежащей нервной или глиальной клетки, с формированием своего рода отделяющихся псевдоподий [18, 24].
Присущий тучным клеткам узколокальный экзоцитоз и избирательный экзоцитоз, а также феномен трансгрануляции указывают на способность мастоцитов к точечному и избирательному действию на окружающие клетки. Но дополнительно к этому известно и постоянное (фоновое) воздействие тучных клеток на соседние клетки: показано, что не активированные внешними факторами мастоциты также выделяют содержимое секреторных гранул, осуществляя постоянное медленное высвобождение компонентов секрета в окружающее пространство (“piecemeal degranulation”). Этот механизм доказан как для млекопитающих, так и рыб, земноводных и птиц (в том числе в головном мозге) [8, 9, 13, 18, 24]. После истощения содержимого секреторных гранул мастоцитов их восполнение происходит в течение 12–24 ч [21].
Благодаря наличию высокоаффинных мембранных рецепторов к иммуноглобулинам Е и G (IgE-bound FcεRI и IgG-bound FcγRs) тучные клетки в организме активируются проникшими через эндотелиальный барьер аллергенами, патогенами и токсинами и выделяют из гранул секрет, содержащий соединения, вызывающие воспалительный эффект. Помимо рецепторов к иммуноглобулинам тучные клетки обладают большим количеством рецепторов ко многим нейромедиаторам и гормонам, среди которых ацетилхолин, серотонин, адреналин, АТФ, кортикостероиды, мелатонин, 17β-эстрадиол, прогестерон, тестостерон, паратиреоидный гормон, нейротензин, субстанция П, бета-эндорфин, вазоактивный интестинальный пептид, кортикотропин-рилизинг гормон и ряд других, под действием которых тучные клетки могут вызвать не только воспалительный, но также противовоспалительный или иммуномодулирующий эффекты, выделяя соответствующие медиаторы, состав и количество которых зависят от активирующего агента [5, 16, 17, 23].
Распределение в ЦНС. В ЦНС позвоночных животных тучные клетки были описаны у представителей различных таксонов. Предваряя изложение этих данных, следует заметить, что, помимо позвоночных, гранулярные гемоциты, морфологически сходные с тучными клетками позвоночных и содержащие гепарин, гистамин и триптазу, были обнаружены у некоторых беспозвоночных: в гемолимфе пресноводного рака Astacus leptodactylus, триатомового клопа Rhodnius prolixus и асцидии Styela plicata [25, 26]. Предполагается, что эти клетки являются филогенетическими предшественниками тучных клеток позвоночных.
Рыбы. Клетки с характерными для мастоцитов микроскопическими и гистохимическими особенностями были идентифицированы у бесчелюстных рыб (Agnatha: миксины и миноги), у хрящевых рыб (Chondrichthyes: акулы), у представителей многих семейств костистых рыб (лососевые, карповые, эритриновые и др.). Они были обнаружены в слизистой оболочке кишечника, дерме и жабрах [25, 26]. Что касается присутствия тучных клеток в мозге рыб, то нам известна единственная за последние полвека работа Weiss (1979) [27], в которой с помощью световой и электронной микроскопии удалось выявить мастоциты в головном мозге (в 4 случаях из 56 исследованных особей рыб трех видов). Тучные клетки были сосредоточены в мозговых оболочках щуки (Esox lucius) и в мозговых оболочках и гипоталамусе (вокруг крупных кровеносных сосудов, между нейрональными и глиальными волокнами, а также субэпендимально) карпа (Cyprinus carpio) и кумжи (Salmo trutta fario). Кроме того, тучные клетки наблюдали в мозге костистых рыб после заражения паразитами [28].
Пресмыкающиеся. Исследований тучных клеток у рептилий сравнительно немного, но они были продемонстрированы во всех подгруппах пресмыкающихся (ящерицы, змеи, сцинки, крокодилы, черепахи) [25, 26], в том числе в головном мозге. У китайской трехкилевой черепахи (Chinemys reevesii) большое количество гистамин-содержащих тучных клеток было обнаружено в мозговых оболочках [29], а при экспериментальном повреждении коры мозга ящерицы Podarcis hispanica тучные клетки (наряду с микроглией) скапливаются в месте поражения [30].
Земноводные. Среди земноводных внутримозговые тучные клетки были описаны у нескольких видов лягушек (Rana esculenta, Rana pipiens, Rana temporaria и Xenopus laevis) и у жабы Bufo bufo: большое их число наблюдается в мягкой мозговой оболочке, сосудистом сплетении и во всех областях головного мозга, особенно в медиальной перегородке, эпиталамусе и гипоталамусе. Как правило, тучные клетки прилегают к кровеносным сосудам или внутреннему слою выстилки мозговых желудочков. Полового диморфизма в распределении тучных клеток в мозге лягушек не было выявлено [10, 31]. В мозге головастиков этих видов лягушек и жаб мастоциты располагаются аналогичным образом, хотя на ранних стадиях они меньше размером и не проявляют метахромазии в отличие от тучных клеток мозга взрослых животных; число мастоцитов прогрессивно растет по мере развития личинки [25]. Помимо лягушек и жаб, тучные клетки описаны в мозге тритонов Triturus cristatus carnifex и Triturus pyrrhogaster. Если у первого они сосредоточены в мозговых оболочках, то у второго наблюдались, помимо того, также в сосудистом сплетении и ткани мозга вокруг капилляров [32, 33]. У аксолотля (Ambystoma mexicanum) тучные клетки в большом количестве наблюдаются в сосудистом сплетении, а также в нейрогипофизе и белом веществе головного мозга. Интересно, что, в отличие от типичной округлой формы, мастоциты мозга аксолотля представляют собой клетки с длинными, тонкими и разветвленными цитоплазматическими отростками [34].
Птицы. О наличии тучных клеток у птиц хорошо известно [25]. В мозге птиц распределение мастоцитов было подробно описано на примере дикой смеющейся горлицы (Streptopelia roseogrisea). Наибольшее число мастоцитов отмечено в медиальном ядре поводка, в сосудистом сплетении и мягкой мозговой оболочке. Они также были обнаружены в таламусе, палеостриатуме, эктостриатуме, неостриатуме, гиперстриатуме и слуховой области конечного мозга (поле L) [12, 35]. Особо следует отметить, что, в отличие от тучных клеток в мозге представителей других классов позвоночных, у горлицы в медиальном поводке лишь малая часть мастоцитов (несколько процентов) прилегали к эндотелию сосудов, тогда как большинство их располагалось в нейропиле среди нервных и глиальных клеток и их отростков [35]. Тучные клетки описаны в эпифизе нескольких видов птиц (домашний воробей (Passer domesticus), серая цапля (Ardea cinera), белолобый гусь (Anser albifrons) [36]. В мозге горлицы мастоциты появляются на 13–14-й день эмбрионального развития (в мягкой мозговой оболочке) и количество их растет вплоть до полового созревания (6 мес), после чего снижается [35]. У курицы (Gallus gallus domesticus) мастоциты выявлены в сосудистом сплетении, начиная с поздней стадии эмбриогенеза [37].
Млекопитающие. Среди млекопитающих тучные клетки в ЦНС больше всего исследовались у наиболее популярных лабораторных животных – мышей (Mus musculus) и крыс (Rattus norvegicus). Однако результаты исследований, проведенных на разных линиях этих видов, существенно варьируют. Так, количество тучных клеток в твердой мозговой оболочке мышей линий SJL/J и C3H различалось втрое [38]. В головном мозге мышей линии Swiss Webster тучные клетки были идентифицированы в мягкой и паутинной оболочках мозга и сосудистом сплетении мозговых желудочков, а в собственно ткани мозга – только в таламусе (в значительном количестве, причем у самок значительно больше, чем у самцов) [39–41], у мышей-альбиносов ICR – в таламусе и редко – в медиальном ядре поводка [42], а у мышей C57BL/6, по одним данным, тучные клетки наблюдались в таламусе, гиппокампе и мягкой и паутинной оболочках мозга [43], по другим – помимо перечисленных областей – также в обонятельных луковицах, коре большого мозга, миндалине, гипоталамусе, мозжечке и сосудистом сплетении, причем во всех случаях отмечается преимущественно периваскулярная локализация мастоцитов [44]. В то же время у линии мышей B10.PL тучные клетки были выявлены только в гиппокампе и энторинальной коре [45].
Аналогичный разброс данных существует и по локализации тучных клеток в ЦНС крыс. Так, если у крыс линии Lewis (самок) тучные клетки обнаружены только в таламусе [46], то у белых беспородных крыс и крыс линии Вистар тучные клетки, помимо таламуса, наблюдаются в мягкой и паутинной оболочках мозга, в коре большого мозга – в лобной и теменной коре, причем большинство их располагалось в III, IV и V слоях, а также в гипоталамусе, эпендимной выстилке четвертого желудочка и сосудистом сплетении [9, 39, 47, 48]. У крыс Sprague-Dawley самок мастоциты, помимо перечисленных уже областей, наблюдали также в медиальном ядре поводка и белом веществе мозга (мозолистое тело, бахромка гиппокампа), причем с выраженной асимметрией [20, 49]. У самцов этой линии мастоциты наблюдались в таламусе, срединном возвышении и оболочках мозга, но не в коре мозга или базальных ганглиях [19]. Различие данных, полученных разными авторами, по-видимому, связано как с реальной вариабельностью распределения тучных клеток у разных линий мышей и крыс, так и с различной эффективностью методов, примененных для их обнаружения.
Тучные клетки выявляются в мозге крыс уже в позднем эмбриональном периоде (Е15) и вплоть до 11-го дня после рождения они сосредоточены исключительно в области мягкой мозговой оболочки, окружающей промежуточный мозг, и в сосудистом сплетении. Позже, на 11–13-й день постнатального развития эти клетки мигрируют вдоль кровеносных сосудов в кору большого мозга, а также фимбрию гиппокампа и затем в таламус (дорсолатеральное и постеролатеральное ядра) [50, 51]. В ходе постнатального развития – в возрастном периоде 3–30 дней – количество тучных клеток в таламусе и латеральных коленчатых телах прогрессивно растет (примерно в 15–20 раз), достигая максимального уровня к 30-му дню [52, 53], по другим данным – к 14- или 21-му постнатальному дню [10, 54].
Помимо мышей и крыс, тучные клетки были обнаружены в разных областях мозга других грызунов: морской свинки (Cavia porcellus), монгольской песчанки (Meriones unguiculatis), золотистого хомячка (Mesocricetus auratus), шиншиллы (Chinchilla laniger) и ряда других видов [14, 39, 47, 55–59]. Наиболее типичная для мозга грызунов локализация тучных клеток представлена на рис. 1.
Рис. 1.
Участки, в которых наиболее часто могут быть обнаружены тучные клетки при изучении головного мозга грызунов. a – Схематичное изображение фронтального среза головного мозга на уровне –3.3 мм от брегмы; красными кружками отмечены места локализации тучных клеток (по данным литературных источников). Men – менингеальные оболочки мозга, Cort – кора головного мозга (теменная), FH – гиппокампальная борозда (fissura hippocampi), Hb – поводок, ME – срединное возвышение, LV – боковые желудочки, III V – третий желудочек. b – иллюстрация тучной клетки в области поводка головного мозга крысы. Препарат из Отдела общей и частной морфологии Института экспериментальной медицины. Окраска крезиловым фиолетовым. Стрелка указывает на тучную клетку.
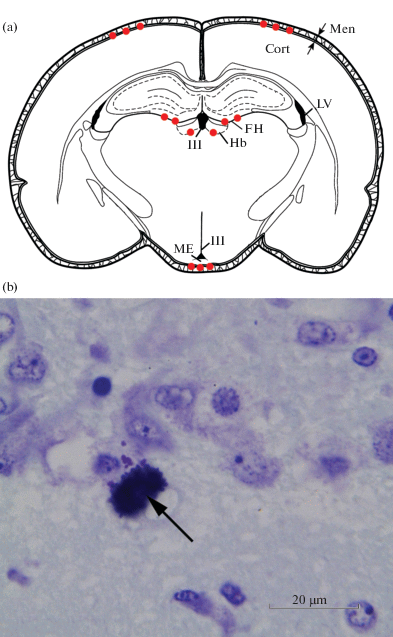
У других млекопитающих, часто используемых в экспериментальных исследованиях, тучные клетки в ЦНС изучены меньше. По имеющимся данным в ЦНС кролика (Oryctolagus cuniculus) и кошки (Felis catus) распределение мастоцитов практически одинаково: большое число их обнаружено в мягкой и паутинной оболочке, в коре большого мозга, таламусе и гиппокампе, меньше – в гипоталамусе, самом заднем поле (area postrema) (у кошки – в большом количестве, у кролика – изредка), полосатом теле, бледном шаре, коре мозжечка, срединном ядре шва, эпифизе, сером веществе ствола мозга и спинного мозга, сосудистом сплетении; в белом веществе мозга тучные клетки встречались значительно реже, чем в сером. Кроме того, мастоциты наблюдались у кошки в септальных ядрах, медиальном ядре поводка и латеральном коленчатом теле, а в сосудистом органе терминальной пластинки – только до достижения половой зрелости [10, 11, 14, 55–57, 60]. Есть данные о наличии тучных клеток в мозге собаки (Canis lupus familiaris), в частности, в теменной коре мозга, обонятельных луковицах, самом заднем поле и эпифизе [10, 14, 55].
В целом ряде исследований было продемонстрировано наличие и распределение тучных клеток в мозге ежа (Erinaceus europaeus). Преимущественным местом расположения мастоцитов были ядра поводка и таламуса, они обнаружены также в сосудистом сплетении, эпендимной выстилке четвертого желудочка мозга, в мягкой и паутинной оболочках мозга и гипоталамусе. Отмечается половой диморфизм в распределении тучных клеток: в таламусе самок их было достоверно больше, чем у самцов [20, 39, 54, 61]. У другого представителя семейства насекомоядных – бурой мускусной землеройки (Suncus murimus) тучные клетки также обнаружены в поводке и таламусе, а кроме того, в некоторых септальных и гипоталамических ядрах, причем максимальное их число наблюдалось на пятый постнатальный день, после чего их количество снижалось до уровня взрослых животных [58].
В 1970-е годы были опубликованы работы нескольких независимых исследователей по изучению тучных клеток в ЦНС, проведенные сразу на многих видах млекопитающих. В них были представлены факты о наличии мастоцитов в мягкой и паутинной мозговых оболочках и сосудистом сплетении желудочков мозга у большинства, если не всех исследованных видов животных (серая лисица (Urocyon sp.), саванновая лисица (Cerdocyon thous), лев (Panthera leo), тигр (Panthera tigris), индийский слон (Elephas maximus), тупайя (Tupaia glis), опоссум (Didelphis marsupialis), морской лев (Zalophus californianus), различные виды грызунов). Кроме того, у многих животных мастоциты наблюдались также в ядрах поводка, дорсальном таламусе и коре большого мозга (преимущественно в лобной и теменной, в основном в III, IV и V слоях) и эпифизе [14, 39, 54–56]. Мастоциты были описаны в мозге овцы (Ovis aries) и коровы (Bos taurus taurus). У овцы большое число мастоцитов наблюдается в вентральном таламусе и гипоталамусе, значительно меньше их в медиальном ядре поводка, коре мозга (преимущественно в глубоких слоях), белом веществе, сосудистом сплетении и эпендимной выстилке желудочков мозга, мягкой и паутинной оболочках мозга, эпифизе, медиальных и латеральных коленчатых телах. Отмечается выраженная асимметрия распределения мастоцитов [14, 20]. У коровы особенно много мастоцитов в гипоталамусе, эпифизе и, что редко отмечается у других видов животных, в мозжечке [14, 57].
Тучные клетки описаны у многих низших и высших приматов: у представителей лори (Nyticebus coucang), галаго (Otolemur crassicaudatus), долгопятов (Tarsius tarsier), лемуров (Eulemur fulvus), игрунков (Сallithrix penicillata), макак (Macaca mulatta, Macaca fascicularis, Macaca arctoides), у беличьего саймири (Saimiri sciureus), капуцинов (Cebus capucinus, Cebus apella macrocephalus), коат (Ateles geoffroyi), шимпанзе (Pan troglodytes). Мастоциты наблюдались в мягкой и паутинной оболочках, сосудистом сплетении, а также в различных структурах головного мозга: в медиальном ядре поводка, миндалине, гипоталамических ядрах, скорлупе, ограде, субфорникальном органе, коре большого мозга и эпифизе [14, 39, 54–56]. В мозге человека (Homo sapiens) тучные клетки были обнаружены в твердой и мягкой оболочках мозга, сосудистом сплетении, самом заднем поле (area postrema) и эпифизе [3, 4, 6, 14, 36, 62–68]. Кроме того, есть единичные данные, которые пока не получили подтверждения, о нахождении мастоцитов в воронке гипофиза, субфорникальном органе, сосудистом органе терминальной пластинки, теменной коре большого мозга, а также в спинном мозге [10, 66, 69]. Таксоны, у представителей которых были обнаружены тучные клетки в структурах ЦНС, представлены в табл. 2.
Таблица 2.
Таксоны, у представителей которых обнаружены тучные клетки в мозге
| Класс | Отряд | Семейство | Источник |
|---|---|---|---|
| Лучеперые рыбы (Actinopterygii) | Щукообразные (Esociformes) | Щуковые (Esocidae) | 27 |
| Карпообразные (Cypriniformes) | Карповые (Cyprinidae) | 27, 28 | |
| Лососеобразные (Salmoniformes) | Лососевые (Salmonidae) | 27 | |
| Пресмыкающиеся (Reptilia) | Черепахи (Testudines) | Азиатские пресноводные черепахи (Geoemydidae) | 29 |
| Чешуйчатые (Squamata) | Настоящие ящерицы (Lacertidae) | 30 | |
| Земноводные (Amphibia) | Бесхвостые земноводные (Anura) | Настоящие лягушки (Ranidae) | 10, 25, 31 |
| Пиповые (Pipidae) | 25 | ||
| Жабы (Bufonidae) | 25 | ||
| Хвостатые земноводные (Caudata) | Саламандровые (Salamandridae) | 32, 33 | |
| Амбистомовые (Ambystomatidae) | 34 | ||
| Птицы (Aves) | Голубеобразные (Columbiformes) | Голубиные (Columbidae) | 12, 24, 35 |
| Воробьинообразные (Passeriformes) | Воробьиные (Passeridae) | 36 | |
| Гусеобразные (Anseriformes) | Утиные (Anatidae) | 36 | |
| Аистообразные (Ciconiiformes) | Цаплевые (лат. Ardeidae) | 36 | |
| Курообразные (Galliformes) | Фазановые (Phasianidae) | 37 | |
| Млекопитающие (Mammalia) | Грызуны (Rodentia) | Мышиные (Muridae) | 10, 14, 19, 20, 38–54, 57, 59 |
| Свинковые (Caviidae) | 10, 14, 55, 56 | ||
| Хомяковые (Cricetidae) | 10, 14, 54, 57 | ||
| Беличьи (Sciuridae) | 56 | ||
| Агутиевые (Dasyproctidae) | 55, 56 | ||
| Паковые (Cuniculidae) | 56 | ||
| Зайцеобразные (Lagomorpha) | Зайцевые (Leporidae) | 14, 57 | |
| Насекомоядные (Eulipotyphla) | Ежовые (Erinaceidae) | 20, 39, 54, 61 | |
| Землеройковые (Soricidae) | 39, 54, 58 | ||
| Хищные (Carnivora) | Кошачьи (Felidae) | 14, 54–57 | |
| Псовые (Canidae) | 14, 54, 55 | ||
| Ушастые тюлени (Otariidae) | 54 | ||
| Парнокопытные (Artiodactyla) | Полорогие (Bovidae) | 14, 20, 57 | |
| Тупайи (Scandentia) | Тупайевые (Tupaiidae) | 39, 54 | |
| Опоссумы (Didelphimorphia) | Опоссумовые (Didelphidae) | 55 | |
| Хоботные (Proboscidea) | Слоны (Elephantidae) | 54 | |
| Приматы (Primates) | Долгопятовые (Tarsiidae) | 54 | |
| Лориевые (Loridae) | 39 | ||
| Галаговые (Galagonidae) | 56 | ||
| Лемуровые (Lemuridae) | 56 | ||
| Игрунковые (Callitrichidae) | 14 | ||
| Капуциновые (Cebidae) | 14, 54, 55 | ||
| Паукообразные обезьяны (Atelidae) | 54 | ||
| Мартышковые (Cercopithecidae) | 55, 56 | ||
| Гоминиды (Hominidae), кроме человека | 54, 55, | ||
| Гоминиды (Hominidae), человек (Homo sapiens) | 3, 4, 6, 10, 14, 36, 62–69 |
Таким образом, тучные клетки широко представлены в структурах ЦНС млекопитающих, причем наиболее типичны они для мягкой и паутинной оболочек мозга, сосудистого сплетения, различных ядер таламуса, поводка и гипоталамуса, реже мастоциты встречаются в коре большого мозга, гиппокампе и эпендимной выстилке желудочков мозга. Нередко наблюдается асимметричное распределение мастоцитов. В перинатальный период количество тучных клеток в мозге обычно выше, чем у взрослых животных.
Изменение количества и активности тучных клеток. Во многих исследованиях отмечается высокая вариабельность количества тучных клеток в целом и соотношения числа активированных (дегранулирующих) и неактивированных мастоцитов в мозге у представителей одного и того же вида животных одного пола и возраста. Это связано с тем, что благодаря наличию разнообразных рецепторов тучные клетки чувствительны не только к патологическим факторам (патогенные микроорганизмы, гельминты, аллергены), что вызывает соответствующую воспалительную реакцию, но и способны реагировать на изменение многих физиологических факторов. Так, показано, что тучные клетки головного мозга дегранулируют под действием стресса, или, вернее, гормонов и пептидов надпочечников и гипоталамо-гипофизарной системы, опосредующих действие стресса на организм (кортизол, кортикостерон, кортикотропин-рилизинг-фактор, субстанция П) [10, 70–72]. При этом одни виды стресса (иммобилизация или взятие в руки) уменьшают число тучных клеток в головном мозге экспериментальных животных, тогда как хронический субординационный стресс, внутрибрюшинное введение циклофосфамида (противоопухолевый препарат с высокой общей токсичностью) или интратекальная инъекция – увеличивают их [41, 71, 73]. Также возрастает число мастоцитов в головном мозге человека при инфекционных и паразитарных заболеваниях [6, 7].
Количество тучных клеток в головном мозге заметно изменяется в зависимости от состояния репродуктивной системы. Число мастоцитов в отдельных областях мозга существенно меняется в ходе эстрального цикла самок грызунов [40, 59], брачное ухаживание и спаривание достоверно повышают (а введение тестостерона или дигидротестостерона самцам или 17β-эстрадиола самкам может десятикратно повысить) число мастоцитов в поводке, но не других областях мозга горлицы [24, 74, 75]. Популяция тучных клеток в мозге также увеличивается у мышей-самцов после спаривания, крыс-самцов после размещения с овариэктомированными самками, инъецированными эстрогеном и прогестероном, или у самок крыс после родов [42, 76, 77]. Гонадэктомия, наоборот, снижает количество тучных клеток (в поводке горлицы и самом заднем поле кота) [55, 74]. Помимо репродуктивной системы, на функциональную активность и число тучных клеток в головном мозге оказывают влияние гормоны щитовидной железы и гипофиза [31]. Известно также, что активность мастоцитов мозга подвержена циркадным колебаниям и зависит от светового режима [78, 79], а число тучных клеток в мозге крыс и мышей значительно изменяется под действием слабых магнитных полей [80].
Имеются данные о том, что электростимуляция верхнего шейного ганглия, нервные окончания которого формируют прямые контакты с тучными клетками оболочек мозга крысы, ведет к накоплению серотонина в мастоцитах, а ганглиоэктомия приводит к дегрануляции тучных клеток [81]. По результатам других авторов, наоборот, электростимуляция верхнего шейного или тройничного ганглия вызывала дегрануляцию мастоцитов в твердой мозговой оболочке [82].
Ацетилхолин дозо-зависимо повышает функциональную активность тучных клеток в твердой мозговой оболочке крыс при посредстве М-холинорецепторов [83], а стимуляция серотониновых 5-HT1B/1D рецепторов крыс увеличивает количество тучных клеток в таламусе [19]. Количество мастоцитов в головном и спинном мозге человека изменяется также в ходе развития некоторых нервных и психических заболеваний [84]. Приведенные данные свидетельствуют, что функциональная активность и число тучных клеток в ЦНС постоянно изменяются под действием патогенных факторов и регулируются эндокринной и нервной системами.
Механизмы изменения числа тучных клеток в ЦНС. Увеличение количества тучных клеток в мозге, как предполагается, происходит не за счет мастоцитогенеза в нервной системе, поскольку в мозге (как и в периферических органах) не обнаружено тучных клеток с признаками деления [10], а за счет миграции в мозг предшественников мастоцитов из кровеносного русла (в кровеносном русле выявляются только незрелые тучные клетки). Транспорт экзогенных незрелых и зрелых мастоцитов из кровеносного русла в ткань мозга был продемонстрирован для взрослых мышей линии C57BL/6 и самок крыс Вистар [77, 85].
Интересно, что увеличение числа тучных клеток в мозге в экспериментальных условиях происходит в течение короткого промежутка времени (минут-часов) [21, 77], что свидетельствует о высокой реактивности мастоцитов в ЦНС. Кроме того, столь короткий промежуток времени позволяет предполагать присутствие в нервной ткани собственного пула негранулярных клеток-предшественников, которые при необходимости могут быстро трансформироваться в тучные клетки. Предполагалось, что такими предшественниками могут быть так называемые клетки Мато (они же “периваскулярные макрофаги”) – периваскулярные гранулярные клетки, которые происходят из костного мозга, расположены около сосудов мозга и содержат множество гидролитических ферментов [86]. Они обладают свойствами иммунных клеток и активируются при нейровоспалении и аутоиммунных заболеваниях, однако отличаются от тучных клеток ультраструктурно и, в противоположность последним, оксифильны и не содержат гепарина и триптазы, которые характерны для мастоцитов. Таким образом, вопрос о механизмах восполнения тучных клеток в мозге пока не вполне ясен. Не известен пока и механизм уменьшения числа мастоцитов в ЦНС под действием различных факторов.
Функции тучных клеток в ЦНС. Как отмечалось практически во всех исследованиях, мастоциты в мозге преимущественно локализованы вблизи сосудов [3–5, 20, 33, 44, 45, 47, 49 и др.], причем особенно часто они встречаются в структурах, омываемых ликвором мозговых желудочков, в первую очередь, в сосудистом сплетении, мозговых оболочках и циркумвентрикулярных органах. Периваскулярная локализация тучных клеток вместе с наличием рецепторов к большому числу гормонов, различных пептидов, нейромедиаторов, токсинов указывает на вероятную роль мастоцитов как сенсоров, реагирующих на изменение гормонального фона в организме и появление или изменение количества (концентрации) патогенных факторов. Эта рецепторная функция тучных клеток в головном мозге (как и других органах), очевидно, должна сочетаться с эффекторной функцией. Как и на какие мишени передают сигнал об изменении функционального состояния организма тучные клетки в головном мозге?
Прилежание тучных клеток к кровеносным сосудам и желудочкам мозга уже наводит на мысль о возможном участии мастоцитов в регуляции гемодинамики и проницаемости мозговых кровеносных сосудов и, соответственно, регуляции транспорта (молекулярного и, возможно, клеточного) между сосудистым руслом, глимфатической системой, интерстициальной жидкостью и ликвором желудочков. Данное предположение подтверждается способностью тучных клеток синтезировать и выделять вазоактивные соединения, такие как гистамин, серотонин и эндотелиальный фактор роста/фактор сосудистой проницаемости, которые изменяют скорость кровотока (давление) в сосудах и повышают проницаемость их стенок. Экспериментально было доказано непосредственное участие тучных клеток мозга в увеличении проницаемости гемато-энцефалического барьера, путем активации эндотелиоцитов [22, 70, 87], по-видимому, за счет стимуляции экспрессии Е- и Р-селектинов [88]. Кроме того, предполагается участие мастоцитов в ангиогенезе. Эта гипотеза основывается на исследованиях ангиогенеза при нормальном развитии и опухолевом росте. В раннем постнатальном онтогенезе крыс 90% тучных клеток головного мозга непосредственно контактируют с кровеносными сосудами, причем они расположены преимущественно в точках ветвления крупных сосудов. В ходе онтогенеза количество тучных клеток в точках ветвления сосудов растет [51, 52, 89]. С другой стороны, генетически или фармакологически вызванная нехватка тучных клеток у мышей замедляла рост экспериментально индуцированной опухоли (внемозговой локализации) [87, 90], что свидетельствует в пользу стимулирующего влияния тучных клеток на рост сосудов. Данный эффект могут обеспечивать несколько компонентов секрета мастоцитов, для которых доказано активирующее влияние на ангиогенез: васкулярный эндотелиальный фактор роста, ангиогенин, гепарин, гистамин, основной фактор роста фибробластов, трансформирующий ростовой фактор-бета, фактор некроза опухолей-альфа (ФНО-альфа), интерлейкин IL-8 и, возможно, другие вещества [87, 91, 92]. Выяснение механизмов ангиогенного действия тучных клеток имеет большое значение, поскольку ангиогенез играет существенную роль в нормальном и опухолевом росте, а также в репаративных процессах после повреждений ЦНС.
Тучные клетки, выделяя различные медиаторы (такие, как гистамин, триптаза, простагландины и др.), способны напрямую воздействовать на ноцицептивные нейроны в мозге и тем самым участвовать в центральной модуляции ноцицепции [70, 93].
Известна гипотеза о том, что тучные клетки играют определенную роль в гибернации животных. Было показано, что количество тучных клеток в мозге ежа и амфибий во время спячки возрастает [32, 61] (так же, как и число тучных клеток в периферических органах ящериц [94]). Во время гибернации также повышаются уровень и скорость обмена гистамина в головном мозге, который содержится как в гистаминергических нейронах, так и в тучных клетках [95]. Помимо того, установлено, что холод усиливает дегрануляцию тучных клеток [10]. На основе этих фактов было предположено, что увеличенное количество мастоцитов, а с ними гистамина и гепарина предотвращает тромбообразование в кровеносных сосудах животных в спячке, когда скорость кровотока резко снижается [25].
Помимо влияния на функционирование мозговых кровеносных сосудов показано действие тучных клеток на некоторые другие физиологические и патофизиологические внутримозговые процессы, а также поведение животных. Влияние мастоцитов на эти процессы исследуют с помощью двух экспериментальных подходов. Во-первых, это использование линии генетически модифицированных мышей (KitW-sh/W-sh (sash–/–) или KitW/W-v) с отсутствием тучных клеток. Кроме того, фармакологический подход позволяет блокировать мастоциты, стабилизируя их мембраны и предотвращая дегрануляцию – с помощью кромогликата натрия, либо, наоборот, активировать их, вызывая дегрануляцию – с помощью соединения 48/80 (compound 48/80). Использование данных методических подходов позволило доказать участие тучных клеток головного мозга в регуляции цикла сон–бодрствование, пищедобывательном поведении и питании [96], двигательной активности [97], социальном поведении крыс и их реакции на стресс [98]. Продемонстрировано участие мастоцитов в выработке условного рефлекса [99], в научении и пространственной памяти [44, 100]. Нарушения памяти и внимания при гиперфункции тучных клеток отмечены также в клинике [101].
В некоторых исследованиях удалось показать, что эффект тучных клеток на поведение опосредован действием гистамина и серотонина. Кроме того, доказано действие других веществ, секретируемых тучными клетками, в частности, цитокинов (IL-1, IL-6, IL-15, ФНО-альфа) и простагландинов на процессы научения и памяти [44, 96, 102, 103].
Очевидно, что действие тучных клеток на поведенческие реакции опосредуется их взаимодействием с нервными и глиальными клетками головного мозга. Это взаимодействие реализуется различными способами: путем прямого контакта мастоцитов с нейронами [72], с помощью синтезируемых в тучных клетках нейромедиаторов, хемокинов и интерлейкинов, воздействующих на соответствующие рецепторы на нервных и глиальных клетках [72, 84], и путем уже упоминавшегося процесса трансгрануляции [13, 18]. Кстати, именно путем трансгрануляции гепарин тучных клеток доставляется в нейроны и подавляет выброс из их цитоплазмы внутриклеточного кальция, тем самым изменяя реактивность нервных клеток [104].
Активация тучных клеток, которая сопровождается дегрануляцией, вызывает электрофизиологически регистрируемое (по частоте спайкового разряда) возбуждение или, реже, торможение нейронов таламуса крысы – отдела мозга, в котором сконцентрировано большое количество мастоцитов [105, 106]; по-видимому, данный эффект реализуется, в первую очередь, за счет аминовых медиаторов мастоцитов – гистамина и серотонина, которые через соответствующие рецепторы влияют на возбудимость нервных клеток [95]. Провоспалительные цитокины, характерные для тучных клеток (ФНО-альфа, IL-1-бета и IL-18), ингибируют долговременное потенцирование – форму нейрональной пластичности, которая, как считается, лежит в основе обучения и памяти [103, 107]. Есть данные об участии медиаторов мастоцитов (серотонин, гистамин, ФНО-альфа, IL-1-бета, IL-6) в регуляции нейрогенеза во взрослом гиппокампе [44, 84, 103, 108].
Помимо нейромедиаторных рецепторов тучные клетки оказывают воздействие на нейроны через специфические рецепторы к триптазе и другим протеазам мастоцитов. Так, триптаза взаимодействует с активируемым протеазой рецептором-2 (protease-activated receptor-2, PAR2) нейронов, протеазы тучных клеток 6 и 7 активируют сигнальный путь ERK1/2, МАРК и транскрипционный фактор NF-κB в нейронах [84, 109, 110]. Подобным образом тучные клетки действуют и на астроциты: триптаза, выделяемая тучными клетками, действует на астроцитарный PAR2 и, активируя сигнальный путь PAR2-PI3K/AKT, вызывает выброс из астроцитов интерлейкина IL-6. Через сигнальный путь PAR2-МАРК триптаза вызывает выброс ФНО-альфа (цитокины IL-6 и ФНО-альфа известны как провоспалительные медиаторы), при этом одновременно в астроцитах усиливается экспрессия трансформирующего ростового фактора-бета и цилиарного нейротрофического фактора (два цитокина-регулятора воспаления и восстановления нервной ткани). Протеазы тучных клеток 6 и 7 активируют ERK1/2, МАРК и NF-κB, индуцируя выброс из них провоспалительных интерлейкина IL-33 и хемокина CCL2 [100, 109–112]. Эти механизмы взаимодействия тучных клеток и астроцитов реализуются во время нейровоспалительной реакции.
Показано, что активация гистаминовых рецепторов на астроцитах гистамином вызывает усиление работы трансмембранного переносчика глутамата GLT-1, что ведет к снижению концентрации глутамата в межклеточной жидкости и, таким образом, снижает риск глутаматного повреждения нейронов [113]. Этот факт свидетельствует о возможном участии тучных клеток, богатых гистамином, в предотвращении эксайтотоксического повреждения нервных клеток глутаматом, которое лежит в основе некоторых патологических состояний нервной системы.
Дегрануляция тучных клеток (с выбросом триптазы, гистамина и других сигнальных молекул) активирует также микроглиальные клетки, стимулируя на них PAR2 и гистаминовые рецепторы Н1 и Н4, что вызывает выброс провоспалительных медиаторов – ФНО-альфа и интерлейкина IL-6 (которые реципрокно активируют PAR2 на тучных клетках), а также увеличивает экспрессию нейротрофического фактора мозга (BDNF) и его специфического рецептора PR2X4 [84, 111, 114, 115]. Этот механизм взаимодействия позволяет мастоцитам совместно с микроглиоцитами участвовать в регуляции нейровоспаления.
Помимо действия на астро- и микроглию тучные клетки способны вызывать апоптоз олигодендроцитов и демиелинизацию, что может быть фактором патогенеза демиелинизирующих заболеваний [116].
Таким образом, тучные клетки оказывают заметное влияние на физиологические процессы в ЦНС и поведенческие реакции, а также активируют глиальные и, до некоторой степени, нервные клетки, запуская воспалительный процесс. Воспаление – это сложная реакция организма в ответ на инфекцию или повреждение, необходимая для ликвидации изначальной причины поражения и восстановления поврежденных структур. Однако, если по каким-то причинам воспалительный процесс становится хроническим, это само по себе может стать причиной повреждения и гибели клеточных структур. В полной мере это относится к нервной системе, где удалось установить участие воспаления в патогенезе ряда заболеваний (в этом случае для обозначения локального воспалительного процесса используют термин “нейровоспаление”). Тучные клетки активно способствуют развитию нейровоспаления, выбрасывая провоспалительные цитокины, хемокины, лейкотриены, гистамин, серотонин и активируя астроциты, микроглию, олигодендроциты и Т-клетки. В последние полтора-два десятилетия получены достоверные сведения об участии тучных клеток в нейровоспалительном процессе и развитии таких заболеваний, как рассеянный склероз, болезнь Альцгеймера, мигрень. Возможно участие мастоцитов в патогенезе депрессии, расстройствах аутистического спектра и шизофрении [5, 17, 70, 84, 93, 110, 111].
ЗАКЛЮЧЕНИЕ
Анализируя представленные литературные данные, следует отметить, что многофункциональные по своему существу тучные клетки являются обязательным компонентом ЦНС у представителей различных видов млекопитающих, птиц, пресмыкающихся, земноводных и рыб. Для тучных клеток характерна определенная преференция в локализации, отмечаемая вне зависимости от вида животного, это — структуры мозговых оболочек, циркумвентрикулярные органы и стволовые центры нейроэндокринной регуляции. Количество тучных клеток в мозге непостоянно и меняется в ходе постнатального онтогенеза и под действием различных гормональных и иммунных факторов. Для ряда видов характерны половой диморфизм и асимметрия в распределении тучных клеток. Данные о распределении тучных клеток в мозге животных и человека не полны и противоречивы, что обусловлено вариабельностью результатов, полученных с использованием различных способов их визуализации. Характерной особенностью мастоцитов головного мозга является их преимущественно периваскулярное расположение.
Для тучных клеток характерно наличие многочисленных гранул, содержащих различные медиаторы, количество которых исчисляется, по-видимому, сотнями. Механизмы выброса медиаторов из гранул разнообразны: путем дегрануляции (экзоцитоза), включая узколокальный и избирательный экзоцитоз, с помощью процесса трансгрануляции или постоянного медленного выделения компонентов гранул в межклеточное пространство. Это разнообразие обеспечивает локальное и дистантное действие мастоцитов на другие клетки центральной нервной системы.
Тучные клетки обладают большим числом рецепторов к иммуноглобулинам, многим нейромедиаторам и гормонам, что делает их высокочувствительными к изменениям внешней и внутренней среды организма в целом и головного и спинного мозга в частности. Множество медиаторов, содержащихся в мастоцитах, позволяют им вызывать воспалительный, противовоспалительный, иммуно-, васкуло-, глиоцито- и/или нейрономодулирующий эффект, интенсивность и направленность которого зависит от состава и количества экскретируемых медиаторов и способа их выброса, что в свою очередь зависят от того, какие именно рецепторы на тучных клетках (и какими агентами) активируются. Тонкие механизмы разных способов выделения медиаторов из тучных клеток в ЦНС остаются неясными.
Тучные клетки контролируют проницаемость мозговых кровеносных сосудов в зоне функционирования гемато-энцефалического, ликворо-энцефалического и гемато-ликворного барьеров, что определяет их в качестве ключевых элементов сложных механизмов поддержания гомеостаза нервной ткани. Они участвуют в регуляции ангиогенеза при нормальном и опухолевом росте. Одной из наименее изученных, но весьма перспективных с медицинской точки зрения функций тучных клеток является их нейропротекторная функция, осуществляемая при посредстве астроцитов при эксайтотоксическом стрессе. Все изложенное свидетельствует о необходимости более углубленного изучения цитологических, биохимических и функциональных особенностей тучных клеток ЦНС в сравнительном аспекте, поскольку именно эти клетки занимают центральное место в механизмах взаимодействия иммунной и центральной нервной системы и могут оказаться удобной точкой приложения для новых методов терапевтических воздействий на систему нейроиммуноэндокринной регуляции организма.
Список литературы
Galli S. J. New insights into “the riddle of the mast cells”: microenvironmental regulation of mast cell development and phenotypic heterogeneity. Lab. Invest. 62 (1): 5–33. 1990.
Wernersson S., Pejler G. Mast cell secretory granules: armed for battle. Nat. Rev. Immunol. 14 (7): 478–494. 2014.
Федорова Е.А., Григорьев И.П., Сырцова М.А., Суфиева Д.А., Новикова А.Д., Коржевский Д.Э. Выявление морфологических признаков дегрануляции тучных клеток сосудистого сплетения головного мозга человека с использованием различных методов окраски и иммуногистохимии. Морфология. 153 (2): 70–75. 2018. [Fedorova E.A., Grigorev I.P., Syrtzova M.A., Sufieva D.A., Novikova A.D., Korzhevskii D.E. Detection of morphological signs of mast cell degranulation in the human choroid plexus using different staining methods. Morfologiia. 153 (2): 70–75. 2018. (In Russ)].
Федорова Е.А., Суфиева Д.А., Григорьев. И.П., Коржевский Д.Э. Тучные клетки эпифиза человека. Усп. геронтол., 31 (4): 484–489. 2018. [Fedorova E.A., Sufieva D.A., Grigorev I.P., Korzhevskii D.E. Mast cells of the human pineal gland. Adv. Gerontol. 9 (1): 62–66. 2019.]
Nelissen S., Lemmens E., Geurts N., Kramer P., Maurer M., Hendriks J., Hendrix S. The role of mast cells in neuroinflammation. Acta Neuropathol. 125 (5): 637–650. 2013.
Maślińska D., Dąmbska M., Kaliszek A., Maśliński S. Accumulation, distribution and phenotype heterogeneity of mast cells (MC) in human brains with neurocysticercosis. Folia Neuropathol. 39 (1): 7–13. 2001.
Maślińska D., Laure-Kamionowska M., Gujski M., Ciurzynska G., Wojtecka-Lukasik E. Post-infectional distribution and phenotype of mast cells penetrating human brains. Inflamm. Res. 54 (Suppl. 1): S15-6. 2005.
Crivellato E., Nico B., Gallo V.P., Ribatti D. Cell secretion mediated by granule-associated vesicle transport: a glimpse at evolution. Anat. Rec. (Hoboken). 293 (7): 1115–1124. 2010.
Florenzano F., Bentivoglio M. Degranulation, density, and distribution of mast cells in the rat thalamus: a light and electron microscopic study in basal conditions and after intracerebroventricular administration of nerve growth factor. J. Comp. Neurol. 424 (4): 651–669. 2000.
Ibrahim M.Z.M. The mast cells of the mammalian central nervous system. 1. Morphology, distribution and histochemistry. J. Neurol. Sci. 21 (4): 431–478. 1974.
Manning K.A., Pienkowski T.P., Uhlrich D.J. Histaminergic and non-histamine-immunoreactive mast cells within the cat lateral geniculate complex examined with light and electron microscopy. Neuroscience, 63 (1): 191–206. 1994.
Wilhelm M. Neuro-immune interactions in the dove brain. Gen. Comp. Endocrinol. 172 (1): 173–180. 2011.
Wilhelm M., Silver R., Silverman A.J. Central nervous system neurons acquire mast cell products via transgranulation. Eur. J. Neurosci. 22 (9): 2238–2248. 2005.
Machado A.B.M., Faleiro L.C.M., Da Silva W.D. Study of mast cell histamine contents of the pineal body. Z. Zellforsch. 65 (4): 521–529. 1965.
Mukai K., Tsai M., Saito H., Galli S.J. Mast cells as sources of cytokines, chemokines, and growth factors. Immunol. Rev. 282 (1): 121–150. 2018.
Theoharides T.C., Alysandratos K.D., Angelidou A., Delivanis D.A., Sismanopoulos N., Zhang B., Asadi S., Vasiadi M., Weng Z., Miniati A., Kalogeromitros D. Mast cells and inflammation. Biochim Biophys Acta. 1822 (1): 21–33. 2012.
Traina G. Mast cells in the brain – Old cells, new target. J. Integr. Neurosci. 16 (S1): S69-S83. 2017.
Vukman K.V., Försönits A., Oszvald Á., Toth E.A., Buzas E.I. Mast cell secretome: soluble and vesicular components. Semin. Cell Dev. Biol. 67: 65–73. 2017.
Dubayle D., Servière J., Menétrey D. Evidence for serotonin influencing the thalamic infiltration of mast cells in rat. J. Neuroimmunol. 159 (1–2): 20–30. 2005.
Michaloudi H.C., Papadopoulos G.C. Mast cells in the sheep, hedgehog and rat forebrain. J. Anat. 195 (Pt 4): 577–586. 1999.
Yang M.F., Chien C.L., Lu K.S. Compound 48/80-induced degranulation of GnRH-like immunoreactive mast cells in the brain and mesentery of the gerbil. Zool. Stud. 41 (1): 99–110. 2002.
Lehman M., Silver R. CSF signaling in physiology and behavior. Prog. Brain Res. 125: 415–433. 2000.
Gaudenzio N., Sibilano R., Marichal T., Starkl P., Reber L.L., Cenac N., McNeil B.D., Dong X., Hernandez J.D., Sagi-Eisenberg R., Hammel I., Roers A., Valitutti S., Tsai M., Espinosa E., Galli S.J. Different activation signals induce distinct mast cell degranulation strategies. J. Clin. Invest. 126 (10): 3981–3998. 2016.
Wilhelm M., King B., Silverman A.J., Silver R. Gonadal steroids regulate the number and activational state of mast cells in the medial habenula. Endocrinology. 141 (3): 1178–1186. 2000.
Baccari G.C., Pinelli C., Santillo A., Minucci S., Rastogi R.K. Mast cells in nonmammalian vertebrates: an overview. Int. Rev. Cell Mol. Biol. 290: 1–53. 2011.
Crivellato E., Ribatti D. The mast cell: an evolutionary perspective. Biol. Rev., 85 (2): 347–360. 2010.
Weiss J. Über Vorkommen und Ultrastruktur von Mastzellen im Hypothalamus der Knochenfische. Z. Mikrosk. Anat. Forsch. 93 (1): 147–160. 1979.
Ali N.M. Mast cells enter a teleost’s brain by Xth cranial nerve in response to Diplostomum phoxini (Trematoda). Experientia 40 (2): 197–198. 1984.
Inagaki N., Panula P., Yamatodani A., Wada H. Organization of the histaminergic system in the brain of the turtle Chinemys reevesii. J. Comp. Neurol. 297 (1): 132–144. 1990.
Nacher J., Ramírez C., Palop J.J., Artal P., Molowny A., López-García C. Microglial cells during the lesion-regeneration of the lizard medial cortex. Histol. Histopathol. 14 (1): 103–117. 1999.
Monteforte R., Pinelli C., Santillo A., Rastogi R.K., Polese G., Baccari G.C. Mast cell population in the frog brain: distribution and influence of thyroid status. J. Exp. Biol. 213 (10): 1762–1770. 2010.
Ciani F., Franceschini V., Del Grande P., Minelli G. Mast cells in the central nervous system of Triturus cristatus carnifex. Z. Mikrosk. Anat. Forsch. 100 (6): 838–846. 1986.
Inoue Y., Akita M., Shimai K. The mast cells in the brain of the Triturus pyrrhogaster (Boie). I. The histologic studies. Keio J. Med. 17 (4): 235–249. 1968.
Kappers J.A., Ten Kate I., De Bruyn H.J. On mast cells in the choroid plexus of the axolotl (Ambystoma mex.). Z. Zellforsch. Mikrosk. Anat. 48 (6): 617–634. 1958.
Zhuang X., Silverman A.J., Silver R. Distribution and local differentiation of mast cells in the parenchyma of the forebrain. J. Comp. Neurol. 408 (4): 477–488. 1999.
Quay W.B. Histological structure and cytology of the pineal organ in birds and mammals. Prog. Brain Res. 10: 49–86. 1965.
Ribatti D., Bertossi M., Nico B., Roncali L. Mast cells in the chick embryo choroid plexuses. J. Submicrosc. Cytol. 19 (2): 371–373. 1987.
Johnson D., Yasui D., Seeldrayers P. An analysis of mast cell frequency in the rodent nervous system: numbers vary between different strains and can be reconstituted in mast cell-deficient mice. J. Neuropathol. Exp. Neurol. 50 (3): 227–234. 1991.
Kiernan J.A. A comparative survey of the mast cells of the mammalian brain. J. Anat. 12 (2): 303–311. 1976.
Kovács K.J., Larson A.A. Mast cells accumulate in the anogenital region of somatosensory thalamic nuclei during estrus in female mice. Brain Res. 1114 (1): 85–97. 2006.
Taiwo O.B., Kovacs K.J., Larson A.A. Chronic daily intrathecal injections of a large volume of fluid increase mast cells in the thalamus of mice. Brain Res. 1056 (1): 76–84. 2005.
Yang M., Chien C., Lu K. Morphological, immunohistochemical and quantitative studies of murine brain mast cells after mating. Brain Res. 1999; 846 (1): 30–39.
Hendrix S., Kramer P., Pehl D., Warnke K., Boato F., Nelissen S., Lemmens E., Pejler G., Metz M., Siebenhaar F., Maurer M. Mast cells protect from post-traumatic brain inflammation by the mast cell-specific chymase mouse mast cell protease-4. FASEB J. 27 (3): 920–929. 2013.
Nautiyal K.M., Dailey C.A., Jahn J.L., Rodriquez E., Son N.H., Sweedler J.V., Silver R. Serotonin of mast cell origin contributes to hippocampal function. Eur. J. Neurosci. 36 (3): 2347–2359. 2012.
Hendrix S., Warnke K., Siebenhaar F., Peters E. M., Nitsch R., Maurer M. The majority of brain mast cells in B10.PL mice is present in the hippocampal formation. Neurosci. Lett. 392 (3): 174–177. 2006.
Brenner T., Soffer D., Shalit M., Levi-Schaffer F. Mast cells in experimental allergic encephalomyelitis: characterization, distribution in the CNS and in vitro activation by myelin basic protein and neuropeptides. J. Neurol. Sci. 122 (2): 210–213. 1994.
Dropp J.J. Mast cells in the central nervous system of several rodents. Anat. Rec. 174 (2): 227–237. 1972.
Persinger M.A. Brain mast cell numbers in the albino rat: sources of variability. Behav. Neural Biol. 25 (3): 380–386. 1979.
Goldschmidt R.C., Hough L.B., Glick S.D., Padawer J. Mast cells in rat thalamus: nuclear localization, sex difference and left-right asymmetry. Brain Res. 323 (2): 209–217. 1984.
Dimitriadou V., Rouleau A., Tuong M.D., Ligneau X., Newlands G.F., Miller H.R., Schwartz J.C., Garbarg M. Rat cerebral mast cells undergo phenotypic changes during development. Brain Res. Dev. Brain Res. 97 (1): 29–41. 1996.
Lambracht-Hall M., Dimitriadou V., Theoharides T.C. Migration of mast cells in the developing rat brain. Brain Res. Dev. Brain Res. 56 (2): 151–159. 1990.
Michaloudi H., Grivas I., Batzios C., Chiotelli M., Papadopoulos G.C. Parallel development of blood vessels and mast cells in the lateral geniculate nuclei. Brain Res. Dev. Brain Res. 140 (2): 269–276. 2003.
Persinger M.A. Developmental alterations in mast cell numbers and distributions within the thalamus of the albino rat. Dev. Neurosci. 4 (3): 220–224. 1981.
Dropp J.J. Mast cells in mammalian brain. I. Distribution. Acta Anat. (Basel). 94 (1): 1–21. 1976.
Cammermeyer J. Mast cells in the mammalian area postrema. Z. Anat. Entwickl. Gesch. 139 (1): 71–92. 1972.
Cammermeyer J. Mast cells and postnatal topographic anomalies in mammalian subfornical body and supraoptic crest. Z. Anat. Entwickl. Gesch. 140 (3): 245–269. 1973.
Edvinsson L., Cervos-Navarro J., Larsson L.I., Owman C., Rönnberg A.L. Regional distribution of mast cells containing histamine, dopamine, or 5-hydroxytryptamine in the mammalian brain. Neurology. 27 (9): 878–883. 1977.
Gill C.J., Rissman E.F. Mast cells in the neonate musk shrew brain: implications for neuroendocrine immune interactions. Brain Res. Dev. Brain Res. 111 (1): 129–136. 1998.
Kriegsfeld L.J., Hotchkiss A.K., Demas G.E., Silverman A.J., Silver R., Nelson R.J. Brain mast cells are influenced by chemosensory cues associated with estrus induction in female prairie voles (Microtus ochrogaster). Horm. Behav. 44 (5): 377–384. 2003.
brahim M.Z.M. The immediate and delayed effects of compound 48/80 on the mast cells and parenchyma of rabbit brain. Brain Res. 17 (2): 348–350. 1970
Krüger G. Mast cells in the brain of the hedgehog (Erinaceus europaeus Lin.). Distribution and seasonal variations. Acta Zool. 51 (1–2), 85–93. 1970.
Коржевский Д.Э. Тучные клетки в сосудистом сплетении у детей. Морфология. 112 (5): 48–50. 1997. [Korzhevskii D.E. Mast cells in choroid plexus of kids. Morfologiia. 112 (5): 48–50. 1997. (In Russ)].
Турыгин В.В., Бабик Т.М., Бояков А.А. Характеристика тучных клеток сосудистых сплетений желудочков головного мозга человека при старении. Морфология. 126 (6): 61–62. 2004. [Turygin V.V., Babik T.M., Boyakov A.A. Characteristics of mast cells in the choroid plexus of the ventricles of the human brain in aging. Neurosci. Behav. Physiol. 35 (9): 909–911. 2005.]
Юнеман О.А. Морфологическая организация эпифиза и сосудистого сплетения III желудочка головного мозга человека. Морфол. ведом. 3: 97–100. 2012. [Yuneman O.A. Morphological organization of pineal gland and third ventricle choroid plexus of human brain. Morfol. Vedom. 3: 97–100. 2012. (In Russ)].
Cammermeyer J., Adams R.D. The histopathological reaction of the area postrema. Acta Psychiat. Scand. 23 (3–4): 205–229. 1948.
Dropp J.J. Mast cells in the human brain. Acta Anat. (Basel). 105 (4): 505–513. 1979.
Maślińska D., Laure-Kamionowska M., Deręgowski K., Maśliński S. Association of mast cells with calcification in the human pineal gland. Folia Neuropathol. 48 (4): 276–282. 2010.
Porzionato A., Macchi V., Parenti A., De Caro R. The distribution of mast cells in the human area postrema. J. Anat. 204 (2): 141–147. 2004.
Fiala M., Chattopadhay M., La Cava A., Tse E., Liu G., Lourenco E., Eskin A., Liu P.T., Magpantay L., Tse S., Mahanian M., Weitzman R., Tong J., Nguyen C., Cho T., Koo P., Sayre J., Martinez-Maza O., Rosenthal M.J., Wiedau-Pazos M. IL-17A is increased in the serum and in spinal cord CD8 and mast cells of ALS patients. J. Neuroinflammation. 7 (1): 76. 2010.
Kempuraj D., Mentor S., Thangavel R., Ahmed M.E., Selvakumar G.P., Raikwar S.P., Dubova I., Zaheer S., Iyer S.S., Zaheer A. Mast cells in stress, pain, blood-brain barrier, neuroinflammation and Alzheimer’s disease. Front. Cell Neurosci. 13: 54. 2019.
Persinger M.A. Handling factors not body marking influence thalamic mast cell numbers in the preweaned albino rat. Behav. Neural Biol. 30 (4): 448–459. 1980.
Rozniecki J.J., Dimitriadou V., Lambracht-Hall M., Pang X., Theoharides T.C. Morphological and functional demonstration of rat dura mater mast cell–neuron interactions in vitro and in vivo. Brain Res. 849 (1): 1–15. 1999.
Chikahisa S., Harada S., Shimizu N., Shiuchi T., Otsuka A., Nishino S., Séi H. Mast cell involvement in glucose tolerance impairment caused by chronic mild stress with sleep disturbance. Sci. Rep. 7: 13640. 2017.
Zhuang X., Silverman A.J., Silver R. Reproductive behavior, endocrine state, and the distribution of GnRH-like immunoreactive mast cells in dove brain. Horm. Behav. 27 (3): 283–295. 1993.
Zhuang X., Silverman A.J., Silver R. Mast cell number and maturation in the central nervous system: influence of tissue type, location and exposure to steroid hormones. Neuroscience. 80 (4): 1237–1245. 1997.
Asarian L, Yousefzadeh E., Silverman A.J., Silver R. Stimuli from conspecifics influence brain mast cell population in male rats. Horm. Behav. 42 (1): 1–12. 2002.
Silverman A.J., Sutherland A.K., Wilhelm M., Silver R. Mast cells migrate from blood to brain. J. Neurosci. 20 (1): 401–408. 2000.
Каредина В.С., Довбыш Т.В., Кожевникова Т.А. Суточный цикл функциональной активности тучных клеток твердой мозговой оболочки крыс. Бюлл. эксп. биол. мед. 90 (3): 356–357. 1980. [Karedina V.S., Dovbysch T.V. Kozhevnikova T.A. Circadian rhythm of mast cell function in the rat dura. Biul. Eksper. Biol. i Medit. 90 (9): 1286–1288. 1981].
Mareš V., Brückner G., Biesold D. Mast cells in the rat brain and changes in their number under different light regimens. Exp. Neurol. 65 (2): 278–283. 1979.
Tümkaya L., Kalkan Y., Gökçe F.M., Erdivanli B., Yilmaz A., Bahceci I., Yazici Z. A., Mercantepe T. The effects of mobile phone exposure on mast cells in rat dura mater. Int. J. Morphol. 37 (2): 719–723. 2019.
Ferrante F., Ricci A., Felici L., Cavallotti C., Amenta F. Suggestive evidence for a functional association between mast cells and symphathetic nerves in meningeal membranes. Acta Histochem. Cytochem. 23 (5): 637–646. 1990.
Keller J., Dimlich R., Zuccarello M., Lanker L., Strauss T., Fritts M. Influence of the sympathetic nervous system as well as trigeminal sensory fibres on rat dural mast cells. Cephalalgia. 11 (5): 215–222. 1991.
Каредина В.С. Экспериментальные доказательства холинореактивности тканевых базофилов твердой мозговой оболочки головного мозга крыс. Арх. анат. 86 (4): 19–26. 1984. [Karedina V.S. Experimental evidence of the cholinoreactivity of tissue basophils of the dura mater of the brain in the rat. Arkh. Anat. Gistol. Embriol. 1984; 86 (4): 19–26. (In Russ)].
Hendriksen H., van Bergeijk D., Oosting R.S., Redegeld F.A. Mast cells in neuroinflammation and brain disorders. Neurosci. Biobehav. Rev. 79: 119–133. 2017.
Nautiyal K.M., Liu C., Dong X., Silver R. Blood-borne donor mast cell precursors migrate to mast cell-rich brain regions in the adult mouse. J. Neuroimmunol. 240–241: 142–146. 2011.
Ookawara S., Mitsuhashi U., Suminaga Y., Mato M. Study on distribution of pericyte and fluorescent granular perithelial (FGP) cell in the transitional region between arteriole and capillary in rat cerebral cortex. Anat Rec. 244 (2): 257–264. 1996.
Ribatti D. The crucial role of mast cells in blood-brain barrier alterations. Exp. Cell Res. 338 (1): 119–125. 2015.
Kubes P., Granger D. N. Leukocyte-endothelial cell interactions evoked by mast cells. Cardiovasc. Res. 32 (4): 699–708. 1996.
Khalil M., Ronda J., Weintraub M., Jain K., Silver R., Silverman A.J. Brain mast cell relationship to neurovasculature during development. Brain Res. 1171: 18–29. 2007.
Soucek L., Lawlor E.R., Soto D., Shchors K., Swigart L.B., Evan G.I. Mast cells are required for angiogenesis and macroscopic expansion of Myc-induced pancreatic islet tumors. Nat. Med. 13: 1211–1218. 2007.
Norrby K. Mast cells and angiogenesis. APMIS. 110 (5): 355–371. 2002.
Ribatti D., Ranieri G. Tryptase, a novel angiogenic factor stored in mast cell granules. Exp. Cell Res. 332: 157–162. 2015.
Koroleva K., Gafurov O., Guselnikova V., Nurkhametova D., Giniatullina R., Sitdikova G., Mattila O.S., Lindsberg P.J., Malm T.M., Giniatullin R. Meningeal mast cells contribute to ATP-induced nociceptive firing in trigeminal nerve terminals: direct and indirect purinergic mechanisms triggering migraine pain. Front. Cell. Neurosci. 13: 195. 2019.
Minucci S., Izzo Vitiello I., Marmorino C., Di Matteo L., Chieffi Baccari G. Mast cell-Leydig cell relationships in the testis of the lizard Podarcis s. sicula Raf: thermal manipulation, ethane 1,2-dimethane sulphonate (EDS) and sex hormone treatment. Zygote 3 (3): 259–264. 1995.
Haas H.L., Sergeeva O.A., Selbach O. Histamine in the nervous system. Physiol. Rev. 88 (3): 1183–1241. 2008.
Chikahisa S., Kodama T., Soya A., Sagawa Y., Ishimaru Y., Séi H., Nishino S. Histamine from brain resident mast cells promotes wakefulness and modulates behavioral states. PLoS ONE 8 (10): e78434. 2013.
Larson A.A., Thomas M.J., McElhose A., Kovács K.J. Spontaneous locomotor activity correlates with the degranulation of mast cells in the meninges rather than in the thalamus: disruptive effect of cocaine. Brain Res., 1395: 30–37. 2011.
Manchanda R.K., Jaggi A.S., Singh N. Ameliorative potential of sodium cromoglycate and diethyldithiocarbamic acid in restraint stress-induced behavioral alterations in rats. Pharmacol. Rep. 63 (1): 54–63. 2011.
Fitzpatrick C.J., Morrow J.D. Thalamic mast cell activity is associated with sign-tracking behavior in rats. Brain Behav. Immun. 65: 222–229. 2017.
Zhang X., Yao H., Qian Q., Li N., Jin W., Qian Y. Cerebral mast cells participate in postoperative cognitive dysfunction by promoting astrocyte activation. Cell Physiol. Biochem. 40 (1–2): 104–116. 2016.
Picard M., Giavina-Bianchi P., Mezzano V., Castells M. Expanding spectrum of mast cell activation disorders: monoclonal and idiopathic mast cell activation syndromes. Clin. Ther. 35 (5): 548–562. 2013.
Малашенкова И.К., Крынский С.А., Хайлов Н.А., Казанова Г.В., Величковский Б.Б., Дидковский Н.А. Роль цитокинов в консолидации памяти. Усп. соврем. биол. 135 (5): 419–436. 2015. [Malashenkova I.K., Krynskiy S.A., Hailov N.A., Kazanova G.V., Velichkovsky B.B., Didkovsky N.A. The role of cytokines in memory consolidation. Usp. Sovrem. Biol. 135 (5): 419–436. 2015. (In Russ)].
Yirmiya R., Goshen I. Immune modulation of learning, memory, neural plasticity and neurogenesis. Brain Behav. Immun. 25 (2): 181–213. 2011.
Jonas S., Sugimori M., Llinás R. Is low molecular weight heparin a neuroprotectant? Ann. N. Y. Acad. Sci. 825: 389–393. 1997.
Kőszegi Z., Kovács P., Wilhelm M., Atlasz T., Babai N., Kállai V., Hernádi I. The application of in vivo microiontophoresis for the investigation of mast cell–neuron interactions in the rat brain. J. Biochem. Biophys. Meth. 69 (1–2): 227–231. 2006.
Kovács P., Hernádi I., Wilhelm M. Mast cells modulate maintained neuronal activity in the thalamus in vivo. J. Neuroimmunol. 171 (1–2): 1–7. 2006.
Pickering M., O’Connor J.J. Pro-inflammatory cytokines and their effects in the dentate gyrus. Prog Brain Res. 163: 339–354. 2007.
Borsini A., Zunszain P.A., Thuret S., Pariante C.M. The role of inflammatory cytokines as key modulators of neurogenesis. Trends Neurosci. 38 (3): 145–157. 2015.
Kempuraj D., Selvakumar G.P., Zaheer S., Thangavel R., Ahmed M.E., Raikwar S., Govindarajan R., Iyer S., Zaheer A. Cross-talk between glia, neurons and mast cells in neuroinflammation associated with Parkinson’s disease. J. Neuroimmune Pharmacol. 13 (1): 100–112. 2018.
Kempuraj D., Thangavel R., Selvakumar G.P., Ahmed M.E., Zaheer S., Raikwar S.P., Zahoor H., Saeed D., Dubova I., Giler G., Herr S., Iyer S.S., Zaheer A. Mast cell proteases activate astrocytes and glia-neurons and release interleukin-33 by activating p38 and ERK1/2 MAPKs and NF-κB. Mol. Neurobiol. 56 (3): 1681–1693. 2019.
Skaper S.D., Facci L., Zusso M., Giusti P. An inflammation-centric view of neurological disease: beyond the neuron. Front. Cell Neurosci. 12:72. 2018.
Zeng X., Zhang S., Xu L., Yang H., He S. Activation of protease-activated receptor 2-mediated signaling by mast cell tryptase modulates cytokine production in primary cultured astrocytes. Mediators Inflamm. 2013: 140812. 2013.
Fang Q., Hu W.W., Wang X.F., Yang Y., Lou G.D., Jin M.M., Yan H.J., Zeng W.Z., Shen Y., Zhang S.H., Xu T.L., Chen Z. Histamine up-regulates astrocytic glutamate transporter 1 and protects neurons against ischemic injury. Neuropharmacology. 77: 156–66. 2014.
Dong H., Zhang X., Wang Y., Zhou X., Qian Y., Zhang S. Suppression of brain mast cells degranulation inhibits microglial activation and central nervous system inflammation. Mol. Neurobiol. 54 (2): 997–1007. 2017.
Zhang S., Zeng X., Yang H., Hu G., He S. Mast cell tryptase induces microglia activation via protease-activated receptor 2 signaling. Cell Physiol. Biochem. 29 (5–6): 931–940. 2012.
Medic N., Lorenzon P., Vita F., Trevisan E., Marchioli A., Soranzo M.R., Fabbretti E., Zabucchi G. Mast cell adhesion induces cytoskeletal modifications and programmed cell death in oligodendrocytes. J. Neuroimmunol. 218 (1–2): 57–66. 2010.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


