Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 5, стр. 402-410
ИЗУЧЕНИЕ ВЛИЯНИЯ НЕОНАТАЛЬНОЙ ВОСПАЛИТЕЛЬНОЙ БОЛИ НА КОГНИТИВНЫЕ ПРОЦЕССЫ И РЕАКТИВНОСТЬ ГИПОТАЛАМО-ГИПОФИЗАРНО-АДРЕНОКОРТИКАЛЬНОЙ СИСТЕМЫ У КРЫС ПРЕПУБЕРТАТНОГО ВОЗРАСТА
В. А. Михайленко 1, *, И. П. Буткевич 1, Е. А. Вершинина 1
1 Институт физиологии им. И.П. Павлова, РАН
Санкт-Петербург, Россия
* E-mail: viktormikhailenko@yandex.ru
Поступила в редакцию 23.04.2021
После доработки 27.05.2021
Принята к публикации 29.05.2021
Аннотация
Исследовали влияние воспалительной боли у новорожденных крысят на динамику содержания кортикостерона в плазме крови, а в поздний препубертатный период развития (45–53 дня) – на процессы пространственного обучения, кратковременной и долговременной памяти и реактивность гипоталамо-гипофизарно-адренокортикальной системы (ГГАКС) к стрессу принудительного плавания у крыс обоего пола. Впервые обнаружено продолжительное усиление реактивности ГГАКС в ответ на периферический очаг воспалительной боли, вызванный инъекцией формалина, у новорожденных крысят, что дало возможность предполагать о модификации в развитии ГГАКС и возможном ее участии в регуляции когнитивных способностей. Обнаружено, что неонатальная боль вызывала дефицит пространственного обучения и памяти, проявив половой диморфизм в реализации процессов пространственного обучения и памяти. После регистрации долговременной памяти у 53-дневных крыс в ответ на принудительное плавание обнаружено повышенное содержание кортикостерона по сравнению с базальным уровнем, но различий в уровне гормона между крысами с неонатальной болью и контрольными животными, как и половых различий, не было выявлено. Таким образом, у крыс в поздний препубертатный период развития не обнаружено прямой взаимосвязи между активацией ГГАКС неонатальной болью и показателями пространственного обучения и памяти, что, вероятно, указывает на вовлечение других нейробиологических систем на влияние неонатальной боли на когнитивные способности.
ВВЕДЕНИЕ
Неонатальный и препубертатный (подростковый) периоды относятся к критическим периодам развития, которые характеризуются реорганизацией нейробиологических систем, включая ГГАКС, репродуктивную систему и различные нейротрансмиттерные системы [1–5]. Интенсивно протекающее структурно-функциональное созревание головного мозга в критические периоды определяют повышенную реактивность нервной системы к болевым раздражителям [6, 7]. Боль в раннем возрасте модифицирует в постнатальном онтогенезе не только ноцицепцию [8], но и функциональную активность ГГАКС [9], что в дальнейшем вызывает изменения разных типов поведения [6]. Ранее нами было обнаружено, что очаг воспалительной боли на периферии у новорожденных крысят является фактором риска формирования тревожно-депрессивного состояния, усиления болевого ответа и ухудшения процесса обучения при достижении животными раннего препубертатного периода развития (25–35 дней) [10]. В многочисленных исследованиях показано, что стресс, не связанный с болью, модифицирует развитие ГГАКС, что в дальнейшем проявляется в ухудшении процессов обучения и памяти у взрослых [11, 12], но не известно, на каком этапе развития становятся очевидными последствия именно болевого стресса, нередко встречающегося в неонатальной клинике. Данные литературы позволяют сопоставлять уровень развития головного мозга новорожденного крысенка с уровнем развития головного мозга недоношенного ребенка [13], поэтому в настоящей работе мы использовали одно- и двухсуточных крыс в качестве модели для исследования влияний повторной воспалительной боли у рожденного раньше срока ребенка (модель недоношенной беременности). На основании разных критериев развития нервной системы и поведения у крысы были установлены границы препубертатного периода развития с 21-го по 59-й постнатальный день [14]. Использование разнополых особей способствует изучению механизмов исследуемых явлений. Однако работы преимущественно проводятся только на самцах [15, 16]. Известно, что половое созревание у самок начинается с 35 ± 2-го дня, а у самцов с 42 ± 2-го дня [2], поэтому мы использовали 45–53-дневных крыс (поздний препубертатный период), у которых уже могут проявиться половые различия в когнитивных процессах. В подростковом периоде начинают проявляться последствия негативных воздействий, которые испытал организм в раннем возрасте. Изучение этих последствий на разнополых особях именно на этом этапе индивидуального развития является важным направлением в исследовании механизмов неврологических и когнитивных нарушений с целью их возможной коррекции и восстановления нормальной жизнедеятельности.
В настоящей работе мы исследовали ранее не изученное влияние воспалительной боли у новорожденных крысят на реактивность ГГАКС, а в позднем препубертатном периоде (45–53 дней) – на процессы пространственного обучения, памяти и на реактивность ГГАКС к стрессу принудительного плавания у самцов и самок крыс.
МАТЕРИАЛ И МЕТОДИКА
Работа выполнена на потомстве крыс линии Вистар, полученных из Биоколлекции Института физиологии им. И.П. Павлова РАН (Санкт-Петербург) и доставленных в виварий лаборатории. Все процедуры работы с животными проводились в соответствии с принципами Базельской декларации; протоколы опытов утверждены комиссией по гуманному обращению с животными Института физиологии им. И.П. Павлова РАН. В виварии лаборатории взрослые самки и самцы, как и их потомство, содержались в стандартных условиях (свободный доступ к стандартизированной пище и воде, 12:00–12:00 включение и выключение света в 8 ч, 22–23°С). Беременность определяли по мазку из влагалища на следующий день после подсадки. После рождения крысят (P0, постнатальный день) в каждом помете оставляли не более восьми животных. Для определения реактивности ГГАКС у новорожденных крысят в ответ на создание очага воспалительной боли были использованы самки и самцы (по два самца и две самки от каждой матери), рожденные от пятнадцати матерей (эксперимент 1). Крысята в первый день после рождения были подвергнуты подкожной инъекции воспалительного агента формалина (2.5%, 0.5 мкл) в подошву задней конечности (контроль – инъекция физиологического раствора). Через 30 мин после этой процедуры декапитацией собирали кровь у одной группы крысят, у крысят второй группы – через сутки, третьей группы – через семь суток для дальнейшего определения содержания кортикостерона в плазме крови (в каждой экспериментальной и контрольной группе 6–8 крысят). Кровь у новорожденных собирали в одну пробирку от одного самца и одной самки.
Для изучения влияния неонатального болевого воздействия на когнитивные способности и реактивность ГГАКС у крыс, рожденных от 16 матерей, в препубертатный период развития очаг воспалительной боли создавали аналогично вышеописанному в одно- и повторно двухдневном возрасте инъекцией формалина в подошву задней конечности, спинку этих подопытных крысят маркировали (эксперимент 2). Контрольным крысятам инъецировали физиологический раствор в подошву задней конечности в то же место, в том же объеме. Каждая группа состояла из 12–16 животных. Крысят возвращали в гнезда к своим матерям, где они находились до 30-дневного возраста, затем разнополых крыс рассаживали в разные клетки.
С 45-дневного возраста оценивали способность к пространственному обучению нахождения платформы в водном лабиринте Морриса [17, 18]; тренировочные пробы продолжались в течение пяти дней. План обучения каждый день был одинаков для каждого животного: по четыре попытки в первой пробе, перерыв четыре минуты, и четыре попытки во второй пробе; местоположение платформы в бассейне было постоянным. Бассейн был условно разделен на четыре квадранта. В первую попытку крысу помещали в 1-й квадрант бассейна, во вторую – во 2-й, в третью – в 3-й и, наконец, в четвертую попытку – в 4-й квадрант бассейна. В бассейне (диаметр 120 см, высота 72 см), наполненном до 40 см водой (24°С), замутненной мелом, в одном из квадрантов ниже воды на 2 см находилась платформа, которую крыса должна была найти в течение 60 с. На платформе крыса находилась 20 с, во время которых она могла свободно ориентироваться в пространстве по окружающим предметам, затем ее помещали на 15 с в сухую клетку для отдыха. В каждой попытке регистрировали латентный период достижения платформы. На пятый день после первой пробы крыс оставляли в сухой клетке на 1 ч в другом помещении. Затем у этих животных регистрировали кратковременную память, для чего крысу помещали в бассейн без платформы и регистрировали латентный период достижения целевого квадранта, места, где в тренировочных пробах находилась платформа. После регистрации кратковременной памяти крыс вытирали и возвращали в свои клетки. Через 96 ч после регистрации кратковременной памяти регистрировали долговременную память в тех же условиях, что и кратковременную память. Кроме латентного периода нахождения целевого квадранта регистрировали время, в течение которого крыса находилась в целевом квадранте за период времени, равный 60 с. Регистрацию в водном лабиринте Морриса проводили как визуально, так и с помощью вебкамеры и регистрации на компьютере с использованием специальной компьютерной программы.
Определение реактивности ГГАКС у крыс в ответ на принудительное плавание осуществляли через 30 мин после завершения регистрации долговременной памяти. Кровь собирали декапитацией у самцов и самок в разные пробирки, центрифугировали плазму и хранили при –20°С до проведения иммуноферментного анализа (ИФА) на содержание кортикостерона.
Статистический анализ для первой (a) и второй (b) проб, статистические сравнения влияния воздействия, пола и дня тестирования проведены с помощью многофакторного дисперсионного анализа ANOVA. Факторы: пол (самцы, самки), воздействие (формалин, физиологический раствор) и дни (1, 2, 3, 4, 5) для первой пробы и дни (1, 2, 3, 4) для второй пробы. Влияние воздействия, пола и дня тестирования на пространственную кратковременную и долговременную память проверяли с использованием смешанного дисперсионного анализа ANOVA, факторы: пол (самцы, самки), воздействие (формалин, контроль), латентность (кратковременная/долговременная память), время пребывания в целевом квадранте (кратковременная/долговременная память). Для кортикостерона новорожденных и 53-дневных крыс статистический анализ проведен с использованием двухфакторного дисперсионного анализа. Факторы для новорожденных: время после инъекции формалина: 30 мин, 1 сутки, 7 суток, и воздействие: базальный уровень, физиологический раствор и формалин; факторы для 53-дневных: пол и воздействие: базальный уровень, физиологический раствор и формалин. Парные сравнения между группами проведены с помощью теста Бонферрони.
РЕЗУЛЬТАТЫ
Пространственное обучение. В препубертатный период развития, как у контрольных, так и у подопытных крыс, обнаружена способность к пространственному обучению: латентный период достижения платформы уменьшился к пятому тренировочному дню. Для первой пробы (а) получены значимые главные эффекты для факторов день: F(2.6 152.7) = 122, p < 0.001, η2 = 0.678 (Greenhouse-Geisser тест) и воздействие: F(1, 58) = 8, p = 0.007, η2 = 0.120. Хотя взаимодействие пола и воздействия не было получено, различия между формалином и контролем проводились отдельно для самцов и самок в целях единообразия представления результатов в первой и второй пробе. Post-hoc анализ показал, что неонатальная воспалительная боль нарушила процесс обучения у самцов, увеличив у них латентность в первой пробе в первый (р = 0.017) и пятый (р = 0.002) тренировочные дни, у самок в третий и четвертый день (p < 0.05, в обоих случаях (рис. 1а).
Рис. 1.
Латентный период достижения платформы в водном лабиринте Морриса в первую пробу – в течение пяти дней (а), и вторую пробу – в течение четырех дней (б), у самцов и самок крыс препубертатного возраста, подвергнутых в новорожденном состоянии воспалительной боли.
По вертикали: латентный период (с), по горизонтали: номера тренировочных дней. В первой пробе уровень значимости: * p < 0.05, ** p < 0.01, различия между формалином и контролем у самцов; +p < 0.05, различия между формалином и контролем у самок. Во второй пробе уровень значимости: * p < 0.05, ** p < 0.01, различия между формалином и контролем у самцов; #p < 0.05, ##p < 0.01 половые различия.
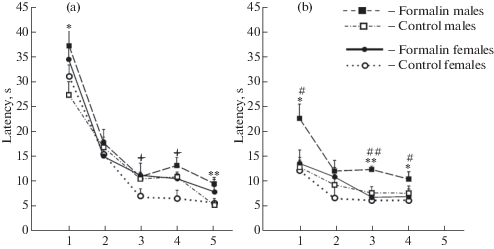
Для второй пробы (b) получены главные эффекты для факторов день: F(1.9 109.7) = 19.4, p < 0.001, η2 = 0.250 (Greenhouse-Geisser тест), воздействие: F(1, 58) = 14.7, p < 0.001, η2 = 0,202, пол: F(1, 58) = = 12, p = 0.001, η2 = 0.172, а также взаимодействие пола и воздействия: F(1, 58) = 4, p = 0.05, η2 = 0.062. Post-hoc анализ показал, что неонатальная боль увеличила латентный период у самцов (в первый, третий и четвертый день p = 0.011, p = 0.003 и p = = 0.04 соответственно) (рис. 1b). Половые различия выявлены во второй пробе у крыс с неонатальной болью с более высокой латентностью у самцов (в 1, 3 и 4 день, p = 0.024, p = 0.01 и p = 0.04 соответственно) (рис. 1b).
Пространственная кратковременная и долговременная память. Смешанный дисперсионный анализ ANOVA обнаружил значимый главный эффект только для воздействия во времени пребывания в целевом квадранте (кратковременная/долговременная память) F(1.56) = 6.5, p = 0.013, η2 = 0.105. Неонатальная боль не изменила кратковременную память у крыс обоего пола, о чем свидетельствовало отсутствие изменений в латентном периоде достижения целевого квадранта, в котором находилась платформа во время обучения. Парные сравнения по Бонферрони показали, что неонатальная боль вызвала дефицит долговременной памяти только у самцов, у которых латентность увеличилась (р < 0.01) по сравнению с латентностью у контрольных самцов, тогда как у особей женского пола неонатальная боль нивелировала различия в латентности между долговременной и кратковременной памятью, которые были обнаружены у контрольных самок с большей эффективностью осуществления задачи в долговременной памяти (р < 0.05) (рис. 2a).
Рис. 2.
Регистрация кратковременной (a) и долговременной (b) памяти в водном лабиринте Морриса у самцов и самок крыс препубертатного возраста, подвергнутых в новорожденном состоянии воспалительной боли.
По вертикали: латентный период достижения целевого квадранта (с) и время нахождения в целевом квадранте (с). Белые столбики – контроль, темные столбики – формалин. Уровень значимости: * p < 0.05, ** p < 0.01, различия между формалином и контролем у самцов; #p < 0.05, различия в латентном периоде достижения целевого квадранта между кратковременной и долговременной памятью у контрольных самок.
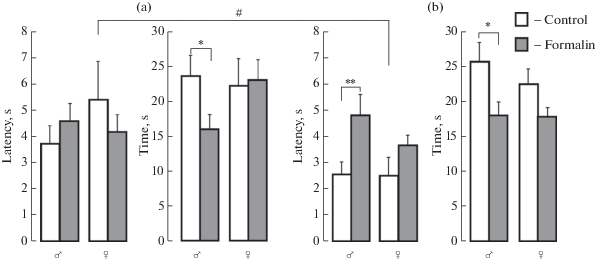
При оценке памяти по другому показателю, времени пребывания в целевом квадранте неонатальная боль вызвала дефицит в кратковременной и долговременной памяти у самцов: уменьшение показателя в обоих случаях (р < 0.05) по сравнению с временем пребывания в целевом квадранте у контрольных самцов. Различия в эффективности между кратковременной и долговременной памятью отсутствовали как у контрольных, так и у подопытных крыс (рис. 2b).
Кортикостерон в плазме крови у новорожденных в ответ на боль, вызванную формалином. Здесь получены значимые главные эффекты для обоих факторов и значимо взаимодействие времени и воздействия, F(2.47) = 75.6, p < 0.001, η2 = 0.763, F(2.47) = = 26.3, p < 0.001, η2 = 0.528 и F(4.47) = 9.7, p < 0.001, η2 = 0.451, время и воздействие соответственно. Post-hoc анализ показал, что содержание кортикостерона в плазме крови в ответ на воспалительную боль в новорожденном возрасте увеличилось через 30 мин по сравнению с уровнем гормона у контрольных крыс и базальным уровнем. Через сутки эти различия сохранялись, исключая различия между базальным кортикостероном и уровнем гормона у контрольных крыс; через семь дней подобные соотношения наблюдались на уровне тенденции (табл. 1).
Таблица 1.
Влияние инъекции формалина или физиологического раствора в подошву задней конечности у новорожденных крысят на уровень кортикостерона в плазме крови через разные интервалы времени и у 53-дневных самцов и самок крыс в ответ на принудительное плавание после тестирования долговременной памяти
| Возраст животных | Уровень кортикостерона (нмоль/л) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Базальный уровень | Время после введения веществ | ||||||||
| Физиологический раствор (Контроль) | Формалин | ||||||||
| Новорож-денные | Одно-суточные | Семи-суточные | 30 мин | 24 ч | 7 сут | 30 мин | 24 ч | 7 сут | |
| С 1-го по 7-й день | 248.2 ± 67.3 | 184.9 ± 79.6 | 77.3 ± 28.3 | 449.3 ± 190.1** | 211.9 ± 62.1 | 97.5 ± 31.2 | 721.6 ± 144.1++*** | 331.6 ± 45.8+* | 110.7 ± 39.3 |
| 53-дневные | После теста Морриса + принудительное плавание | ||||||||
| Самцы | 166.5 ± 131.1 | 618.5 ± 233.6** | 552.8 ± 108.0* | ||||||
| Самки | 172.4 ± 79.2 | 610.3 ± 107** | 577.2 ± 107.0** | ||||||
Кортикостерон в плазме крови у 53-дневных самцов и самок крыс после регистрации долговременной памяти в ответ на принудительное плавание. Здесь значим главный эффект воздействия: F(2.36) = = 13.1, p < 0.001, η2 = 0.421. Post-hoc анализ показал, что содержание кортикостерона в плазме крови у подопытных и контрольных крыс было выше по сравнению с базальным уровнем гормона, но различий в уровне гормона между подопытными и контрольными крысами, как и между полами, не было выявлено (табл. 1).
ОБСУЖДЕНИЕ
Приоритетные данные, полученные в настоящей работе, свидетельствуют о том, что воспалительная неонатальная боль, вызванная инъекцией формалина в подошву задней конечности, увеличивает у новорожденных крысят содержание кортикостерона в плазме крови по сравнению с контролем. Повышенный уровень стрессорного гормона сохраняется через сутки после инъекции. Периферический очаг воспаления в новорожденном состоянии повышает уязвимость когнитивных процессов у этих животных в поздний препубертатный период развития, притом четко проявляется половой диморфизм в протекании процессов пространственного обучения и кратковременной, и долговременной памяти. Однако не было выявлено прямой взаимосвязи между активацией ГГАКС неонатальной болью у новорожденных и показателями пространственного обучения и памяти у крыс в позднем препубертатном возрасте.
Полученные данные указывают на то, что неонатальная боль вызывает дефицит пространственного обучения у самцов в первой и второй тренировочных пробах, а у самок – только в первой; даже в последний пятый день латентный период достижения платформы был значительно больше по сравнению с контролем у самцов. Вторая за день тренировочная проба наглядно продемонстрировала ухудшение способности повторить выполнение задачи (спустя 4 мин после отдыха) у самцов. Именно во второй пробе обнаружены половые различия в латентном периоде достижения целевого квадранта.
При исследовании пространственной кратковременной и долговременной памяти более яркое влияние неонатальной боли проявилось в показателе продолжительности пребывания в целевом квадранте, чем в показателе латентности достижения платформы. У самцов неонатальная боль вызвала дефицит как кратковременной, так и долговременной памяти. Следует подчеркнуть, что в позднем препубертатном возрасте отсутствовали различия в эффективности выполнения задачи между кратковременной и долговременной памятью, как у контрольных, так и у подопытных крыс.
Нам известно лишь о нескольких исследованиях, выполненных на грызунах, по изучению влияния неонатальной воспалительной боли, вызванной каррагеном или адъювантом Фрейнда, на память. Например, воспалительная боль, вызванная внутриплантарной инъекцией каррагена (1%) в первый день жизни (P0), привела к дефициту пространственной памяти у взрослых крыс [19], а также изменила регуляцию ГГАКС [20]. Инъекция адъюванта Фрейнда на P1 не оказала влияния на кратковременную или долговременную память у крыс на P60, но привела к пространственному дефициту обучения у самцов крыс [21]. Боль, вызванная у новорожденных крыс инъекцией формалина, который производит менее длительную боль, чем воспалительная боль, вызванная каррагеном или адъювантом Фрейнда, нарушила пространственное обучение и память в радиальном лабиринте, в котором используется пищевое подкрепление, у взрослых крыс [22]. Не обнаруженная нами взаимосвязь между активацией ГГАКС неонатальной болью у новорожденных и показателями пространственного обучения и памяти у крыс в позднем препубертатном возрасте может быть обусловлена использованием разной интенсивности действия воспалительных агентов и разном их стрессорном влиянии на ГГАКС.
Ранее мы показали, что воспалительная боль на P1 и P2 не изменила пространственное обучение у 33-дневных самок-подростков в течение только одного тренировочного дня [23]. Более детальное и продолжительное изучение последствий воспалительного болевого воздействия на когнитивные способности и стресс-гормональную систему в подростковом возрасте особенно важно, так как нейробиологические и поведенческие изменения существенно различаются на разных стадиях подросткового возраста, и эти изменения, вызванные стрессовыми раздражителями в раннем возрасте, могут проявляться неодинаково на каждой их этих стадий.
Гиппокамп, медиальная префронтальная кора и миндалина, структуры мозга, вовлеченные в регуляцию ГГАКС [24] и когнитивных способностей [25], могут влиять на чувствительность ГГАКС к половым гормонам и изменять процессы обучения и памяти. Поэтому не исключено, что половые гормоны могут быть одной из причин обнаруженных нами различий в процессах обучения и памяти между самцами и самками в этот критический период развития крысы.
Полученное нами впервые продолжительное усиление реактивности ГГАКС в ответ на воспалительную боль, вызванную инъекцией формалина в подошву задней конечности, у новорожденных крысят, позволило предполагать о модификации в развитии ГГАКС и возможном ее участии в изменении когнитивных способностей. Ноцицептивная система и ГГАКС тесно связаны благодаря восходящим проекциям от дорсального ядра шва, к паравентрикулярному ядру гипоталамуса, а также нисходящим проекциям из гипоталамуса к центру серотонинергических нейронов головного мозга. Однако наши эксперименты показали, что активация ГГАКС неонатальной болью не имеет прямой взаимосвязи с пространственным обучением и памятью у крыс позднего препубертатного возраста. Во влияние боли у новорожденных могут быть включены и другие физиологические системы, такие как иммунная система, которая находится в тесном взаимодействии с ГГАКС, реагирует на воспаление и стресс и поэтому может влиять на нейроны мозга и когнитивные функции. Половые различия в микроглии, нейроиммунных клетках, начинают проявляться в пренатальный период организации половой дифференциации мозга [26], и иммунная система начинает функционировать как регулятор половых различий в развитии мозга и поведения [27, 28]. Современные данные указывают на взаимодействие иммунной и половой систем с ГГАК системой [29]. Взаимосвязь между вышеперечисленными системами может обусловливать наблюдаемые нами и половые различия во влиянии неонатальной боли на пространственное обучение и память. Можно предположить, что неонатальная боль, нарушая процессы торможения и возбуждения в центральной нервной системе, изменяет синхронизацию развития ГГАКС, гипоталамо-гипофизарно-гонадной системы (ГГГС) и иммунной системы, которые тесно взаимодействуют друг с другом и влияют на нейропластичность структур, вовлеченных в процессы обучения и памяти.
Надо отметить, что границы препубертатного периода развития с 21-го по 59-й постнатальный день [14] варьируют в зависимости от применяемых критериев (морфогенетические, поведенческие и нейрогормональные). Использование разнополых особей способствует изучению механизмов исследуемых явлений [30]. Вопрос о влиянии неонатальной воспалительной боли на когнитивные процессы и об участии в этом процессе ГГАКС в ходе постнатального онтогенеза требует дальнейших исследований [31]. Полученные нами в настоящей работе результаты на крысах позднего препубертатного возраста, подвергнутых в новорожденном состоянии воспалительной боли, могут быть полезны педиатрам при лечении когнитивных отклонений у подростков с учетом полового диморфизма. Работы, проводимые на животных с использованием модели недоношенной беременности человека, должны осуществляться в тесной связи с исследованиями педиатров с целью фармакологической коррекции нарушений, вызванных неонатальной болью, у подростков с учетом полового диморфизма.
Список литературы
Romeo RD (2010) Pubertal maturation and programming of hypothalamic-pituitary-adrenal reactivity. Front Neuroendocrinol 31: 232–240. https://doi.org/10.1016/j.yfrne.2010.02.004
McCormick CM, Mathews IZ (2010) Adolescent development, hypothalamic-pituitary-adrenal function, and programming of adult learning and memory. Progress in Neuro-Psychopharmac. Biol. Psychiatry. 34: 756–765. https://doi.org/10.1016/j.pnpbp.2009.09.019
Novak CM, Ozen M, Burd I (2018) Perinatal Brain Injury: Mechanisms, Prevention, and Outcomes. Clin. Perinatol. 45: 357–375. https://doi.org/10.1016/j.clp.2018.01.015
Renz H, Adkins BD, Bartfeld S, Blumberg RS, Farber DL, Garssen J, Ghazal P, Hackam DJ, Marsland BJ, McCoy KD, Penders J, Prinz I, Verhasselt V, von Mu-tius E, Weiser JN, Wesemann DR, Hornef MW (2018) The neonatal window of opportunity-early priming for life. J. Allergy Clin. Immunol. https://doi.org/10.1016/j.jaci.2017.11.019
Rulli SB, Cambiasso MJ, Ratner LD (2018) Programming of the reproductive axis by hormonal and genetic manipulation in mice. Reproduction. 156: 101–109. https://doi.org/10.1530/REP-18-0054
Williams MD, Lascelles BDX (2020) Early Neonatal Pain-A Review of Clinical and Experimental Implications on Painful Conditions Later in Life. Front. Pediatr. 7: 8–30. https://doi.org/10.3389/fped.2020.00030
Melchior M, Kuhn P, Poisbeau P (2021) The burden of early life stress on the nociceptive system development and pain responses. Eur. J. Neurosci. https://doi.org/10.1111/ejn.15153
Walker SM (2019) Long-term effects of neonatal pain. Semin. Fetal Neonatal. Med. 24: 101005. https://doi.org/10.1016/j.siny.2019.04.005
Mooney-Leber SM, Brummelte S (2017) Neonatal pain and reduced maternal care: Early-life stressors interacting to impact brain and behavioral development. Neuroscience. 7: 21–36. https://doi.org/10.1016/j.neuroscience.2016.05.001
Butkevich IP, Mikhailenko VA, Vershinina EA, Ulano-va NA (2015) Differences in adaptive behaviors of adolescent male and female rats exposed at birth to inflammatory pain or stress. J. Evolutionary Biochem. Physiology. 51: 305–315. https://doi.org/10.1134/S0022093015040067
Schroeder A, Notaras M, Du X, Hill RA (2018) On the developmental timing of stress: delineating sex-specific effects of stress across development on adult behavior. Brain Sci. 8: 121. https://doi.org/10.3390/brainsci8070121
Cordier JM, Aguggia JP, Danelon V, Mir FR, Rivarola MA, Mascó D (2021) Postweaning Enriched Environment Enhances Cognitive Function and Brain-Derived Neurotrophic Factor Signaling in the Hippocampus in Maternally Separated Rats. Neuroscience. 453: 138–147. https://doi.org/10.1016/j.neuroscience.2020.09.058
Dobbing J (1981) Nutritional growth restriction and the nervous system. In: The molecular basis of neuropathology. Eds: AN Davidson, RHS Thompson. London: Edward Arnold Co 221–233.
Tirelli E, Laviola G, Adriani W (2003) Ontogenesis of behavioral sensitization and conditioned place preference induced by psychostimulants in laboratory rodents. Neurosci. Biobehav. Rev. 27: 163–178. https://doi.org/10.1016/s0149-7634(03)00018-6
Chen M, Xia D, Min C, Zhao X, Chen Y, Liu L, Li X (2016) Neonatal repetitive pain in rats leads to impaired spatial learning and dysregulated hypothalamic-pituitary-adrenal axis function in later life. Sci. Rep. 14: 39159. https://doi.org/10.1038/srep39159
Xia D, Min C, Chen Y, Ling R, Chen M, Li X (2020) Repetitive Pain in Neonatal Male Rats Impairs Hippocampus-Dependent Fear Memory Later in Life. Front. Neurosci. 14: 722. https://doi.org/10.3389/fnins.2020.00722
Morris RGM (1981) Spatial localization does not require the presence of local cues. Learning and Motivation 12: 239–260. https://doi.org/10.1016/0023-9690(81)90020-5
Vorhees CV, Williams MT (2014) Assessing spatial learning and memory in rodents. ILAR J. 55, 310–332. https://doi.org/10.1093/ilar/ilu013
Henderson YO, Victoria NC, Inoue K, Murphy AZ, Parent MB (2015) Early life inflammatory pain induces long-lasting deficits in hippocampal-dependent spatial memory in male and female rats. Neurobiol. Learn. Mem. 118: 30–41. https://doi.org/10.1016/j.nlm.2014.10.010
Victoria NC, Inoue K, Young LJ, Murphy AZ (2013) Long-term dysregulation of brain corticotrophin and glucocorticoid receptors and stress reactivity by single early-life pain experience in male and female rats. Psychoneuroendocrinology. 38: 3015–3028. https://doi.org/10.1016/j.psyneuen.2013.08.013
Amaral C, Antonio B, Oliveira MG, Hamani C, Guinsburg R, Covolan L (2015) Early postnatal nociceptive stimulation results in deficits of spatial memory in male rats. Neurobiol. Learn. Mem. 125: 120–125. https://doi.org/10.1016/j.nlm.2015.08.012
Anand KJ, Garg S, Rovnaghi CR, Narsinghani U, Bhutta AT, Hall RW (2007) Ketamine reduces the cell death following inflammatory pain in newborn rat brain. Pediatr. Res. 62: 283–290. https://doi.org/10.1203/pdr.0b013e3180986d2f
Butkevich IP, Mikhailenko VA, Vershinina EA (2020) The Influence of Perinatal Stress and Antidepressants on Different Types of Adaptive Behavior and Cognitive Abilities of Prepubertal Female Rats. J. Evolutionary Biochemistry and Physiology. 56: 133–144. https://doi.org/10.1139/cjpp-2020-0307
Herman JP, Figueiredo H, Mueller NK, Ulrich-Lai Y, Ostrander MM, Choi DC, Cullinan WE (2003) Central mechanisms of stress integration: hierarchical circuitry controlling hypothalamo-pituitary-adrenocortical responsiveness. Front. Neuroendocrinol. 24: 151–80. https://doi.org/10.1016/j.yfrne.2003.07.001
Euston DR, Gruber AJ, McNaughton BL (2012) The role of medial prefrontal cortex in memory and decision making. Neuron. 76: 1057–1070. https://doi.org/10.1016/j.neuron.2012.12.002
Schwarz JM, Sholar PW, Bilbo SD (2012) Sex differences in microglial colonization of the developing rat brain. J Neurochem. 120. 948–963. https://doi.org/10.1111/j.1471-4159.2011.07630.x
Nelson LH, Lenz KH (2017) The immune system as a novel regulator of sex differences in brain and behavioral development. J. Neurosci. Res. 95. 447–461. https://doi.org/10.1002/jnr.23821
Van Ryzin JW, Pickett LA, McCarthy MM (2018) Microglia: driving critical periods and sexual differentiation of the brain. Dev. Neurobiol. 78. 580–592. https://doi.org/10.1002/dneu.22569
Bereshchenko O, Bruscoli S, Riccardi C (2018) Glucocorticoids, sex hormones, and immunity. Front. Immunol. 9. 1332. https://doi.org/10.3389/fimmu.2018.01332
McCarthy MM, Nugent BM, Lenz KM (2017) Neuroimmunology and neuroepigenetics in the establishment of sex differences in the brain. Nat. Rev. Neurosci. 18: 471–484. https://doi.org/10.1038/nrn.2017.61
Mooney-Leber SM, Brummelte S (2020) Neonatal pain and reduced maternal care alter adult behavior and hypothalamic-pituitary-adrenal axis in a sex-specific manner. Dev. Psychobiol. 62: 631–643. https://doi.org/10.1002/dev.21941
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


