Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 2, стр. 116-125
ПОЛОВОЙ ДИМОРФИЗМ ИЗМЕНЕНИЙ СТРЕСС-ГОРМОНАЛЬНОЙ И КОГНИТИВНОЙ ФУНКЦИЙ У ВЗРОСЛЫХ КРЫС, ПОДВЕРГНУТЫХ ВОСПАЛИТЕЛЬНОЙ БОЛИ В НОВОРОЖДЕННОМ ВОЗРАСТЕ
И. П. Буткевич 1, *, В. А. Михайленко 1, Е. А. Вершинина 1
1 Федеральное государственное учреждение науки Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: irinabutkevich@yandex.ru
Поступила в редакцию 28.10.2021
После доработки 22.11.2021
Принята к публикации 23.11.2021
- EDN: ZZRZLY
- DOI: 10.31857/S0044452922020036
Аннотация
Настоящая работа посвящена исследованию влияний умеренного неонатального болевого стресса, вызванного у новорожденных самцов и самок крысят созданием очага воспалительной боли, на стрессовую реактивность гормонального ответа и когнитивные процессы в водном лабиринте Морриса во взрослом состоянии. Полученные данные указывают на отсутствие значимых различий в показателях пространственного обучения и памяти между подопытными крысами, подвергнутыми неонатальной воспалительной боли, и контрольными животными. Однако у подопытных крыс обнаружены половые различия в пространственной долговременной памяти, эффективность которой была выше у самцов, чем у самок. После тестирования долговременной памяти реактивность гипоталамо-гипофизарно-адренокортикальной системы, оцененная по содержанию гормона стресса кортикостерона в плазме крови в ответ на формалиновый тест, у подопытных самцов была выше, чем у самок. Только у подопытных самок обнаружены различия между показателями кратковременной и долговременной памяти, с более высокой эффективностью кратковременной памяти. Таким образом, обнаружен половой диморфизм во влиянии неонатального болевого стресса на пространственную долговременную память у взрослых крыс; у подопытных самцов по сравнению с подопытными самками выявлена более эффективная долговременная память, сочетающаяся с более высокой стрессовой реактивностью гормонального ответа.
Боль является стрессом для организма. Ранний возраст по сравнению со взрослым характеризуется более высокой чувствительностью к боли из-за незрелости центральной нервной системы и несформировавшейся нисходящей тормозной системы, регулирующей болевые сигналы [1, 2]. Повторные болевые воздействия в неонатальном возрасте нарушают развитие центральной нервной системы [3], что провоцирует в дальнейшем изменения в функциональной активности ноцицептивной системы [4, 5], адаптивной гипоталамо-гипофизарно-адренокортикальной системы (ГГАКС) и разных типов поведения [6]. В неонатальной клинике для новорожденных был введен термин болевой стресс. Клинические данные по исследованию влияния болевого стресса в раннем возрасте на функциональную активность ГГАКС ограничены подростковым возрастом и получены на детях, которые родились раньше срока и нуждались в интенсивных терапевтических процедурах в новорожденном состоянии [6–8]. Обращает на себя внимание противоречивость результатов по исследованию влияния болевого стресса в раннем возрасте на функциональную активность ГГАКС. Как увеличение, так и отсутствие в изменении уровня кортизола было обнаружено после болевых процедур [9]. Противоположные результаты, более низкий уровень кортизола в слюне, был обнаружен у недоношенных детей с более высоким числом болевых процедур в раннем возрасте, чем у детей с меньшим их числом [8, 10].
Существует тесное нейроанатомическое и физиологическое взаимодействие между болью и ГГАКС, которое регулируется гипоталамусом, миндалиной, гиппокампом, префронтальной корой и таламусом [11–13]. Особенности этого взаимодействия в ответ на повреждающие раздражители в раннем возрасте недостаточно изучены. Поскольку существует множество факторов, влияющих на боль и ГГАКС в неонатальный период, данные о влиянии боли на ГГАКС, полученные как в клинике, так и в лабораторных исследованиях на животных, являются неполными [6]. Более того, воздействие стресса и боли на ГГАКС зависит от возраста, даже в младенческом возрасте [14]. Необходимы дальнейшие исследования для выяснения взаимосвязи между неонатальной болью и ГГАКС, так как существует многогранная взаимосвязь между типом боли, ее интенсивностью, полом, возрастом во время воздействия боли и реакцией ГГАКС.
Модификацию стрессорной реактивности ГГАКС связывают с нарушением негативной обратной связи, осуществляемой глюкокортикоидами через паравентрикулярное ядро гипоталамуса и гипофиз. Периферический стероидный гормон ГГАКС, кортизол у людей, кортикостерон у грызунов играют важную роль в обучении и памяти [15]. Ключевыми внешними регуляторами активности ГГАКС являются гиппокамп, амигдала, префронтальная кора, структуры, вовлеченные в когнитивную сферу, поэтому изменения, вызванные неонатальным болевым стрессом в этих структурах мозга, могут модифицировать процессы обучения и памяти. Исследования на младенцах [16] и детях школьного возраста [17] подтверждают неблагоприятное влияние неонатальной боли на когнитивную сферу, однако остается до сих пор открытым вопрос о возможном долговременном влиянии перенесенной неонатальной боли на когнитивные процессы и регуляцию ГГАКС.
Многочисленные работы на животных посвящены изучению влияния не болевого стресса (отнятие от матери, лимитированные жизненные условия и др.) на реактивность ГГАКС и когнитивные способности [14, 18, 19], тогда как число исследований по влиянию болевого стресса крайне ограничено [20]. Существует множество моделей неонатальной боли, каждая из которых имеет свои преимущества и недостатки. Все они предназначены для моделирования опыта младенцев, которые каждый день переживают множество повреждений кожи в отделении интенсивной терапии [21]. Нам известно лишь о нескольких исследованиях на грызунах, в которых изучалось влияние неонатальной воспалительной боли на обучение, память или ГГАКС. Например, боль, вызванная формалином у новорожденных крыс, нарушила у этих животных в возрасте 64 дней пространственное обучение и память, тестированные в радиальном лабиринте, в котором используется пищевое подкрепление [22]. В других работах инъекция воспалительных агентов каррагена или адъюванта Фрейнда в заднюю конечность новорожденным крысятам приводила к дефициту пространственной памяти у взрослых крыс [23], нарушению регуляции ГГАКС, но не влияла на краткосрочную или долгосрочную память у крыс обоего пола [12], однако вызывала дефицит пространственного обучения у самцов крыс [24]. Модель острой воспалительной боли, вызванной подкожной инъекцией формалина, широко используется в течение многих лет в исследованиях болевой системы [25, 26]. Формалин вызывает повреждающие последствия, которые сравнимы с повреждениями в неонатальной клинике, тогда как вышеупомянутые воспалительные агенты карраген и адъювант Фрейнда значительно превосходят повреждения, вызванные инвазивными процедурами, по интенсивности и продолжительности.
Следует подчеркнуть, что данные литературы по исследуемому вопросу получены в основном на особях мужского пола, при исследовании разнополых особей результаты противоречивы [27–29]. Несмотря на несоответствия имеющихся данных, нет сомнения в том, что болезненные травмы и вызванные ими переживания в раннем возрасте могут нарушить процессы пространственного обучения и памяти в постнатальном онтогенезе. Актуальность данного вопроса очевидна, принимая во внимание распространенность в неонатальной клинике инвазивных процедур, которые могут вызвать воспалительный ответ, а также установленную связь между неонатальной болью и нарушениями в ЦНС [3, 4]. Подчеркивается, что для выяснения механизмов влияния болевых переживаний в раннем возрасте на когнитивную функцию и адаптивную стрессовую ГГАКС необходимо включение разнополых особей [6, 14].
Ранее при исследовании влияния неонатальной периферической боли, вызванной формалином, на пространственное обучение и память мы обнаружили половые различия у крыс позднего препубертатного возраста с более выраженным нарушением когнитивной функции у самцов и отсутствием взаимосвязи между активацией ГГНС, неонатальной болью и показателями пространственного обучения и памяти [30]. Настоящее исследование является продолжением предыдущего и проведено на взрослых крысах, чтобы выяснить, сохраняются ли данные нарушения у половозрелых животных. Актуальность данной проблемы очевидна, принимая во внимание распространенность болевых инвазивных процедур в неонатальной клинике (ежедневное взятие крови из пяточки, трахеотомия, уколы, хирургические операции), которые могут вызвать воспалительный ответ, а также установленную связь между неонатальной болью и нарушениями в центральной нервной системе [3, 4]. В настоящее время эта проблема становится особенно актуальной, когда коронавирусная инфекции охватила уже и новорожденных, которым требуется интенсивная терапия.
Цель настоящей работы заключалась в исследовании долговременного влияния болевого стресса, вызванного воспалительной болью на периферии, у одно- и двухсуточных крысят обоего пола, на пространственное обучение и память, а также реактивность ГГАКС в ответ на стресс у взрослых крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа проведена на потомстве крыс линии Вистар, полученных из Биоколлекции Института физиологии им. И.П. Павлова РАН (Санкт-Петербург). Все процедуры работы с животными проводились в соответствии с принципами Базельской декларации; протоколы опытов утверждены комиссией по гуманному обращению с животными Института физиологии им. И.П. Павлова РАН (Протокол № 28/10 от 28.10.2021). Взрослые самки и самцы, как и их потомство (подопытные – 34 самца и 30 самок, контрольные – 29 самцов и 28 самок), содержались в стандартных условиях (свободный доступ к стандартизированной пище и воде, 12:00–12:00 включение и выключение света в 8 ч, 22–23°С) в виварии лаборатории. На следующее утро, после подсадки к трем не рожавшим самкам двух самцов, у самок брали мазки из влагалища для определения беременности. Через сутки после рождения потомства в каждом помете оставляли не более восьми крысят, самцов и самок поровну по возможности. Одно- и повторно двухдневным крысятам инъецировали подкожно раствор формалина (2.5%, 0.5 мкл) в подошву задней конечности (контроль – инъекция физиологического раствора) для создания очага воспалительной боли, после чего крысят сразу возвращали к своим матерям. Подопытных крысят маркировали.
В возрасте 30 дней разнополых крыс рассаживали без матери в разные клетки не более четырех-пяти крыс в каждой. Начиная с 90–100-дневного возраста, у животных исследовали процесс пространственного обучения в течение пяти дней в водном лабиринте Морриса [31]. Крысу помещали в бассейн, в котором она должна была в течение 60 с найти металлическую платформу (диаметр 10 см), расположенную на дне бассейна (диаметр 120 см, высота 72 см, температура воды 22–24°С) ниже уровня воды на 2 см. Бассейн визуально разделяли на четыре части, в одной из них находилась платформа, местоположение которой не изменяли. Регистрировали время нахождения платформы (латентный период, с). Если попытка была неудачной, экспериментатор сам помещал крысу на платформу, в этом случае латентный период принимали за 60 с. Первые четыре попытки с перерывом между каждой в 15 с и пребыванием на платформе в 20 с составляли первую пробу. Следующая вторая аналогичная проба предоставлялась крысе через четыре мин отдыха в сухой клетке. Кратковременную память регистрировали на пятый день после первой пробы, а через четверо суток после этого – долговременную память; в обоих случаях крысу на 60 с помещали в бассейн без платформы и регистрировали латентный период достижения целевого квадранта, места, где ранее находилась платформа, а также время пребывания в целевом квадранте за период времени, равный 60 с. Использовали специальную компьютерную программу для регистрации траектории движения крысы с помощью вебкамеры. После завершения исследования долговременной памяти у крыс оценивали реактивность ГГАКС в ответ на боль, вызванную инъекцией формалина в заднюю конечность. Через 30 мин после инъекции формалина (пик болевого ответа, [32]) декапитацией собирали образцы крови для дальнейшего определения содержания кортикостерона в плазме крови. Плазму крови хранили при температуре минус 20°С. Кортикостерон определяли в двух экземплярах методом иммуноферментного анализа с использованием стандартных наборов (“Xema-Medica Co” Cat №: K210R; Россия) с помощью спектрофотометрической пластины (Spectrostar NANO, BMG Labtech, Германия).
Полученные данные проверялись на нормальность выборок с использованием критерия Колмогорова-Смирнова, с последующим тестом статистических методов. Статистический анализ результатов проводили с использованием дисперсионного анализа ANOVA в программном комплексе SPSS Inc 13 с последующими множественными сравнениями по Бонферрони. Анализ данных по обучению, памяти и кортикостерону проводили с использованием разных моделей дисперсионного анализа: двухфакторного (пол, воздействие), смешанного (кратковременная и долговременная память, пол, воздействие) и трехфакторного (пол, воздействие и время) соответственно. Данные представлены в виде среднего ± стандартная ошибка. Статистические решения принимали на 5%-ном уровне значимости.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Для пространственного обучения применяли одномерный двухфакторный анализ для каждого дня в отдельности (факторы: пол & воздействие). Главные эффекты дали значимое влияние пола, но не воздействия, в первый тренировочный день в первой пробе (F(1.117) = 4.455, p = 0.037, η2 = 0.037 и второй пробе F(1.117) = 5.252, p = 0.024, η2 = 0.043. Смешанный дисперсионный анализ (зависимые переменные – значения латентного периода, факторы: пол, воздействие, попытки) обнаружил у подопытных крыс половые различия в первый день только во второй пробе (р = 0.026), в первой пробе – на уровне тенденции (р = 0.067), с более продолжительным латентным периодом у самцов (рис. 1а, 1с). Первый день принято рассматривать как самый показательный во влиянии стрессовых воздействий на процесс обучения в тесте Морриса [33].
Рис. 1.
Латентный период достижения платформы в водном лабиринте Морриса в первую пробу в течение пяти тренировочных дней и вторую пробу в течение четырех тренировочных дней пространственного обучения, у самцов (а) и самок (b) взрослых крыс, подвергнутых неонатальной воспалительной боли, и контрольных крыс. По горизонтали: номера проб (1, 2) и пяти тренировочных дней. (c) Графики а1–b1 и а2–b2 иллюстрируют результаты статистического анализа в первый тренировочный день в пробе 1 и пробе 2 у самцов и самок. Различия между подопытными самцами и самками в первый день в первой пробе: а1–b1, уровень значимости: p = 0.067; во второй пробе: а2–b2, уровень значимости: *p = 0.026.

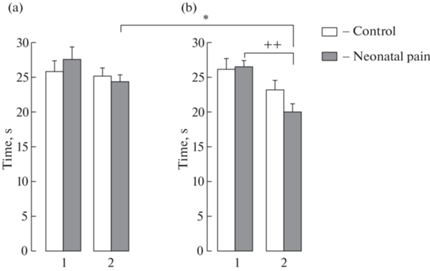
В пространственной памяти также не было обнаружено значимого влияния неонатальной боли у крыс обоего пола. Трехмерный дисперсионный анализ выявил значимые различия в долговременной памяти между подопытными самцами и самками для продолжительности нахождения в целевом квадранте F(1.93) = 5.62, p = 0.020, η2 = 0.057, с более высокой эффективностью у самцов (р = 0.017). У подопытных самок обнаружены различия во времени нахождения в целевом квадранте между кратковременной и долговременной памятью F(1.23) = = 15.4, p = 0.001, η2 = 0.401 с большей продолжительностью в кратковременной памяти (p < 0.01), т.e. с более эффективной кратковременной памятью по сравнению с долговременной (рис. 2).
Рис. 2.
Регистрация кратковременной (1) и долговременной (2) памяти в водном лабиринте Морриса у самцов (a) и самок (b) взрослых крыс, подвергнутых в новорожденном состоянии воспалительной боли. По вертикали: время нахождения в целевом квадранте (с). Белые столбики – контроль, темные столбики – неонатальная боль. Уровень значимости: *p < 0.05, половые различия в долговременной памяти у крыс с неонатальной болью; ++p < 0.01, между кратковременной и долговременной памятью у самок с неонатальной болью.
При исследовании реактивности ГГАКС в ответ на формалиновый тест после тестирования у взрослых крыс долговременной памяти трехфакторный (пол, воздействие и время) дисперсионный анализ ANOVA обнаружил главные эффекты для времени: F(2.64) = 74.745, p < 0.001, η2 = 0.700 и взаимодействия факторов Время и Воздействие: F(2.64) = = 3.65, p = 0.032, η2 = 0.102. Апостериорный анализ с поправкой Бонферрони показал, что неонатальная боль увеличила у взрослых крыс с тестированной долговременной памятью содержание кортикостерона в ответ на 30-минутный формалиновый тест по сравнению с базальным уровнем гормона (p < 0.001 у обоего пола) и с уровнем гормона у контрольных самцов (p = 0.012), но не у самок. У подопытных животных выявлены половые различия с более высокой реактивностью ГГАКС у самцов, чем у самок (p = 0.048), тогда как для контрольных самцов и самок реактивность ГГАКС в подобных условиях была идентичной. Через сутки после формалинового теста уровень кортикостерона был нормализован (табл. 1).
Таблица 1.
Влияние воспалительной боли, вызванной инъекцией формалина или физиологического раствора в подошву задней конечности у новорожденных крысят, на уровень кортикостерона в плазме крови через 30 мин и 24 часа после формалинового теста у взрослых самцов и самок крыс
| Пол животных | Уровень кортикостерона (нмоль/л) | |||||
|---|---|---|---|---|---|---|
| Базальный уровень | Время отбора пробы после формалинового теста | |||||
| Физиологический раствор (контроль) | Формалин | Физиологический раствор (контроль) | Формалин | |||
| 30 мин | 24 ч | 30 мин | 24 ч | |||
| Самцы | 180.5 ± 54.5 | 173.1 ± 75.8 | ^767.5 ± 96.9 | 296.0 ± 51.1 | *** +1189.4 ± 108.7 | 338.4 ± 56.9 |
| Самки | 278.4 ± 48.2 | 217.4 ± 30.4 | 838.2 + 127.5 | 383.1 ± 111.2 | ***968.9 ± 102.6 | 345.9 ± 79.8 |
Примечание. Неонатальная боль увеличила у взрослых крыс, прошедших тестирование долговременной памяти, содержание кортикостерона через 30 мин после формалинового теста по сравнению с базальным уровнем гормона (***p < 0.001 у обоего пола) и уровнем гормона у контрольных самцов (^p = 0.012), но не у контрольных самок, в результате чего у подопытных животных проявились половые различия с более высокой реактивностью ГГАКС у самцов, чем у самок (+p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные в настоящей работе результаты показали, что боль, вызванная подкожной инъекцией воспалительного агента формалина в подошву задней конечности в первые два дня жизни крысят, не изменила во взрослом состоянии исследованные характеристики пространственного обучения, кратковременной и долговременной памяти в водном лабиринте Морриса у крыс обоего пола. В то же время у крыс с неонатальной воспалительной болью, но не у контрольных, были выявлены половые различия в пространственной долговременной памяти, которая характеризовалась более высокой эффективностью у самцов. После тестирования долговременной памяти у самцов с неонатальной воспалительной болью реактивность ГГАКС в ответ на формалиновый тест была выше, чем у контрольных самцов, тогда как у самок аналогичных различий в уровне кортикостерона не проявилось. У подопытных крыс обнаружены половые различия в реактивности ГГАКС в ответ на формалиновый тест, с более высокой реактивностью у самцов, чем у самок, тогда как у контрольных животных реактивность ГГАКС была идентичной. Кроме того, только у подопытных самок, но не у подопытных самцов и не у контрольных крыс обоего пола, долговременная память была менее эффективна по сравнению с кратковременной памятью.
Ранее нами было впервые показано, что новорожденные крысята в ответ на инъекцию формалина в подошву задней конечности демонстрируют продолжительное (более суток) увеличение содержания кортикостерона в плазме крови, что дало нам возможность предполагать о долговременном влиянии данного воспалительного болевого воздействия на ГГАКС и, возможно, на когнитивную функцию [34]. Однако в препубертатный период развития только самцы с аналогичным неонатальным воздействием, но не самки, обнаружили ухудшение в пространственном обучении и памяти, но реактивность ГГАКС в ответ на принудительное плавание не была изменена у крыс обоего пола по сравнению с контролем (физиологический раствор) [34]. Данные настоящего исследования указывают на модификацию влияний неонатальной воспалительной боли у крыс в процессе развития. Действительно, негативное влияние неонатальной умеренной воспалительной боли, выявленное нами у самцов крыс препубертатного возраста, не проявилось у взрослых самцов, более того, долговременная память у них стала достоверно эффективнее, чем у самок.
Отсутствие влияния повторной неонатальной воспалительной боли на характеристики пространственного обучения и памяти у взрослых крыс в настоящей работе можно было бы связать с низкой концентрацией формалина, используемой нами для новорожденных крысят в первые два дня жизни. Действительно, при использовании в качестве воспалительного агента формалина с более высокими концентрацией и объемом (4%, 5 мкл) по сравнению с нашей работой, и более продолжительной инъекцией (с первого по четвертый день жизни) в каждую лапу крысятам авторы обнаружили у них в 64-дневном возрасте нарушение пространственного обучения и памяти в радиальном лабиринте [22]. В данном инструменте используется пищевое подкрепление, крыса ориентируется по запаху и визуальным меткам внутри лабиринта, тогда как в водном лабиринте Морриса, который применяли мы, – по предметам вокруг бассейна и в отсутствие обонятельных стимулов; и, наконец, еще одно отличие между нашей работой и упомянутой – это разные линии крыс (Вистар и Спрэг-Доули). Мы не можем сравнивать наши результаты с результатами, полученными с применением у новорожденных грызунов каррагена или адъюванта Фрейнда в связи с тем, что данные воспалительные агенты вызывают значительно более продолжительные и повреждающие последствия, чем формалин. Перечисленные, хотя и несопоставимые данные указывают на то, что воспалительная боль в раннем возрасте может иметь долгосрочные последствия для последующей функции ГГАКС и когнитивной сферы.
Наряду с отсутствием различий во влиянии неонатального болевого стресса между подопытными и контрольными крысами, мы обнаружили у подопытных самцов по сравнению с подопытными самками более эффективную долговременную память, сочетающуюся с более высокой стрессовой реактивностью гормонального ответа. Какие механизмы могут быть вовлечены во влияние неонатальной воспалительной боли на когнитивные процессы и реактивность ГГАКС во взрослом состоянии? В месте инъекции формалина выделяется “inflammatory soup” (“воспалительный суп”) [35], в состав которого входят многие вещества, включая и гистамин, который вызывает расширение капилляров, повышение их проницаемости, увеличение выброса адреналина и глюкокортикоидов. Высвобождение этих сигнальных молекул усиливает воспалительный ответ, опосредует периферическую сенсибилизацию и передает болевые сигналы в дорсальный рог спинного мозга. Стимуляция первичных афферентных нейронов вызывает высвобождение медиаторов воспаления, которые, в свою очередь, активируют центральные нейроны и глиальные клетки. В раннем онтогенезе гистамин может способствовать синаптической пластичности, зависимой от NMDA-рецептора, а во взрослом возрасте – ингибировать синаптическую пластичность, зависящую от NMDA-рецептора, также через рецептор H3, что может указывать на зависимую от возраста связь рецептора H3 с внутриклеточными процессами [36, 37]. Чувствительность организма к гистамину высокая в период низкого уровня глюкокортикоидов, наблюдаемого у крыс в утренние часы. Именно в это время мы собирали кровь у новорожденных для определения кортикостерона в ответ на инъекцию формалина [34], тогда как кровь у взрослых – после регистрации долговременной памяти, т.е. после полудня. Нельзя исключить, что возрастные особенности влияний гистамина и его H3 рецептора, а также реципрокные отношения между гистамином и глюкокортикоидами, вовлечены в эффекты неонатальной боли на реактивность ГГАКС.
Высокий и относительно длительный уровень кортикостерона, вызванный формалиновой болью у новорожденных крыс [34], ухудшает развитие паравентрикулярного ядра гипоталамуса (PVN). Кортикотропин-рилизинг-гормон (CRH) данного ядра регулирует нейрогенез в гиппокампе, который участвует в пространственном обучении и памяти [38]. Нейросекреторные системы CRH кроме нейропептидов выделяют глутамат в гипофизарные портальные сосуды [39]. Глутаматергические нейроны являются одними из основных звеньев в процессах обучения и запоминания [6]. Роль глутамата во время развития в основном связана с его инотропным рецептором (NMDA рецептором), который присутствует уже у P0 крыс [40]. При созревании возбуждающих синапсов в гиппокампе новорожденной крысы в NMDA рецепторе преобладает NR2B рецепторная субъединица, при активации которой быстрее, чем при активации NR2A субъединицы, развивается долгосрочная потенциация, что способствует укреплению памяти. В ходе постнатального развития происходит смена NR2B на NR2A рецепторную субъединицу. Чрезмерные уровни глюкокортикоидов усиливают высвобождение глутамата [41], вызывая нейротоксичность, которая усиливает апоптоз, как показано в гиппокампе и других областях мозга в течение первой послеродовой недели у крысы [42, 43]. Показано, например, что избирательная потеря белка NR2B и последующая синаптическая дисфункция ослабляют функцию префронтальной коры во время развития и провоцируют возникновение ранних когнитивных нарушений [44]. Вышеописанные возрастные модификации рецептора гистамина и рецепторных субъединиц NMDA рецептора могут быть вовлечены в выявленные нами изменения в пространственном обучении, памяти и ГГАКС у взрослых подопытных крыс.
Влияние неонатальной боли на когнитивную функцию осуществляется и другими физиологическими системами. Половые стероидные гормоны эстрогены и андрогены модулируют пренатальное и постнатальное развитие многих процессов в ноцицептивной, иммунной системах, ГГАКС и когнитивной функции [45]. Особое внимание в настоящее время уделяется половым различиям в развитии микроглии, реагирующей на стресс и боль [46]. Специфическое для пола выделение эстрогенов в неонатальном периоде с доминированием женского полового гормона у самцов приводит к дифференцированному вовлечению иммунной системы у разнополых особей в ответ на болевой стресс. Неонатальная боль может неодинаково изменить у разнополых особей сбалансированное развитие тесно взаимосвязанных между собой иммунной системы, ГГАКС и гипоталамо-гипофизарно-гонадной системы, которые влияют на синаптическую пластичность в структурах головного мозга (47). Существует предположение, что стресс в раннем возрасте может иметь не только повреждающие последствия, но и адаптационный потенциал, который, взаимодействуя с чувствительностью индивидуума к программированию (пластичность в раннем возрасте), определяет в дальнейшем активность физиологических систем организма. На основании наших предыдущих исследований [48] и данных литературы [49] мы допускаем, что обнаруженная нами у подвергнутых неонатальной боли самцов более высокая по сравнению с самками эффективность пространственной долговременной памяти, сочетающаяся с более высокой реактивностью ГГАКС, может свидетельствовать в поддержку теории соответствия-несоответствия [50], которая предполагает адаптивную способность умеренного стресса в ранний критический период развития в подготовке организма к соответствующим условиям данной стрессовой среды (в нашем случае формалиновый тест) у взрослых крыс. Дизайн настоящего исследования включал стресс воспалительной боли в новорожденном возрасте, а во взрослом состоянии – стресс в водном лабиринте Морриса и болевой стресс в формалиновом тесте. Взаимодействие различных типов стресса, как неоднократно отмечалось в литературе, может привести к неожиданным результатам [51]. Таким образом, обнаруженные половые различия у подопытных крыс свидетельствуют о том, что стресс умеренной неонатальной воспалительной боли может определять в дальнейшем половой диморфизм в пространственной памяти, что косвенно указывает на половые различия в синаптической пластичности, лежащей в основе обучения и памяти, в структурах, которые вовлечены в когнитивные процессы. Данные, полученные в нашем исследовании, позволяют заключить, что умеренный стресс воспалительной боли у новорожденных крыс способствует формированию у самцов адаптивной восприимчивости к факторам окружающей среды (чувствительность к программированию в предъявляемых крысам экспериментальных условий оказалась выше у самцов, чем у самок), что в результате проявилось у самцов в более высокой эффективности долговременной памяти и более высокой реактивности ГГАКС в ответ на формалиновый стресс. Очевидно, что данная ситуация с коронавирусом у детей раннего возраста обусловит всплеск исследований по взаимосвязи когнитивных нарушений с неонатальным болевым стрессом.
Список литературы
Fitzgerald M (2015) What do we really know about newborn infant pain? Exp Physiol 100: 1451–1457. https://doi.org/10.1113/ep085134
De Kort AR, Joosten EAJ, Patijn J, Tibboel D, van den Hoogen NJ (2021) The development of descending serotonergic modulation of the spinal nociceptive network: a life span perspective. Pediatr Res Online ahead of print. https://doi.org/10.1038/s41390-021-01638-9
Brewer CL, Baccei ML (2020) The development of pain circuits and unique effects of neonatal injury. Neural Transmission (Vienna) 127: 467–479. https://doi.org/10.1007/s00702-019-02059-z
Schwaller F, Fitzgerald M (2014) The consequences of pain in early life: injury-induced plasticity in developing pain pathways. Eur J Neurosci 39: 344–352. https://doi.org/10.1111/ejn.12414
Williams MD, Lascelles BDX (2020) Early Neonatal Pain-A Review of Clinical and Experimental Implications on Painful Conditions Later in Life. Front Pediatr 7: 8–30. https://doi.org/10.3389/fped.2020.00030
Mooney-Leber SM, Brummelte S (2017) Neonatal pain and reduced maternal care: Early-life stressors interacting to impact brain and behavioral development. Neuroscience 7: 21–36. https://doi.org/10.1016/j.neuroscience.2016.05.001
Grunau RE, Holsti L, Haley DW, Oberlander T, Weinberg J, Solimano A, Whitfield MF, Fitzgerald C, Yu W (2005) Neonatal procedural pain exposure predicts lower cortisol and behavioral reactivity in preterm infants in the NICU. Pain 113: 293–300. https://doi.org/10.1016/j.pain.2004.10.020
Brummelte S, Chau CMY, Cepeda IL, Cecil MY, Chau, Degenhardt A, Weinberg J, Synnes AR, Grunau RE (2015) Cortisol levels in former preterm children at school age are predicted by neonatal procedural pain-related stress. Psychoneuro-endocrinology 51: 151–163. https://doi.org/10.1016/j.psyneuen.2014.09.018
Herrington CJ, Olomu IN, Geller SM (2004) Salivary cortisol as indicators of pain in preterm infants: a pilot study. Clin Nurs Res 13: 53–68. https://doi.org/10.1177/1054773803259665
Grunau RE, Cepeda IL, Chau CM, Brummelte S, Weinberg J, Lavoie PM, Ladd M, Hirschfeld AF, Russell E, Koren G, Van Uum S, Brant R, Turvey SE (2013) Neonatal pain-related stress and NFKBIA genotype are associated with altered cortisol levels in preterm boys at school age. PLoS One 8: 9. https://doi.org/10.1371/journal.pone.0073926
Ulrich-Lai YM, Herman JP (2009) Neural regulation of endocrine and autonomic stress responses. Nat Rev Neurosci 10: 397–409. https://doi.org/10.1038/nrn2647
Victoria NC, Inoue K, Young LJ, Murphy AZ (2013) Long-term dysregulation of brain corticotrophin and glucocorticoid receptors and stress reactivity by single early-life pain experience in male and female rats. Psychoneuroendocrinology 38: 3015–3028. https://doi.org/10.1016/j.psyneuen.2013.08.013
Timmers I, Quaedflieg CWE, Hsu MC, Heathcote LC, Rovnaghi CR, Simons LE (2019) The interaction between stress and chronic pain through the lens of threat learning. Neurosci Biobehav Rev 107: 641–655. https://doi.org/10.1016/j.neubiorev.2019.10.007
Van Bodegom M, Homberg JR, Henckens MJAG (2017) Modulation of the Hypothalamic-Pituitary-Adrenal Axis by Early Life Stress Exposure. Front Cell Neurosci 11: 87. https://doi.org/10.3389/fncel.2017.00087
Akirav I, Kozenicky M, Tal D, Sandi C, Venero C, Richter-Levin G (2004) A facilitative role for corticosterone in the acquisition of a spatial task under moderate stress. Learn Mem 11: 188–195. http://www.learnmem.org/cgi/doi/10.1101/lm.61704
Grunau RE, Whitfield MF, Petrie-Thomas J, Synnes AR, Cepeda IL, Keidar A, Rogers M, Mackay M, Hubber-Richard P, Johannesen D (2009). Neonatal pain, parenting stress and interaction, in relation to cognitive and motor development at 8 and 18 months in preterm infants. Pain 143: 138–146. https://doi.org/10.1016/j.pain.2009.02.014
Ranger M, Grunau RE (2014) Early repetitive pain in preterm infants in relation to the developing brain. Pain Manag 4: 57–67. https://doi.org/10.2217/pmt.13.61
Bonapersona V, Kentrop J, Van Lissa CJ, Van der Veen R, Joëls M, Sarabdjitsingh RA (2019) The behavioral phenotype of early life adversi ty: A 3-level meta-analysis of rodent studies. Neurosci Biobehav Rev 102: 299–307. https://doi.org/10.1016/j.neubiorev.2019.04.021
Fitzgerald E, Sinton MC, Wernig-Zorc S, Morton NM, HolmesMC, Boardman JP, Drake AJ (2021) Altered hypothalamic DNA methylation and stress-induced hyperactivity following early life stress. Epigenetics Chromatin 14 (1): 31. https://doi.org/10.1186/s13072-021-00405-8
Khawla Q, Alzoubi NKH, Alhusban A, Bawaane A, Al-Azzani M, Khabour OF (2017) Sucrose and naltrexone prevent increased pain sensitivity and impaired long-term memory induced by repetitive neonatal noxious stimulation: Role of BDNF and β-endorphin. Physiol Behav 179: 213–219. https://doi.org/10.1016/j.physbeh.2017.06.015
Grunau RE, Holsti L, Peters JW (2006) Long-term consequences of pain in human neonates. Sem Fetal Neonatal Med 11: 268–275. https://doi.org/10.1016/j.siny.2006.02.007
Anand KJ, Garg S, Rovnaghi CR, Narsinghani U, Bhutta AT, Hall RW (2007) Ketamine reduces the cell death following inflammatory pain in newborn rat brain. Pediatr. Res 62: 283–290. https://doi.org/10.1203/pdr.0b013e3180986d2f
Henderson YO, Victoria NC, Inoue K, Murphy AZ, Parent MB (2015) Early life inflammatory pain induces long-lasting deficits in hippocampal-dependent spatial memory in male and female rats. Neurobiol Learn Mem 118: 30–41. https://doi.org/10.1016/j.nlm.2014.10.010
Amaral C, Antonio B, Oliveira MGM, Haman C, Guinsburg R, Covolan L (2015) Early postnatal nociceptive stimulation results in deficits of spatial memory in male rats Neurobiol. Learn Mem 125: 120–125. https://doi.org/10.1016/j.nlm.2015.08.012
Tjølsen A, Berge O-G, Hunskaar S (1992) The formalin test: an evaluation of the method. Pain 51: 5–17. https://doi.org/10.1016/0304-3959(92)90003-t
Roca-Vinardell A, Berrocoso E, Llorca-Torralba M, García-Partida JA, Gibert-Rahola J, Mico JA (2018) Involvement of 5-HT1A/1B receptors in the antinociceptive effect of paracetamol in the rat formalin test. Neurobiol Pain 3: 15–21. https://doi.org/10.1016/j.ynpai.2018.01.004
Chen M, Xia D, Min C, Zhao X, Chen Y, Liu L, Li X (2016) Neonatal repetitive pain in rats leads to impaired spatial learning and dysregulated hypothalamic-pituitary-adrenal axis function in later life. Sci Rep 14: 39159. https://doi.org/10.1038/srep39159
Xia D, Min C, Chen Y, Ling R, Chen M, Li X (2020) Repetitive pain in neonatal male rats impairs hippocampus-dependent fear memory later in life. Front Neurosci 14: 722. https://doi.org/10.3389/fnins.2020.00722
Mogil JS (2020) Qualitative sex differences in pain processing: emerging evidence of a biased literature. Nature Rev Neurosci 21: 353–365. https://doi.org/10.1038/s41583-020-0310-6
Mikhailenko VA, Butkevich IP, Vershinina EA (2021). Studying the effect of neonatal inflammatory pain on cognitive processes and the reactivity of the hypothalamic-pituitary-adrenal system in rats of prepubertal age. J. Evol Biochem Physiol 57: 031–1039. https://doi.org/10.31857/S0044452921050041
Morris RGM (1981) Spatial localization does not require the presence of local cues. Learn and Motivat 12:239–260. https://doi.org/10. 1016/0023-9690(81)90020-5
Butkevich I, Mikhailenko V, Semionov P, Bagaeva T, Otellin V, Aloisi AM (2009) Effects of maternal corticosterone and stress on behavioral and hormonal indices of formalin pain in male and female offspring of different ages. Horm Behav 55: 149–157. https://doi.org/10.1016/j.yhbeh.2008.09.008
Vorhees CV, Williams MT (2014) Assessing spatial learning and memory in rodents. ILAR J 55: 310–332. https://doi.org/10.1093/ilar/ilu013
Butkevich IP, Mikhailenko VA, Vershinina EA, Barr GA (2021) The Long-Term Effects of Neonatal Inflammatory Pain on Cognitive Function and Stress Hormones Depend on the Heterogeneity of the Adolescent Period of Development in Male and Female Rats. Front Behav Neurosci 15: 691578. https://doi.org/10.3389/fnbeh.2019.00125
Basbaum AI, Jessell TM (2000) The perception of pain. Principles of neural science. Eds: ER Kandel, JH.Schwartz, TM Jessell. New York: McGraw-Hill Comp. 472–481.
Drutel G, Peitsaro N, Karlstedt K, Wieland K, Smit MJ, Timmerman H (2001) Identification of rat H3 receptor isoforms with different brain expression and signaling properties. Mol Pharmacol 59: 1–8. https://doi.org/10.1124/mol.59.1.1
Rapanelli M, Frick LR, Horn KD, Schwarcz RC, Pogorelov V, Nairn AC (2016) The Histamine H3 receptor differentially modulates Mitogen-activated Protein Kinase (MAPK) and act signaling in striatonigral and striatopallidal neurons. J Biol Chem 291: 21042–21052. https://doi.org/10.1074/jbc.m116.731406
Koutmani Y, Gampierakis IA, Polissidis A, Ximerakis M, Koutsoudaki PN, Polyzos A, Agrogiannis G, Karaliota S, Thomaidou D, Rubin LL, Politis PK, Karalis KP (2019) CRH Promotes the Neurogenic Activity of Neural Stem Cells in the Adult Hippocampus. Cell Rep 29: 932–945.e7. https://doi.org/10.1016/j.celrep.2019.09.037
Hrabovszky E, Wittmann G, Turi GF, Liposits Z, Fekete C (2005) Hypophysiotropic Thyrotropin-Releasing Hormone and Corticotropin-Releasing Hormone Neurons of the Rat Contain Vesicular Glutamate Transporter-2. Endocrinology 146: 341–347. https://doi.org/10.1210/en.2004-0856
Behuet S, Cremer, JN, Cremer M, Palomero-Gallagher N, Zilles K, Amunts (2019) Developmental Changes of Glutamate and GABA Receptor Densities in Wistar Rats. Front Neuroanat 13: 100. https://doi.org/10.3389/fnana.2019.00100
Verhaeghe R, Gao V, Morley-Fletcher S, Bouwalerh H, Van Camp G, Cisani F, Nicoletti F, Maccari S (2021) Maternal stress programs a demasculinization of glutamatergic transmission in stress-related brain regions of aged rats. Geroscience 13: 1–23. https://doi.org/10.1007/s11357-021-00375-5
Lu J, Goula D, Sousa N, Almeida OFX (2003) Ionotropic and metabotropic glutamate receptor mediation of glucocorticoid-induced apoptosis in hippocampal cells and the neuroprotective role of synaptic N-methyl-D-aspartate receptors. Neuroscience 121: 123–131. https://doi.org/10.1016/s0306-4522(03)00421-4
Dührsen L, Simons SH, Dzietko M, Genz K, Boos V, Sifringer M, Tibboel D, Felderhoff-Mueser U (2013) Effects of repetitive exposure to pain and morphine treatment 742 on the neonatal rat brain. Neonatology 103: 35–43. https://doi.org/10.1159/000341769
Gulchina Y, Xu S-J, Snyder MA, Elefant F, Gao W-J (2017) Epigenetic mechanisms underlying NMDA receptor hypofunction in the prefrontal cortex of juvenile animals in the MAM model for schizophrenia. J Neurochem 143: 320–333. https://doi.org/10.1111/jnc.14101
Green MR, McCormick CM (2016) Sex and stress steroids in adolescence: Gonadal regulation of the hypothalamic-pituitary-adrenal axis in the rat. Gen Comp Endocrinol 234: 110–116. https://doi.org/10.1016/j.ygcen.2016.02.004
Nelson LH, Lenz KH (2017) The immune system as a novel regulator of sex differences in brain and behavioral development. J Neurosci Res 95: 447–461. https://doi.org/10.1002/jnr.23821
Wang K, Xu F, Campbell SP, Hart KD, Durham TD, Maylie J, Xu J (2020) Rapid actions of anti-Müllerian hormone in regulating synaptic transmission and long-term synaptic plasticity in the hippocampus. FASEB J 34: 706–719. https://doi.org/10.1096/fj.201902217R
Butkevich IP, Mikhailenko VA, Vershinina EA (2020) Combination of Stressors in the Critical Periods of Development Increases Resistance to Inflammatory Pain Stress in Adult Rats. Neuroscie Behav Physiology 50: 1090–1097. https://doi.org/10.1007/s11055-020-01010-0
Nederhof E, Schmidt MV (2012) Mismatch or cumulative stress: Toward an integrated hypothesis of programming effects. Physiol Behav 106: 691–700. https://doi.org/10.1016/j.physbeh.2011.12.008
Daskalakis NP, Bagot RC, Parker KJ (2013) The three-hit concept of vulnerability and resilience: toward understanding adaptation to early-life adversity outcome. Psychoneuroendocrinology 38: 1858–1873. https://doi.org/10.1016/j.psyneuen.2013.06.008
Sokołowski A, Folkierska-Żukowska M, Jednoróg K, Moodie CA, Dragan WŁ (2020) The relationship between early and recent life stress and emotional expression processing: A functional connectivity study. Cogn Affect Behav Neurosci 20: 588–603. https://doi.org/10.3758/s13415-020-00789-2
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


