Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 2, стр. 126-140
СРАВНИТЕЛЬНАЯ ОЦЕНКА ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ МИТОХОНДРИЙ ЭПИДИДИМИСА КРЫС ПРИ ОКИСЛИТЕЛЬНОМ СТРЕССЕ, ОПОСРЕДОВАННОМ ГИПЕРГОМОЦИСТЕИНЕМИЕЙ И ВВЕДЕНИЕМ L-NAME
В. И. Звягина 1, *, Э. С. Бельских 1
1 ФГБОУ ВО Рязанский государственный медицинский университет им. академ. И.П. Павлова Минздрава России
Рязань, Россия
* E-mail: vizvyagina@yandex.ru
Поступила в редакцию 07.08.2021
После доработки 30.12.2021
Принята к публикации 09.01.2022
- EDN: ZDINZB
- DOI: 10.31857/S0044452922020097
Аннотация
В настоящей работе дана сравнительная оценка состояния карбонилирования белков с определением резервно-адаптационного потенциала и анализом доли первичных и вторичных маркеров окислительного повреждения белков, возникающего в митохондриях, полученных из эпидидимиса крыс при окислительном стрессе, вызванном гипергомоцистеинемией и L-NAME-опосредованном ингибировании NO-синтаз. Продемонстрировано, что усиление окислительной модификации митохондриальных белков под влиянием высокого уровня гомоцистеина сопровождается снижением концентрации метаболитов NO (II) и сходно с изменениями, вызванными введением неселективного ингибитора NO-синтаз – L-NAME. Эти изменения сопровождаются признаками вторичной митохондриальной дисфункции в виде уменьшения активности сукцинатдегидрогеназы, Н+-ATФазе, лактатдегидрогеназы, увеличения уровня лактата и снижения содержания карнитина. При этом выраженность изменений исследуемых параметров различалась в митохондриях тканей головки и хвоста придатка яичка крыс. В головке эпидидимиса наблюдались метаболические сдвиги, связанные с изменением биоэнергетических процессов – увеличение концентрации митохондриального лактата, при одновременном уменьшении активности лактатдегидрогеназы, сукцинатдегидрогеназы и Н+–ATФазе митохондрий. В тканях хвоста отмечались эффекты, которые носили в большей степени защитный характер и были направлены на поддержку его функциональной активности в условиях окислительного стресса.
По итогам работ последних лет, посвященных изучению механизмов редокс-регуляции, становится все более очевидным значение функционального статуса митохондрий как фактора, имеющего критическое значение для процессов гаметогенеза, оплодотворения и последующего эмбриогенеза [1, 2]. Способность митохондрий генерировать активные формы кислорода (АФК) неотделима от их энергопродуцирующей функции, при этом модуляция образования АФК происходит при участии оксида азота (NO) (II) [3]. Установлено, что посредством влияния на дыхательную цепь NO (II) вовлечен во множество регуляторных каскадов, определяющих функциональный статус митохондрий [3]. Данное обстоятельство позволяет предположить, что редокс-регуляция, т.е. регуляция, осуществляемая активными формами кислорода (АФК) и активными формами азота (АФА), представляет собой новое перспективное направление в репродуктивной медицине для изучения на фундаментальном уровне нарушений фертильности и процессов оплодотворения, а также поиска точек приложения для терапевтической коррекции нарушений фертильности [1, 4, 5]. При этом потребность в исследованиях данного направления подчеркивают результаты крупных статистических исследований, демонстрирующих тенденцию к увеличению выявляемости случаев бесплодия во всем мире, в том числе идиопатических форм, в лечении которых значительную роль играет антиоксидантная терапия [6, 7].
Среди возможных факторов, связанных с нарушением редокс-регуляции в репродуктивных органах, вызывает интерес уровень гомоцистеина. Так, R.J. Aitken и соавт. было продемонстрировано, что пациенты с диагностированным бесплодием при отсутствии дефицита фолатов имели повышенный уровень гомоцистеина в сперме [8]. При этом увеличение содержания гомоцистеина было ассоциировано с возрастанием продукции АФК митохондриями сперматозоидов.
Гомоцистеин – это непротеиногенная, серосодержащая аминокислота, которая может синтезироваться из метионина путем деметилирования. Первым возможным продуктом данного пути метаболизма метионина является образование S-аденозилметионина (SАМ), реакция катализируется ферментом метионинаденозилтрансферазой [9]. Большинство молекул SАМ, синтезируемых из метионина, используются в качестве донора метильной группы в реакциях трансметилирования, таких как метилирование нуклеиновых кислот, фосфолипидов, гистонов, биогенных аминов и белков [10]. В итоге образуется S- аденозилгомоцистеин (SАН), который впоследствии гидролизуется с участием S-аденозил-L-гомоцистеингидролазы до гомоцистеина и аденозина [11]. Уровень гомоцистеина будет зависеть от трех ферментативных реакций: 1) одна часть гомоцистеина превращается в метионин путем трансметилирования с участием метионинсинтазы с использованием N5-метил-тетрагидрофолиевой кислоты в качестве донора метильной группы и витамина В12 (метилкобаламина) как кофактора фермента; 2) гомоцистеин также может быть реметилирован при участии фермента бетаин-гомоцистеин-S-метилтрансферазы, где донором метильных групп выступает бетаин, образующийся у человека из холина, поступающего с пищей. Данный путь преобладает в печени и почках; 3) гомоцистеин может метаболизироваться путем транссульфирования с образованием цистеина. Также альтернативным путем превращения гомоцистеина является образование его тиолактона под действием метионил-тРНК-синтетазы [12].
В предыдущей работе нами было установлено, что как накопление гомоцистеина, так и применение неселективного ингибитора синтаз оксида азота (II) – L-NAME, сопровождалось снижением концентрации метаболитов NO (II) не только в сыворотке крови, но и в митохондриальной фракции гомогенатов тканей легких у крыс. При этом индуцированный системный дефицит синтеза NO (II) был ассоциирован с окислительным повреждением митохондрий и развитием вторичной митохондриальной дисфункции в различных тканях у крыс [13].
Таким образом, представляется интересным изучение адаптивных механизмов, активация которых способна предупреждать дефицит синтеза NO (II) в митохондриях в условиях стресса. Среди подобных механизмов обращает на себя внимание карнитиновый гомеостаз, тесно связанный как с биоэнергетическими процессами митохондрий, так и с продукцией NO (II) [14, 15].
Наибольшая концентрация L-карнитина зафиксирована в эпидидимисе, где протекают процессы созревания и поддержания жизнеспособности уже сформированных сперматозоидов [16]. Сообщается, что эпидидимальная дисфункция, связанная с нарушением формирования микроокружения для сперматозоидов, может являться существенным фактором мужского бесплодия [17]. В этой связи изучение показателей карнитинового гомеостаза и окислительного стресса различных отделов эпидидимиса в условиях воздействия стрессоров позволит оценить значение L-карнитина для реализации адаптивных реакций митохондрий [18].
Таким образом, мы поставили цель – дать сравнительную оценку процессов карбонилирования белков, биоэнергетики, уровня карнитина и метаболитов NO (II) в митохондриях эпидидимиса крыс при окислительном стрессе, индуцированном тяжелой формой гипергомоцистеинемии и L-NAME-опосредованном ингибировании NO-синтаз.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнено на крысах-самцах линии Wistar. Эксперименты с животными проведены в соответствии с “Европейской конвенцией о защите позвоночных животных, используемых для экспериментальных и других научных целей” (Страсбург, 1986), приказом Министерства здравоохранения и социального развития Российской Федерации от 23 августа 2010 г. № 708н “Об утверждении правил лабораторной практики” и положениями Биоэтической комиссии ФГБОУ ВО РязГМУ Минздрава России (Протокол № 16, 06.11.2018). Животные содержались в стандартных условиях вивария, для кормления они получали сухой корм “Чара” (“Ассортимент-Агро”, Россия), содержащий 0.7% метионина-цистина в пересчете на сухое вещество, все витамины группы B, в том числе B6 – 28 мг/кг, B9 – 64 мг/кг, B12 – 0.13 мг/кг.
Минимальный размер выборки рассчитывался со статистическим допущением о 5%-й альфа ошибке и 95% доверительным интервалом, принимая частоту снижения метаболитов NO (II) сыворотки по меньшей мере на 33% и с учетом ГОСТ Р ИСО 5479-2002, где минимальным количеством наблюдений для расчета непараметрической статистики считается 8 животных [13, 19].
Экспериментальные животные были поделены на 5 групп:
1-ю группу (n = 8) животных составляли крысы с тяжелой гипергомоцистеинемией (>100 мкмоль/л), для этого животным в течение 21 дня внутрижелудочно (через зонд) вводили 25% суспензию метионина в дозе 1.5 г метионина (“Sigma-Aldrich”, США) на 1 кг массы тела 2 раза в сутки; дополнительно вместо питьевой воды крысы получали 1% водный раствор метионина при свободном доступе к поилкам [20]. Крысы 2-й группы (n = 8) служили контролем для 1-й группы и по аналогичной схеме получали суспензионную основу, в состав которой входили: вода, твин-80 (ЗАО “Вектон”, Россия) и крахмал (ЗАО “Вектон”, Россия). Поилки для этих животных наполняли обычной питьевой водой. В пищевой рацион данной группы метионин не включался [20]. 3-я группа (n = 8) – животным ежедневно 1 раз в сутки в течение 7 дней внутрибрюшинно вводили раствор метилового эфира Nω‑нитро-L-аргинина (L-NAME, “Sigma-Aldrich”, США), приготовленный на физиологическом растворе в дозе 25 мг/кг [21]. Крысам 4-й группы (n = 8) по аналогичной схеме – L-NAME в дозе 200 мг/кг [22]. Животные 5-й группы (n = 8) служили контролем для 3-й и 4-й групп и получали вместо L-NAME физиологический раствор.
Выведение животных из эксперимента осуществлялось утром до приема пищи под эфирным рауш-наркозом при сохраненном дыхании и сердцебиении путем обескровливания пересечением брюшной аорты. После этого извлекали эпидидимис, промывали его в среде, содержащей 0.25 М сахарозу, 0.001 М ЭДТА и 0.05 М трис-буфер, рН 7.4. Митохондриальную фракцию выделяли путем дифференциального центрифугирования. К части суспензии митохондрий добавляли тритон X-100 в конечной концентрации 0.02% для разрушения мембран. Все описанные выше процедуры проводили при температуре не выше 4°С. В дальнейшем для анализа использовали:
– сыворотку крови, в которой определяли концентрацию общего гомоцистеина и метаболитов NO (II);
– митохондриальную фракцию с разрушенными мембранами (с добавлением детергента тритон X-100), где оценивали количество окислительно-модифицированных белков (ОМБ), концентрацию метаболитов NO (II), лактат, L-карнитин, активность ферментов лактатдегидрогеназы (ЛДГ) и супероксиддисмутазы (СОД);
– митохондриальную фракцию с неразрушенными мембранами (без добавления детергента), в которой определяли активности Н+-АТФазы и сукцинатдегидрогеназы (СДГ).
Концентрацию общего гомоцистеина определяли иммуноферментным анализом с помощью коммерческого набора (“Axis Shield”, Великобритания), содержание белка – методом Лоури с помощью набора реактивов (“Экосервис”, Россия), суммарный уровень нитратов и нитритов (NOx) – метаболитов NO (II), – фотоколориметрическим методом с использованием реактива Грисса и хлорида ванадия (III) на анализаторе StatFax 3200 (Awareness Technology, США) в модификации В.А. Метельской и Н.Г. Гумановой [23]. Концентрацию молочной кислоты измеряли лактатоксидазным методом с использованием набора (“Diasys”, ФРГ) на анализаторе StatFax 1900+ (Awareness Technology, США), активность сукцинатдегидрогеназы (СДГ) – спектрофотометрическим методом по реакции восстановления гексацианоферрата (III) калия на спектрофотометре СФ-2000 (Россия) [24].
Активность лактатдегидрогеназы (ЛДГ) определяли по снижению концентрации NADH в реакции восстановления пирувата с помощью коммерческого набора (“Diasys”, Германия) на анализаторе StatFax 1900 + (Awareness Technology, США), активность Н+-ATPase – измеряя содержание неорганического фосфата методом Боданского после остановки реакции с использованием фотоколориметра КФК-3-01 ЗОМЗ (Россия) [25].
Общую активность митохондриальной супероксиддисмутазы (СОД) оценивали по торможению реакции аутоокисления кверцетина с использованием фотоколориметра КФК-3-01 ЗОМЗ (Россия) [26].
Уровень окислительно-модифицированных белков (ОМБ) оценивали методом Levine в модификации Дубининой. Окисление белков под действием свободных радикалов приводит к образованию в них карбонильных групп, фрагментации и агрегации белковых молекул. Эти необратимые модификации способны повлиять на функционирование белков. Определение карбонильных производных аминокислотных остатков в белках является информативным методом изучения их окислительной модификации, так как эти производные являются стабильными конечными продуктами окисления протеинов [27]. Анализ количества карбонильных производных проводили на спектрофотометре СФ-2000 (Россия), с последующим перерасчетом площади под кривой абсорбции света [27]. Общее количество продуктов спонтанной окислительной модификации белков выражали в условных единицах (S СП ОМБ – площадь под кривой спектра поглощения спонтанно окисленно-модифицированных белков) [27]. Кроме общей площади под кривой абсорбции света рассчитывали количество 2.4-динитрофенилгидразонов альдегидных (АДНФГ) и кетопроизводных (КДНФГ) аминокислот нейтрального и основного характера. Параллельно определению спонтанной ОМБ проводили определение металл-индуцированного окисления с помощью реакции Фентона, служившее показателем максимально возможного окислительного повреждения белковых молекул, которое принималось за 100%. Затем рассчитывали резервно-адаптационный потенциал окислительного повреждения митохондриальных белков (S ОМБ, СП/МК), который выражали в % как отношение спонтанной ОМБ (S СП ОМБ) к металл-индуцированной ОМБ. Чем ниже доля продуктов спонтанного окисления (S СП ОМБ), тем выше резервно-адаптационный потенциал (РАП ОМБ) [27].
Концентрацию карнитина в митохондриях тканей эпидидимиса крыс определяли на анализаторе StatFax 3200 (Awareness Technology, США) по методу L. Wan и R.W. Hubbard, основанному на образовании свободного KoASH, реагирующего неэнзиматически с 5.5-дитиобис-2-нитробензоатом (DTNB) с образованием окрашенного 5-тио-2-нитробензоата, интенсивность окраски которого измеряли спектрофотометрически при λ = 410 нм [28].
Статистическую обработку результатов проводили с помощью Statistica 10.0 (StatSoft Statistica, США). Построение графиков осуществляли, используя GraphPad Prism 9.0 (GraphPad Software, США). Иллюстрацию создавали с помощью интернет-ресурса BioRender.com. Соответствие выборок нормальному распределению проверяли с использованием критерия Шапиро–Уилка. Распределение отличалось от нормального, в связи с чем для выявления различий между независимыми группами использовали критерий Краскела–Уоллиса и критерий Манна–Уитни с поправкой Бонферрони для множественных сравнений или критерий Манна–Уитни при сравнении 2 групп. Уровень отличий рассматривался как статистически значимый при вероятности нулевой гипотезы об отсутствии различий p < 0.05 [19].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При моделировании тяжелой формы гипергомоцистеинемии (ГГЦ) обнаруживалось статистически значимое снижение суммарных метаболитов NO (II) (NOx), а также значительное повышение концентрации гомоцистеина в сыворотке крови (рис. 1).
Рис. 1.
(a) Концентрация метаболитов NO (II) (NOx) и (b) гомоцистеина (Hcy) в сыворотке крови исследуемых групп животных.
Примечание: * – различия групп при р < 0.05; ** – различия групп при p < 0.01, *** – различия групп при p < 0.001. Значения представлены как Me[Q1; Q3].

Для анализа воздействия гипергомоцистеинемии и недостатка генерации NO (II) на процессы свободно-радикального окисления белков в митохондриях клеток эпидидимиса были исследованы количество окисленно-модифицированных аминокислотных остатков в белках и активность СОД, так как ее активность в митохондриях обеспечивает сохранение биодоступности NO (II) [29].
Окисление белков под действием АФК приводит к формированию в них карбонильных групп, фрагментации и агрегации белковых молекул. Карбонильные производные аминокислотных остатков в белках являются стабильными конечными продуктами их окисления, что делает определение протеинов информативным методом изучения ОМБ.
Анализ общей площади под кривой абсорбции света показал, что в группе животных, получавших метионин, наблюдалось увеличение общего количества карбонильных производных белков в митохондриях, как в головке, так и в хвосте эпидидимиса. Данные изменения, по-видимому, свидетельствовали об усилении окислительного повреждения белков и развитии окислительного стресса.
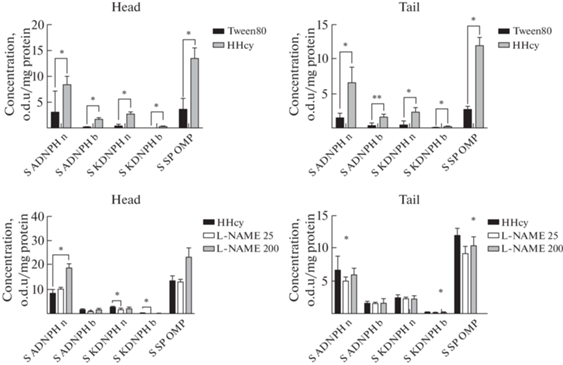
При этом доля первичных (АДНФГ) и вторичных маркеров (КДНФГ) в хвосте придатка яичка статистически значимо не отличалась от группы животных, которым вводили только суспензионную основу. В головке эпидидимиса увеличивалась доля кетонов, что могло приводить к агрегации белков и нарушению их нативной структуры (рис. 2).
Рис. 2.
Анализ площади под кривой спектра поглощения 2,4-динитрофенилгидразонов в головке и хвосте эпидидимиса в исследуемых моделях.
Примечание: * – различия групп при р < 0.05, ** – различия групп при р < 0.01. Результаты приведены в е.о.п./мг белка. Значения представлены как Me[Q1; Q3]. S ADNPH n (S АДНФГ н) – площадь под кривой нейтральных альдегиддинитрофенилгидразонов, S ADNPH b (S АДНФГ о) – площадь под кривой основных альдегиддинитрофенилгидразонов, S KDNPH n (S КДНФГ н) – площадь под кривой нейтральных кетондинитрофенилгидразонов, S KDNPH b (S КДНФГ о) – площадь под кривой нейтральных альдегиддинитрофенилгидразонов, S SP OMP (S СП ОМБ) – общая площадь под кривой спектра поглощения окислительно-модифицированных белков. Head – анатомический отдел головки эпидидимиса, Tail – анатомический отдел хвоста эпидидимиса.
Также в головке имело место увеличение доли спонтанных окислительно-модифицированных белков, что свидетельствовало о сниженной способности митохондрий к адаптации в условиях окислительного стресса, вызванного метиониновой нагрузкой (табл. 1).
Таблица 1.
Изменения исследуемых показателей митохондрий головки и хвоста эпидидимиса при моделировании тяжелой формы гипергомоцистеинемии, результаты представлены в виде Me [Q1; Q3]
| Головка эпидидимис | Хвост эпидидимис | |||
|---|---|---|---|---|
| Суспензионная основа (1), n = 8 | ГГЦ (2), n = 8 | Суспензионная основа (1), n = 8 | ГГЦ (2), n = 8 | |
| NOх, мкмоль/мг белка | 42.3 [37.8; 48.8] | 31.1 [26.5 32.3] р1–2 < 0.01 |
41.8 [30.7; 53.0] | 43.2 [38.1; 44.3] p1–2 > 0.05 |
| Лактат, мкмоль/г белка | 11.2 [10.3; 16.6] | 29.6 [25.4; 31.2] р1–2 < 0.001 |
10.9 [8.1; 16.5] | 38.2 [27.4; 43.1] р1–2 < 0.001 |
| ЛДГ, ЕД/г белка | 33.0 [25.5; 36.7] | 19.2 [13.3; 25.6] p1–2 < 0.05 |
21.1 [13.0; 27.5] | 15.6 [13.0; 17.9] р1–2 > 0.05 |
| Карнитин общий, мкмоль/мг белка в пробе | 89.6 [86.9;102.6] | 24.9 [22.9; 26.0] p1–2 < 0.001 |
85.2 [74.8; 94.1] | 21.1 [20.9;24.5] р1–2 < 0.001 |
| Карнитин свободный, мкмоль/мг белка в пробе | 46.4 [41.3;64.4] | 13.5 [11.7; 15.2] p1–2 < 0.001 |
48.2 [44.1; 54.7] | 9.7 [9.0;10.8] p1–2 < 0.001 |
| Карнитин свободный/Карнитин общий | 0.51[0.47;0.68] | 0.53[0.52; 0.54] p1–2 > 0.05 |
0.57 [0.53; 0.58] | 0.45 [0.42;0.47] p1–2 < 0.01 |
| СДГ, нмоль сукцината/мг белка в мин | 70.3 [32.7; 93.1] | 20.8 [11.2; 24.5] p1–2 < 0.01 |
56.4 [39.4; 93.6] | 14.8 [10.0; 21.5] p1–2 < 0.01 |
| Н+-ATФазе, мкмоль фосфата/ мг белка в час | 26.2 [21.4; 44.4] | 14.8 [11.5; 18.6] p1–2 < 0.01 |
20.1 [15.5; 27.2] | 9.5 [6.9; 11.1] p1–2 < 0.010 |
| СОД, УЕ/мг белка | 1.7 [1.3; 2.1] | 5.7 [3.6; 7.3] p1–2 < 0.001 |
2.7 [1.9; 3.0] | 9.1 [6.9; 10.8] p1–2 < 0.01 |
| S ОМБ, СП/МК, (РАП ОМБ), % | 34.0 [30.5; 42.1] | 80.7 [70.6; 90.4] p1–2 < 0.001 |
42.6 [22.4; 51.1] | 46.8 [44.3; 55.2] p1–2 > 0.05 |
Примечание: NOх – суммарные метаболиты оксида азота NO (II), ЛДГ – лактатдегидрогеназа, СОД – супероксиддисмутаза, СДГ – сукцинатдегидрогеназа, СП/МК ОМБ – отношение количества спонтанно окислительно-модифицированных белков к количеству металл-индуцированных окислительно-модифицированных белков (РАП ОМБ). Суспензионная основа – контроль к группе животных с экспериментальной гипергомоцистеинемией; ГГЦ – группа животных с экспериментальной гипергомоцистеинемией.
Одновременно наблюдалось усиление антиоксидантной защиты: активность СОД в митохондриях гомогенатов тканей эпидидимиса возрастала в головке в 3.35 и хвосте – в 3.37 раза, что, вероятно, отражало их адаптацию к окислительному стрессу.
В группе животных с тяжелой гипергомоцистеинемией было выявлено снижение концентрации суммарных метаболитов NO (II) в митохондриях гомогената головки эпидидимиса относительно контрольной группы, получавшей только суспензионную основу.
В эксперименте было установлено, что снижению концентрации NOx в митохондриях придатка яичка сопутствовало значительное уменьшение общего уровня карнитина как в головке, так и хвосте эпидидимиса, за счет снижения доли свободного карнитина.
Наряду со значительным уменьшением концентрации карнитина, критически необходимого для поддержания β-окисления в митохондриях, отмечалось снижение активности маркерных ферментов биоэнергетических процессов (СДГ, Н+-ATФазе) и увеличение концентрации митохондриального лактата как в хвосте, так и головке придатка яичка крыс.
До недавнего времени образование лактата считалось тупиковым путем метаболизма, однако, исследования последних десятилетий продемонстрировали, что лактат способен проникать в клетки через систему челночных белков – монокарбоксилатных транспортеров (MCT). При этом превращение лактата в пируват и наоборот регулируется специфическими изоформами лактатдегидрогеназы, образуя тем самым высоко адаптируемую метаболическую промежуточную систему [30]. Возможно, увеличение концентрации лактата в данных условиях может служить маркером активации адаптивных систем.
Поскольку моделирование гипергомоцистеинемии сопровождалась снижением как уровня метаболитов NO (II), так и содержания окисленно-модифицированных белков в митохондриях эпидидимиса, в нашей работе было решено сравнить паттерн изменений функциональной активности митохондрий с введением экспериментальным животным неселективного ингибитора NO-синтаз Nω-нитро-L-аргинина метилового эфира (L-NAME) в дозах 25 мг/кг и 200 мг/кг [21, 22, 31].
В работе выявлено, что ингибирование NO-синтаз в условиях модели L-NAME 25 мг/кг, как и при ГГЦ сопровождается снижением уровня метаболитов NO, при назначении дозы L-NAME 200 мг/кг этот эффект был статистически значимо более выражен (табл. 2).
Таблица 2.
Показатели метаболитов митохондрий головки и хвоста эпидидимиса при моделировании L-NAME индуцированного дефицита синтеза NO, результаты представлены в виде Me [Q1; Q3]
| Головка эпидидимис | |||
|---|---|---|---|
| Контроль (5), n = 8 | L-NAME 25 (3), n = 8 | L-NAME 200 (4), n = 8 | |
| NOх, мкмоль/мг белка | 60.0 [49.3; 64.6] p3–5 > 0.0167 p4–5 < 0.001 |
32.4 [21.1; 50.0] | 22.7 [18.2; 25.8] p3–4 > 0.05 |
| Лактат, мкмоль/г белка | 17.2 [14.2; 18.3] p3–5 > 0.0167 p4–5 > 0.0167 |
22.7 [17.0; 33.9] | 31.3 [19.3; 36.5] p3–4 > 0.05 |
| Карнитин общий, мкмоль/мг белка | 132 [125; 141] p3–5 < 0.0167 p4–5 < 0.01 |
98 [75; 103] | 77 [73; 85
] p3–4 > 0.05 |
| Карнитин свободный, мкмоль/мг белка | 54.2 [46.7; 66.2] p3–5 > 0.0167 p4–5 > 0.0167 |
77.3 [52.1; 84.1] | 59.4 [41.4; 73.7] p3–4 > 0.05 |
| Карнитин свободный/Карнитин общий | 0.43 [0.40; 0.49] p3–5 < 0.001 p4–5 > 0.0167 |
0.77 [0.66; 0.80] | 0.75 [0.60; 0.84] p3–4 > 0.05 |
| Хвост эпидидимиса | |||
| NOх, мкмоль/мг белка | 70.7 [55.4; 112.0] p3–5 < 0.001 p4–5 < 0.001 |
32.5 [17.8; 47.9] | 28.0 [25.7; 37.0] p3–4 > 0.05 |
| Лактат, мкмоль/г белка | 16.4 [12.2; 17.7] p3–5 < 0.001 p4–5 < 0.001 |
28.5[26.3; 29.7] | 35.1 [30.1; 37.3] p3–4 > 0.0167 |
| Карнитин общий, мкмоль/мг белка | 110.0 [98.0; 120.0] p3–5 > 0.0167 p4–5 > 0.05 |
106.7 [104.9; 117.5] | 109.8 [92.2; 129.0] p3–4 > 0.05 |
| Карнитин свободный, мкмоль/мг белка | 44.1 [37.5; 47.9] р3–5 < 0.001 p4–5 < 0.01 |
83.9 [64.5; 101.1] | 60.6 [53.0; 64.6] р3–4 > 0.05 |
| Карнитин свободный/Карнитин общий | 0.41 [0.37; 0.43] р3–5 < 0.001 р4–5 > 0.0167 |
0.77 [0.66; 0.84] | 0.56 [0.47; 0.68] р3–4 > 0.05 |
При анализе расчета площадей под кривой абсорбции света выявлено, что как при гипергомоцистеинемии, так и при L-NAME-индуцированном дефиците NO (II) наблюдается статистически значимый прирост количества карбонильных производных нейтрального и основного характера как за счет АДНФГ, так и за счет КДНФГ относительно обеих контрольных групп (рис. 2).
Так, в группе с ГГЦ содержание спонтанно окислительно-модифицированных белков в митохондриях головки эпидидимиса составляло 379%, в хвосте – 441% от уровня показателя контрольной группы, в серии L-NAME 25 мг/кг – 186% и 131% соответственно, с увеличением дозы L-NAME до 200 мг/кг возрастала и степень повреждения белков – 325 и 149% (табл. 1, табл. 3).
Таблица 3.
Показатели окислительного стресса митохондрий головки и хвоста эпидидимиса при моделировании L‑NAME индуцированного дефицита синтеза NO (II), результаты представлены в виде Me [Q1; Q3]
| Головка эпидидимис | |||
|---|---|---|---|
| Контроль (5), n = 8 | L-NAME 25 (3), n = 8 | L-NAME 200 (4), n = 8 | |
| СОД, ОЕ/мг белка | 34.4 [32.7; 39.0] p3–5 < 0.001 p4–5 < 0.001 |
3.8 [1.6; 10.0] | 6.2 [4.5; 8.6] p3–4 > 0.05 |
| S СП ОМБ, е.о.п./мг белка | 7.2 [6.2; 8.6] p3–5 < 0.001 p4–5 < 0.001 |
13.4 [11.7; 14.5] | 23.4 [13.9; 27.1] p3–4 > 0.0167 |
| S ОМБ, СП/МК (РАП ОМБ), % | 33.1 [27.3; 46.1] p3–5 < 0.01 p4–5 < 0.01 |
80.8 [62.2; 95.5] | 76.7 [68.4; 86.7] p3–4 > 0.05 |
| Хвост эпидидимис | |||
| СОД, ОЕ/мг белка | 30.9 [28.1; 43.7] р3–5 < 0.001 p4–5 < 0.001 |
5.5 [4.0; 10.5] | 5.4 [3.8; 9.1] p3–4 > 0.05 |
| S СП ОМБ, е.о.п./мг белка | 7.1 [5.4; 8.1] р3–5 < 0.01 p4–5 < 0.001 |
9.3 [8.1; 10.3] | 10.6 [9.2; 12.1] p3–4 > 0.05 |
| S ОМБ, СП/МК (РАП ОМБ), % | 41.1 [35.6; 47.2] р3–5< 0.01 p4–5 < 0.01 |
64.4 [52.7; 72.1] | 78.9 [75.6; 83.1] p3–4 < 0.0167 |
Примечание: СОД – супероксиддисмутаза, СП ОМБ – уровень спонтанно окислительно-модифицированных белков, СП/МК ОМБ – отношение количества спонтанно окислительно-модифицированных белков к количеству металл-индуцированных окислительно-модифицированных белков (РАП ОМБ). С учетом поправки Бонферрони на множественное сравнение групп статистически значимым уровень отличий считался при p < 0.017.
Однако в условиях метиониновой нагрузки окислительная модификация белков в равной степени выявлена и в головке, и хвосте эпидидимиса. При использовании ингибитора NOS в большей степени данный показатель повышался в головке придатка яичка при дозе 200 мг/кг (рис. 2).
Обнаруженное уменьшение резервно-адаптационного потенциала в условиях L-NAME индуцированного дефицита NO, вероятно, демонстрирует сниженную способность митохондрий адаптироваться к условиям окислительного стресса. При этом уровень активности СОД уменьшался при назначении L-NAME как в дозе 25, так и в 200 мг/кг дозе (табл. 3).
При оценке содержания митохондриального карнитина в условиях моделирования L-NAME в обеих выбранных дозах в головке придатка яичка была обнаружена динамика уменьшения содержания общего карнитина, как и при гипергомоцистеинемии. При этом в хвосте эпидидимиса уровень общего карнитина не снижался, при статистически значимом увеличении уровня свободного карнитина (рис. 3).
Рис. 3.
Сравнение уровней метаболитов NO (II) (NOx) и фракций L-карнитина в моделях дефицита синтеза NO (II).
Примечание: * – статистически значимые отличия между исследуемыми группами при p < 0.017. Результаты представлены в виде Me [Q1; Q3]. HHcy (ГГЦ) – группа с моделированием тяжелой гипергомоцистеинемии, L-NAME 25 – группа получавшая L-NAME в дозе 25 мг/кг, L-NAME 200 – группа, получавшая L-NAME в дозе 200 мг/кг. Head – анатомический отдел головки эпидидимиса, Tail – анатомический отдел хвоста эпидидимиса.

В условиях применения ингибитора L-NAME 25 мг/кг наблюдался схожий характер сдвигов показателей биоэнергетики (СДГ, Н+-ATФазе), что и в условиях модели L-NAME 200 мг/кг, а тенденция изменения данных показателей была близка к таковой при ГГЦ (табл. 4).
Таблица 4.
Показатели активности ферментов митохондрий головки и хвоста эпидидимиса при моделировании L-NAME индуцированного дефицита синтеза NO, результаты представлены в виде Me [Q1; Q3]
| Головка эпидидимиса | |||
|---|---|---|---|
| Контроль (5), n = 8 | L–NAME 25 (3), n = 8 | L–NAME 200 (4), n = 8 | |
| ЛДГ, ЕД/г белка | 114.1 [78.8; 130.6] p3–5 > 0.05 p4–5 < 0.001 |
62.1 [34.6; 103.7] | 15.6 [12.4; 23.9] p3–4 < 0.01 |
| СДГ, нмоль сукцината/мг белка в мин | 35.0 [22.1; 42.7] p3–5 < 0.001 p4–5 < 0.0167 |
18.9 [15.6; 21.3] | 17.7 [16.3; 25.4] p3–4 > 0.05 |
| Н+–ATФазы, мкмоль фосфата/ мг белка в ч | 22.8 [21.5; 30.4] p3–5 < 0.001 p4–5 < 0.001 |
8.2 [6.6; 9.0] | 9.1 [6.2;10.8] p3–4 > 0.05 |
| Хвост эпидидимиса | |||
| ЛДГ, ЕД/г белка | 27.6 [25.9; 44.3] p3–5 > 0.0167 p4–5 < 0.001 |
6.5 [1.7; 24.0] | 4.6 [3.6; 6.3] p3–4 > 0.05 |
| СДГ, нмоль сукцината/мг белка в мин | 27.1 [25.2; 34.1] р3–5 < 0.001 p4–5 < 0.001 |
11.2 [7.5; 13.4] | 9.2 [8.0; 11.9] p3–4> 0.05 |
| Н+-ATФазы, мкмоль фосфата/ мг белка в ч | 17.6 [12.0; 20.1] р3–5 < 0.001 p4–5 < 0.001 |
1.14 [0.40; 1.49] | 3.66 [3.38; 4.28] p3–4 < 0.001 |
Примечание: ЛДГ – лактатдегидрогеназа, СДГ – сукцинатдегидрогеназа, СОД – супероксиддисмутаза, СП/МК ОМБ – отношение количества спонтанно окислительно-модифицированных белков к количеству металл-индуцированных окислительно-модифицированных белков. С учетом поправки Бонферрони на множественное сравнение групп статистически значимым уровень отличий считался при p < 0.017.
Концентрация молочной кислоты повышалась в митохондриях хвоста эпидидимиса при экспериментальном ингибировании NO-синтаз в обеих выбранных дозах; в гомогенате ткани головки наблюдалось аналогичное статистически значимое повышение только в дозе 200 мг/кг. При этом увеличение концентрации митохондриального лактата сопровождалось более выраженным снижением уровня митохондриальной ЛДГ. При ГГЦ мы увидели статистически значимое увеличение уровня лактата в хвосте эпидидимиса и уменьшение активности ЛДГ в головке эпидидимиса.
Сравнивая исследуемые модели дефицита NO (II), не было выявлено различий по выраженности дефицита уровня NOx в митохондриях головки и хвоста эпидидимиса, однако, были обнаружены статистически значимые различия в изменении уровня митохондриального карнитина (рис. 3). Для модели тяжелой формы гипергомоцистеинемии было характерно значительное снижение содержания общего карнитина за счет свободной фракции. При этом различия также были связаны с более высокой активностью H+-ATФазе в модели ГГЦ по сравнению с моделями L-NAME. Уровень митохондриального лактата, активность СОД и СДГ статистически значимо не отличались (рис. 4).
Рис. 4.
Сравнение активности исследуемых ферментов, концентрации лактата и резервно-адаптационного потенциала окислительной модификации белков митохондрий эпидидимиса в моделях дефицита синтеза NO (II).
Примечание: * – статистически значимые отличия между исследуемыми группами при p < 0.017. Результаты представлены в виде Me [Q1; Q3]. S OMP, SP/MC (СП/МК ОМБ) – отношение количества спонтанно окислительно-модифицированных белков к количеству металл-индуцированных окислительно-модифицированных белков (РАП ОМБ). HHcy (ГГЦ) – группа с моделированием тяжелой гипергомоцистеинемии, L-NAME 25 – группа, получавшая L-NAME в дозе 25 мг/кг, L-NAME 200 – группа получавшая L-NAME в дозе 200 мг/кг. Head – анатомический отдел головки эпидидимиса, Tail – анатомический отдел хвоста эпидидимиса.

Характер изменений исследуемых показателей в хвосте и головке придатка яичка показал схожий паттерн изменений. При этом для митохондрий хвоста эпидидимиса отмечались больший РАП ОМБ и активность ЛДГ в модели ГГЦ, а для головки была характерна большая активность ЛДГ в условиях модели L-NAME 25 мг/кг.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Недавние исследования показывают, что взаимодействие между гомоцистеином и митохондриями является сложным процессом, в котором конечные эффекты опосредованы активными формами кислорода. Было предложено несколько механизмов окислительного стресса, индуцированного гомоцистеином, включая 1) прямое образование АФК путем аутоокисления гомоцистеина в присутствии ионов переходных металлов, 2) активацию окислительных систем и 3) ингибирование антиоксидантной защиты. В том числе гомоцистеин может изменять структуру и функцию белков, путем их окислительной модификации, однако, этот процесс остается практически не изученным [32].
Обнаруженное нами увеличение интенсивности окислительной модификации белков и формирование окислительного стресса характерны для обеих видов экспериментальных моделей. Однако L‑NAME-индуцированный окислительный стресс, помимо повышения продукции АФК, сопровождался нарушением антиоксидантных защитных механизмов, что выражалось в снижении активности СОД. При экспериментальной гипергомоцистеинемии активность данного фермента, наоборот, повышалась, что, вероятно, смягчало последствия окислительного стресса в ткани придатка яичка.
Основываясь на литературных данных, можно предполагать, что снижение концентрации метаболитов NO, ассоциированное с тяжелой формой гипергомоцистеинемии обусловлено одной из следующих возможных причин. Так как гомоцистеин способствует окислению тетрагидробиоптерина – кофактора NO-синтаз, это приводит к разобщению субъединиц фермента, который является димером, и спонтанному синтезу кислородных радикалов с сопутствующим понижением продукции NO (II) [33]. Увеличение уровня окислительно-модифицированных белков косвенно подтверждает возможность этого механизма.
Кроме того, известно, что гомоцистеин ингибирует фермент диметиларгининдиметиламиногидролазу (DDAH), метаболизирующий природный ингибитор NO-синтаз – асимметрический диметиларгинин (АДМА) [34]. Также имеются данные о способности гомоцистеина нарушать транспорт аргинина, субстрата NO-синтаз, через мембраны [35].
Снижение уровня метаболитов NO (II) в митохондриях головки и хвоста эпидидимиса при метиониновой нагрузке было сопоставимо с таковым под действием ингибитора NO-синтаз. При этом большая доза L-NAME вызывала более выраженные изменения исследуемых показателей. Это говорит о важной роли нарушения метаболизма оксида азота (II) под действием гомоцистеина в развитии окислительного стресса.
В целом можно отметить и определенное сходство изменений в энергетическом обмене эпидидимиса в условиях гипергомоцистеинемии и L-NAME-индуцированного дефицита NO (II). И введение метионина, и назначение раствора L-NAME вызывали торможение процессов аэробного окисления в ткани эпидидимиса, о чем свидетельствует снижение активности СДГ, а также, возможно, и окислительного фосфорилирования, на что указывает уменьшение активности Н+-ATФазы.
Интересен тот факт, что как при экспериментальной модели ГГЦ, так и при L-NAME индуцированном ингибировании NO-синтаз снижается уровень митохондриального карнитина.
В условиях избыточного получения метионина животными карнитин может принимать участие в элиминации его избытка через индукцию транс-аминаз. Образующаяся при этом кетокислота окисляется дегидрогеназным комплексом разветвленных аминокислот до 3-метилтиопропионила, который способен формировать короткоцепочечные ацилы с карнитином и удаляться из организма через почки [36, 37]. За счет этого снижается степень выраженности гипергомоцистеинемии.
С помощью еще одного подобного механизма действия L-карнитина возможно предотвращение снижения концентрации метаболитов NO (II) в условиях моделирования ГГЦ. Так, известно, что увеличение S-аденозилметионин-зависимого метилирования белков способно приводить к увеличению продукции АДМА [38]. В условиях окислительного стресса, индуцированного гомоцистеином, лизосомальный протеолиз, связанный с элиминацией поврежденных белков, будет способствовать высвобождению АДМА. Так как АДМА наряду с путем, опосредованным DDAH, может метаболизироваться в митохондриях при участии фермента аланинглиоксальаминотрансферазы с образованием α-кето-δ-(N,N′-диметилгуанидино) валериановой кислоты (DMGV) [36–39]. Данный промежуточный продукт может быть подвергнут воздействию декарбоксилазы разветвленных кетокислот с образованием γ-(N,N′-диметилгуанидино)бутановой кислоты (DMGB), который при участии карнитин-ацилтрансферазы II способен образовывать эфиры карнитина, которые в дальнейшем элиминируются почками с мочой [40].
DDAH-1 и DDAH-2 могут инактивироваться в условиях повышенной концентрации гомоцистеина, поэтому выведение метаболитов АДМА в виде эфиров карнитина можно рассматривать как адаптивный механизм, активация которого направлена на предотвращение снижения синтеза NO (II).
Обобщающая схема вероятных механизмов адаптации к метиониновой нагрузке при участии L-карнитина приведена на рис. 5.
Рис. 5.
Возможные механизмы предотвращения снижения продукции NO(II) в условиях моделирования тяжелой гипергомоцистеинемии.
Примечание: Met – метионин, SAM – S-аденозилметионин, SAH-S-аденозилгомоцистеин, Hcy-гомоцистеин, ADMA – асимметричный NG,NG-диметиларгинин, DMGV – α-кето-δ-(N,N′-диметилгуанидино) валериановая кислота, DMGB – γ-(N,N′-диметилгуанидино)бутановая кислота, αKMTB – α-кето-γ-метилтиобутират, MTP-3-метилтиопропионат, L-carnitine – L-карнитин, Carnitine ether – эфиры карнитина альфа-кетокислот, ROS – активные формы кислорода/ reactive oxygen species, Transamination – трансаминирование, PRMT – белковые аргининметилтрансферазы, DDAH-1.2 – NG,NG-диметиларгининдиметиламиногидролазы-1,2, AGXT2 – аланин-глиоксиламинотрансфераза 2, BCKDC – дегидрогеназный комплекс разветвленных альфа-кетокислот, CRAT 2 -карнитинацилтрансфераза 2, ADMA degradation products – продукты деградации АДМА (цитрулин, аминометил), NO (II) synthesis – синтез NO (II), efflux – выделение метаболита из клетки, Renal elimination – выделение метаболита из организма с почками, Methionine load – метиониновая нагрузка, Protein methylation – метилирование белков, Lysosomal proteolysis – лизосомальный протеолиз. Пунктиром обозначен транспорт через мембраны. Сделано с помощью BioRender.com.
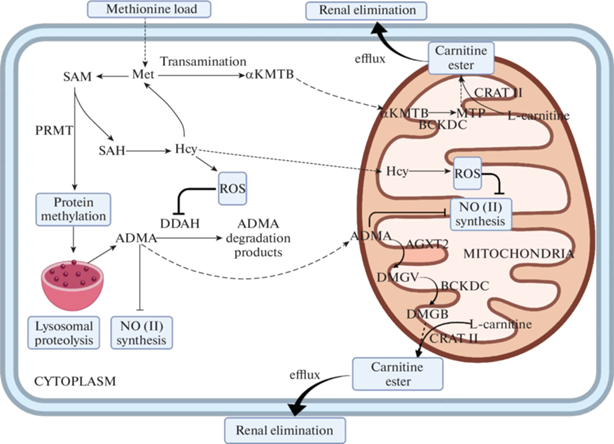
Механизм снижения общего пула карнитина в головке придатка яичка, вызванного применением ингибитора NOS, не известен, но не исключены возможность окислительной модификации ферментов транспорта карнитина и снижение их активности.
Важно отметить, что текущее исследование имело ряд потенциальных методических ограничений. Формирование окислительно-модифицированных белков может происходить не только под влиянием активных форм кислорода и азота, но и за счет воздействия редуцирующих сахаров [27]. В свете этого использованный способ комплексной оценки не позволяет точно выявить источник, обусловливающий прирост уровня карбонилированных белков. Тем не менее по данным литературы хорошо известно, что повышение уровня гомоцистеина в различных тканях ассоциировано с развитием окислительного дистресса [8, 9, 11].
Также установлено, что митохондриальная супероксиддисмутаза является важным звеном антиоксидантной защиты, которое играет значительную роль в обеспечении биодоступности оксида азота II (NO) [41], так как скорости реакций дисмутации супероксида под действием супероксиддисмутазы и взаимодействия с ним NO с образованием пероксинитрита сопоставимы [42]. В то же время использованный метод определения позволяет охарактеризовать лишь суммарную супероксиддисмутазную активность митохондрий.
Известно, что митохондрии различных типов тканей и даже клеток могут значительно различаться по своим функциональным возможностям и адаптационным способностям и проявлять неоднородные реакции на субстраты и ингибиторы, отличаться по своей чувствительности к окислительному стрессу в зависимости от локализации в различных тканях [43]. Поэтому оценка биохимических сдвигов в условиях экспериментальных моделей может способствовать выявлению органоспецифичных функциональных особенностей митохондрий в силу их гетерогенности. Вместе с тем особенностью исследуемых моделей является системный характер обнаруживаемых метаболических сдвигов. Поэтому необходимы дополнительные исследования, которые позволят определить динамику исследуемых показателей во всех органах, особенно тех, где происходит основной метаболизм поступающих веществ.
ЗАКЛЮЧЕНИЕ
Таким образом, тяжелая форма гипергомоцистеинемии, как и экспериментальное L-NAME-индуцированное ингибирование NO-синтаз, приводит к развитию окислительного стресса, выражающегося в увеличении уровня спонтанно окислительно-модифицированных белков в митохондриях эпидидимиса крыс, также в снижении резервно-адаптационного потенциала окислительной модификации белков. При этом при гипергомоцистеинемии наблюдается повышение активности СОД, в то время как при экспериментальном ингибировании NO-синтаз - значительное снижение активности данного фермента.
Также метиониновая нагрузка приводила к снижению уровня метаболитов NO (II) как в сыворотке крови, так и митохондриальной фракции головки эпидидимиса, что было сопоставимо с воздействием ингибитора NOS – L-NAME, особенно при его назначении в дозе 200 мг/кг.
На фоне гипергомоцистеинемии, как и при экспериментальном изменении синтеза NO (II), наблюдаются снижение активности маркерных ферментов биоэнергетических процессов митохондрий СДГ, Н+-АТФазы, ЛДГ, снижение содержания карнитина и увеличение концентрации лактата в митохондриях.
Моделирование различных видов окислительного стресса демонстрировало реализацию различных типов адаптивных ответов тканей головки и хвоста придатка яичка крыс. В головке эпидидимиса наблюдались метаболические сдвиги, связанные с изменением биоэнергетических процессов – увеличение концентрации митохондриального лактата при одновременном уменьшении активности лактатдегидрогеназы, сукцинатдегидрогеназы и Н+-ATPase митохондрий. В тканях хвоста отмечались изменения, которые носили в большей степени защитный характер и были направлены на поддержку его функциональной активности в условиях окислительного стресса.
Список литературы
Jung JH, Seo JT (2014) Empirical medical therapy in idiopathic male infertility: Promise or panacea? Clin Exp Reprod Med 41: 108–114. https://doi.org/10.5653/cerm.2014.41.3.108
Agarwal A, Mulgund A, Hamada A, Chyatte MR (2015) A unique view on male infertility around the globe. Reprod Biol Endocrinol 13: 1–9. https://doi.org/10.1186/s12958-015-0032-1
Lebedev GS, Golubev NA, Shaderkin IA, Shaderkina VA, Apolikhin OI, Sivkov AV, Komarova VA (2019) Male infertility: epidemiology and causes. Statistics in the Russian Federation in 2000–2018 years. Exp Clinical Urol 11: 4–12. https://doi.org/10.29188/2222-8543-2019-11-4-4-12
Tengan CH, Moraes CT (2017) NO control of mitochondrial function in normal and transformed cells. Biochim Biophys Acta – Bioenerg 1858: 573–581. https://doi.org/10.1016/j.bbabio.2017.02.009
Sies H, Jones DP (2020) Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nat Rev Mol Cell Biol 21: 363–383. https://doi.org/10.1038/s41580-020-0230-3
Almansa-Ordonez A, Bellido R, Vassena R, Barragan M, Zambelli F (2020) Oxidative stress in reproduction: A mitochondrial perspective. Biology (Basel) 9: 1–21. https://doi.org/10.3390/biology9090269
Ramalho-Santos J, Varum S, Amaral S, Mota PC, Sousa AP, Amaral A (2009) Mitochondrial functionality in reproduction: From gonads and gametes to embryos and embryonic stem cells. Hum Reprod Update 15: 553–572. https://doi.org/10.1093/humupd/dmp016
Aitken RJ, Flanagan HM, Connaughton H, Whiting S, Hedges A, Baker MA (2016) Involvement of homocysteine, homocysteine thiolactone, and paraoxonase type 1 (PON-1) in the etiology of defective human sperm function. Andrology 4: 345–360. https://doi.org/10.1111/andr.12157
Barroso M, Handy DE, Castro R (2017) The Link Between Hyperhomocysteinemia and Hypomethylation. J Inborn Errors Metab Screen 5: 232640981769899. https://doi.org/10.1177/2326409817698994
Scott JM, Weir DG, Molloy A, McPartlin J, Daly L, Kirke P (1994) Folic acid metabolism and mechanisms of neural tube defects. Ciba Found Symp 181: 180–191. https://doi.org/10.1002/9780470514559.ch11
Schalinske KL, Smazal AL (2012) Homocysteine Imbalance: A pathological metabolic marker. Adv Nutr 3: 755–762. https://doi.org/10.3945/an.112.002758
Finkelstein JD (1998). The metabolism of homocysteine: pathways and regulation. European J Pediatrics 157 (2): 40–44. https://doi.org/10.1007/pl00014300
Медведев ДВ, Звягина ВИ, Урясьев ОМ, Бельских ЭС, Булатецкий СВ, Рябков АН (2017) Метаболические изменения в митохондриях легких при экспериментальной гипергомоцистеинемии у крыс. Биомедицинская химия 63 (3): 248–254. [Medvedev DV, Zvyagina VI, Uryasev OM, Belskikh ES, Bulatetskiy SV, Ryabkov AN (2017). Metabolicheskie izmeneniia v mitokhondriiakh legkikh pri éksperimental'noĭ gipergomotsisteinemii u krys. Biomeditsinskaia khimiia 63 (3): 248–254 (In Russ)]. https://doi.org/10.18097/PBMC20176303248
Sharma S, Sud N, Wiseman DA, Carter AL, Kumar S, Hou Y, Rau T, Wilham J, Harmon C, Oishi P, Fineman JR, Black SM (2008) Altered carnitine homeostasis is associated with decreased mitochondrial function and altered nitric oxide signaling in lambs with pulmonary hypertension. Am J Physiol - Lung Cell Mol Physiol 294: 46–56. https://doi.org/10.1152/ajplung.00247.2007
Black SM, Field-Ridley A, Sharma S, Kumar S, Keller RL, Kameny R, Maltepe E, Datar SA, Fineman JR (2017) Altered carnitine homeostasis in children with increased pulmonary blood flow due to ventricular septal defects. Pediatr Crit Care Med 18: 931–934. https://doi.org/10.1097/PCC.0000000000001275
Agarwal A, Said TM (2004). Carnitines and male infertility. Reproductive biomedicine online 8 (4): 376–384. https://doi.org/10.1016/s1472-6483(10)60920-0
Elbashir S, Magdi Y, Rashed A, Henkel R, Agarwal A (2021) Epididymal contribution to male infertility: An overlooked problem. Andrologia 53: 1–14. https://doi.org/10.1111/and.13721
Park Y-J, Pang M-G (2021) Mitochondrial Functionality in Male Fertility: From Spermatogenesis to Fertilization. Antioxidants 10: 98. https://doi.org/10.3390/antiox10010098
Реброва ОЮ (2003) Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA М., МедиаСфера [Reb-rova OJu (2003) Statisticheskij analiz medicinskih dannyh. Primenenie paketa prikladnyh programm STATISTICA M. [Statistical analysis of medical data. Application of the STATISTICA M application software package], MediaSfera. (In Russ)].
Медведев ДВ, Звягина ВИ, Фомина МА (2014) Способ моделирования тяжелой формы гипергомоцистеинемии у крыс. Российский медико-биологический вестник имени академика И.П. Павлова 22 (4): 42–46. [Medvedev DV, Zvyagina VI, Fomina MA (2014) Modeling of severe hyperhomocysteinemia in rats. I.P. Pavlov Russian Medical Biological Herald 22 (4): 42–46. (In Russ)]. https://doi.org/10.17816/PAVLOVJ2014442-46
Покровский МВ, Покровская ТГ, Кочкаров ВИ, Артюшкова ЕБ (2008) Эндотелиопротекторные эффекты L-аргинина при моделировании дефицита окиси азота. Эксперим. и клин. фармакол. 71 (2): 29–31. [Pokrovskii MV, Pokrovskaya TG, Kochkarov VI, Ar-tyushkova EB (2008) Endothelioprotective properties of L-arginine on a nitric oxide deficiency model. Eksperimental’naya i klinicheskaya farmakologiya. 71 (2): 29–31. (In Russ)].
Wang ZY, Håkanson R (1995) Role of nitric oxide (NO) in ocular inflammation. British journal of pharmacology 116 (5): 2447–2450. https://doi.org/10.1111/j.1476-5381.1995.tb15094.x
Метельская ВА, Гуманова НГ (2005) Скрининг-метод определения уровня метаболитов оксида азота в сыворотке крови. Клиническая лабораторная диагностика 6: 15–18. [Metelskaya VA, Gumanova NG (2005) Screening method for determining the level of nitric oxide metabolites in blood serum. Clinical Laboratory Diagnostics 6: 15–18. (In Russ)].
Прохорова МИ (ред.) (1986) Методы биохимических исследований (липидный и энергетический обмен), Издательство Ленинградского университета, Л. [Prokhorova MI (ed.) (1986) Methods of biochemical research (lipid and energy metabolism), L., Leningrad University Press. (In Russ)].
Серебров ВЮ, Суханова ГА (ред.) (2008) Биоэнергетика клетки. Томск: Сибирский государственный медицинский университет. [Serebrov VYu, Sukhanova GA (eds.) (2008) Bioenergetics of the cell Tomsk: Siberian State Medical University. (In Russ)].
Костюк ВА, Потапович АИ, Ковалева ЖВ (1990) Простой и чувствительный метод определения активности супероксиддисмутазы, основанный на реакции окисления кверцетина. Вопросы медицинской химии 36 (2): 88–91. [Kostjuk V A, Potapovich AI, Kovaleva ZhV (1990) A simple and sensitive method for determining the activity of superoxide dismutase, based on the quercetin oxidation reaction. Voprosy medicinskoj khimii. – Question of medical chemistry 36 (2): 88–91. (In Russ)].
Фомина МА, Абаленихина ЮВ (2018) Окислительная модификация белков тканей при изменении синтеза оксида азота. М.: Изд-во ГЭОТАР-Медиа. [Fomina MA, Abalenikhina YuV (2018) Okislitel’naya modifikatsiya belkov tkaney pri izmenenii sinteza oksida azota. (Oxidative modification of tissue proteins by changing the synthesis of nitric oxide.) Moscow: GEOTAR-Media. (In Russ)].
Wan L, Hubbard RW (1998). Determination of free and total carnitine with a random-access chemistry analyzer. Clinical chemistry 44 (4): 810–816.
Fukai T, Ushio-Fukai M (2011) Superoxide dismutases: role in redox signaling, vascular function, and diseases. Antioxidants & redox signaling 15 (6): 1583–1606. https://doi.org/10.1089/ars.2011.3999
Brooks GA (2020) Lactate as a fulcrum of metabolism. Redox Biol 35: 101454. https://doi.org/10.1016/j.redox.2020.101454
Kopincová J, Púzserová A, Bernátová I (2012) L-NAME in the cardiovascular system – nitric oxide synthase activator? Pharmacol Reports 64: 511–520. https://doi.org/10.1016/s1734-1140(12)70846-0
Kaplan P, Tatarkova Z, Sivonova MK, Racay P, Lehotsky J (2020) Homocysteine and Mitochondria in Cardiovascular and Cerebrovascular Systems. Int J Mol Sci 21 (20): 7698. https://doi.org/10.3390/ijms21207698
Steed MM, Tyagi SC (2011) Mechanisms of cardiovascular remodeling in hyperhomocysteinemia. Antioxid Redox Signal 15: 1927–1943. https://doi.org/10.1089/ars.2010.3721
Stühlinger MC, Tsao PS, Her JH, Kimoto M, Balint RF, Cooke JP (2001) Homocysteine impairs the nitric oxide synthase pathway role of asymmetric dimethylarginine. Circulation 104: 2569–2575. https://doi.org/10.1161/hc4601.098514
Jin L, Caldwell RB, Li-Masters T, Caldwell RW (2007) Homocysteine induces endothelial dysfunction via inhibition of arginine transport. J Physiol Pharmacol 58: 191–206.
Звягина ВИ, Бельских ЭС, Урясьев ОМ, Медведев ДВ, Киселева ВА, Твердова ЛВ (2018) Влияние карнитина хлорида на митохондрии сердца крыс при моделировании гипергомоцистеинемии. Медицинский Вестник Северного Кавказа 13 (1): 78–81. [Zvyagina VI, Belskikh ES, Uryasyev OM, Medvedev DV, Kiseleva VA, Tverdova LV (2018) Influence of carnitine chloride on mitochondria of the heart of rats during the modeling of hyperhomocysteinemia. Medical News of the North Caucasus 13 (1): 78–81. (In Russ)]. https://doi.org/10.14300/mnnc.2018.13022
Mastrototaro L, Sponder G, Saremi B, Aschenbach JR (2016) Gastrointestinal methionine shuttle: Priority handling of precious goods. IUBMB Life 68 (12): 924–934. https://doi.org/10.1002/iub.1571
Dayal S, Lentz SR (2005) ADMA and hyperhomocysteinemia. Vascular medicine (London, England) 10 (2): 27–33. https://doi.org/10.1191/1358863x05vm599oa
Tain Y, Hsu C (2017) Toxic Dimethylarginines: Asymmetric Dimethylarginine (ADMA) and Symmetric Dimethylarginine (SDMA). Toxins 9 (3): 92. https://doi.org/10.3390/toxins9030092
Ogawa T, Kimoto M, Watanabe H, Sasaoka K (1987) Metabolism of NG,NG-and NG,N'G-dimethylarginine in rats. Arch Biochem Biophys 252 (2): 526–537. https://doi.org/10.1016/0003-9861(87)90060-9
Obal D, Dai S, Keith R, Dimova N, Kingery J, Zheng Y-T, Zweier J, Velayutham M, Prabhu SD, Li Q, Conklin D, Yang D, Bhatnagar A, Bolli R, Rokosh G (2012) Cardiomyocyte-restricted overexpression of extracellular superoxide dismutase increases nitric oxide bioavailability and reduces infarct size after ischemia/reperfusion Basic Res Cardiol, 107 (6): 305. https://doi.org/10.1007/s00395-012-0305-1
Radi R (2018). Oxygen radicals, nitric oxide, and peroxynitrite: Redox pathways in molecular medicine. Proc Nat Acad Sci USA 115 (23): 5839–5848. https://doi.org/10.1073/pnas.1804932115
Kuznetsov AV, Margreiter R (2009) Heterogeneity of mitochondria and mitochondrial function within cells as another level of mitochondrial complexity. Internat J Molecular Sciences 10 (4): 1911–1929. https://doi.org/10.3390/ijms10041911
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


