Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 3, стр. 196-208
КАЛЬЦИЕВЫЙ КОМПОНЕНТ ФОТООТВЕТОВ СЕТЧАТКИ МОЛЛЮСКА LYMNAEA STAGNALIS: ФАРМАКОЛОГИЧЕСКИЙ И УЛЬТРАСТРУКТУРНЫЙ АНАЛИЗ
В. В. Жуков 1, *, М. В. Сафонов 1
1 Балтийский федеральный университет им. И. Канта
Калининград, Россия
* E-mail: valerzhukov@mail.ru
Поступила в редакцию 03.02.2022
После доработки 05.03.2022
Принята к публикации 18.03.2022
- EDN: EEOETT
- DOI: 10.31857/S004445292203007X
Аннотация
Данное исследование направлено на анализ роли ионов кальция в механизме преобразования светового сигнала в сетчатке большого прудовика Lymnaea stagnalis. С этой целью изучено влияние на электрические реакции изолированного глаза моллюска веществ, влияющих на концентрацию цитоплазматического Сa2+. Применяли: модулятор кальциевого тока 2-аминоэтилдифенил борат, хелатирующий агент двухвалентных катионов EGTA, а также (+)-цис-дилтиазем и Cd2+ как блокаторы кальциевых каналов. Все применявшиеся вещества с различной степенью эффективности подавляли медленную волну электроретинограммы и связанную с ней импульсную активность. Делается вывод, что фототрансдукция в микровиллярных рецепторах сетчатки прудовика включает повышение концентрации цитоплазматического Ca2+. Результаты фармакологических экспериментов, а также особенности ультраструктуры сетчатки моллюска позволяют предполагать, что этот результат достигается не только выбросом Ca2+ из внутриклеточных депо апикальных частей фоторецепторов, но и, по крайней мере, частично поступлением из внеклеточной среды.
Результаты детальных исследований механизмов преобразования светового сигнала в сетчатке позвоночных и членистоногих животных легли в основу представления об однозначном соответствии цитологического типа фоторецептора полярности его электрической реакции и молекулярному механизму фототрансдукции [1, 2]. Так, в рабдомерных (микровиллярных) фоторецепторах, характерных для глаз беспозвоночных животных, поглощение кванта света молекулами зрительного пигмента активирует инозитолфосфатный сигнальный путь, который приводит к открытию TRP каналов и деполяризации клетки [3]. В цилиарных же фоторецепторах сетчатки позвоночных животных возбуждение и изомеризация молекулы родопсина на свету активируют гуанилатциклазный путь фототрансдукции, который приводит к закрытию катионных каналов, управляемых цГМФ, и гиперполяризации клетки [4]. Активация обоих сигнальных путей происходит посредством специфических для каждого из типов фоторецепторов G-белков, функционально сопрягающих молекулы зрительного пигмента с трансдукционными каскадами. Такой же схеме в целом соответствуют свойства рабдомерных (микровиллярных) и цилиарных фоторецепторных клеток двойной сетчатки глаз двустворчатых моллюсков родов Pecten и Lima [5]. Однако ввиду малочисленности исследований механизмов фоторецепции у представителей других таксонов утверждение описанной связи может быть распространено на них пока только в виде предположения, включая брюхоногих моллюсков – представителей наиболее крупного по числу видов класса мягкотелых. Последнее обстоятельство обусловливает интерес к исследованию механизмов световой чувствительности у этих животных с позиции эволюционной и сравнительной физиологии.
К настоящему времени присутствие в организме одного животного фоторецепторных клеток разного цитологического типа и/или реализующих различные пути преобразования светового сигнала уже перестало быть уникальной особенностью двустворчатых моллюсков и установлено для ряда организмов, принадлежащих различным таксонам позвоночных и беспозвоночных животных [6, 7]. Указанное разнообразие достигается, прежде всего, за счет светочувствительных клеток, не входящих в состав сетчатки глаза, включая центральные нейроны [8, 9], которые невозможно отнести к одной из упомянутых цитологических групп. При этом именно для моллюсков, по-видимому, наиболее характерно одновременное наличие у одного животного сразу нескольких видов световой чувствительности [10]. Так, у пресноводного брюхоногого моллюска Lymnaea stagnalis чувствительность к свету помимо сетчатки глаза проявляют также кожные покровы ноги, мантии и головной части туловища [11]. Освещение глаза прудовика приводит к on-реакции фоторецепторов сетчатки: деполяризации и возникновению в них потенциалов действия [12], которые проводятся по аксонам оптического нерва в центральные ганглии [13]. В отличие от фоторецепторов глаза светочувствительные клетки кожи L. stagnalis в целом не имеют четкой локализации. Лишь в коже мантии в области пневмостома выявлено скопление структур, обладающих иммунореактивностью к антителам опсина осьминога, которые определены как принадлежащие фоторецепторам [14]. Световая стимуляция этой части тела моллюска вызывает фазную off-реакцию в правом париетальном нерве (n. parietalis dexter) и появление возбуждающего постсинаптического потенциала (ВПСП) в интернейроне RPeD11 [15]. Эти события являются частью нейрофизиологического механизма оборонительного поведения, а именно втягивания тела животного в раковину с одновременным закрытием пневмостома в ответ на резкое снижение освещенности кожи. Исходя из того, что импульсная реакция в париетальном нерве отражает активность светочувствительных клеток кожи, можно предполагать, что фоторецепторы сетчатки и кожи имеют отличные друг от друга функциональные свойства, в основе которых могут лежать различные пути преобразования светового сигнала.
Фармакологический анализ электрических реакций RPeD 11, а также проявлений оборонительного теневого рефлекса, дал основания для вывода о том, что off-ответ фоторецепторов кожи обеспечивается работой каналов, управляемых циклическими нуклеотидами, а именно цГМФ [16]. Однако при этом цитологический тип светочувствительных клеток кожи L. stagnalis остается пока неизвестным, в то время как в состав сетчатки этого моллюска входят только микровиллярные фоторецепторы [17, 18]. Следуя описанной выше коррелятивной связи, можно было бы предполагать, что в фоторецепторах сетчатки прудовика фототрансдукция проходит по инозитолфосфатному пути, включающему модуляцию внутриклеточной концентрации Ca2+. Однако ввиду необходимости экспериментальной проверки такого предположения, а также с целью сравнения процессов преобразования светового сигнала в различных фоторецепторах L. stagnalis, мы предприняли фармакологический анализ вовлеченности Ca2+ в генерацию электрических реакций сетчатки этого моллюска на световую стимуляцию. Для сопоставимости результатов набор примененных нами веществ включал и те, что были использованы в исследованиях фоторецепторов кожи [16]. Предварительные результаты исследования были опубликованы ранее [19].
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные
Объектом исследования были взрослые особи прудовика Lymnaea stagnalis с размером раковины около 3 см, собранные в водоемах города Светлый, Калининградская область, и содержавшиеся в лабораторных условиях.
Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям биоэтической комиссии БФУ им. И. Канта.
Электронная микроскопия
Для приготовления срезов использовали препарат глаза с участками прилегающей ткани. Образец ткани предварительно фиксировали в 2.5% растворе глутарового альдегида, приготовленном на 0.1%‑ном какодилатном буфере (рН = 7.5), а затем обезвоживали в серии этилового спирта возрастающей концентрации от 50 до 100% и пропиленоксидом. Обезвоженный образец заливали в “Аралдид” или “Эпон 812”. С полученных блоков делали срезы на ультрамикротоме Reichert-Jung Ultracut E толщиной около 50 нм. Полученные срезы контрастировали цитратом свинца по Рейнольдсу и уранилацетатом свинца. Для просмотра срезы помещали на медные сеточки.
Просмотр и фотографирование срезов проводили на электронном микроскопе Philips EM 300 (Медицинский факультет высшей технической школы Северного Рейна-Вестфалии, Ахен).
Электрофизиологические эксперименты
Экспериментальный препарат состоял из изолированного глаза с отрезком оптического нерва. В некоторых опытах для облегчения процессов диффузионного обмена между микросредой апикальных отделов фоторецепторов и внешним раствором из глазного бокала удаляли хрусталик. Все препараты готовили под бинокулярным микроскопом в условиях общего затемнения и с использованием красного фильтра в осветителе.
Регистрация электроретинограммы (ЭРГ) выполнялась холдером A-M Systems с всасывающим портом и Ag/AgCl электродом, в котором укреплялась стеклянная пипетка с диаметром входного отверстия около 70 мкм. Электрод закрепляли в экспериментальной ванночке объемом 1 мл. Стеклянные пипетки изготавливали на пуллере PC10 и оплавляли до нужного диаметра на микрокузнице MF900 (Narishige).
Электрические сигналы усиливали (A-M System Model 1800, ×100) в полосе частот 0.1–500 Гц, оцифровывали с шагом дискретизации 0.1 мс (Digidata 1440A), записывали на компьютере и обрабатывали с использованием программного пакета pClamp 10.4. Для получения записей импульсной активности программными средствами поднимали нижнюю границу полосы пропускаемых частот до 10 Гц.
Световая стимуляция осуществлялась светодиодом GNL-3012GD (λmax = 525 нм), свет от которого подавали к препарату по оптоволоконному жгуту. Освещенность препарата составляла около 1000 лк. В качестве управляемого параметра была выбрана длительность стимула, которую задавали через Digidata 1440A.
Ход электрофизиологического эксперимента
Приготовленный препарат помещали в экспериментальную ванночку, заполненную физиологическим раствором, которую устанавливали в экранированную камеру. Отрезок оптического нерва полностью затягивали в наконечник, который под отрицательным давлением плотно прилегал к глазному бокалу. В таком виде препарат оставляли в темноте на время не менее 40 мин до установления относительно стабильной амплитуды ЭРГ, что считали завершением темновой адаптации и определяли периодической регистрацией реакции на световой стимул длительностью 500 мс. По истечении периода адаптации выполняли блок стимуляции световыми вспышками нарастающей длительности. Затем вводили в ванночку раствор исследуемого вещества до достижения необходимой расчетной концентрации и оставляли глаз в новом растворе на время около 15 мин, после чего повторяли блок стимуляции световыми раздражителями. Процедуру стимуляции проводили повторно через 15 мин. Затем возвращали в ванночку исходный физиологический раствор, отмывая им препарат не менее одного часа. В процессе отмывания повторяли блок стимуляции световыми раздражителями для контроля степени восстановления световых ответов глаза.
Использованные вещества
2-Аминоэтилдифенил борат (2-APB, Sigma, D9754) применяли как ингибитор входящего кальциевого тока через каналы TRP и модулятор внутриклеточного высвобождения ионов Ca2+, в том числе и управляемого через рецепторы IP3 [20]. Маточный раствор вещества 10 мМ готовили на диметилсульфоксиде (DMSO) и хранили в морозильной камере при –25°C в атмосфере аргона. Во время опыта маточный раствор разводили до концентрации 1 мМ физиологическим раствором и в необходимом объеме добавляли в экспериментальную ванночку для достижения нужной концентрации.
Этиленгликоль-бис-(β-аминоэтиловый эфир)-N,N,N',N'-тетрауксусной кислоты тетранатриевая соль (EGTA, Sigma-Aldrich, E8145) применялась как хелатор двухвалентных катионов с повышенным сродством в отношении ионов Ca2+. Маточный раствор EGTA 0.1 М готовили в NaOH и хранили в морозильной камере при –25°C. В ходе эксперимента его разбавляли до желаемой концентрации физиологическим раствором, не содержащим Са2+, и использовали для наполнения экспериментальной ванночки.
Хлорид кадмия (CdCl2, Sigma-Aldrich, 202908) использовали для введения в раствор Cd2+ как блокаторов кальциевых каналов [21]. Исходный водный раствор 0.1 М хранили в холодильнике при 4°C и добавляли в необходимом объеме в экспериментальную ванночку для достижения нужной концентрации.
(+)-цис-дилтиазем гидрохлорид (DTZ, Sigma, D2521), блокатор некоторых типов каналов Са2+ [22, 23], применяли для сравнения его эффективности по отношению к фоторецепторам кожи [16] и сетчатки. Маточный раствор DTZ 10 мМ готовили на дистиллированной воде и хранили в морозильной камере при –25°С. Процедура получения рабочего раствора для эксперимента была такой же, как и для 2-APB.
Состав физиологического раствора (мМ): NaCl – 40; KCl – 3; CaCl2 – 3; MgCl2 – 3. Значение рН = = 7.4–7.6 устанавливали HEPES. В экспериментах с применением EGTA использовали физиологический раствор такого же состава, только без Са2+ (бескальциевый раствор).
Обработка и статистический анализ результатов
Значения амплитуд медленной волны ЭРГ в каждом опыте нормировали относительно ее максимального значения, полученного в контрольном физиологическом растворе до аппликации вещества. Нормированные значения усредняли по всем опытам. Статистическую обработку результатов проводили с помощью двухфакторного дисперсионного анализа (ANOVA) в программе GraphPad Prism 7.04. Достоверность различий средних значений ЭРГ, полученных в контрольных растворах и в присутствии веществ, оценивали на основе критериев Тьюки и Шидака.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Ультраструктура
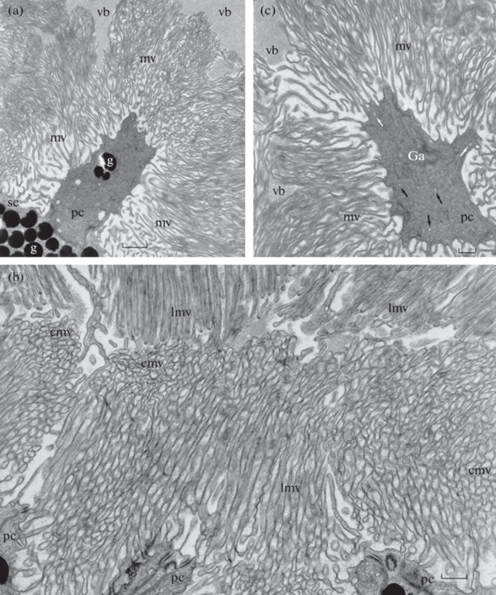
Основные детали структурной организации и клеточного состава сетчатки L. stagnalis подробно описаны ранее в ряде исследований [17, 18]. Поэтому мы сфокусировали внимание на структурных особенностях апикальных частей фоторецепторных клеток и их микровиллярного аппарата как места потенциальной локализации зрительного пигмента и молекулярных элементов механизма фототрансдукции. Вершины фоторецепторных клеток диаметром поперечного сечения около 4–6 мкм выдаются в полость глазного бокала на расстояние до 10–12 мкм. Они образуют многочисленные микровиллярные выросты диаметром от 0.08 до 0.4 мкм и длиной до 6–7 мкм (рис. 1a). В большинстве своем расположение микровилл отдельного фоторецептора выглядит слабо упорядоченным, хотя встречаются отдельные пучки и области их одинаковой пространственной ориентации (рис. 1b). Вероятно, что эти группы микровилл принадлежат разным морфологическим типам фоторецепторов. На полученных фотографиях не просматривается деталей ультраструктуры микровилл: их внутреннее пространство выглядит однородным. При этом в цитоплазме стволовой части апексов фоторецепторов обнаружены многочисленные везикулярные образования, мембранные структуры и митохондрии (рис. 1c).
Рис. 1.
Электронные микрофотографии срезов трех разных частей сетчатки Lymnaea stagnalis. (a) Средняя часть латеральной стенки глазного бокала. Виден профиль апикальной части фоторецепторной клетки с тремя гранулами экранирующего пигмента и многочисленными микровиллами. Такие же многочисленные гранулы, видимые в нижней части фотографии, принадлежат опорным клеткам. (b) Дно глазного бокала. Видны продольные и поперечные срезы упорядоченных в пространстве пучков микровилл фоторецепторных клеток. (c) Поперечный срез апикальной части фоторецепторной клетки в нижней части полости глазного бокала. Многочисленные микровиллы этой фоторецепторной клетки плохо организованы в пространстве. Видны многочисленные везикулы и митохондрии, часть из которых обозначены соответственно черными и белыми стрелками. Имеются также элементы эндомембранных систем, предположительно аппарата Гольджи (Ga). pc – фоторецепторная клетка; sc – опорная (пигментная) клетка; mv – микровиллы; cmv – поперечное сечение микровилл; lmv – продольный срез микровилл; vb – стекловидное тело; g – гранулы экранирующего пигмента. Масштабная линейка: 0.5 мкм.
Электроретинограмма
Детальное описание ЭРГ L. stagnalis и ее свойств было выполнено ранее [13]. Поэтому здесь ограничимся лишь некоторыми комментариями. Электрическая реакция глаза, вызванная короткой вспышкой света, состоит из медленной волны и связанным с ней разрядом импульсной активности. Латентный период возникновения волны ЭРГ всегда был короче такового импульсной реакции. Так, например, если после включения света начало волны ЭРГ фиксировали через 150 мс, то вспышку импульсов, возникающих на ее восходящей фазе, – примерно через 250 мс. Форма ЭРГ обычно однообразна, хотя иногда встречались отклонения, что, вероятно, связано с особенностями положения глаза во всасывающем наконечнике. Абсолютное значение амплитуды ЭРГ варьировало от опыта к опыту, но влияние этого фактора устраняли нормированием полученных величин. В некоторых наших опытах амплитуда медленной волны могла достигать 2 мВ, а импульсной активности в максимуме ответа – около 25 мкВ. Ввиду того, что медленная волна, по-видимому, является интегральным показателем рецепторного потенциала фоторецепторов, ее амплитуда была выбрана в качестве ключевого параметра при последующем фармакологическом анализе фототрансдукции.
Влияние веществ на ЭРГ
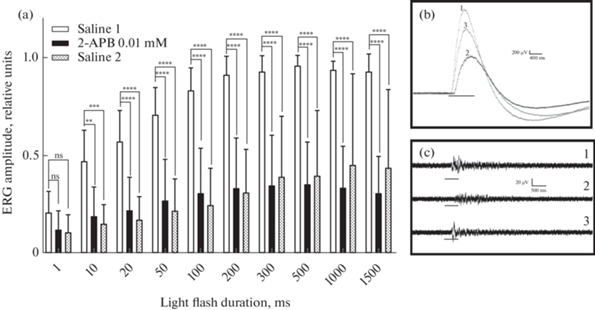
Влияние 2-APB на световые реакции сетчатки глаза было исследовано в диапазоне концентраций 1–100 мкМ. Признаки угнетающего влияния вещества на медленную волну ЭРГ проявлялись при его концентрации около 2 мкМ, а при 100 мкМ наблюдалось практически ее полное подавление. В концентрации 10 мкМ 2-APB уменьшал амплитуду ЭРГ в среднем до 0.31 ± 0.19 от исходной величины при длительности вспышки 1 с. В этих опытах статистическая значимость наблюдаемого эффекта подтверждается для всех значений длительности светового стимула кроме 1 мс, причем свыше 10 мс – с высокой степенью достоверности (рис. 2а). Угнетающее влияние препарата проявлялось в снижении как амплитуды волны ЭРГ, так и импульсной активности. И обратно, нарастание волны ЭРГ при возврате физиологического раствора сопровождалось восстановлением, по крайне мере частичным, импульсной активности (рис. 2b, c). Эти события достаточно хорошо коррелировали друг с другом. Эффект, произведенный веществом, сохранялся в течение нескольких часов, однако все же был обратимым. В специально поставленных опытах с длительным отмыванием полное восстановление амплитуды ЭРГ и импульсного компонента реакции на свет наблюдали через 9 ч после завершения аппликации 2-APB в концентрации 10 мкМ.
Рис. 2.
Влияние аппликации 2-АPB на амплитуду медленной волны и импульсного компонента ЭРГ изолированного глаза Lymnaea stagnalis. (a) Нормированная и усредненная (n = 14) амплитуда медленной волны ЭРГ, вызванной световой вспышкой различной продолжительности в физиологическом растворе (Saline 1), после 30 мин добавления 0.01 мМ 2‑APB и после 1 ч восстановления физиологического раствора (Saline 2). (b, c) Примеры волн ЭРГ (b) и импульсных ответов (c), полученных на вспышку света, в физиологическом растворе (1), после 30-минутного применения 0.01 мкМ 2-APB (2) и после 1 ч восстановления физиологического раствора (3). Обозначения: вертикальные линии – стандартное отклонение; горизонтальные линии (b и c) – отметка вспышки света; **** – p < 0.0001; *** – p = 0.0001; ** – p = 0.001; ns – p > 0.05 (тест Тьюки).
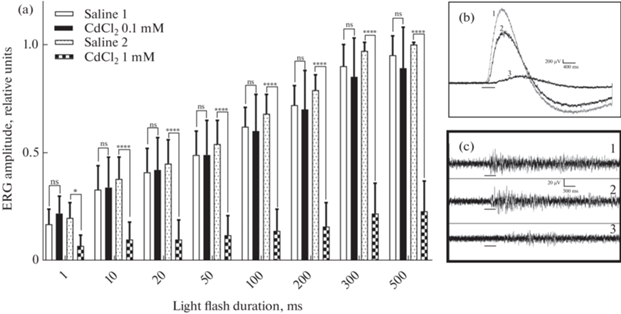
CdCl2, введенный в физиологический раствор в концентрации 0.1 мМ, не оказывал статистически значимых изменений амплитуды ЭРГ. Она сильно уменьшалась для всех длительностей световой вспышки при 1 мМ CdCl2. Так, при длительности 500 мс амплитуда волны ЭРГ уменьшалась в среднем до 0.23 ± 0.14 от исходного значения (рис. 3a, b). Импульсная активность в этом случае также была подавлена, но импульсы небольшой величины еще сохранялись (рис. 3c). После возврата физиологического раствора восстановление электрических ответов не наблюдалось даже при длительном промывании.
Рис. 3.
Влияние Cd2+ на амплитуду медленной волны и импульсного компонента ЭРГ изолированного глаза Lymnaea stagnalis. (a) Нормированная и усредненная (n = 15) амплитуда медленной волны ЭРГ, вызванная световой вспышкой различной продолжительности в физиологическом растворе (Saline 1), после 30 мин добавления 0.1 мМ CdCl2, 1 ч восстановления физиологического раствора (Saline 2) и после 30-минутного применения соли кадмия в концентрации 1 мМ. (b, c) Примеры регистраций волн ЭРГ (b) и импульсных ответов (с), полученных в ответ на вспышку света, в физиологическом растворе (1), после 30-минутного применения Cd2+ в концентрации 0.1 мМ (2) и 1 мМ (3). Обозначения: вертикальные линии – стандартное отклонение; горизонтальные линии (b и c) – отметка вспышки света; **** – p < 0.0001; * – p = 0.01; ns – p > 0.05 (тест Тьюки).
Влияние EGTA на амплитуду ЭРГ по сравнению с Cd2+ выглядит менее эффективным: при концентрации EGTA 1 мМ амплитуда ответа обратимо уменьшалась в среднем до 0.56 ± 0.22 от исходного значения при длительности вспышки 500 мс (рис. 4a). После возврата к физиологическому раствору амплитуда ЭРГ восстанавливалась в течение 1 ч. Повышение концентрации EGTA до 10 мМ приводило к существенному уменьшению амплитуды ЭРГ в среднем до 0.15 ± 0.16 (рис. 4b). Этот эффект был очень сильным и, как правило, сохранялся после нескольких часов возврата к физиологическому раствору. Во всех выполненных экспериментах в случае проявления угнетающего влияния веществ на амплитуду волны ЭРГ также уменьшалась амплитуда импульсного компонента реакции глаза на световой стимул (рис. 4с). Все опыты с аппликацией EGTA проводили в бескальциевом растворе. При этом замена физиологического раствора на бескальциевый не оказывала заметного влияния ни на амплитуду ЭРГ, ни на импульсную реакцию на свет. Дополнительно проверяли возможность вовлечения в рецепторный ответ поступающего потока ионов кальция, которые могли бы сохраняться в стекловидном теле и в бескальциевом растворе. С этой целью были проведены несколько экспериментов на препарате глаза с удаленным хрусталиком. Результаты одного из них представлены на рис. 5. Этот препарат, как и интактный изолированный глаз, демонстрировал стабильный электрический ответ на свет в бескальциевом растворе. Однако применение 1 мМ EGTA приводило к быстрому снижению амплитуды медленной волны ЭРГ на 40–50%. Возврат к бескальциевому раствору приводил к небольшому росту волны ЭРГ, а переход к физиологическому раствору сопровождался увеличением как амплитуды волны (рис. 5a), так и импульсной активности (рис. 5b) практически до исходных величин.
Рис. 4.
Влияние EGTA на амплитуду медленной волны и импульсного компонента ЭРГ изолированного глаза Lymnaea stagnalis. (a) Нормализованная и усредненная (n = 16) амплитуда медленной волны ЭРГ, вызванной световой вспышкой различной длительности в физиологическом растворе (Saline 1), через 30 мин добавления 1 мМ EGTA, через 1 ч восстановления физиологического раствора (Saline 2) и через 30 мин аппликации 10 мМ хелатирующего агента. (b, c) Примеры волн ЭРГ (b) и импульсных ответов (c), полученных на вспышку света в физиологическом растворе (1), после 30-минутного применения EGTA в концентрации 1 мМ (2) и 10 мМ EGTA (3). Обозначения: вертикальные линии – стандартное отклонение; горизонтальные линии (b и c) – отметка вспышки света; **** – p < 0.0001; ** – p = 0.0026; * – p < 0.05; ns – p > 0.05 (тест Шидака).
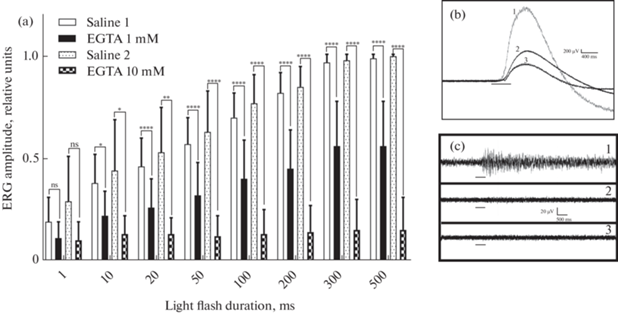
Рис. 5.
Примеры записей волн ЭРГ (а) и импульсных реакций (b) изолированного глаза Lymnaea stagnalis с удаленным хрусталиком, полученных на световую вспышку, в бескальциевом растворе (1), после 10 мин аппликации 1 мМ EGTA (2), через 10 мин после возвращения бескальциевого раствора (3) и через 10 мин пребывания в физиологическом растворе (4). Горизонтальные линии – отметка вспышки света.
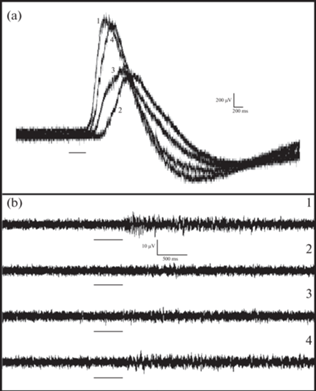
DTZ в концентрациях до 0.1 мМ не оказывал статистически значимых отклонений амплитуды волны ЭРГ от контроля, так и заметных изменений импульсной активности в ответ на световые стимулы всех использованных значений длительности. В некоторых случаях возврат к физиологическому раствору после аппликации DTZ сопровождался даже некоторым увеличением амплитуды ЭРГ. Статистически значимое угнетающее влияние DTZ на ЭРГ проявлялось при концентрации 0.5 мМ (рис. 6a). При этом амплитуда волны ЭРГ составила в среднем 0.43 ± 0.19 от исходной величины при длительности вспышки 1.5 с (рис. 6b). Продолжительное отмывание препарата физиологическим раствором приводило к, по крайней мере, частичному восстановлению обоих компонентов ответа на освещение (рис. 6b, c).
Рис. 6.
Влияние DTZ на амплитуду медленной волны и импульсного компонента ЭРГ изолированного глаза Lymnaea stagnalis. (a) Нормализованная и усредненная (n = 10) амплитуда медленной волны ЭРГ, вызванной вспышкой света различной продолжительности в физиологическом растворе (Saline 1), после 30 мин добавления 0.5 мМ DTZ и спустя 1 ч после восстановления физиологического раствора (Saline 2). (b, c) Примеры записей волн ЭРГ (b) и импульсных ответов (c), полученных на световую вспышку в физиологическом растворе (1), после 30 мин аппликации 0.5 мМ DTZ (2) и 1 ч восстановления физиологического раствора. Обозначения: вертикальные линии – стандартное отклонение; горизонтальные линии (b и c) – отметка вспышки света; **** – p < 0.0001; ** – p = 0.005; * – p = 0.019; ns – p > 0.05 (тест Тьюки).

Анализ влияния 2-APB, DTZ и Cd2+ на амплитуду ЭРГ в бескальциевом растворе, содержащем 1 мМ EGTA, проводили с целью анализа возможного вклада входящего тока Ca2+ в генерацию ответа фоторецепторов на световой стимул. Эти опыты выполнялись на препаратах как интактного глаза, так и после удаления хрусталика. На рисунке 7 представлены примеры ЭРГ, полученные в таких экспериментах. Во всех опытах введение в бескальциевый раствор 1 мМ EGTA уменьшало амплитуду ЭРГ до 50–60% от ее исходного значения. На этом фоне введение в раствор 0.2 мМ Cd2+ приводило к дальнейшему уменьшению ЭРГ, которое имело прогрессирующий и необратимый характер (рис. 7a). В таких же исходных условиях введение в раствор 1 мМ DTZ немного даже увеличивало амплитуду ЭРГ (рис. 7b), а 0.1 мМ 2-APB практически полностью ее подавляло (рис. 7с). Следует отметить, что эффект этих веществ был обратимым, а в случае восстановления бескальциевого раствора после аппликации 2-APB амплитуда ЭРГ даже увеличилась.
Рис. 7.
Влияние 1 мМ DTZ (a), Cd2+ (b) и 0.1 мМ 2-APB (c) на ЭРГ Lymnaea stagnalis. Записи, представленные на (а) и (с), сделаны в бескальциевом растворе (1), после добавления 1 мМ EGTA (2) и аппликации веществ (3) и последующего возвращения исходного раствора (4). Записи, представленные на (b), сделаны: в бескальциевом растворе (1), после добавления 1 мМ EGTA (2), введения в раствор Cd2+ в концентрациях 0.1 мМ (3), 0.4 мМ (4) и 0.5 мМ (5) и возврата к исходному раствору (6). ЭРГ на (a) и (b) получены в опытах на препаратах изолированного глаза, а на (с) – после удаления хрусталика. Горизонтальные линии – отметка вспышки света.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ полученных результатов строится на представлении, что медленная волна ЭРГ представляет собой интегральный показатель рецепторных потенциалов светочувствительных клеток сетчатки. Поэтому обсуждение возможных путей фототрансдукции в сетчатке L. stagnalis основано на эффектах препаратов, влияющих именно на этот компонент реакции на свет. Экспериментальные результаты, представленные в статье, указывают на важную роль Са2+ в трансформации светового сигнала в фоторецепторах сетчатки L. stagnalis. Поскольку 2-APB позиционируется как модулятор высвобождения Са2+ из цитоплазматических депо [24], то его ингибирующее действие на ЭРГ прудовика указывает на наличие именно этого этапа в фототрансдукции в сетчатке прудовика. Такой механизм реализуется, например, в рабдомерных фоторецепторах мечехвоста Limulus. В них регуляция концентрации Са2+ предположительно осуществляется посредством активации рецепторов IP3 мембран внутриклеточных депо. Применение 2‑APB подавляет повышение концентрации цитоплазматического Са2+ в фоторецепторах Limulus и их деполяризацию, вызванную светом, а также внутриклеточной инъекцией IP3 [25]. Однако в фоторецепторах Drosophila повышение внутриклеточной концентрации Са2+ при фототрансдукции обеспечивается его поступлением в цитоплазму из внешнего раствора через активируемые TRP-каналы мембран микровилл [26, 27]. Таким образом, в фоторецепторах животных даже одной таксономической группы могут реализовываться разные механизмы фототрансдукции. Такая диверсификация делает необходимым рассмотреть оба пути поступления Са2+ в цитоплазму фоторецепторов L. stagnalis. В бескальциевом растворе сохранялась амплитуда волн ЭРГ, генерируемых препаратами как интактных глаз, так и после удаления из них хрусталика (рис. 5 и 7). Однако после введения в раствор EGTA амплитуда этого ответа уменьшалась, а оставшийся ответ подавлялся аппликацией 2-APB (рис. 7). Мы предлагаем следующую трактовку этой последовательности событий. В растворе, не содержащем Ca2+, вблизи микровилл фоторецепторов сохраняется некоторое количество Ca2+, которые не удаляются полностью путем диффузии, но могут быть связаны хелатором. В таких условиях угнетающее влияние на электрические реакции 2-APB может быть интерпретировано как подавление внутриклеточного выброса Ca2+ в цитоплазму. Отметим отсутствие заметного влияния DTZ на ЭРГ L. stagnalis в бескальциевом растворе в присутствии EGTA при том, что в физиологическом растворе он в концентрациях, начиная с 0.5 мМ, уменьшал амплитуду ЭРГ (рис. 6). Возможно, что в физиологическом растворе в применяемых концентрациях проявлялось его блокирующее действие на кальциевые каналы по фармакологическим свойствам близкие в Cav каналам, блокируемым (+)-цис-дилтиаземом.
На основании изложенного выше мы предполагаем, что процесс фототрансдукции L. stagnalis включает повышение концентрации Ca2+ в цитоплазме как за счет стимуляции его выхода из цитоплазматических депо, так и частично за счет входящего трансмембранного тока этих ионов, подобного тому, что был обнаружен в микровиллярных фоторецепторах Lima scarba [28]. Судя по изменениям амплитуды ЭРГ оба пути поступления Ca2+ в цитоплазму фоторецепторов вносят примерно одинаковый вклад в их деполяризацию.
Подавление ЭРГ после введения в раствор Cd2+ проявлялось во всех вариантах растворов (физиологическом, бескальциевом и после добавления в него EGTA) при примерно одинаковой концентрации 0.2 мМ. Учитывая необратимый характер указанного влияния, а также способность Cd2+ проходить через плазматические мембраны [29], можно предполагать, что влияние этого иона на ЭРГ может быть результатом неспецифического деструктивного действия на белки. Однако, если увеличение концентрации цитоплазматического Ca2+ может быть частично обеспечено входящим током этих ионов, то почему угнетающее влияние Cd2+ проявляется только в высоких концентрациях 0.2–0.3 мМ в физиологическом растворе. Это при том, что блокирующий эффект Cd2+ на потенциал-зависимые кальциевые каналы проявляется уже при концентрациях в диапазоне 2–10 мкМ [21]. Таким образом, отсутствие влияния на ЭРГ низких концентраций Сd2+ в физиологическом растворе входит в видимое противоречие с описанным эффектом EGTA. Предположение о нечувствительности входящего тока Ca2+ фоторецепторов к практически миллимолярным концентрациям Cd2+ представляется маловероятным. Мы пока не имеем однозначного ответа на этот вопрос, который нуждается в дальнейшем изучении.
Выход Ca2+ из цитоплазматических депо может быть результатом гидролиза PIP2 с образованием IP3 и последующей активации его рецепторов, как это происходит у Limulus [25]. Однако, основываясь только на влиянии 2-APB на амплитуду ЭРГ L. stagnalis, нельзя с уверенностью утверждать, что выброс Са2+ в цитоплазму фоторецепторов происходит за счет активации рецепторов IP3 [30, 31]. Такой механизм может быть рассмотрен в качестве предположения и также нуждается в дополнительных исследованиях. Другой вопрос, где расположены депо кальция и может ли действие на них IP3 обеспечиваться механизмом простой диффузии его молекул в цитоплазме? Электронно-микроскопический анализ не дает очевидных свидетельств наличия таких структурных элементов в цитоплазме микровилл фоторецепторов L. stagnalis. При этом в стволовой части их апикальных отделов присутствуют многочисленные везикулы и внутриклеточные мембраны, которые могут быть структурной основой внутриклеточного депо ионов кальция. Предположим, что высвобождение Са2+ из депо контролируется активацией рецепторов IP3, которая достигается повышением концентрации этого вторичного мессенджера в цитоплазме. В этом случае вопрос заключается в том, может ли образование IP3 в мембранах микроворсинок, наиболее вероятном месте локализации родопсина, обеспечить эффективную активацию его рецепторов на внутриклеточных структурах апикальной части фоторецептора? Расчеты, основанные на величине коэффициента диффузии IP3 в цитоплазме клеток нейробластомы, дают в предельном случае около 5 мкм как расстоянии, на котором эффективность внутриклеточного медиатора может быть равна половине максимальной [32]. Такая величина вполне согласуется с линейными размерами фоторецепторных микроворсинок L. stagnalis, включая их проксимальные отделы. Поэтому представляется, что геометрия фоторецепторной клетки вполне обеспечивает механизм диффузии внутриклеточного мессенджера к цитоплазматическим депо кальция.
Результаты, полученные в данной работе, свидетельствуют также о различии путей фототрансдукции в сетчатке и коже L. stagnalis. Основание для такого вывода видится в противоположном влиянии 2-APB на реакцию фоторецепторов глаза и кожи на освещение. Так, в наших экспериментах 2-APB в концентрациях выше 2 мкМ подавлял волну ЭРГ и импульсные реакции фоторецепторов сетчатки на освещение. При этом в концентрации до 50 мкМ 2-APB не оказывал заметного влияния на электрические off-реакции RPeD11 на световое раздражение кожи и поведенческое проявление теневого рефлекса. [16]. В то же время ингибирующее действие DTZ в обоих исследованиях проявлялось в сходных концентрациях. В настоящее время мы не можем связать выявленные различия в действии 2-APB на фоторецепторы сетчатки и кожи прудовика с различиями в их строении или электрических свойствах. Реакции на свет, регистрируемые в изолированном глазу, отражают активность фоторецепторов, направляющих свои аксоны непосредственно к зрительному нерву без синаптического переключения [33]. Таким образом, эффекты фармакологических препаратов, наблюдаемые в наших экспериментах, являются результатом их влияния на микровиллярные фоторецепторы сетчатки. Что касается электрических off-реакций центрального нейрона RPeD11, регистрируемых при световой cтимуляции кожи мантии, то они являются результатом прохождения сигнала хотя бы через один синапс, образованный на нейроне афферентными волокнами мантийного нерва [15]. При этом не очевидно, что электрические реакции на световую стимуляцию области пневмостома L. stagnalis, регистрируемые в самом мантийном нерве [14], принадлежат именно фоторецепторным клеткам и не трансформируются, например, в нервном сплетении кожи. Кроме того, остается неизвестным цитологический тип светочувствительных элементов кожи прудовика. По результатам электронно-микроскопического исследования сенсорных структур кожи этого моллюска функция фоторецептора была приписана цилиарным клеткам [34]. Однако это предположение до сих пор не подтверждено.
Отдельно стоит обсудить вопрос об участии Ca2+ в генерации импульсной составляющей ЭРГ. Как сама ЭРГ, так и электрические реакции отдельных фоторецепторов [12] состоят из градуальной волны деполяризации и возникающих на ее фоне импульсных реакций. Возможно, что эти процессы разнесены в фоторецепторах пространственно и, очевидно, обеспечиваются различными механизмами. Следует указать, что в случае ЭРГ, которая регистрируется внеклеточно, импульсный компонент представляет собой результат сложения амплитуд потенциалов действия многочисленных фоторецепторов. Поэтому увеличение амплитуды вспышки импульсов в восходящую фазу и пик волны ЭРГ могут быть результатом как увеличения частоты, так и числа возбуждающихся фоторецепторов. В случае применения 2-APB в целом наблюдалось соответствие амплитуд волны ЭРГ и импульсного компонента (рис. 2b, c), что объяснимо, если предположить сугубо внутриклеточный механизм действия вещества. В этом случае число и частота импульсирующих фоторецепторов зависят от амплитуд их деполяризации, являющихся, в свою очередь, конечным результатом фототрансдукции. Исчезновение же импульсной реакции при лишь частичном подавлении амплитуды волны ЭРГ, вызванном применением EGTA (рис. 4b, c), может указывать на важную роль именно внеклеточного Ca2+ в генерации потенциалов действия фоторецепторов. Аналогично может быть объяснено заметное уменьшение импульсного компонента ЭРГ при введении в раствор DTZ (рис. 6b, c). Что касается эффектов Cd2+, то вопрос механизмов его влияния на компоненты ЭРГ требует дополнительного изучения.
Суммируя приведенные выше рассуждения, мы можем сформулировать некоторые выводы относительно механизмов преобразования светового сигнала в фоторецепторах L. stagnalis:
1) регуляция концентрации Ca2+ в цитоплазме является компонентом фототрансдукции в микровиллярных фоторецепторах сетчатки;
2) источником поступления в цитоплазму Ca2+ являются как внутриклеточные депо, так и внеклеточная микросреда;
3) выраженный угнетающий эффект 2-APB на ЭРГ при отсутствии его заметного влияния на электрические реакции центрального нейрона RPeD11, вызванные световой стимуляцией мантии [16], позволяет предполагать различия молекулярных механизмов фототрансдукции в сетчатке и коже моллюска;
4) входящий ток Ca2+ является компонентом механизма генерации фоторецепторами потенциалов действия.
Представленные в статье результаты и их интерпретация являются первым шагом в изучении путей преобразования света в фоторецепторах брюхоногих моллюсков, которое имеет перспективу продолжения как на клеточном, так и на молекулярном уровне.
Список литературы
Yau KW, Hardie RC (2009) Phototransduction motifs and variations. Cell 139 (2): 246–264. https://doi.org/10.1016/j.cell.2009.09.029
Abbas F, Vinberg F (2009) Transduction and adaptation mechanisms in the cilium or microvilli of photoreceptors and olfactory receptors from insects to humans. Front Cell Neurosci 15: 662453. https://doi.org/10.3389/fncel.2021.662453
Katz B, Minke B (2009) Drosophila photoreceptors and signaling mechanisms. Front Cell Neurosci 3: 2. https://doi.org/10.3389/neuro.03.002.2009
Fu Y, Yau KW (2007) Phototransduction in mouse rods and cones. Pflugers Arch 454 (5): 805–819. https://doi.org/10.1007/s00424-006-0194-y
Nasi E, del Pilar Gomez M, Payne R (2000) Phototransduction mechanisms in microvillar and ciliary photoreceptors of invertebrates. In D.G. Stavenga, W.J. DeGrip, E.N. Pugh (eds). Handbook of Biological Physics. V. 3. Elsevier Science B.V. North-Holland. 389–448. https://doi.org/10.1016/S1383-8121(00)80011-1
Fain GL, Hardie R, Laughlin SB (2010) Phototransduction and the evolution of photoreceptors. Curr Biol 20(3): R114–R124. https://doi.org/10.1016/j.cub.2009.12.006
Arendt D, Tessmar-Raible K, Snyman H, Dorresteijn AW, Wittbrodt J (2004) Ciliary photoreceptors with a vertebrate-type opsin in an invertebrate brain. Science 306: 869–871. https://doi.org/10.1126/science.1099955
Gotow T, Nishi T (2009) A new photosensory function for simple photoreceptors, the intrinsically photoresponsive neurons of the sea slug Onchidium. Front Cell Neurosci 3: 18. 2009. https://doi.org/10.3389/neuro.03.018.2009
Kartelija G, Nedeljkovic M, Radenovic L (2003) Photosensitive neurons in mollusks. Comp Biochem Physiol A 134 (3): 483–495. https://doi.org/10.1016/s1095-6433(02)00351-3
Katagiri Y, Katagiri Y (2008) A multiple photoreceptive system in a marine gastropod, Onchidium: 1) Morphological characteristics and photoresponse of four kinds of photoreceptor cells. Hikaku seiri seikagaku (Comparative Physiology and Biochemistry) 25 (1): 4–10. https://doi.org/10.3330/hikakuseiriseika.25.4
Sudoplatov KA, Zhukov VV (1999) Electrical responses of peripheral nerves of the mollusc Lymnaea stagnalis to photostimulation of skin surface. J Evol Biochem Physiol 35 (4): 360–369. https: //www.researchgate.net/publication/289523282
Sakakibara M, Aritaka T, Iizuka A, Suzuki H, Horikoshi T, Lukowiak K (2005) Electrophysiological responses to light of neurons in the eye and statocyst of Lymnaea stagnalis. J Neurophysiol 93 (1): 493–507. https://doi.org/10.1152/jn.00692.2004
Zhukov VV, Fedorenko AD, Lavrova AI, Postnikov EB (2017) Electrical responses of Lymnaea stagnalis to light stimulation: Effect of divalent cations. J Evol Biochem Physiol 53 (5): 404–413. https://doi.org/10.1134/S0022093017050064
Takigami S, Sunada H, Horikoshi T, Sakakibara M (2014) Morphological and physiological characteristics of dermal photoreceptors in Lymnaea stagnalis. Biophysics (Nagoya-shi) 10: 77–88. https://doi.org/10.2142/biophysics.10.77
Sunada H, Sakaguchi T, Horikoshi T, Lukowiak K, Sakakibara M (2010) The shadow-induced withdrawal response, dermal photoreceptors, and their input to the higher-order interneuron RPeD11 in the pond snail Lymnaea stagnalis. J Exp Biol 213(20): 3409–3415. https://doi.org/10.1242/jeb.043521
Pankey S, Sunada H, Horikoshi T, Sakakibara M (2010) Cyclic nucleotide-gated channels are involved in phototransduction of dermal photoreceptors in Lymnaea stagnalis. J Comp Physiol B 180 (8): 1205–1211. https://doi.org/10.1007/s00360-010-0490-x
Stoll CJ (1973) Observations on the ultrastructure of the eye of the basommatophoran snail Lymnaea stagnalis (L.). Proc Kon Ned Akad Wet 76C: 414–424. https: //eurekamag.com/research/023/225/023225797.php
Bobkova MV, Gál J, Zhukov VV, Shepeleva IP, Meyer-Rochow VB (2004) Variations in the Retinal Designs of Pulmonate Snails (Mollusca, Gastropoda): Squaring Phylogenetic Background and Ecophysiological Needs (I). Invertebrate Biology 123 (2): 101–115. https://doi.org/10.1111/j.1744-7410.2004.tb00146.x
Zhukov VV, Saphonov MV (2020) Activation of IP3 receptors is a component of phototransduction in gastropods retina. J Evol Biochem Physiol 56(7): 811. https://doi.org/10.31857/S0044452920072978
Maruyama T, Kanaji T, Nakade S, Kanno T, Mikoshiba K (1997) 2APB, 2-aminoethoxydiphenyl borate, a membrane-penetrable modulator of Ins(1,4,5)P3-induced Ca2+ release. J Biochem 122 (3): 498–505. https://doi.org/10.1093/oxfordjournals.jbchem.a021780
Lansman JB, Hess P, Tsien RW (1986) Blockade of current through single calcium channels by Cd2+, Mg2+, and Ca2+. Voltage and concentration dependence of calcium entry into the pore. J Gen Physiol 88 (3): 321–347. https://doi.org/10.1085/jgp.88.3.321
Dobrev D, Milde AS, Andreas K, Ravens U (1999) The effects of verapamil and diltiazem on N-, P- and Q-type calcium channels mediating dopamine release in rat striatum. Br J Pharmacol 127 (2): 576–582. https://doi.org/10.1038/sj.bjp.0702574
Laryushkin DP, Maiorov SA, Zinchenko VP, Gaidin SG, Kosenkov AM (2021) Role of L-Type Voltage-Gated Calcium Channels in Epileptiform Activity of Neurons. Int J Mol Sci 22 (19): 10342. https://doi.org/10.3390/ijms221910342
Leybaert L (2016) IP3, still on the move but now in the slow lane. Sci Signal 9 (453): fs17. https://www.science.org/doi/10.1126/scisignal.aal1929
Wang Y, Deshpande M, Payne R (2002) 2-Aminoethoxydiphenyl borate inhibits phototransduction and blocks voltage-gated potassium channels in Limulus ventral photoreceptors. Cell Calcium 32 (4): 209–216. https://doi.org/10.1016/S0143416002001562
Montell C (2012) Drosophila visual transduction. Trends Neurosci 35 (6): 356–363. https://doi.org/10.1016/j.tins.2012.03.004
Hardie RC (2012) Phototransduction mechanisms in Drosophila microvillar photoreceptors. WIREs Membr Transp Signal 1: 162–187. https://doi.org/10.1002/wmts.20
del Pilar Gomez M, Nasi E (2009) Prolonged calcium influx after termination of light-induced calcium release in invertebrate photoreceptors. J Gen Physiol 134 (3): 177–189. https://doi.org/10.1085/jgp.200910214
Van Kerkhove E, Pennemans V, Swennen Q (2010) Cadmium and transport of ions and substances across cell membranes and epithelia. Biometals 23 (5): 823–855. https://doi.org/10.1007/s10534-010-9357-6
Bootman MD, Collins TJ, Mackenzie L, Roderick HL, Berridge MJ, Peppiatt CM (2002) 2-aminoethoxydiphenyl borate (2-APB) is a reliable blocker of store-operated Ca2+ entry but an inconsistent inhibitor of InsP3-induced Ca2+ release. FASEB J 16 (10): 1145–1150. https://doi.org/10.1096/fj.02-0037rev
Prakriya M, Lewis RS (2001) Potentiation and inhibition of Ca(2+) release-activated Ca(2+) channels by 2-aminoethyldiphenyl borate (2-APB) occurs independently of IP(3) receptors. J Physiol 536 (1): 3–19. https://doi.org/10.1111/j.1469-7793.2001.t01-1-00003.x
Dickinson GD, Ellefsen KL, Dawson SP, Pearson JE, Parker I (2016) Hindered cytoplasmic diffusion of inositol trisphosphate restricts its cellular range of action. Sci Signal 9 (453): ra108. https://doi.org/10.1126/scisignal.aag1625
Zhukov VV (2007) On the problem of retinal transmitters of the freshwater mollusc Lymnaea stagnalis. J Evol Biochem Phys 43 (5): 524–532. https://doi.org/10.1134/S0022093007050118
Zylstra U (1972) Distribution and ultrastructure of epidermal sensory cells in the freshwater snail Lymnaea stagnalis and Biomphalaria pheifferi. Neth J Zool 22: 283–298. https://doi.org/10.1163/002829672X00103
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


