Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 5, стр. 410-420
ВЛИЯНИЕ ДОНОРА ОКСИДА АЗОТА S-НИТРОЗОГЛУТАТИОНА НА ЭКСПРЕССИЮ КОНСТИТУТИВНОГО АНДРОСТАНОВОГО РЕЦЕПТОРА
Ю. В. Абаленихина 1, *, Е. А. Судакова 1, А. А. Сеидкулиева 1, А. В. Щулькин 1, Е. Н. Якушева 1
1 Рязанский государственный медицинский университет имени академика И.П. Павлова
Рязань, Россия
* E-mail: abalenihina88@mail.ru
Поступила в редакцию 08.04.2022
После доработки 23.06.2022
Принята к публикации 16.07.2022
- EDN: IFMGQG
- DOI: 10.31857/S0044452922050023
Аннотация
Настоящая работа посвящена изучению механизмов регуляции конститутивного андростанового рецептора (CAR) при воздействии донора оксида азота (NO) S-нитрозоглутатиона (GSNO) in vitro. Исследование выполнено на клетках линии Сасо-2, которые инкубировали в питательной среде в присутствии S-нитрозоглутатиона (диапазон концентраций 1–500 мкМ) в течение 3, 24 и 72 ч. Относительное количество CAR оценивали методом вестерн-блот. В работе показано, что кратковременное воздействие донора NO GSNO в течение 3 и 24 ч в концентрациях 1–500 мкМ не влияло на количество CAR, а при экспозиции 72 ч с GSNO в концентрациях 1, 10 и 50 мкМ отмечалось его увеличение. Доказано, что повышение относительного количества CAR при воздействии низких концентраций GSNO (1 мкМ) реализуется через NO-цГМФ-сигнальный путь. При увеличении концентрации GSNO до 10 и 50 мкМ отмечается развитие нитрозативного стресса и регуляция CAR осуществляется через битирозин. Прогрессирование нитрозативного стресса (концентрация GSNO 100 и 500 мкМ) приводит к снижению относительного количества CAR, предположительно, вследствие повреждения его молекулы.
Конститутивный андростановый рецептор (CAR) – член суперсемейства ядерных рецепторов (NR1I3 – Nuclear Receptor Subfamily 1, Group I, Member 3, семейство орфановые рецепторы) [1], регулирующий экспрессию целевых генов и принимающий участие в защите организма от ксенобиотиков.
CAR главным образом экспрессируется в гепатоцитах и энтероцитах тонкого кишечника, где регулирует биотрансформацию лекарственных веществ [2]. Низкий уровень базальной экспрессии CAR обнаружен также в скелетных и сердечной мышцах, ткани почек и головном мозге [3, 4].
CAR в виде комплекса с шаперонами (HSP90, HSP70, HSP60) конститутивно локализуется в цитозоле клеток [5]. Взаимодействие с лигандами приводит к диссоциации CAR от шаперонов, транслокации рецептора в ядро, где он в виде гетеродимера с рецептором ретиноевой кислоты (RXR) запускает транскрипцию таргетных генов [6].
Долгое время считалось, что основной функцией CAR является индукция ферментов детоксикации ксенобиотиков в микросомальной цепи окисления – CYP2B, CYP2C, CYP3A, а также ферментов второй фазы биотрансформации уридиндифосфат глюкуронозилтрансферазы, сульфотрансферазы [7, 8]. Новые экспериментальные данные указывают на то, что функции CAR гораздо шире, чем рецептор ксенобиотиков. Показано, что CAR может принимать участие в обмене желчных кислот, билирубина, жирных кислот, стероидных гормонов, метаболизме глюкозы [9]. В связи с этим актуальным представляется изучение вопросов регуляции CAR.
Оксид азота (NO) выступает в качестве важного внутриклеточного мессенджера. Физиологической мишенью для NO является растворимая гуанилатциклаза (рГЦ) [10], которая при активации увеличивает внутриклеточную концентрацию циклического гуанозинмонофосфата (цГМФ), в результате чего активируется протеинкиназа G, кальций-кальмодулинзависимая протеинкиназа в клетках головного мозга [11] и MAP-киназа фибробластов [12].
Эндогенный NO участвует во многих жизненно важных процессах, являясь универсальным и необходимым регулятором функций клеточного метаболизма. NO ингибирует агрегацию и адгезию тромбоцитов [13], миграцию лейкоцитов [14], участвует в регуляции тонуса кровеносных сосудов [15], деятельности органов дыхания [16], желудочно-кишечного тракта [17] и мочеполовой системы [18], кроме этого NO играет важную роль в нейротрансмиссии [16, 17, 19] и в формировании иммунного ответа [20].
Известно, что NO отличается высокой реакционной способностью, благодаря наличию неспаренного электрона на внешней π-орбитали [21]. Основным продуктом окисления оксида азота являются химически инертные нитратные ионы, способные вновь превращаться в NO [22]. При взаимодействии NO с супероксид-анион радикалом образуется пероксинитрит, который оказывает не только токсическое действие, взаимодействуя с липидами, белками и ДНК, но и регуляторное, влияя на активность киназ (протеинкиназа В и С, фосфоинозид-3-киназа, митоген-активируемые протеинкиназы и др.).
Одним из продуктов нитрозативного стресса является битирозин, который образуется в результате взаимодействия пероксинитрита с тирозином. Битирозин выступает не только в качестве маркера нитрозативного стресса, но также выполняет функции сигнальной молекулы [23].
Таким образом, NO как через цГМФ-сигнальный путь, так и через продукты нитрозативного стресса (например, битирозин) может оказывать регуляторное воздействие, в том числе и на СAR.
Цель исследования – изучить влияние донора оксида азота S-нитрозоглутатиона на изменение экспрессии CAR и установить возможный механизм регуляции.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнено на линии клеток аденокарциномы ободочной кишки человека (Caco-2) (ЦКП “Коллекция культур клеток позвоночных”, Российская Федерация). Культивирование клеток проводили в инкубаторе WS-189C (“World Science”, Корея) при 37°С и 5%-ном содержании СО2, в среде Игла, модифицированной Дульбекко, (DMEM) с высоким содержанием глюкозы (4500 мг/л), с добавлением L-глутамина (4 мМ), 15% эмбриональной бычьей сыворотки, 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина (все компоненты “Sigma-Aldrich”, Германия).
Культивирование клеток осуществляли в 96-луночном планшете (“Сorning”, США) для определения жизнеспособности клеток и 6-луночных планшетах (“Сorning”, США) для оценки биохимических показателей в течение 21 суток, так как при этом сроке происходит их спонтанная дифференцировка в энтероцитоподобные клетки, экспрессирующие CAR [24].
Исследование было выполнено в три этапа:
Первый этап – оценка влияния донора оксида азота на относительное количество CAR в клетках линии Сасо-2, включал в себя две серии экспериментов:
1.1. Контрольная серия – клетки, которые инкубировали в питательной среде без добавления тестируемых веществ.
1.2. Опытная серия – S-нитрозоглутатион (GSNO, “Sigma-Aldrich”, Германия) добавляли в культуральную среду в конечных концентрациях 1, 10, 50, 100 и 500 мкМ и инкубировали в течение 3, 24 и 72 ч. При инкубации 72 ч смену питательной среды проводили каждые 24 ч.
Второй этап – изучение роли NO-цГМФ-сигнального пути в регуляции CAR, включал в себя три серии экспериментов:
2.1. Контрольная серия – клетки инкубировали в питательной среде с добавлением этанола (растворитель ODQ) в конечной концентрации 0.0001% в течение 72 ч.
2.2. Ингибирование NO-цГМФ-сигнального пути. В качестве ингибитора растворимой гуанилатциклазы использовали – 1H-[1.2.4]оксадиазоло-[4.3-а]хиноксалин-1-он (ODQ, “Sigma Aldrich”, Германия). Клетки инкубировали в питательной среде с добавлением ODQ в концентрации 10 мкМ в течение 72 ч [25].
2.3. Индукция CAR под действием GSNO – клетки инкубировали в культуральной среде, содержащей этанол в конечной концентрации 0.0001%, с добавлением GSNO (“Sigma-Aldrich”, Германия) в конечной концентрации 10 мкМ в течение 72 ч.
2.4. Влияние GSNO на количество CAR в условиях ингибирования рГЦ – клетки инкубировали с GSNO в концентрациях 1 и 10 мкМ, повышающих уровень СAR, совместно с ODQ в концентрации 10 мкМ в течение 72 ч [25]. Ингибитор добавляли в питательную срезу за 30 мин до внесения GSNO.
Третий этап – оценка влияния продукта нитрозативного стресса – битирозина на относительное количество CAR в клетках линии Сасо-2, включала две серии опытов.
3.1. Контрольная серия – клетки, которые инкубировали с питательной средой без добавления тестируемого вещества.
3.2. Опытная серия – битирозин (“Cambridge Isotope Laboratories”, Франция) добавляли к клеткам линии Caco-2 в концентрациях 0.2; 0.4; 1 и 1.5 мМ и инкубировали в течение 72 ч. Смену питательной среды проводили каждые 24 ч.
На каждый эксперимент в каждой временной точке и концентрации было выполнено по 3 повторения (n = 3).
Получение клеточных лизатов. После завершения экспериментов с клетками их снимали с лунок раствором, состоящим из 0.25% трипсина и 0.2% ЭДТА (“Sigma-Aldrich”, Германия).
Клетки в количестве 1 × 106 промывали фосфатным буфером рН 7.4 (“BioRad”, США). Далее лизировали ледяным буфером в объеме 150 мкл. Состав лизирующего буфера: 50 мМ трис-HCl (pH 7.4), 150 мМ KCl, 0.5% тритон X-100, смесь ингибиторов протеиназ (“Sigma-Aldrich”, Германия). Полученную клеточную суспензию встряхивали на шейкере и инкубировали на льду в течение 10 мин. Затем центрифугировали при 5000 g (СМ-50, “Eppendorf”, Германия) 10 мин. Цитоплазматическую фракцию переносили в отдельные пробирки и использовали для определения биохимических показателей.
Определение уровня метаболитов оксида азота (суммарная концентрация нитратов и нитритов, NOx) проводили фотоколориметрическим методом с использованием реактива Грисса (“Нева Реактив”, Россия) и хлорида ванадия (III) (“Acros organics”, Франция). Интенсивность окраски определяли на микропланшетном анализаторе Stat Fax 2100 (“Awareness Technology”, США) при длине волны 540 нм [26]. Концентрацию NOx рассчитывали по калибровочному графику, для построения которого использовали NaNO3.
Уровень пероксинитрита анализировали по интенсивности светопоглощения при длине волны 302 нм СФ 2000 (“ОКБ-спектр”, Россия). Концентрацию рассчитывали с использованием молярного коэффициента 1670 М–1 см–1 [27].
Определение концентрации битирозина осуществляли по интенсивности флуоресценции образца в фосфатном буфере (рН 7.4) при длине волны возбуждения (экстинкция) 325 нм и длине волны испускания (эмиссия) 415 нм на спектрофлуориметре Shimadzu RF-6000 (“Shimadzu Corporation”, Япония) [28].
Концентрацию метаболитов оксида азота, пероксинитрита и битирозина выражали в нмоль/мг белка.
Количество белка в пробах анализировали методом Бредфорда (Pierce Coomassie Plus (Bradford) Assay Kit, “ThermoFisher”, США) [29].
Определение количества CAR в клетках линии Сасо-2 проводили методом вестерн-блот.
После окончания экспозиции клетки снимали с лунок раствором трипсин-ЭДТА (“Sigma-Aldrich”, США), трижды промывали раствором фосфатного буфера (“BioRad”, США) и лизировали в NP40 Cell Lysis Buffer Thermo (“Thermo Fisher Scientific”, США) c добавлением смеси ингибиторов протеиназ (“Sigma-Aldrich”, США) в течение 30 мин при 4°С и постоянном перемешивании из расчета 107 клеток на 100 мкл буфера. Полученный лизат центрифугировали при 22 440 g в течение 10 мин (“AvantiJXN-3, BeckmanCoulter”, США).
Супернатант подвергали электрофорезу с использованием TGX Stain-Free FastCast Acrylamide Kit (“Bio-Rad”, США). Перед загрузкой образцы смешивали с буфером Laemmli (“Bio-Rad”, США), содержащим 50 мМ β-меркаптоэтанола (“Bio-Rad”, США) в соотношении 1:3, инкубировали 5 мин при температуре 70°C. Гели прогоняли при 100 В в течение 90 мин.
Для определения относительного количества CAR методом вестерн-блот использовали первичные мышиные моноклональные антитела (MB67 CAR Monoclonal Antibody, “Invitrogen”, США) в концентрации 1:200. Визуализацию первичных антител осуществляли с использованием вторичных кроличьих антител (Rabbit anti-Mouse IgG (H+L) Secondary Antibody, HRP, “Invitrogen”, США) в разведении 1:4000. Белки визуализировали хемилюминесценцией с помощью Chemi Doc XRS+ (“Bio-Rad”, США). Интенсивность полученных полос (бэндов) анализировали денситометрически с помощью программного обеспечения ImageLab (“Bio-Rad”, США). Количество CAR оценивали относительно содержания белка домашнего хозяйства GAPDH (первичные мышиные антитела GAPDH Loading Control Monoclonal Antibody (GA1R), DyLight 68, “Invitrogen”, США разведение 1:1000, вторичные кроличьи антитела – Rabbitanti-Mouse IgG (H+L) Secondary Antibody, HRP, “Invitrogen”, США, разведение 1:4000).
Цитотоксический тест (МТТ-тест). Клетки засевали в 96-луночный планшет из расчета 104 клеток на каждую лунку и культивировали в течение 21 сут, затем добавляли питательную среду с GSNO. После окончания инкубации в каждую лунку добавляли по 20 мкл 0.5%-ного раствора бромида 3-(4.5-диметилтиазол-2-ил)-2.5-дифенил тетразолия (МТТ) и инкубировали в течение 2 ч, затем раствор МТТ удаляли и добавляли 200 мкл 1%-ного раствора диметилсульфоксида (“ПанЭко”, Россия) [30]. Поглощение измеряли через 10 мин при 530 нм на спектрофотометре для планшетов Stat Fax 2100 (“Awareness Technology”, США).
Жизнеспособность клеток Сасо-2 в присутствии GSNO рассчитывали по формуле:
Статистический анализ. Полученные результаты обрабатывали с помощью программного обеспечения GrafPad Prism 8, Statistica 13.0 (StatSoft, Inc). Данные представлены в виде среднего арифметического значения (M) ± стандартное отклонение (SD). Для оценки статистической значимости различий использовали дисперсионный анализ (ANOVA), попарные сравнения осуществляли с помощью критерия Фишера. Статистически значимыми считали различия при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Развитие нитрозативного стресса под действием GSNO в клетках линии Caco-2.
Уровень метаболитов оксида азота возрастал при всех концентрациях GSNO (1–500 мкМ) и всех сроках эксперимента. Максимальные изменения наблюдались при концентрации 500 мкМ: при инкубации 3 ч – на 51.8% (р < 0.001) выше значений контроля, при инкубации 24 ч – на 58.9% (р < 0.001) и при инкубации 72 ч – на 68.5% (р < 0.001) (рис. 1а). При этом концентрация не изменялась в зависимости от времени инкубации.
Рис. 1.
Изменение уровня метаболитов оксида азота (а), битирозина (b), пероксинитрита (c) при воздействии S-нитрозоглутатиона в концентрациях 1–500 мкМ (M, n = 3).
* р <0.05 – статистически значимые отличия от контроля; #р <0.05 – статистически значимые отличия от группы 3 ч; ^ р <0.05 – статистически значимые отличия от группы 24 ч (тест Фишера).
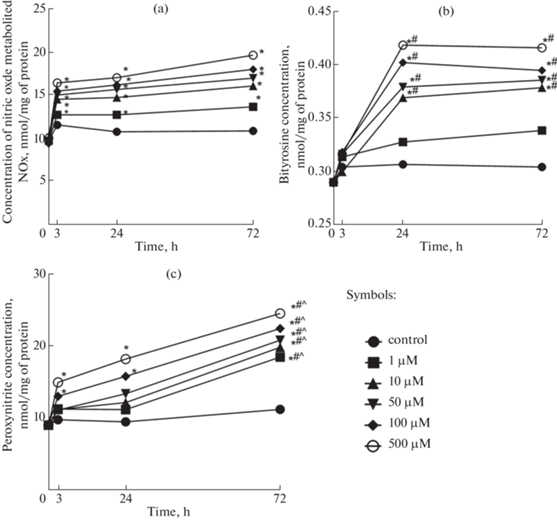
Выраженность нитрозативного стресса оценивали по уровню битирозина и пероксинитрита (рис. 1b, c). Содержание битирозина не изменялось при воздействии GSNO в концентрациях 1–500 мкМ в течение 3 ч. При экспозиции 24 ч и концентрации GSNO 1 мкМ содержание битирозина также не изменялось, а при концентрациях 10, 50, 100 и 500 мкМ увеличивалось на 18.3% (р < 0.01), 22.1% (р < 0.01), 29.4% (р < 0.01) и 34.9% (р < 0.001) по сравнению с контролем соответственно. При увеличении длительности воздействия до 72 ч количество битирозина при концентрации GSNO 1 мкМ не изменялось и возрастало при концентрациях 10 мкМ на 30.3% (р < 0.01), 50 мкМ – на 27.3% (р < 0.01), 100 мкМ – на 32.6% (р < 0.01), 500 мкМ – на 38.3% (р < 0.001) (рис. 1b).
Содержание битирозина статистически значимо увеличивалось на 16.1% (р < 0.001) и на 24.7% (р < 0.001) при инкубации с GSNO в концентрации 10 мкМ в течение 24 и 72 ч соответственно относительно экспозиции 3 ч. GSNO в концентрации 50 мкМ способствовал увеличению содержания битирозина на 13.8% (р < 0.001) и на 13.5% (р < < 0.001) при экспозиции 24 и 72 ч относительно инкубации 3ч, а в концентрации 100 мкМ – на 34.1% (р < 0.001) и 28.8% (р < 0.001). При использовании GSNO в концентрации 500 мкМ наблюдалось увеличение концентрации битирозина на 34.1% (р < 0.001) и на 30.5% (р < 0.001) при инкубации 24 и 72 ч соответственно относительно срока воздействия 3 ч.
При длительности экспозиции 3 ч GSNO увеличивал уровень пероксинитрита в концентрациях 100 и 500 мкМ на 68.1% (р < 0.01) и 92.6% (р < 0.001) соответственно (рис. 1c).
Аналогичные результаты были получены и при длительности эксперимента 24 ч: содержание пероксинитрита увеличивалось на 34.0% (р < 0.05) и 53.6% (р < 0.01) по сравнению с контролем соответственно. При увеличении длительности экспозиции до 72 ч содержание пероксинитрита возрастало при концентрациях GSNO 1 – 500 мкМ, максимально на 84.4% (р < 0.001) при концентрации 500 мкМ (рис. 1c).
Уровень пероксинитрита повышался при инкубации клеток в течение 72 ч с GSNO в концентрации 1 мкМ на 9.9% (р < 0.001) и на 8.9% (р < 0.001), 10 мкМ – на 72.9% (р < 0.01) и 72.9% (р < 0.001), 50 мкМ – на 65.9% (р < 0.001) и 68.6% (р < 0.001), 100 мкМ – на 41.8% (р < 0.001) и 72.3% (р < 0.001), 500 мкМ – на 24.3% (р < 0.01) и 50.0% (р < 0.001) относительно срока воздействия 3 и 24 ч соответственно (рис. 1c).
Цитотоксическое действие GSNO оценивалось по результатам МТТ-теста. В контрольной группе жизнеспособность клеток была принята за 100%. GSNO в концентрациях 1–500 мкМ и длительности воздействия 3 ч достоверно не влиял на жизнеспособность клеток. При воздействии GSNO в концентрациях 1–50 мкМ и длительности экспозиции 24 ч жизнеспособность клеток также не изменялась, а при концентрациях 100 и 500 мкМ снижалась до 79.9 ± 6.7% (р < 0.05) и 78.8 ± 7.2% (р < 0.05). Увеличение длительности экспозиции до 72 ч приводило к снижению жизнеспособности до 68.4 ± ± 11.4% (р < 0.001), 69.5 ± 6.1% (р < 0.001) и 50.9 ± ± 7.5% (р < 0.001) при концентрации GSNO 50, 100 и 500 мкМ соответственно (рис. 2).
Рис. 2.
Изменение жизнеспособности клеток (%) при воздействии S-нитрозоглутатиона в концентрациях 1–500 мкМ (M, n = 3).
* р < 0.05 – статистически значимые отличия от контроля; #р < 0.05 – статистически значимые отличия от группы 3 ч; ^ р < 0.05 – статистически значимые отличия от группы 24 ч (тест Фишера).
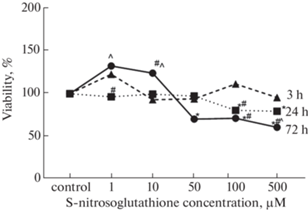
При анализе результатов в зависимости от срока инкубации были получены следующие результаты. GSNO в концентрации 100 мкМ при длительности экспозиции 24 и 72 ч снижал выживаемость клеток на 28.6% (р < 0.05) и на 37.9% (р < 0.01) относительно инкубации 3 ч, а в концентрации 500 мкМ и длительности воздействия 72 ч на 46.3% (р < 0.001) и на 35.4% (р < 0.05) относительно 3 и 24 ч экспозиции.
Таким образом, полученные данные подтверждают, что GSNO является донором NO, причем концентрации 100 и 500 мкМ при длительности экспозиции 24 ч и 50, 100 и 500 мкМ при длительности воздействия 72 ч являются токсичными для клеток линии Caco-2 [31].
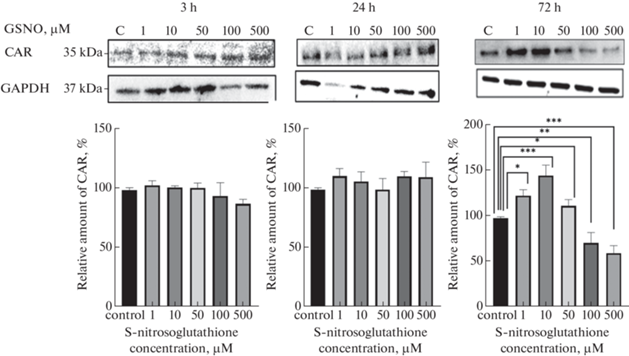
Влияние GSNO на количество CAR в клетках линии Caco-2. При воздействии GSNO на клетки линии Сaco-2 в течение 3 и 24 ч количество CAR достоверно по сравнению с контролем не изменялось (рис. 3).
При культивировании клеток линии Сасо-2 с GSNO в концентрациях 1, 10 и 50 мкМ в течение 72 ч количество CAR статистически значимо увеличивалось по сравнению с контролем на 25.5% (р < 0.05), на 47.9% (р < 0.001) и 18.7% (p < 0.05) соответственно. При повышении концентрации донора NO до 100 и 500 мкМ наблюдалось снижение количества транскрипционного фактора на 27.5% (р < 0.01) и на 38.8% (р < 0.001) соответственно относительно контрольных значений (рис. 3).
Изучение роли NO-цГМФ-сигнального пути в регуляции CAR.
Рис. 3.
Относительное количество конститутивного андростанового рецептора в клетках линии Caco-2 при воздействии S-нитрозоглутатиона в концентрациях 1 – 500 мкМ в течение 3, 24 и 72 ч (M ± SD, n = 3).
C-контроль; *р < 0.05; **р < 0.01; ***р < 0.001 по сравнению с контролем (тест Фишера).
При изучении роли NO-цГМФ-сигнального пути в регуляции CAR при воздействии GSNO в течение 72 ч были получены следующие результаты.
Ингибитор рГЦ ODQ в концентрации 10 мкМ и спирт (растворитель ODQ) не влияли на относительное количество CAR (рис. 4).
Рис. 4.
Относительное количество конститутивного андростанового рецептора в клетках линии Сасо-2 при воздействии S-нитрозоглутатиона в сочетании с ингибированием растворимой гуанилатциклазы (ODQ, 10 мкМ) в течение 72 ч.
**р < 0.01; ***р < 0.001; ****p < 0.0001 по сравнению с контролем (тест Фишера).
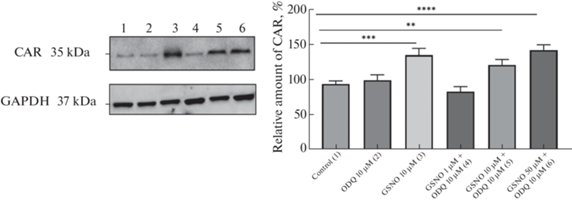
Сочетанное применение ODQ и GSNO в концентрации 1 мкМ приводило к нормализации относительного количества CAR по сравнению с контролем (индуцирующий эффект GSNO подавлялся ODQ). В то же время ODQ не влиял на стимулирующее действие GSNO в концентрациях 10 и 50 мкМ на относительное количество CAR, которое возрастало на 22.3% (р < 0.01) и 43.8% (р <0.0001) соответственно по сравнению с контролем (рис. 4).
Полученные результаты свидетельствуют о том, что индуцирующее действие GSNO в концентрации 1 мкМ на CAR реализуется через NO-цГМФ-сигнальный путь.
Оценка влияния продукта нитрозативного стресса – битирозина на относительное количество CAR в клетках линии Сасо-2.
Добавление битирозина в питательную среду в концентрации 0.4 мМ приводило к возрастанию относительного количества CAR на 26.2% (р < 0.001), в концентрации 1 мМ – на 13.1% (р < 0.01) по сравнению с контролем, а в концентрациях 0.2 и 1.5 мМ не оказывало эффекта (рис. 5).
Рис. 5.
Относительное количество конститутивного андростанового рецептора в клетках линии Сасо-2 при воздействии битирозина в концентрациях 0.2, 0.4, 1, 1.5 мМ в течение 72 ч (M ± SD, n = 3).
C – контроль; ***p < 0.001; **p < 0.01 по сравнению с контролем (тест Фишера).
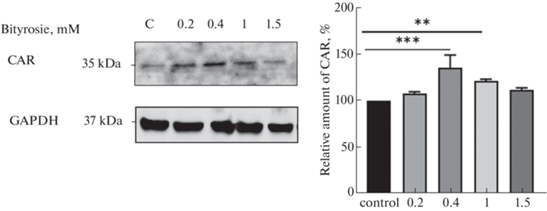
Полученные результаты свидетельствуют о том, что продукт нитрозативного стресса – битирозин участвует в регуляции экспрессии CAR.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
GSNO представляет собой S-нитрозированное производное глутатиона и является физиологической эндогенной молекулой-носителем NO. Гомеостатический уровень GSNO в клетке низкий, поскольку он быстро и необратимо разлагается на NO и глутатион при участии фермента S-нитрозоглутатионредуктазы (КФ 1.2.1.1.46) [32].
GSNO не проникает в клетки напрямую, однако его добавление вызывает повышение внутриклеточных уровней S-нитрозотиолов. Предполагается, что GSNO диссоциирует во внеклеточном пространстве с высвобождением NO, который затем может диффундировать через клеточную мембрану [33]. Также описан независимый от NO механизм его проникновения внутрь клеток. Нитрозогруппа от GSNO переносится на цистеин с образованием S-нитрозоцистеина, который способен проникать внутрь клеток через систему транспортера аминокислот [34]. S-нитрозоцистеин внутри клеток может либо вновь нитрозилировать глутатион с образованием GSNO, либо непосредственно нитрозилировать тиолы белков и запускать сигнальные каскады.
GSNO считается важным медиатором сигнальных механизмов NO, однако его эффект зависит от концентрации и времени воздействия: концентрации от 1 до 100 мкМ оказывают регуляторное действие [35, 36], а концентрации выше 500 мкМ являются токсичными [37].
Анализ литературных данных и определил рабочий диапазон концентраций GSNO 1–500 мкМ. Полученные результаты демонстрируют, что добавление GSNO к клеткам линии Caco-2 вызывает повышение содержания метаболитов NO в лизате клеток, что свидетельствует об адекватности используемой экспериментальной модели.
В представленном исследовании было показано, что воздействие GSNO в концентрациях 1, 10 и 50 мкМ на клетки линии Сасо-2 в течение 72 ч приводило к увеличению относительного количества CAR. В дальнейшем в ходе работы были изучены возможные механизмы данного явления.
Экспрессия CAR может изменяться в результате белок-белковых взаимодействий (Src-семейство киназ [38], ретиноидный Х рецептор [39], шаперон 90 [40, 41]), посттрансляционной модификации (фосфорилирование [42], убиквинтирование [5]), транскрипционной и посттранскрипционной регуляции (метилирование) [43].
При воздействии GSNO на клетки линии Сасо-2 возможны механизмы регуляции: через NO-цГМФ-сигнальный путь (NO-зависимый), а также через продукты нитрозативного стресса (битирозин-зависимый).
Основной физиологической мишенью для NO в организме является рГЦ, которая катализирует биосинтез из гуанозинтрифосфата (ГТФ) циклического гуанозинмонофосфата (цГМФ). цГМФ – это универсальная внутриклеточная сигнальная молекула, присутствующая в большинстве типе клеток [44].
Важно отметить, что GSNO в концентрации 1 мкМ в течение 72 ч вызывал повышение уровня метаболитов NO и пероксинитрита, что свидетельствует о генерации NO, однако содержание битирозина при этом не изменялось. Следовательно, регуляция CAR в этих условиях осуществляется посредством NO и маловероятна при участии битирозина.
В ходе настоящего исследования с помощью специфического ингибитора растворимой гуанилатциклазы – ODQ было показано, что повышение уровня CAR при воздействии GSNO в концентрации 1 мкМ реализуется через NO-ГЦ-цГМФ сигнальный путь.
Дальнейшее увеличение концентрации GSNO (10 и 50 мкМ) приводило к увеличению уровня метаболитов NO, образованию пероксинитрита и повреждению белковых молекул по тирозину.
Нитрозилирование тирозина представляет собой наиболее специфичную окислительную модификацию. Нитротирозин частично диссоциирует до фенолята, но основное его количество конденсируется до 3.3-дитирозина (битирозина) [45]. Доказано, что образование битирозина превалирует над нитротирозином при длительном воздействии и/или более высоком уровне активных форм азота, что позволяет рассматривать его в качестве маркера нитрозативного стресса [46].
Поэтому на следующем этапе исследования изучался другой потенциальный механизм регуляции через продукт нитрозативного стресса – битирозин.
Прямое воздействие битирозина в концентрациях 0.4 и 1 мМ на клетки линии Сасо-2 приводило к увеличению относительного количества CAR, что указывает на участие продукта нитрозативного стресса в регуляции данного орфанного рецептора. Сигнальная роль битирозина согласуется с данными литературы [47, 48].
При усугублении нитрозативного стресса (воздействие GSNO в концентрациях 100 и 500 мкМ) наблюдались снижение жизнеспособности клеток и уменьшение относительного количества CAR.
Конститутивный андростановый рецептор состоит из 301 аминокислоты, из них 33 приходится на формирование лиганд-связывающего кармана. Аминокислоты, выстилающие и окружающие лиганд-связывающий карман, идентифицированы как наиболее важные и определяющие активность CAR [49].
При усугублении нитрозативного стресса происходит взаимодействие пероксинитрита с аминокислотными остатками белков. Пероксинитрит проявляет высокую реакционную активность в отношении следующих аминокислот: цистеин, триптофан, метионин, тирозин. Можно предположить, что изменение относительного количества СAR может объясняться его структурной модификацией – нитрозилированием цистеина (292), триптофана (283, 305), метионина (241, 272, 316, 418) и тирозина (283, 311, 399), входящих в состав лигандсвязывающего кармана CAR.
Таким образом, нами показано, что воздействие донора NO GSNO в течение 3 и 24 ч в концентрациях 1–500 мкМ не влияет на количество CAR. Увеличение длительности экспозиции до 72 ч приводит к увеличению относительного количества CAR при экспозиции с GSNO в концентрациях 1, 10 и 50 мкМ, при этом регуляция осуществляется по разным механизмам.
Повышение относительного количества CAR при воздействии низких концентраций GSNO (1 мкМ) реализуется через NO-цГМФ-сигнальный путь, а при увеличении концентрации GSNO до 10 и 50 мкМ отмечается развитие нитрозативного стресса, и регуляция осуществляется через продукт нитрования – битирозин. В условиях прогрессирование нитрозативного стресса, вызванного GSNO в концентрации 100–500 мкМ, относительное количество CAR снижается, что, вероятно, связано с повреждением его молекулы.
Список литературы
Kachaylo EM, Pustylnyak VO, Lyakhovich VV, Gu-lyaeva LF (2011) Constitutive androstane receptor (CAR) is a xenosensor and target for therapy. Biochemistry (Mosc) 76 (10): 1087–1097. https://doi.org/10.1134/S0006297911100026
Qatanani M, Moore DD (2005) CAR, the continuously advancing receptor, in drug metabolism and disease. Current Drug Metabolism 6 (4): 329–339. https://doi.org/10.2174/1389200054633899
Timsit YE, Negishi M (2007) CAR and PXR: the xenobiotic-sensing receptors. Steroids 72: 231–246. https://doi.org/10.1016/j.steroids.2006.12.006
Nishimura M, Naito S, Yokoi T (2004) Tissue-specific mRNA expression profiles of human nuclear receptor subfamilies. Drug Metab Pharmacokinet 19 (2): 135–149. https://doi.org/10.2133/dmpk.19.135
Timsit YE, Negishi M (2014) Coordinated regulation of nuclear receptor CAR by CCRP/DNAJC7, HSP70 and the ubiquitin-proteasome system. PLoS One 9 (5): e96092. https://doi.org/10.1371/journal.pone.0096092
Kakizaki S, Yamamoto Y, Ueda A, Moore R, Sueyoshi T, Negishi M (2003) Phenobarbital induction of drug/steroid-metabolizing enzymes and nuclear receptor CAR. Biochim Biophys Acta 1619 (3): 239–242. https://doi.org/10.1016/s0304-4165(02)00482-8
He L, Wu J, Tang W, Zhou X, Lin Q, Luo F, Yin Y, Li T (2018) Prevention of oxidative stress by α-ketoglutarate via activation of car signaling and modulation of the expression of key antioxidant-associated targets in vivo and in vitro. J Agric Food Chem 66 (43): 11273–11283. https://doi.org/10.1021/acs.jafc.8b04470
Yang H, Wang H (2014) Signaling control of the constitutive androstane receptor (CAR). Protein Cell 5 (2): 113–123. https://doi.org/10.1007/s13238-013-0013-0
Lynch C, Pan Y, Li L, Heyward S, Moeller T, Swaan PW, Wang H (2014) Activation of the constitutive androstane receptor inhibits gluconeogenesis without affecting lipogenesis or fatty acid synthesis in human hepatocytes. Toxicol Appl Pharmacol 279 (1): 33–42. https://doi.org/10.1016/j.taap.2014.05.009
Abalenikhina YV, Kosmachevskaya OV, Topunov AF (2020) Peroxynitrite: toxic agent and signaling molecule (review). Appl Biochem Microbiol 56: 611–623. https://doi.org/10.1134/S0003683820060022
Araki S, Osuka K, Takata T, Tsuchiya Y, Watanabe Y (2020) Coordination between calcium/calmodulin-dependent protein kinase II and neuronal nitric oxide synthase in neurons. Int J Mol Sci 21: 7997. https://doi.org/10.3390/ijms21217997
Browning DD, McShane MP, Marty C, Ye RD (2000) Nitric oxide activation of p38 mitogen-activated protein kinase in 293T fibroblasts requires cGMP-dependent protein kinase. J Biol Chem 275 (4): 2811–2816. https://doi.org/10.1074/jbc.275.4.2811
Bladowski M, Gawrys J, Gajecki D, Szahidewicz-Krupska E, Sawicz-Bladowska A, Doroszko A (2020) Role of the platelets and nitric oxide biotransformation in ischemic stroke: a translative review from bench to bedside. Oxid Med Cell Longev 28: 2979260. https://doi.org/10.1155/2020/2979260
Saini R, Azam Z, Sapra L, Srivastava RK (2021) Neuronal nitric oxide synthase (nNOS) in neutrophils: an insight. Rev Physiol Biochem Pharmacol 180: 49–83. https://doi.org/10.1007/112_2021_61
Zweier JL, Ilangovan G (2020) Regulation of nitric oxide metabolism and vascular tone by cytoglobin. Antioxid Redox Signal 32 (16): 1172–1187. https://doi.org/10.1089/ars.2019.7881
Antosova M, Mokra D, Pepucha L, Plevkova J, Buday T, Sterusky M, Bencova A (2017) Physiology of nitric oxide in the respiratory system. Physiol Res 66 (Suppl 2): 159–172. https://doi.org/10.33549/physiolres.933673
Sanders KM, Ward SM (2019) Nitric oxide and its role as a non-adrenergic, non-cholinergic inhibitory neurotransmitter in the gastrointestinal tract. Br J Pharmacol 176 (2): 212–227. https://doi.org/10.1111/bph.14459
Ahmad A, Dempsey SK, Daneva Z, Azam M, Li N, Li PL, Ritter JK (2018) Role of nitric oxide in the cardiovascular and renal systems. Int J Mol Sci 19 (9): 2605. https://doi.org/10.3390/ijms19092605
Garthwaite J (2019) NO as a multimodal transmitter in the brain: discovery and current status. Br J Pharmacol 176 (2): 197–211. https://doi.org/10.1111/bph.14532
Mazurek M, Rola R (2021) The implications of nitric oxide metabolism in the treatment of glial tumors. Neurochem Int 150: 105172. https://doi.org/10.1016/j.neuint.2021.105172
Lancaster JR (2015) Nitric oxide: a brief overview of chemical and physical properties relevant to therapeutic applications. Future Sci OA 1 (1): FSO59. https://doi.org/10.4155/fso.15.59
Гуманова НГ (2021) Оксид азота и его циркулирующие метаболиты NOх, их роль в функционировании человеческого организма при прогнозе риска сердечно-сосудистой смерти (Часть II). Профилакт мед 24 (10): 119–125. [Gumanova NG (2021) Nitrogen oxide and its circulating NOх metabolites, their role in human body functioning and cardiovascular death risk prediction (Part II). Russ J Preventiv Med 24 (10): 199–125. (In Russ)]. https://doi.org/10.17116/profmed202124101119
Koseki K, Yamamoto A, Tanimoto K, Okamoto N, Teng F, Bito T, Yabuta Y, Kawano T, Watanabe F (2021) Dityrosine crosslinking of collagen and amyloid-β peptides is formed by vitamin B12 deficiency-generated oxidative stress in Caenorhabditis elegans. Int J Mol Sci 22 (23): 12959. https://doi.org/10.3390/ijms222312959
Li AP (2020) In vitro human cell-based experimental models for the evaluation of enteric metabolism and drug interaction potential of drugs and natural products. Drug Metab Dispos 48 (10): 980–992. https://doi.org/10.1124/dmd.120.000053
Hwang TL, Wu CC, Teng CM (1998) Comparison of two soluble guanylyl cyclase inhibitors, methylene blue and ODQ, on sodium nitroprusside-induced relaxation in guinea-pig trachea. Br J Pharmacol 125 (6): 1158–1163. https://doi.org/10.1038/sj.bjp.0702181
Метельская ВА, Гуманова НГ (2005) Скрининг – метод определения уровня метаболитов оксида азота сыворотке человека. Клин лаб диагност 6: 15–18. [Metelskaya VA, Gumanova NG (2005) Screening method for determining the level of nitric oxide metabolites in human serum. Clin Lab Diagnost 6: 15–18. (In Russ)].
Лобышева ИИ, Сереженков ВА, Ванин АФ (1999) Взаимодействие динитрозильных тиолсодержащих комплексов железа с пероксинитритом и перекисью водорода in vitro. Биохимия 64 (2): 194–200. [Lobysheva II, Serezhenkov VA, Vanin AF (1999) Interaction of dinitrosyl thiol-containing iron complexes with peroxynitrite and hydrogen peroxide in vitro. Biochemistry 64 (2): 194–200. (In Russ)].
Amado R, Aeschbach R, Neukom H (1984) Dytirosine: in vitro production and characterization. Methods Enzymol 107: 377–388. https://doi.org/10.1016/0076-6879(84)07026-9
Bradford M.M. (1976) A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analyt Biochem 72: 248–254. https://doi.org/10.1006/abio.1976.9999
Tolosa L, Donato MT, Gómez-Lechón MJ (2015) General cytotoxicity assessment by means of the MTT assay. Methods Mol Biol 1250: 333–348. https://doi.org/10.1007/978-1-4939-2074-7_26
Абаленихина ЮВ, Судакова ЕА, Сеидкулиева АА, Щулькин АВ, Якушева ЕН (2021) Функционирование прегнан Х рецептора в условиях нитрозативного стресса. Биомед химия 67 (5): 394–401. [Abalenikhina YV, Sudakova EA, Seidkulieva AA, Shchulkin AV, Yakusheva EN (2021) Functioning of pregnan X receptor under conditions of nitrosative stress. Biomed Khim 67 (5): 394–401. (In Russ)]. https://doi.org/10.18097/PBMC20216705394
Rizza S, Giglio P, Faienza F, Filomeni G (2019) Therapeutic application of nitric oxide in cancer and inflammatory disorders. Elsevier Inc. https://doi.org/10.1016/B978-0-12-816545-4.00009-8
Ramachandran N, Root P, Jiang XM, Hogg PJ, Mutus B (2001) Mechanism of transfer of NO from extracellular S-nitrosothiols into the cytosol by cell-surface protein disulfide isomerase. Proc Natl Acad Sci U S A 98 (17): 9539–9544. https://doi.org/10.1073/pnas.171180998
Ramachandran N, Root P, Jiang XM, Hogg PJ, Mutus B (2001) Mechanism of transfer of NO from extracellular S-nitrosothiols into the cytosol by cell-surface protein disulfide isomerase. Proc Natl Acad Sci U S A 98: 9539–9544. https://doi.org/10.1073/pnas.171180998
Zhang Y, Sun C, Xiao G, Shan H, Tang L, Yi Y, Yu W, Gu Y (2019). S-nitrosylation of the Peroxiredoxin-2 promotes S-nitrosoglutathione-mediated lung cancer cells apoptosis via AMPK-SIRT1 pathway. Cell Death Dis 10 (5): 329. https://doi.org/10.1038/s41419-019-1561-x
Kim J, Islam SMT, Qiao F, Singh AK, Khan M, Won J, Singh I (2021) Regulation of B cell functions by S-nitrosoglutathione in the EAE model. Redox Biol 45: 102053. https://doi.org/10.1016/j.redox.2021.102053
Mussbacher M, Stessel H, Pirker T, Gorren ACF, Mayer B, Schrammel A (2019) S-nitrosoglutathione inhibits adipogenesis in 3T3-L1 preadipocytes by S-nitrosation of CCAAT/enhancer-binding protein β. Sci Rep 9 (1): 15403. https://doi.org/10.1038/s41598-019-51579-x
Chen T, Chen Q, Xu Y, Zhou Q, Zhu J, Zhang H, Wu Q, Xu J, Yu C (2011) SRC-3 is required for CAR-regulated hepatocyte proliferation and drug metabolism. J Hepatol 56 (1): 210–217. https://doi.org/10.1016/j.jhep.2011.07.015
Suino K, Peng L, Reynolds R, Li Y, Cha JY, Repa JJ, Kliewer SA, Xu HE (2004) The nuclear xenobiotic receptor CAR: structural determinants of constitutive activation and heterodimerization. Mol Cell 16 (6): 893–905. https://doi.org/10.1016/j.molcel.2004.11.036
Yoshinari K, Kobayashi K, Moore R, Kawamoto T, Negishi M (2003) Identification of the nuclear receptor CAR: HSP90 complex in mouse liver and recruitment of protein phosphatase 2A in response to phenobarbital. FEBS Letters 548 (1–3): 17–20. https://doi.org/10.1016/s0014-5793(03)00720-8
Kanno Y, Miyama Y, Ando M, Inouye Y (2010) Dependence on the microtubule network and 90-kDa heat shock protein of phenobarbital-induced nuclear translocation of the rat constitutive androstane receptor. Mol Pharmacol 77 (2): 311–316. https://doi.org/10.1124/mol.109.060434
Chen T, Laurenzana EM, Coslo DM, Chen F, Omiecinski CJ (2014) Proteasomal interaction as a critical activity modulator of the human constitutive androstane receptor. Biochem J 458 (1): 95–107. https://doi.org/10.1042/BJ20130685K
Scopino K, Dalgarno C, Nachmanoff C, Krizanc D, Thayer KM, Weir MP (2021) Arginine methylation regulates ribosome CAR function. Int J Mol Sci 22 (3): 1335. https://doi.org/10.3390/ijms22031335
Tejero J, Shiva S, Gladwin MT (2019) Sources of vascular nitric oxide and reactive oxygen species and their regulation. Physiol Rev 99 (1): 311–379. https://doi.org/10.1152/physrev.00036.2017
Ferrer-Sueta G, Campolo N, Trujillo M, Bartesaghi S, Carballal S, Romero N, Alvarez B, Radi R (2018) Biochemistry of peroxynitrite and protein tyrosine nitration. Chem Rev 118 (3): 1338–1408. https://doi.org/10.1021/acs.chemrev.7b0056846
Boer TR, Palomino RI, Mascharak PK (2019) Peroxynitrite-mediated dimerization of 3-nitrotyrosine: unique chemistry along the spectrum of peroxynitrite-mediated nitration of tyrosine. Med One 4: e190003. https://doi.org/10.20900/mo.20190003
Lu Y, Ma S, Tang X, Li B, Ge Y, Zhang K, Yang S, Zhao Q, Xu Y, Ren H. (2020) Dietary dityrosine induces mitochondrial dysfunction by diminished Thyroid Hormone Function in Mouse Myocardia. J Agric Food Chem. 26; 68(34): 9223–9234. https://doi: 10.1021/acs.jafc.0c03926
Lu Y, Ma S, Tang X, Li B, Ge Y, Zhang K, Yang S, Zhao Q, Xu Y, Ren H. (2020) Dietary Dityrosine Induces Mitochondrial Dysfunction by Diminished Thyroid Hormone Function in Mouse Myocardia. J Agric Food Chem 68 (34): 9223–9234. https://doi.org/10.1021/acs.jafc.0c03926
Mathäs M, Nusshag C, Burk O, Gödtel-Armbrust U, Herlyn H, Wojnowski L, Windshügel B (2014) Structural and functional similarity of amphibian constitutive androstane receptor with mammalian pregnane X receptor. PloS One 9 (5): e96263. https://doi.org/10.1371/journal.pone.0096263
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


