Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 5, стр. 421-433
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА МЕХАНИЧЕСКИХ СВОЙСТВ КАПСУЛЫ БРЫЖЕЕЧНЫХ ЛИМФАТИЧЕСКИХ УЗЛОВ МОЛОДЫХ И СТАРЕЮЩИХ БЫКОВ
Г. И. Лобов 1, *, М. Е. Косарева 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: lobovgi@infran.ru
Поступила в редакцию 31.05.2022
После доработки 27.07.2022
Принята к публикации 02.08.2022
- EDN: ZCGHJO
- DOI: 10.31857/S0044452922050072
Аннотация
Эффективность системы транспорта лимфы влияет не только на баланс интерстициальной жидкости, но и на другие аспекты гомеостаза. Известно, что транспорт лимфы из интерстициального пространства в магистральные вены обеспечивается преимущественно ритмическими сокращениями сегментов лимфатических сосудов – лимфангионов. При этом в сеть лимфатических сосудов последовательно встроены лимфатические узлы, роль которых в транспорте лимфы изучена слабо. Целями данной работы были исследования соотношения длина – натяжение в капсуле брыжеечных лимфатических узлов быка и расчет величины давления, которое способны генерировать лимфатические узлы, а также сопоставление активных и пассивных механических характеристик капсулы лимфатических узлов молодых и стареющих животных. Эксперименты на изолированных капсулах лимфатических узлов показали, что лимфатические узлы являются хорошо растяжимыми структурами, что позволяет им беспрепятственно заполняться лимфой даже на максимуме лимфообразования. Наши данные показывают, что брыжеечные лимфатические узлы быка обладают способностью регулировать ток лимфы по ним посредством внутренних механизмов. Гладкомышечные клетки капсулы лимфатических узлов чувствительны к растяжению, что проявляется в возрастании силы сокращений при увеличении растяжения капсулы. Лимфатические узлы способны генерировать высокое активное давление при значительном увеличении объема и пассивного давления. Растяжимость капсулы лимфатических узлов стареющих быков и активное давление, развиваемое ими в процессе спонтанных сокращений, снижены по сравнению с аналогичными показателями лимфатических узлов молодых животных. В совокупности, в данной работе представлены первые измерения и анализ соотношения длина – натяжение в капсуле и диаметр – давление в брыжеечных лимфатических узлах молодых и стареющих быков.
В организме позвоночных функционируют две сосудистые системы: кровеносная и лимфатическая. Кровеносная система необходима для обмена воды, солей, кислорода, питательных веществ, гормонов и представляет собой замкнутый круг кровообращения с централизованным насосом. Напротив, лимфатическая сосудистая сеть является открытой системой однонаправленного транспорта с низким давлением, ответственной за реабсорбцию и доставку компонентов интерстициальной жидкости из тканей в венозный отдел кровеносной системы. Транспорт лимфы децентрализован и осуществляется лимфатическими сосудами [1, 2]. Наличие лимфатической сосудистой системы у млекопитающих с их высоким давлением в кровеносных сосудах является обязательным условием для оптимальной гидратации тканей. Во всех тканях в сосудах микроциркуляторного русла фильтрация преобладает над реабсорбцией [3], что в отсутствие дренирующей лимфатической системы могло бы привести к накоплению в интерстициальном пространстве значительного объема жидкости (у человека за сутки до 8–12 л) и отеку [4]. Избыток жидкости реабсорбируется из межклеточного пространства лимфатическими капиллярами. Вместе с водой из интерстиция в лимфатические капилляры поступает широкий спектр различных молекул, профильтрованных из плазмы крови или синтезированных клетками тканей. Из лимфатических капилляров лимфа переходит в собирательные лимфатические сосуды и коллекторы, которые обеспечивают возврат капиллярного ультрафильтрата и внесосудистых белков в кровеносную систему.
Важнейшей функцией лимфатической системы является участие в иммунных реакциях. В составе лимфы (в особенности, кишечной) содержатся тысячи антигенов (аутоантигенов, антигенов из состава пищи и антигенов комменсальной флоры) [5]. Лимфатическая система реализует и контролирует аутотолерантность и иммунный ответ на эти антигены несколькими способами: управление проникновением антигена/дендритных клеток в лимфатические капилляры на периферии; доставку антигена/дендритных клеток по афферентным лимфатическим сосудам в лимфатические узлы (ЛУ); презентацию антигена в ЛУ с участием лимфатических эндотелиальных клеток и клеток стромы ЛУ; регуляция выхода лимфоцитов из ЛУ [2].
Для реализации своих функций лимфатическая система должна иметь эффективную и хорошо регулируемую систему транспорта лимфы. Несмотря на то что исследования лимфатической системы в последние годы развиваются быстрыми темпами [6, 7], механизмы лимфотока и регуляции транспорта лимфы все еще остаются менее изученными по сравнению с кровеносной системой [1, 8]. К настоящему времени установлено, что продвижение лимфы по лимфатическим сосудам осуществляется за счет внешних и внутренних сил. Внешний механизм эффективно функционирует в органах, подвергающихся периодической компрессии (органы грудной и брюшной полостей, скелетные мышцы) [9]. Однако важнейшим механизмом, обеспечивающим движение лимфы по лимфатическим сосудам, является внутренний механизм, именно он является основным источником периодического градиента давления, способствующего лимфотоку [1, 8]. Внутренний механизм накачки лимфы реализуется за счет мощных фазных сокращений гладкомышечных клеток стенки лимфатических сосудов и наличия в них клапанов. Сегменты лимфатических сосудов, называемые лимфангионами, ритмично сокращаясь, эффективно перекачивают лимфу против неблагоприятного градиента давления [10–12].
Количество лимфы, образующейся в тканях, существенно варьирует и в зависимости от активности органов может изменяться в 10–15 раз [13]. Лимфатические сосуды имеют сложную многоконтурную регуляцию (миогенную, эндотелийзависимую, регуляцию с участием химических веществ), благодаря которой их активная транспортная функция изменяется в соответствии с уровнем лимфообразования [14, 15]. Эффективная система регуляции позволяет лимфатическим сосудам эффективно перекачивать значительные объемы лимфы как в физиологических условиях, так и при патологии, обеспечивая тем самым оптимальную гидратацию тканей.
Обязательными элементами лимфатической системы млекопитающих являются ЛУ, их число у человека составляет от 500 до 600 [16]. ЛУ в эмбриональном периоде формируются из лимфатических сосудов, по мере развития они значительно увеличиваются по сравнению с лимфатическими сосудами, заселяются различными клетками и на протяжении жизни выполняют функцию иммунного надзора. ЛУ располагаются в точках схождения афферентных лимфатических сосудов и включены в лимфатическую сосудистую сеть таким образом, что весь объем образующейся в организме лимфы обязательно проходит через один, а чаще – через несколько ЛУ, которые действуют как фильтры патогенов, места встречи антигенпрезентирующих клеток и лимфоцитов, а также как среда для клональной экспансии антигенспецифических Т- и В-лимфоцитов [17, 18]. Антигены и дендритные клетки поступают в ЛУ по лимфатическим сосудам, а лимфоциты – через стенку венул с высоким эндотелием [19]. Исследования иммунных реакций, происходящих в ЛУ, стремительно развиваются, ежегодно публикуются сотни работ. При этом механизмы лимфотока по ЛУ и его регуляция изучены слабо [20, 21].
Основополагающими характеристиками, определяющими реакции органов, имеющих в своем составе гладкомышечные клетки, на различные стимулы, являются механические свойства их стенки [22]. В частности, механические свойства оказывают основное влияние на сократительную функцию кровеносных и лимфатических сосудов [23, 24]. Механические свойства лимфатических сосудов различных регионов разных животных и человека подробно описаны в нескольких работах [25–27]. В ЛУ активным элементом, обеспечивающем продвижение лимфы по синусам ЛУ, является капсула, покрывающая ЛУ снаружи и состоящая из коллагеновых и эластических волокон, формирующих трехмерную сеть, с включенными в нее пучками гладкомышечных клеток [28, 29]. Механические свойства капсулы ЛУ не изучены, соответственно также отсутствуют данные об изменениях механических свойств капсулы ЛУ и ее сократительной функции в зависимости от возраста. Между тем, морфологические исследования показывают, что по мере старения количество соединительной ткани в ЛУ увеличивается [30], участки ЛУ, населенные иммунными клетками, замещаются соединительной тканью, в капсуле и паренхиме ЛУ развиваются фиброз и липоматоз [31, 32].
Цели нашего исследования были двоякими. Во-первых, учитывая ограниченное количество данных о сократительной функции капсулы ЛУ, ее важность для продвижения лимфы по синусам ЛУ и отсутствие информации о чувствительности гладкомышечных клеток капсулы к растяжению, мы поставили задачу исследовать соотношение длина – натяжение в капсуле брыжеечных ЛУ быка и рассчитать величину давления, которое способны генерировать ЛУ. Во-вторых, учитывая выраженные морфологические изменения ЛУ, развивающиеся с возрастом, сопоставить активные и пассивные механические характеристики капсулы ЛУ молодых и стареющих животных.
МЕТОДЫ ИССЛЕДОВАНИЯ
Для исследования забирали брыжеечные ЛУ второго порядка у молодых (18–20 мес) быков (n = 14) и быков в возрасте 7–8 лет (n = 8), которых ветеринары считают стареющими [33]. Исследование было одобрено этической комиссией Института физиологии им. И.П. Павлова РАН. Забор материала для исследований осуществляли в цехе забоя животных племенного завода “Приневское”. ЛУ извлекали из брыжейки через 10–12 мин после обескровливания животных и доставляли в лабораторию в холодном (2–4°С) физиологическом солевом растворе (PSS), состав которого представлен ниже. В лаборатории из капсулы ЛУ на стороне, противоположной воротам ЛУ, вырезали фрагменты капсулы и хранили их до исследования в холодильнике в PSS на льду. Перед исследованием из фрагментов капсулы вырезали полоски шириной 2 мм, в направлении от ворот к выпуклой части ЛУ (рис. 1а). Все полоски имели одинаковые размеры и были вырезаны в одинаковых местах капсулы ЛУ. К обоим концам полосок прикрепляли шелковые лигатуры таким образом, чтобы расстояние между ними составляло 5 мм. Размеры полосок определяли под микроскопом МССО (ЛОМО, Россия) с измерительным окуляром. Подготовленные полоски помещали в камеру миографа с датчиком силы FORT – 10 (WPI, США). Одну лигатуру прикрепляли к штоку датчика, а вторую – к микроманипулятору с микрометром. Через камеру миографа постоянно протекал PSS следующего состава (мМ: NaCl – 120.4; KCl – 5.9; CaCl2 – 2.5; MgCl2 – 1.2; NaH2PO4 – 1.2; NaHCO3 – 15.5; глюкоза – 11.5 (все вещества химически чистые, производства Химпром, Россия) + 10 г/л очищенного бычьего сывороточного альбумина (Merck, Sigma-Aldrich)). Раствор аэрировали газовой смесью, состоящей из 95% О2 и 5% СО2. Температуру раствора поддерживали на уровне 38 ± 0.1°С, рН 7.40 ± 0.02. Сигнал от датчика поступал на вход усилителя INA333 (Texas Instruments Incorporated), затем – в сигма – дельта АЦП, встроенный в микроконтроллер STM32F373 (STMicroelectronics). Далее поток данных с частотой 50 Гц поступал на USB – порт компьютера. Программа регистрации (С++) обеспечивала непрерывную запись информации с датчика на протяжении всего эксперимента.
Рис. 1.
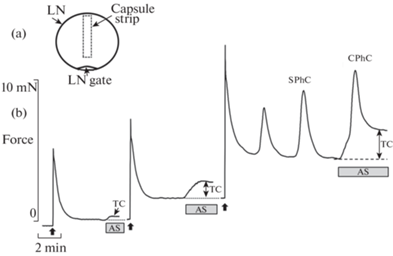
Динамика развития силы в полоске капсулы брыжеечного ЛУ молодого быка при пошаговом увеличении длины: a – схема ЛУ и расположение полоски капсулы в ЛУ, используемой в экспериментах, b – оригинальная кривая, иллюстрирующая реакции полоски капсулы ЛУ при пошаговом ее удлинении. По завершении релаксации после каждого шага растяжения на полоску действовали активирующим раствором (AS). TC– тоническое сокращение, SPhC – спонтанное фазное сокращение, CPhC– фазное сокращение, вызванное действием активирующего раствора. Вертикальные стрелки показывают момент удлинения полоски. Разрывы на кривой соответствуют 15 мин действия PSS до восстановления исходного уровня тонуса.
Полоски капсулы ЛУ уравновешивали в ненагруженном состоянии на протяжении 40 мин. Затем пошагово (с шагом 500 мкм) увеличивали длину полосок с помощью микроманипулятора. После завершения релаксации и установления стабильного уровня силы полоски активировали раствором (AS), в котором весь Na+ был заменен на К+ с добавлением 20 мкМ норадреналина (Norepinephrine bitartrate, Sigma-Aldrich). АS действовал до развития полосками максимальной силы. Затем АS в камере миографа заменяли на проточный PSS до восстановления исходного уровня тонуса. Растяжение – активацию полосок капсулы ЛУ повторяли до уменьшения активной силы до 60% от максимальной. После каждого шага увеличения длины измеряли пассивное натяжение и после активации – общее натяжение (при фазном и тоническом сокращении). Активное натяжение рассчитывали путем вычитания из общего натяжения величины пассивного натяжения. Полученные данные в последующем переводили в натяжение на единицу длины посредством деления зарегистрированной силы (в Н) на длину полоски (в м). На основании полученных данных были построены графики зависимости пассивного, активного и общего натяжения от длины. Для сравнения натяжений среди полосок капсулы ЛУ разного диаметра, длину полосок (L) нормализовали к оптимальной длине (Lo), при которой полоски капсулы генерировали максимальное активное натяжение. Соответственно длину полоски на графиках выражали как отношение реальной длины полоски к Lo (L/Lo). Диаметр ЛУ при построении графиков расчетного давления определяли в соответствии с данными о диаметре ЛУ до вырезания полосок капсулы и рассчитывали по формуле $D = \frac{{{\text{Dисх}} \times L}}{{{\text{Lисх}}}}$, где D – расчетный диаметр ЛУ, соответствующий длине полоски капсулы после растяжения, Dисх – диаметр ЛУ до препарирования, Lисх – длина полоски капсулы ЛУ до растяжения, L – длина полоски после растяжения. Величины трансмурального давления были получены из значений напряжения и диаметра с использованием закона Лапласа с учетом толщины капсулы и рассчитаны по формуле: $P = T \times \frac{{2h}}{r}$, где Р – трансмуральное давление, Т – напряжение в полоске капсулы ЛУ, h – толщина капсулы, r – радиус ЛУ.
Мы забирали в брыжейке быка ЛУ второго порядка, которые имели форму слегка уплощенной сферы c диаметром от 21.3 до 28.7 мм. Толщина капсулы ЛУ составляла от 212 до 256 мкм. Всего было изучено 37 полосок, вырезанных из капсулы брыжеечных ЛУ молодых быков и 26 полосок капсулы ЛУ стареющих животных. 8 полосок капсулы ЛУ не проявляли спонтанной сократительной активности при растяжении и были исключены из анализа. Статистическую обработку результатов проводили с помощью программы “StatSoft STATISTICA 6.1.478”. Для проверки нормальности распределения данных применяли критерий Шапиро–Уилка. Данные соответствовали распределению Гаусса и представлены в виде среднего арифметического значения и стандартной ошибки (M ± m).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Соотношение длина – натяжение
При исследовании механических характеристик капсулы брыжеечных ЛУ быка было установлено, что на первых этапах растяжения полоски капсулы ЛУ демонстрировали значительную релаксацию. Применение AS на первых шагах увеличения длины приводило к слабому тоническому сокращению полосок (рис. 1b). Начиная с третьего – четвертого шагов удлинения полоски капсулы ЛУ, без каких-либо дополнительных воздействий генерировали спонтанные фазные сокращения, амплитуда которых на первых шагах растяжения возрастала, а в последующем снижалась.
Начиная с третьего – четвертого шагов удлинения полосок капсулы ЛУ действие AS сопровождалось развитием двуфазного сокращения, состоящего из быстрого фазного сокращения с последующим частичным расслаблением до плато (рис. 1). Мы измеряли амплитуду как фазных, так и тонических сокращений полосок капсулы ЛУ, вызванных действием AS. Величину тонического сокращения полосок капсулы ЛУ при генерации ими фазных сокращений измеряли при максимальном расслаблении полосок. Удлинение полосок капсулы ЛУ производили до снижения амплитуды активных фазных сокращений до 60% от максимального. На основании полученных данных были построены графики длина – натяжение для полосок капсулы брыжеечных ЛУ быков разного возраста (рис. 2).
Рис. 2.
Зависимость пассивного (1), общего (2) и активного (3) натяжения полосок капсулы брыжеечных ЛУ молодых (а) и стареющих быков (b) от длины при вызванных действием активирующего раствора фазных сокращениях. Lo – длина полосок, при которой они генерировали максимальную активную силу.
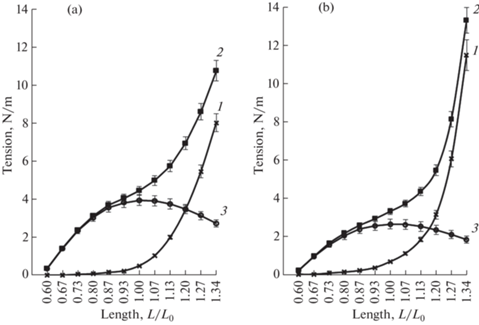
На первых шагах удлинения полосок капсулы ЛУ развиваемое ими пассивное натяжение было минимальным. Левая часть графиков (при L/Lo = = 0.6–0.93) длина – пассивное натяжение показывает, что в интервале длин 0.6–0.93 Lо полоски капсулы ЛУ обладают высокой растяжимостью. Сравнение данных, полученных при исследовании полосок капсулы ЛУ молодых и стареющих быков, выявило достоверное увеличение пассивного натяжения в полосках капсулы ЛУ стареющих животных при увеличении длины полосок более 0.93 Lо (р < 0.05). Максимальные различия были выявлены при длинах полосок капсулы 1.13–1.34 Lо.
Фазное активное натяжение при длине полосок Lo составило в полосках капсулы ЛУ молодых быков в среднем 3.94 ± 0.33 Н/м при пассивном натяжении 0.51 ± 0.04 Н/м (рис. 2a). В полосках капсулы ЛУ стареющих животных аналогичные показатели составили 2.63 ± 0.21 и 0.67 ± 0.05 Н/м (рис. 2b). Левая часть графиков длина – активное натяжение (рис. 2) показывает быстро нарастающее увеличение активного натяжения по мере удлинения полосок капсулы ЛУ молодых быков, в то время как у стареющих животных угол наклона восходящей части графика был значительно меньше. Полоски капсулы ЛУ как молодых, так и стареющих животных при длинах 0.8–1.27 Lo генерировали активное натяжение более 75% от максимального.
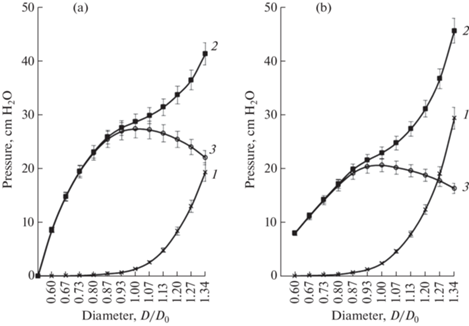
Соотношение диаметр – давление
На основании данных о соотношении длины и натяжения при фазных сокращениях были рассчитаны величины пассивного и активного давления, которое может генерировать капсула ЛУ в зависимости от растяжения. Мы проводили расчеты давления для фазных сокращений, поскольку только этот тип сокращений может осуществлять активную насосную функцию. На рис. 3 показаны графики зависимости трансмурального давления в брыжеечных ЛУ быков в зависимости от нормализованного диаметра (D/Do), где D и Do были рассчитаны, исходя из величин L и Lo. График зависимости активного давления от диаметра ЛУ молодых быков имеет крутую восходящую и более плавную нисходящую ветви. Максимальное активное давление, развиваемое капсулой брыжеечного ЛУ молодых быков, составило в среднем 27.29 ± ± 1.73 см Н2О. Высокое активное давление поддерживалось капсулой ЛУ при значительном изменении его диаметра: при диаметре от 0.80 до 1.4 Do капсула ЛУ развивала активное давление, составляющее более 80% от максимального. Результаты настоящего исследования показывают, что капсула ЛУ может генерировать высокое активное давление даже при небольшой величине пассивного трансмурального давления (около 1 см Н2О). При повышении пассивного давления способность капсулы ЛУ генерировать высокое активное давление снижалась медленно (при пассивном давлении 20 см H2O капсула ЛУ развивала активное давление около 16 см H2O). Левая часть графика (при диаметрах 0.6–1.0 Do), характеризующего зависимость активного давления от диаметра ЛУ стареющих животных, была более пологой по сравнению с аналогичным графиком для ЛУ молодых быков. Капсула ЛУ стареющих животных при действии AS генерировала значительно меньшее максимальное давление (при Do – 20.52 ± 1.44 см Н2О).
Сравнение максимального активного давления с давлением при спонтанных сокращениях
Одной из целей данного исследования было сравнение величин активного давления в ЛУ, развивающегося при максимальной активации лимфатических гладкомышечных клеток с величинами давления, генерируемого ЛУ при спонтанных фазных сокращениях. Применение AS, содержащего высокую концентрацию К+ и норадреналин, приводило к максимальной активации сократительного аппарата гладкомышечных клеток капсулы ЛУ. Подобная методика широко применяется при исследовании механических свойств артерий, вен и лимфатических сосудов [34]. Однако в физиологических условиях важнейшим естественным активатором сократительной активности гладкомышечных клеток капсулы ЛУ является их растяжение, а силой, обеспечивающей продвижение лимфы по ЛУ – спонтанные фазные сокращения капсулы [20]. Исходя из этого, в заключительной серии экспериментов мы измеряли амплитуду спонтанных фазных сокращений при различном растяжении полосок капсулы ЛУ и на основании полученных данных рассчитали активное давление, которое способна генерировать капсула ЛУ при растяжении без дополнительной стимуляции лимфатических гладкомышечных клеток. Данные этой серии экспериментов представлены на рис. 4. На рис. 4а показаны фрагменты записи одного из экспериментов, показывающие, что с увеличением натяжения полоски капсулы брыжеечного ЛУ быка возрастают амплитуда и частота спонтанных фазных сокращений. Так, при увеличении натяжения полосок капсулы ЛУ от 0.5 до 1.5 N/m амплитуда спонтанных сокращений полоски капсулы ЛУ возрастала с 3.3 до 7.5 mN. При этом частота спонтанных сокращений увеличивалась с 0.26 до 0.54 мин–1. Дальнейшее увеличение натяжения приводило к уменьшению амплитуды спонтанных сокращений капсулы ЛУ (не показано).
Рис. 4.
Спонтанные фазные сокращения капсулы ЛУ молодого быка и расчетное давление, развиваемое капсулой ЛУ при спонтанных сокращениях: а – спонтанные сокращения капсулы ЛУ при натяжении: 0.5 N/m (слева), 1.0 N/m (в центре), 1.5 N/m (справа), b – расчетное давление (1 – пассивное, 2 – активное) при спонтанных сокращениях капсулы ЛУ молодых быков, с – расчетное давление (1 – пассивное, 2 – активное) при спонтанных сокращениях капсулы ЛУ стареющих быков в зависимости от нормализованного диаметра. D/Dо – нормализованный диаметр, где Dо – диаметр, при котором капсула ЛУ развивала максимальную силу сокращений.
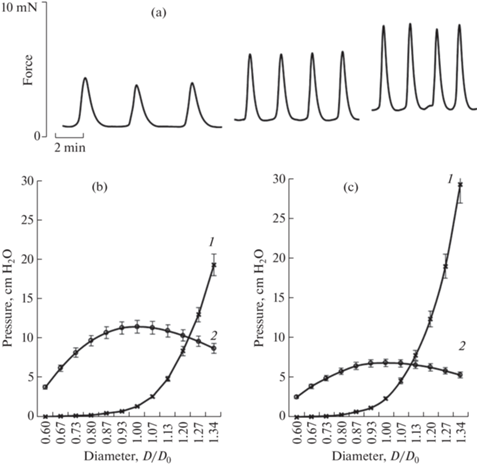
На рис. 4b и c представлены графики зависимости расчетного давления, развиваемого капсулой ЛУ молодых и стареющих быков от диаметра ЛУ при генерации ими спонтанных фазных сокращений. Графики на рис. 4 в общих чертах похожи на графики, представленные на рис. 3, однако величины активного давления, развиваемого капсулой ЛУ при спонтанных сокращениях, были намного меньше по сравнению с давлением, развиваемым капсулой ЛУ при максимальной активации гладкомышечных клеток. Так, при Dо максимальное активное давление, развиваемое капсулой ЛУ молодых быков при действии AS, было 27.3 ± 1.8 см H2O, а при спонтанных сокращениях – 11.4 ± 1.0 см H2O. ЛУ стареющих быков при спонтанных фазных сокращениях развивали достоверно меньшее давление – 8.9 ± 0.8 см H2O (p < 0.01).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Расширение наших знаний об основных механических характеристиках элементов лимфатической системы важно для понимания механизмов транспорта лимфы и его регуляции. Из ранее опубликованных работ известно, что лимфатические сосуды очень растяжимы и функционируют в условиях относительно низкого трансмурального давления [1, 8]. Кроме того, в лимфатических сосудах, в отличие от большинства артерий и вен, проявляется спонтанная фазная сократительная активность. Благодаря ей и наличию клапанов сегменты этих сосудов (лимфангионы) выполняют активную насосную функцию, обеспечивающую эффективный транспорт лимфы. Многочисленные исследования организации лимфатической системы показали, что в процессе лимфотока лимфа обязательно протекает через ЛУ, последовательно включенных в лимфатическую сосудистую сеть. При этом приходится констатировать, что работ по исследованию транспортной функции ЛУ крайне мало [1]. Фундаментальные свойства гладких мышц, входящих в состав капсулы ЛУ, изучены слабо, практически нет данных о механических свойствах капсулы ЛУ. В то же время эта информация крайне необходима как для понимания роли ЛУ в осуществлении лимфотока по лимфатической сети, так и для построения точных математических моделей функционирования ЛУ как центральных структур, реализующих иммунный ответ [35].
В данной работе нами изучены основные механические характеристики капсулы брыжеечных ЛУ молодых и стареющих быков, включая отношение длина – натяжение и спонтанные сокращения. Оснований для выбора брыжеечных ЛУ быка как объекта исследования было несколько: 1) ЛУ лабораторных животных (мыши и крысы) имеют тонкую капсулу, которую крайне сложно выделить без повреждений; 2) параметры сократительной и насосной функции брыжеечных лимфатических сосудов быков хорошо изучены [14, 25]; 3) через ЛУ брыжейки протекает большой объем лимфы (в кишечнике и печени образуется до 80% всей лимфы в организме) [36]; лимфатическая система кишечника подвергается мощной антигенной нагрузке, включая аутоантигены, антигены пищи и комменсальной микрофлоры [37, 38].
Механическую реакцию органов, имеющих в своем составе гладкомышечные клетки, на физиологические нагрузки можно разделить на пассивную и активную составляющие. Пассивный ответ определяется такими компонентами стенки, как эластин и коллаген, в то время как активный ответ является результатом сокращения гладкомышечных клеток. Капсула, покрывающая ЛУ снаружи и определяющая форму и размеры ЛУ, является наименее изученной структурой ЛУ. На фоне сотен публикаций о взаимодействии стромальных клеток, лимфатических эндотелиальных клеток и иммунных клеток в ЛУ в процессе реализации иммунного ответа [39], работ по исследованию состояния и роли капсулы ЛУ в процессе транспорта лимфы крайне мало, при этом имеющиеся данные являются преимущественно морфологическими [29, 40]. При исследовании капсулы ЛУ различных животных и человека показано, что эта капсула состоит преимущественно из коллагеновых и эластических волокон, формирующих сложную трехмерную сеть, и пучков гладкомышечных клеток, ориентированных в разных направлениях [28, 29]. На выпуклой стороне ЛУ найдено максимальное количество гладкомышечных клеток, которые “располагаются плотными слоями и имеют циркуляторную ориентацию” [41]. В нашей работе мы опирались на имеющиеся морфологические данные, т.о. полоски, вырезаемые из капсулы, были ориентированы в соответствии с направлением основной массы гладкомышечных клеток [41]. Механические характеристики капсулы ЛУ не изучены, соответственно нет данных о возрастных изменениях биомеханических свойств капсулы ЛУ, хотя имеются морфологические данные, свидетельствующие о возраст зависимом фиброзе и липоматозе капсулы и паренхимы ЛУ [42, 43].
В нашей работе, выполненной на полосках капсулы брыжеечных ЛУ молодых и стареющих быков, установлено, что капсула ЛУ обладает высокой растяжимостью, что подтверждается выраженной релаксацией полосок капсулы на первых этапах растяжения. Высокая растяжимость капсулы ЛУ также наглядно иллюстрируется графиком, отражающим отношение длины и пассивного натяжения полосок капсулы ЛУ: первые пять шагов удлинения полосок капсулы практически не повышали пассивное натяжение капсулы ЛУ как молодых, так и стареющих животных (рис. 2). По-видимому, так же, как и в лимфатических сосудах, в капсуле ЛУ при малых деформациях основное сопротивление растяжению оказывают волокна эластина с его низким модулем упругости [44]. Представляется, что высокая растяжимость является важным свойством капсулы ЛУ, которая позволяет ЛУ беспрепятственно заполняться лимфой, поступающей по афферентным лимфатическим сосудам даже в условиях повышенного лимфообразования. Высокая растяжимость характерна и для других структур лимфатической системы (например, для брыжеечных лимфатических сосудов быка [25], и, по-видимому, является основополагающим свойством лимфатической системы, позволяющим эффективно прокачивать лимфу при низком трансмуральном давлении. В нашем исследовании растяжимость полосок капсулы ЛУ начинала снижаться при увеличении длины более 0.93 Lo. Следует полагать, что при увеличении деформации в сопротивление капсулы ЛУ растяжению рекрутируются коллагеновые волокна, которые при малых деформациях только расправлялись, а при больших становятся все более натянутыми, что значительно повышает жесткость капсулы. В этом диапазоне длин прослеживались достоверные отличия механических характеристик капсулы ЛУ молодых и стареющих быков, капсула ЛУ стареющих животных демонстрировала значительно бóльшую жесткость.
Применение AS на первых шагах увеличения длины полосок капсулы ЛУ сопровождалось тоническим сокращением препаратов (рис. 1). В последующем, на третьем – четвертом шагах удлинения полосок AS приводил к развитию двуфазного сокращения, которое состояло из быстрого фазного сокращения и следующего за ним частичного расслабления до плато. В этом отношении гладкомышечные клетки капсулы брыжеечных ЛУ быков проявляли такие же свойства, что и гладкомышечные клетки лимфатических сосудов [26, 45], это в определенной степени объясняется их общим происхождением (ЛУ в процессе эмбриогенеза образуются из мезенхимального зачатка с участием уже существующих лимфатических сплетений). Так же, как и лимфатические сосуды, капсула ЛУ при достаточной степени растяжения генерировала спонтанные фазные сокращения, амплитуда и частота которых демонстрировали выраженную зависимость от растяжения. Мы измеряли амплитуду фазных и тонических сокращений, вызванных действием AS, но в дальнейшем анализировали данные о фазных сокращениях, поскольку только этот вид сокращения гладкомышечных клеток обеспечивает насосную функцию элементов лимфатической системы [12].
Максимальное активное натяжение полосок капсулы ЛУ при вызванных действием AS фазных сокращениях было зарегистрировано у молодых животных при пассивном натяжении 0.51 ± 0.03 Н/м и составляло в среднем 3.94 ± 0.19 Н/м (рис. 2). У стареющих быков максимальное активное натяжение полосок капсулы ЛУ составило 2.63 ± 0.14 Н/м при пассивном натяжении 0.67 ± 0.05 Н/м, что свидетельствует об уменьшении активной силы, которую способна развивать капсула ЛУ стареющих быков. Графики, отражающие зависимость активного натяжения полосок капсулы ЛУ молодых и стареющих быков от длины, имели пологую восходящую ветвь и были довольно плоскими при длинах полосок капсулы от 0.8 до 1.2 Lo, активное натяжение полосок в этом диапазоне составляло около 80% от максимального. Представляется интересным, что капсула брыжеечных ЛУ быка демонстрировала примерно такие же величины активного и пассивного натяжения, что и грудной проток человека [46], хотя диаметры грудного протока и ЛУ отличаются более чем на порядок.
На основании данных о пассивном и максимальном активном натяжении капсулы ЛУ нами были проведены расчеты давления, которое может создавать капсула ЛУ при изменении их диаметра. Мы считаем необходимым подчеркнуть, что представленные нами величины пассивного и активного давления в ЛУ являются производными величинами, рассчитанными на основании данных о силе, развиваемой капсулой при разном диаметре ЛУ. Подобные расчеты правомерны и широко используются при исследовании лимфатических сосудов [26, 46]. Расчеты показали, что на первоначальных этапах увеличения диаметра пассивное давление в ЛУ возрастает очень медленно, но при диаметрах бóльших, чем Dо, график зависимости пассивного давления от диаметра становится крутым, т.е. растяжимость капсулы ЛУ значительно снижается. В физиологических условиях зависимость пассивного давления от диаметра определяется количеством соединительнотканных элементов (коллагена и эластина) в капсуле ЛУ. С возрастом в ЛУ развиваются дегенеративные процессы, приводящие к выраженному фиброзу, липоматозу, витрификации и гиалинизации в различных структурах ЛУ, в т.ч. и в капсуле [42, 43], что, по нашему мнению, и приводит к большей жесткости капсулы, наглядно иллюстрируемой в данном исследовании крутой правой частью графика зависимости пассивного давления от диаметра в ЛУ стареющих быков.
Активно генерируемое давление быстро возрастало по мере увеличения диаметра ЛУ. Восходящая часть графика, отражающего зависимость активного давления от диаметра ЛУ, была очень крутой, особенно в ЛУ молодых быков. Так, в брыжеечных ЛУ молодых животных при D/Dо = 0.6 активное давление было 8.53 ± 0.61 см H2O, а при увеличении D/Dо до 0.8 возрастало до 23.04 ± 1.51 см H2O, т.е. гладкомышечные клетки капсулы ЛУ так же, как и гладкомышечные клетки собирающих лимфатических сосудов [47] способны ощущать степень растяжения и реагировать на него увеличением силы сокращений. Важным свойством является также способность капсулы ЛУ генерировать высокое активное давление при значительном увеличении растяжения капсулы: при увеличении диаметра ЛУ до 1.27 Dо ЛУ развивал давление, составляющее более 80% от максимально возможного. Ранее быстрый прирост активного давления и длительное удержание давления на высоком уровне при увеличении диаметра были показаны при исследовании брыжеечных лимфатических сосудов быка [25]. По-видимому, высокая чувствительность к растяжению, высокая реактивность и способность к развитию высокого давления при значительном растяжении характерны для всех элементов лимфатической системы. Графики, иллюстрирующие зависимость активного давления от диаметра в брыжеечных ЛУ молодых и стареющих быков, существенно отличались. В частности, левая часть графика, отражающего зависимость активного давления от диаметра ЛУ стареющих животных, была менее крутой. В ЛУ молодых животных максимальное активное давление при Dо составляло 27.29 ± 1.77 см H2O, а в ЛУ стареющих быков – лишь 20.52 ± 1.63 см H2O (p < 0.01). Мы полагаем, что в основе выявленных различий в растяжимости и снижении силы сокращений капсулы ЛУ молодых и стареющих животных лежат возраст зависимые структурные изменения, заключающиеся не только в избыточном развитии волокнистой соединительной ткани в капсуле и трабекулах ЛУ [42, 43], но и в снижении массы гладкомышечных клеток. Так, при морфометрическом анализе структурно-функциональных изменений брыжеечных ЛУ человека при старении показано уменьшение числа гладкомышечных клеток в капсуле ЛУ [31, 43].
Данные о максимальном активном давлении, регистрируемом при действии различных стимулирующих факторов, характеризуют потенциальную способность гладкомышечных клеток кровеносных и лимфатических сосудов, а также ЛУ к сокращению и развитию силы. Однако в физиологических условиях для выполнения своей специфической функции гладкомышечные клетки сосудов используют только часть своих потенциальных способностей к развитию силы. Так, миогенный тонус в артериях поддерживается сокращениями стенок гладкомышечных клеток, амплитуда которых не превышает 18% от максимальной [48]. В мезентериальных лимфатических сосудах крысы амплитуда спонтанных фазных сокращений составляет лишь 15% от максимально возможной [45]. Результаты нашего исследования показывают, что капсула ЛУ при генерации спонтанных фазных сокращений, лежащих в основе активной насосной функции ЛУ, также реализует лишь часть своих потенциальных возможностей по развитию силы, но эта часть значительно больше по сравнению с лимфатическими сосудами. Величина активного давления, развиваемого капсулой брыжеечных ЛУ молодых быков при Do в процессе спонтанных сокращений, составила 11.4 ± 1.0 см Н2О или 41.7% от максимально развиваемого ею активного давления при действии AS. В ЛУ стареющих животных эта величина оказалась еще меньше – 6.8 ± 0.6 см Н2О (33.1%). Мы полагаем, что в основе столь значительного отличия механических характеристик лимфатических сосудов и ЛУ лежат различия в их строении: лимфатические сосуды являются полыми органами, препятствий для лимфотока в них практически нет, а внутренняя часть ЛУ является пористой структурой с синусами и лабиринтами шириной 5–20 мкм и высоким гидродинамическим сопротивлением [49]. В стенке лимфатических сосудов значительное количество гладкомышечных клеток, расположенных циркулярно и по спирали [50], способных развивать быстрые сокращения, отношение толщины стенки к диаметру сосуда – 1/15–1/20, а в капсуле ЛУ преобладают соединительнотканные элементы, отношение толщины капсулы в диаметру ЛУ – 1/100 и более. В связи с этим в ЛУ, несмотря на общее происхождение гладкомышечных клеток их капсулы и лимфатических сосудов, эволюционно сформировались другие механизмы управления процессом сокращения, что проявляется в скорости и длительности фазных сокращений ЛУ. Сокращения лимфатических сосудов быстрые (до 6 с), с фазой укорочения 1.5–2 с [1], в то время как сокращения капсулы брыжеечных ЛУ быка медленные, фаза укорочения составляет до 30 с при общей продолжительности сокращения до 90 с (рис. 4а). Учитывая высокое гидродинамическое сопротивление ЛУ “при сокращении мышечных элементов ЛУ лимфа выжимается из него, как из губки…” [51].
В основе выявленных различий в способности генерировать активное давление в процессе спонтанных сокращений ЛУ молодых и стареющих животных могут лежать два возраст зависимых процесса. Первый – общее уменьшение числа гладкомышечных клеток в капсуле ЛУ стареющих животных на фоне утолщения капсулы. Второй – возрастные дегенеративные изменения, заключающиеся в фиброзе и гиалинозе капсулы и отложении жира [42], что может механически разобщать пучки гладкомышечных клеток, функционирующие в капсуле ЛУ молодых животных по принципу функционального синцития, и ограничивать возможность распространения возбуждения с одних пучков гладкомышечных клеток на другие.
В заключительной части обсуждения представляется интересным сопоставить рассчитанное нами активно генерируемое давление в брыжеечных ЛУ быка с данными, полученными при непосредственном измерении внутриузлового давления in vivo. К сожалению, мы не нашли в литературе данных о давлении в ЛУ быка. Однако имеются данные о величинах трансмурального давления в ЛУ человека и других животных. Прежде, чем приводить эти данные и сравнивать их с результатами нашего исследования, хотелось бы отметить, что лимфатическая система является системой низкого давления, функционирующей по законам, отличающимся от законов гемодинамики. В лимфатической системе нет централизованного насоса, транспорт лимфы децентрализован и осуществляется сегментами лимфатических сосудов – лимфангионами и ЛУ [1]. В процессе осуществления своей активной транспортной функции лимфангионы кратковременно развивают небольшие волны давления (как правило, это единицы см Н2О), которого вполне достаточно для перекачивания лимфы из дистального лимфангиона в проксимальный. При исследовании брыжеечных лимфатических сосудов быка было показано, что давление в лимфангионах колебалось от 3 до 7 см воды. При этом систолический объем лимфангиона достигал 70% от конечнодиастолического, т.е. лимфатический сосуд как активный насос работал очень эффективно [52]. В другом исследовании было установлено, что активная прокачка лимфы в брыжеечных лимфтических сосудах быка начинается при давлении 2 см Н2О и достигает максимума при 8 см Н2О [53]. Измерение давления в брыжеечных лимфтических сосудах овец показало величины давления – 2–3 см Н2О [54], а в лимфтических сосудах ног претерпевало колебания от 0 до 5 см Н2О [55]. Приблизительно такие же величины давления были получены при исследовании внутрилимфатического давления у мелких животных: в брыжеечных лимфтических сосудах крыс давление в лимфангионе на протяжении цикла сокращение – расслабление колебалось от 0 до 2.5 см Н2О, а при повышении давления на входе повышалось до 5 см Н2О [56]. В другой работе у крыс было зарегистрировано несколько бóльшее давление: в диастолу – около 2 см Н2О, а в систолу повышалось до 11 см Н2О [57]. Резюмируя приведенные величины давления в лимфатических сосудах различных животных, приходится констатировать, что этот параметр не зависит от размеров животного (масса быка и крысы отличаются более чем в 1000 раз). Поскольку ЛУ последовательно встроены в систему лимфтических сосудов, следует полагать, что давление в них должно быть примерно таким же, как и в просвете лимфтических сосудов. Прямых измерений внутриузлового давления мало, имеются данные о давлении лишь в ЛУ мыши и человека. Прямое измерение давления в ЛУ мыши показало, что среднем оно составляет 6.86 ± 0.56 см Н2О [58]. У человека давление в интактных ЛУ составило 9.1 ± 6.2 см Н2О, а в ЛУ, пораженных метастазами раковых клеток – 21.4 ± 15.4 см H2O [59]. Сопоставление рассчитанных нами величин активного давления в брыжеечных ЛУ быка с данными, полученными при прямом измерении давления в ЛУ человека и мыши, позволяет сделать заключение о валидности метода расчета механических характеристик капсулы ЛУ, предпринятом в нашем исследовании.
В заключение нами представлены первые измерения и анализ соотношения длины и натяжения в капсуле брыжеечных ЛУ молодых и стареющих быков. Результаты исследования характеризуют ЛУ как хорошо растяжимые структуры, что позволяет ЛУ беспрепятственно заполняться лимфой даже на максимуме лимфообразования. Наши данные показывают, что брыжеечные ЛУ быка обладают способностью регулировать ток лимфы по ним посредством внутренних механизмов. Высокая чувствительность гладкомышечных клеток капсулы ЛУ к растяжению, проявляющаяся в значительном возрастании силы сокращений при увеличении растяжения капсулы, обеспечивает развитие высокого активного трансмурального давления и увеличение объема прокачиваемой ЛУ лимфы. Важной особенностью ЛУ является их способность генерировать высокое активное давление даже при значительном увеличении объема ЛУ и пассивного давления в нем. Механические характеристики ЛУ молодых и стареющих быков существенно отличаются: растяжимость капсулы стареющих быков снижена, активное давление, развиваемое ими в процессе спонтанных сокращений составляет лишь около 60% от давления, генерируемого ЛУ молодых животных. Мы надеемся, что представленные нами данные позволят расширить знания о механизмах транспорта лимфы по сложно организованной системе лимфатических сосудов и ЛУ и могут быть положены в основу разработок методик терапевтических вмешательств при патологии лимфатической системы у пожилых людей, а также могут быть использованы при математическом моделировании потоков лимфы по ЛУ в процессе развития иммунных реакций.
Список литературы
Лобов ГИ (2022) Лимфатическая система в норме и при патологии. Успехи физиол наук 53: 15–38. [Lobov GI (2022) The lymphatic system in normal and pathological conditions. Progress Physiol Sci 53: 15–38. (In Russ)]. https://doi.org/10.31857/S0301179822020060
Liao S, von der Weid PY (2015) Lymphatic system: an active pathway for immune protection. Semin Cell Dev Biol 38: 83–89https://doi.org/10.1016/j.semcdb.2014.11.012
Levick JR, Michel CC (2010) Microvascular fluid exchange and the revised Starling principle. Cardiovasc Res 87 (2): 198–210. https://doi.org/10.1093/cvr/cvq062
Goswami AK, Khaja MS, Downing T, Kokabi N, Saad WE, Majdalany BS (2020) Lymphatic Anatomy and Physiology. Semin Intervent Radiol 37 (3): 227–236.https://doi.org/10.1055/s-0040-1713440
Macpherson AJ, Smith K (2006) Mesenteric lymph nodes at the center of immune anatomy. J Exp Med 203 (3): 497–500. https://doi.org/10.1084/jem.20060227
von der Weid PY (2019) Lymphatic Vessel Pumping. Adv Exp Med Biol 1124: 357–377. https://doi.org/10.1007/978-981-13-5895-1_15
Steele MM, Lund AW (2021) Afferent Lymphatic Transport and Peripheral Tissue Immunity. J Immunol 206 (2): 264–272. https://doi.org/10.4049/jimmunol.2001060
Breslin JW, Yang Y, Scallan JP, Sweat RS, Adderley SP, Murfee WL (2018) Lymphatic Vessel Network Structure and Physiology. Compr Physiol 9 (1): 207–299. https://doi.org/10.1002/cphy.c180015
Solari E, Marcozzi C, Negrini D, Moriondo A (2020) Lymphatic Vessels and Their Surroundings: How Local Physical Factors Affect Lymph Flow. Biology (Basel) 9 (12): 463https://doi.org/10.3390/biology9120463
Лобов ГИ, Орлов РС (1995) Клеточные механизмы регуляции транспорта лимфы. Рос физиол журн им ИМ Сеченова 81 (6): 19–28. [Lobov GI, Orlov RS (1995) The cellular mechanisms in the regulation of lymph transport. Russ J Physiol 81 (6): 19–28. (In Russ)].
Zweifach BW, Prather JW (1975) Micromanipulation of pressure in terminal lymphatics in the mesentery. Am J Physiol 228 (5): 1326–1335.https://doi.org/10.1152/ajplegacy.1975.228.5.1326
Scallan JP, Zawieja SD, Castorena-Gonzalez JA, Davis MJ (2016) Lymphatic pumping: mechanics, mechanisms and malfunction. J Physiol 594 (20): 5749–5768. https://doi.org/10.1113/JP272088
Olszewski W, Engeset A, Jaeger PM, Sokolowski J, Theodorsen L (1977) Flow and composition of leg lymph in normal men during venous stasis, muscular activity and local hyperthermia. Acta Physiol Scand 99 (2): 149–155. https://doi.org/10.1111/j.1748-1716.1977.tb10365.x
Лобов ГИ, Орлов РС (1988) Саморегуляция насосной функции лимфангиона. Физиол журн СССР им ИМ Сеченова 74 (7): 977–986. [Lobov GI, Orlov RS (1988) Self-regulation of the pump function of the lymphangion. Fiziol Zh SSSR Im IM Sechenova. 74 (7): 977–986. (In Russ)].
Muthuchamy M, Zawieja D (2008) Molecular regulation of lymphatic contractility. Ann N Y Acad Sci 1131: 89–99.https://doi.org/10.1196/annals.1413.008
Willard-Mack CL (2006) Normal structure, function, and histology of lymph nodes. Toxicol Pathol 34 (5): 409–424. https://doi.org/10.1080/01926230600867727
von Andrian UH, Mempel TR (2003) Homing and cellular traffic in lymph nodes. Nature Rev Immunol 3: 867–878. https://doi.org/10.1038/nri1222
Ohtani O, Ohtani Y (2008) Structure and function of rat lymph nodes. Arch Histol Cytol 71 (2): 69–76.https://doi.org/10.1679/aohc.71.69
Randolph GJ, Ivanov S, Zinselmeyer BH, Scallan JP (2017) The Lymphatic System: Integral Roles in Immunity. Annu Rev Immunol 35: 31–52. https://doi.org/10.1146/annurev-immunol-041015-055354
Hughes GA, Allen JM (1993) Neural modulation of bovine mesenteric lymph node contraction. Exp Physiol 78 (5): 663–674. https://doi.org/10.1113/expphysiol.1993.sp003714
Lobov GI, Pan’kova MN (2012) Effect of histamine on contractile activity of smooth muscles in bovine mesenteric lymph nodes. Bull Exp Biol Med 152 (4): 406–408. https://doi.org/10.1007/s10517-012-1539-5
Chi Y, Liang J, Yan D (2006) A material sensitivity study on the accuracy of deformable organ registration using linear biomechanical models. Med Phys 33 (2): 421–433. https://doi.org/10.1118/1.2163838
Hope SA, Hughes AD (2007) Drug effects on the mechanical properties of large arteries in humans. Clin Exp Pharmacol Physiol 34 (7): 688–693. https://doi.org/10.1111/j.1440-1681.2007.04661.x
Arkill KP, Moger J, Winlove CP (2010) The structure and mechanical properties of collecting lymphatic vessels: an investigation using multimodal nonlinear microscopy. J Anat 216 (5): 547–555https://doi.org/10.1111/j.1469-7580.2010.01215.x
Ohhashi T, Azuma T, Sakaguchi M (1980) Active and passive mechanical characteristics of bovine mesenteric lymphatics. Am J Physiol 239 (1): H88–H95.https://doi.org/10.1152/ajpheart.1980.239.1.H88
Ferguson MK, Williams U, Leff AR, Mitchell RW (1993) Length-tension characteristics of bovine tracheobronchial lymphatic smooth muscle. Lymphology 26: 19–24.
Razavi MS, Dixon JB, Gleason RL (2020) Characterization of rat tail lymphatic contractility and biomechanics: incorporating nitric oxide-mediated vasoregulation. J R Soc Interface 17 (170): 20200598. https://doi.org/10.1098/rsif.2020.0598
Folse DS, Beathard GA, Granholm NA (1975) Smooth muscle in lymph node capsule and trabeculae. Anat Rec 183 (4): 517–521.
Castenholz A (1990) Architecture of the lymph node with regard to its function. Curr Top Pathol 84 (Pt 1): 1–32. https://doi.org/10.1007/978-3-642-75519-4_1
Zhdanov DA (1970) Regional characteristics and age-related changes in the structure and cytoarchitectonics of human lymph nodes. Arkh Patol 32 (3): 14–23.
Hadamitzky C, Spohr H, Debertin AS, Guddat S, Tsokos M, Pabst R (2010) Age-dependent histoarchitectural changes in human lymph nodes: an underestimated process with clinical relevance? J Anat 216 (5): 556–562. https://doi.org/10.1111/j.1469-7580.2010.01213.x
Сапин МР (1977) Анатомия соединительнотканного каркаса лимфатических узлов взрослого человека. Архив анат гистол эмбриол 72 (4): 58–65. [Sapin MR (1977) Anatomy of the connective tissue framework of adult human lymph nodes. Arkh Anat Gistol Embriol 72 (4): 58–65. (In Russ)].
Geelhoed GW (1996) “Aging bull”. Med Hypotheses 47 (6): 471–479. https://doi.org/10.1016/s0306-9877(96)90160-7
Zhang RZ, Gashev AA, Zawieja DC, Davis MJ (2007) Length-tension relationships of small arteries, veins, and lymphatics from the rat mesenteric microcirculation. Am J Physiol Heart Circ Physiol 292 (4): H1943–H1952. https://doi.org/10.1152/ajpheart.01000.2005
Novkovic M, Onder L, Cheng HW, Bocharov G, Ludewig B (2018) Integrative Computational Modeling of the Lymph Node Stromal Cell Landscape. Front Immunol 23 (9): 2428. https://doi.org/10.3389/fimmu.2018.02428
Hsu MC, Itkin M (2016) Lymphatic Anatomy. Tech Vasc Interv Radiol 19 (4): 247–254https://doi.org/10.1053/j.tvir.2016.10.003
Bernier-Latmani J, Petrova TV (2017) Intestinal lymphatic vasculature: structure, mechanisms and functions. Nat Rev Gastroenterol Hepatol 14 (9): 510–526. https://doi.org/10.1038/nrgastro.2017.79
Pabst O, Mowat AM (2012) Oral tolerance to food protein. Mucosal Immunol 5: 232–239.
Li L, Wu J, Abdi R, Jewell CM, Bromberg JS (2021) Lymph node fibroblastic reticular cells steer immune responses.Trends Immunol 42 (8): 723–734. https://doi.org/10.1016/j.it.2021.06.006
Faroon OM, Henry RW, al-Bagdadi FK (1987) Smooth muscle distribution in the capsule and trabeculae of the caprine superficial cervical lymph node. Histol Histopathol 2 (3): 313–315.
Пастухова ИА (1986) Миоциты паховых лимфатических узлов. Арх анат гистол эмбриол 90 (6): 32–37. [Pastukhova IA (1986) Myocytes of the inguinal lymph nodes. Arkh Anat Gistol Embriol 90 (6): 32–37. (In Russ)].
Erofeeva LM, Mnikhovich MV (2020) Structural and Functional Changes in the Mesenteric Lymph Nodes in Humans during Aging. Bull Exp Biol Med 168 (5): 694–698. https://doi.org/10.1007/s10517-020-04782-0
Ahmadi O, McCall JL, Stringer MD (2013) Does senescence affect lymph node number and morphology? A systematic review. ANZ J Surg 83 (9): 612–618. https://doi.org/10.1111/ans.12067
Jamalian S, Bertram CD, Richardson WJ, Moore JE, Jr (2013) Parameter sensitivity analysis of a lumped-parameter model of a chain of lymphangions in series. Am J Physiol Heart Circul Physiol 305 (12): H1709–H1717. https://doi.org/10.1152/ajpheart.00403.2013
Zhang R, Gashev AA, Zawieja DC, Lane MM, Davis MJ (2007) Length-dependence of lymphatic phasic contractile activity under isometric and isobaric conditions. Microcirculation 14 (6): 613–625. https://doi.org/10.1080/1073968070143616
Telinius N, Drewsen N, Pilegaard H, Kold-Petersen H, de Leval M, Aalkjaer C, Hjortdal V, Boedtkjer DB (2010) Human thoracic duct in vitro: diameter-tension properties, spontaneous and evoked contractile activity. Am J Physiol Heart Circ Physiol 299 (3): H811–H818. https://doi.org/10.1152/ajpheart.01089.2009
Shirasawa Y, Benoit JN (2003) Stretch-induced calcium sensitization of rat lymphatic smooth muscle. Am J Physiol Heart Circ Physiol 285: H2573–H2577.
Davis MJ, Davidson J (2002) Force–velocity relationship of myogenically active arterioles. Am J Physiol Heart Circ Physiol 282: H165–H174.
Browse NL, Doig RL, Sizeland D (1984) The resistance of a lymph node to lymph flow. Br J Surg 71 (3): 192–196. https://doi.org/10.1002/bjs.1800710308
Борисов АВ (2005) Функциональная анатомия лимфангиона. Морфология 128 (6): 18–27. [Borisov AV (2005) Functional anatomy of lymphangion. Morfologiia. 128 (6): 18–27. (In Russ)].
Иосифов ГМ (1914) Лимфатическая система человека с описанием аденоидов и органов движения лимфы. Томск. Изд. Томского Универ. [Iosifov GM (1914) The human lymphatic system with a description of the adenoids and organs of lymphatic movement. Tomsk. Ed. Tomsk Univer. (In Russ)].
McHale NG, Roddie IC (1976) The effect of transmural pressure on pumping activity in isolated bovine lymphatic vessels. J Physiol 261 (2): 255–269https://doi.org/10.1113/jphysiol.1976.sp011557
Ferguson MK, Williams U (2000) Measurement of flow characteristics during individual contractions in bovine mesenteric lymphatic vessels. Lymphology 33 (2): 36–42.
McGeown JG, McHale NG, Thornbury KD (1987) The effect of electrical stimulation of the sympathetic chain on peripheral lymph flow in the anaesthetized sheep. J Physiol 393: 123–133. https://doi.org/10.1113/jphysiol.1987.sp016814
McGeown JG, McHale NG, Thornbury KD (1987) The role of external compression and movement in lymph propulsion in the sheep hind limb. J Physiol 387: 83–93. https://doi.org/10.1113/jphysiol.1987.sp016564
Scallan JP, Zawieja SD, Castorena-Gonzalez JA, Davis MJ (2016) Lymphatic pumping: mechanics, mechanisms and malfunction. J Physiol 594 (20): 5749–5768.https://doi.org/10.1113/JP272088
Benoit JN, Zawieja DC, Goodman AH, Granger HJ (1989) Characterization of intact mesenteric lymphatic pump and its responsiveness to acute edemagenic stress. Am J Physiol 257 (6 Pt 2): H2059–H2069. https://doi.org/10.1152/ajpheart.1989.257.6.H2059
Bouta EM, Wood RW, Brown EB, Rahimi H, Ritchlin CT, Schwarz EM (2014) In vivo quantification of lymph viscosity and pressure in lymphatic vessels and draining lymph nodes of arthritic joints in mice. J Physiol 592 (6): 1213–1223. https://doi.org/10.1113/jphysiol.2013.266700
Nathanson SD, Mahan M (2011) Sentinel lymph node pressure in breast cancer. Ann Surg Oncol 18 (13): 3791–3796. https://doi.org/10.1245/s10434-011-1796-y
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии