Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 5, стр. 402-409
ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ мРНК ТИТИНА И ОБСКУРИНА В ПОПЕРЕЧНО-ПОЛОСАТЫХ МЫШЦАХ ДЛИННОХВОСТОГО СУСЛИКА UROCITELLUS UNDULATUS
Ю. В. Грицына 1, М. А. Грабарская 1, Г. З. Михайлова 1, С. С. Попова 1, Л. Г. Бобылева 1, А. М. Ермаков 1, Н. М. Захарова 2, И. М. Вихлянцев 1, *
1 Институт теоретической и экспериментальной биофизики РАН
Пущино, Московская область, Россия
2 Институт биофизики клетки РАН – обособленное подразделение
Федерального государственного бюджетного учреждения науки Федеральный исследовательский центр
“Пущинский научный центр биологических исследований Российской академии наук”
Пущино, Московская область, Россия
* E-mail: ivanvikhlyantsev@gmail.com
Поступила в редакцию 09.06.2022
После доработки 05.07.2022
Принята к публикации 05.07.2022
- EDN: AUICPL
- DOI: 10.31857/S0044452922050047
Аннотация
Методом ОТ-ПЦР в реальном времени проведено исследование сезонных изменений содержания мРНК гигантских белков саркомерного цитоскелета титина и обскурина в скелетной мышце m. longissimus dorsi и левом желудочке сердца длиннохвостого суслика Urocitellus undulatus. Эксперименты проводились на животных следующих экспериментальных групп: “летняя активность”, “осенняя активность”, “гипотермия” (спячка) и “зимняя активность”; n = 5 для каждой группы. В сердечной мышце сусликов группы “гипотермия” обнаружено уменьшение (на 28%, р ≤ 0.01) содержания мРНК титина; в трех других группах статистически значимых различий в этом параметре не выявлено. В m. longissimus dorsi сусликов из групп “гипотермия” и “зимняя активность” наблюдалось увеличение в 2.9 раза (р ≤ 0.01) и в 3.6 раза (р ≤ 0.01) соответственно содержания мРНК титина при отсутствии статистически значимых различий в этом параметре между группами “летняя активность” и “осенняя активность”. Содержание мРНК обскурина было повышено в 3.4–3.6 раза (р ≤ 0.01) в сердечной мышце сусликов из групп “осенняя активность”, “гипотермия”, “зимняя активность” и в 3.0 и 3.6 раза (р ≤ 0.01) в скелетной мышце сусликов из групп “гипотермия” и “зимняя активность” соответственно. Таким образом, впервые получены данные о дифференциальной экспрессии мРНК титина и обскурина, указывающие на сопряженные изменения этих белков в мышцах длиннохвостого суслика в период гибернации. Полученные результаты обсуждаются в контексте адаптации поперечно-полосатых мышц длиннохвостого суслика к условиям зимней спячки.
Зимняя спячка является уникальной моделью исследования молекулярных механизмов пластичности поперечно-полосатых мышц. Поиск ответов на вопросы о том, почему, несмотря на развитие атрофии скелетных мышц после продолжительного периода обездвиженности, зимнеспящие животные выходят из состояния гипотермии в течение 2–6 ч (в зависимости от температуры окружающей среды) без нарушений сократительной способности мышц, и какие молекулярные механизмы ответственны за функционирование сердечной мышцы в диапазоне температур от 0°С до 37°С, является актуальным направлением современной биологии, в частности, мышечной физиологии гибернантов, и позволит открыть новые пути коррекции мышечных патологий, связанных с ограничением подвижности.
Исследования, проведенные в этом направлении, выявили дифференциально экспрессирующиеся гены в мышцах гибернантов, что свидетельствует о молекулярно-генетических механизмах, регулирующих сезонные изменения активности многих сигнальных путей, ответственных, в том числе, за синтез и протеолитическую деградацию белков [1–8]. Эти данные свидетельствуют о значительных перестройках на молекулярном уровне, адаптирующих мышцы гибернантов к условиям зимней спячки.
Исследования, проведенные нами ранее, выявили в поперечно-полосатых мышцах длиннохвостого суслика и других гибернантов [9–13] адаптационные изменения изоформного состава и уровня фосфорилирования титина (тайтина, мол. массы изоформ составляют 3000–3800 кДа) – гигантского эластичного белка, отвечающего за поддержание высокоупорядоченной саркомерной структуры, регулирующего актин-миозиновое взаимодействие и участвующего, как механосенсор, в регуляции процессов внутриклеточной сигнализации [14, 15]. В частности, в поперечно-полосатых мышцах истинного гибернанта длиннохвостого суслика Urocitellus undulatus (прежнее название Spermophilus undulatus) в период “осенней” активности – когда в организме зимнеспящих происходят изменения, подготавливающие животных к сезону гибернации, наблюдалась тенденция к увеличению доли более длинных изоформ титина (имеющих большую молекулярную массу) и уменьшению доли более коротких изоформ этого белка [9]. В период гипотермии (спячки), несмотря на ~15–20% уменьшение общего содержания изоформ титина, в поперечно-полосатых мышцах длиннохвостого суслика наблюдалось статистически значимое увеличение доли более длинных изоформ титина в сравнении с их содержанием в период летней активности [9, 12]. В частности, в предсердиях и желудочках сердца сусликов группы гипотермии (спячки) зарегистрировано двукратное увеличение содержания более длинной N2BA-изоформы титина по отношению к содержанию более короткой N2B-изоформе в сравнении с содержанием этих изоформ в сердце летних активных животных [9]. В период “зимней” активности – кратковременной нормотермии (не более суток) между периодами гипотермии, наблюдалось восстановление уменьшенного в период спячки содержания титина в мышцах длиннохвостого суслика [9, 12]. При этом сохранялось повышенное содержание более длинных изоформ этого белка. Представленные данные позволяют говорить о дифференциальной экспрессии гена титина, кодирующего различающиеся по длине изоформы этого белка, в поперечно-полосатых мышцах длиннохвостого суслика.
В данной работе исследованы сезонные изменения содержания мРНК титина в сердечной мышце, сократительная активность которой сохраняется в период спячки, и скелетной мышце m. longissimus dorsi, функциональная активность которой ингибируется в период спячки, у длиннохвостого суслика Urocitellus undulatus. Мы ожидали получить следующие результаты: (1) обнаружить увеличение содержания мРНК титина в двух исследуемых типах мышечной ткани сусликов в период “осенней” активности, принимая во внимание данные об увеличении содержания более длинных (более высокомолекулярных) изоформ титина в сердечной и скелетных мышцах сусликов в этот период [9]; (2) учитывая данные о молекулярных механизмах, стабилизирующих мРНК и защищающих ее от деградации в период спячки [16, 17], обнаружить повышенное содержание мРНК титина в исследуемых мышцах сусликов в этот период, несмотря на общую транскрипционную супрессию в период гипотермии [18]; (3) выявить поддержание стабильно повышенного уровня мРНК титина, а возможно, и его увеличение в мышцах сусликов в период “зимней” активности, учитывая данные о преобладающем синтезе титина в этот период [12]. Аналогичные результаты мы ожидали обнаружить и для мРНК обскурина – сравнительно недавно открытого гигантского мышечного белка, взаимодействующего в саркомере с титином и формирующего вместе с ним трехмерный цитоскелетный каркас, поддерживающий высокоупорядоченную структуру миофибрилл и мышцы в целом [19, 20].
МЕТОДЫ ИССЛЕДОВАНИЯ
В экспериментах были использованы длиннохвостые суслики Urocitellus undulatus, отловленные летом в местах их природного обитания (долина реки Лена, Якутия), и содержащиеся в условиях вивария ИБК РАН (Пущино, Московская область) в индивидуальных клетках при естественном фотопериоде; обеспечение пищей, водой и гнездовым материалом ad libitum. Эксперименты проводились на животных, находящихся в следующих состояниях: “летней” активности (нормотермия, 38°С, май–июль, сезонный контроль); “осенней” активности (нормотермия, 38°С, октябрь–первая половина ноября); гипотермии (глубокое оцепенение (спячка), декабрь–март, температура сердечной мышцы 1.5–2.0°C, продолжительность периода гипотермии 7–11 сут); “зимней” активности (нормотермия, 36–37°С, периодически повторяющиеся временные промежутки (не более суток) между периодами гипотермии, взятие материала происходило через 10–14 ч эутермного состоянии после пробуждения). Количество животных для каждой группы – n = 5. Подготовку животных к экспериментам и контроль их физиологического состояния проводили согласно методике [21]. На проведение экспериментов с животными получено разрешение Комиссии по биологической безопасности и биоэтике ИТЭБ РАН, протокол № 32/2020 от 18 февраля 2020 г. Все процедуры, выполненные в исследовании с участием животных, соответствовали этическим стандартам, утвержденным Директивой 2010/63/EU Европейского парламента и совета европейского союза по охране животных, используемых в научных целях. Образцы мышечной ткани (скелетной мышцы m. longissimus dorsi (пояснично-крестцовый отдел) и левого желудочка сердца после изъятия замораживались в жидком азоте и хранились при температуре –75°C.
Поскольку в базе данных PubMed (https://www.ncbi.nlm.nih.gov/) отсутствуют нуклеотидные последовательности генов титина и обскурина длиннохвостого суслика Urocitellus undulatus, было проведено выравнивание (с помощью программного обеспечения CLUSTAL W (https://www.ebi.ac.uk/Tools/msa/)) известных нуклеотидных последовательностей мРНК титина и обскурина серой крысы (Rattus norvegicus), альпийского сурка (Marmota marmota) и тринадцатиполосного суслика (Ictidomys tridecemlineatus) с целью поиска гомологичных участков в мРНК известных последовательностей изучаемых генов у этих близкородственных животных, относящихся к отряду грызунов. На основе гомологии с известными нуклеотидными последовательностями мРНК титина, обскурина и GAPDH (референсный ген) серой крысы (титин: XM_039106393.1; обскурин: XM_039087230.1; GAPDH: XM_039107008.1), альпийского сурка (титин: XM_015481108.1; обскурин: XM_015498766.1; GAPDH: XM_015500718.1) и тринадцатиполосного суслика (титин: XM_040294541.1; обскурин: XM_040273316.1; GAPDH: XM_005338350.4), были подобраны специфические праймеры (с использованием алгоритмов программы BLAST) для проведения ОТ-ПЦР в реальном времени с целью определения содержания мРНК титина и обскурина в исследуемых мышцах (см. табл. 1). Ген GAPDH был выбран в качестве референсного гена, поскольку содержание его мРНК не менялось в поперечнополосатых мышцах четырех исследованных групп сусликов.
Таблица 1.
Праймеры, используемые для ОТ-ПЦР в реальном времени
| Гены | Прямой праймер | Обратный праймер | Длина продукта ПЦР, п.н. |
|---|---|---|---|
| GAPDH | 5'-TCATGACCACAGTCCATGCC-3' | 5'-CCAGTGGATGCAGGGATGAT-3' | 115 |
| TTN | 5'-AGTCTCGGGCTTGAAAAATGTG-3' | 5'-TCTGTACCATGTCACTTTGGGG-3' | 100 |
| OBSCN | 5'-CACTCCTTCAGCGGAGCAC-3' | 5'-GTCCTTCTCCCAGCTCACG-3' | 129 |
Праймеры были синтезированы фирмой “Евроген” (Россия). Суммарную РНК экстрагировали из 4–6 мг мышечной ткани при помощи RNeasyMicroKit (QIAGEN, Германия) по протоколу изготовителя. Определение концентрации тотальной РНК проводили на спектрофотометре UV 2450 (“Shimadzu”, Япония) в диапазоне от 200 до 320 нм. Пробу перед измерением разводили в 21 раз в TE-буфере (10 мМ Tris, 1 мМ ЭДТА, pH 8.0). Измерение каждой пробы проводилось не менее 3 раз в кювете для микрообъемов. Чистота образцов оценивалась по соотношению показателей поглощения при различных длинах волн. Для проведения обратной транскрипции были использованы компоненты фирмы “Синтол” (Россия). Для синтеза кДНК водный раствор, содержащий 1 мкг суммарной РНК, 30 мкМ случайных гексануклеотидов и 17.4 мкМ олиго-d (T)15, инкубировали в течение 3‑х мин при 70°С и затем переносили на лед. Далее к смеси добавляли 11.5 мкл мастер-микса (1.3 мМ dNTP, 0.02 ед./мкл ингибитора РНКазы, 6 ед./мкл M-MLV-ревертазы, 4 мкл 5х-буфера для M-MLV-ревертазы, “Синтол”). После этого пробы помещали в амплификатор для проведения обратной транскрипции: 10 мин при 25°С, 60 мин при 37°С, 5 мин при 95°С, 30 мин при 4°С. Полученная кДНК использовалась для проведения ПЦР в реальном времени с праймерами, специфичными к генам исследуемых белков (титину, обскурину и GAPDH). ОТ-ПЦР в реальном времени проводилась на амплификаторе ДТ-322 (“ДНК-Технология”, Россия) с использованием ДНК-полимеразы Tersus (“Евроген”) и флуоресцентного красителя SYBR Green I (“Invitrogen”). Режим ПЦР был следующим: 1) “горячий старт” – 95°С, 5 мин; 2) денатурация – 92°С, 10 с; 3) отжиг праймеров – 60°С, 30 с; 4) элонгация – 68°С, 1 мин. Этапы со 2-го по 4-й повторялись 30 раз. Изменение экспрессии генов рассчитывалось по методу ${{2}^{{ - \Delta \Delta {{C}_{t}}}}}$ согласно [22]. Значения ΔΔСt рассчитывались по формуле ΔΔСt= ΔСt (контроль) – ΔСt (опыт), каждое значение ΔСtрассчитывалось по формуле ΔСt = Сt (ген исследуемого белка) – Сt (референсный ген). Продукты ПЦР выделяли из геля согласно протоколу Cleanup Standard (“Евроген”). Фрагменты ДНК были секвенированы в ЗАО “Евроген”. Данные представлены значениями среднего арифметического ± стандартное отклонение M ± SD (при уровне значимости доверительного интервала р ≤ 0.01). Статистический анализ изменений содержания мРНК титина и обскурина проводили с использованием непараметрического U-критерия Манна–Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
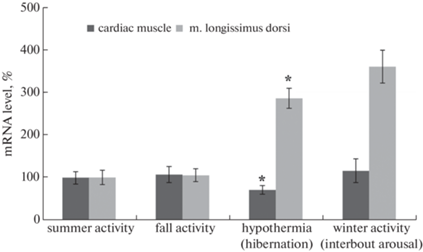
На рис. 1 представлены результаты, показывающие сезонные изменения содержания мРНК титина в сердечной и скелетной мышцах длиннохвостого суслика. Обнаружено уменьшение (на 28%, р ≤ 0.01) содержания мРНК титина в левом желудочке сердца сусликов группы “гипотермия”. В трех других группах статистически значимых различий в этом параметре не выявлено. В скелетной мышце сусликов из групп “гипотермия” и “зимняя активность” наблюдалось увеличение в 2.9 раза (р ≤ ≤ 0.01) и в 3.6 раза (р ≤ 0.01), соответственно, содержания мРНК титина. Статистически значимых различий в этом параметре между группами “летняя активность” и “осенняя активность” не выявлено.
Рис. 1.
Сезонные изменения содержания мРНК титина в поперечнополосатых мышцах длиннохвостого суслика. Указаны группы: летняя активность, осенняя активность, гипотермия (спячка), зимняя активность. *различия по сравнению с контрольной группой (летняя активность) статистически значимы при p ≤ 0.01. Значения представлены как M ± SD, n = 5.
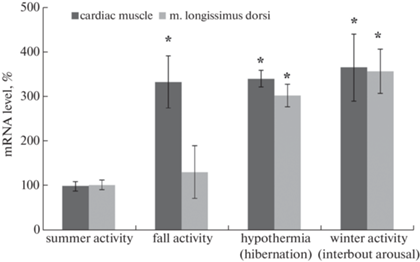
На рис. 2 представлены результаты, показывающие сезонные изменения содержания мРНК обскурина в сердечной мышце и m. longissimus dorsi длиннохвостого суслика. Содержание мРНК обскурина было повышено в 3.4–3.6 раза (р ≤ 0.01) в левом желудочке сердца сусликов из групп “осенняя активность”, “гипотермия”, “зимняя активность” и в 3.0 и 3.6 раза (р ≤ 0.01) в скелетной мышце сусликов из групп гипотермия” и “зимняя активность” соответственно.
Рис. 2.
Сезонные изменения содержания мРНК обскурина в поперечно-полосатых мышцах длиннохвостого суслика. Указаны группы: летняя активность, осенняя активность, гипотермия (спячка), зимняя активность. *различия по сравнению с контрольной группой (летняя активность) статистически значимы при p ≤ 0.01. Значения представлены, как M ± SD, n = 5.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Первое наше предположение об увеличении содержания мРНК титина в исследуемых мышцах в период “осенней” активности не подтвердилось, хотя мы ожидали выявить подобные изменения, особенно в скелетной мышце. В скелетных мышцах многих гибернантов обнаружены так называемые “fast–to–slow” изменения, приводящие к увеличению доли “медленных” волокон (содержащих преимущественно изоформу I типа тяжелой цепи миозина (ТЦМ)) и уменьшению доли “быстрых” волокон (содержащих преимущественно изоформы II типа ТЦМ) в период гибернации [23]. У длиннохвостого суслика подобная трансформация миозинового фенотипа в скелетных мышцах зарегистрирована в период “осенней” активности [24]. Известно также, что в скелетно-мышечных волокнах, содержащих “медленную” изоформу I ТЦМ, экспрессируются более длинные изоварианты N2A-изоформы титина, тогда как в “быстрых” волокнах – более короткие изоварианты N2A-титина. Учитывая это и полученные нами ранее данные об изменениях изоформного состава как титина [9], так и ТЦМ [24] в скелетных мышцах длиннохвостого суслика в период “осенней” активности, мы ожидали обнаружить увеличение содержания мРНК титина в этот период. Подобный результат мы ожидали получить и для сердечной мышцы “осенних” сусликов. Однако увеличения содержания мРНК титина ни в скелетной мышце (m. longissimus dorsi), ни в левом желудочке сердца длиннохвостого суслика в период “осенней” активности не было обнаружено. Эти данные позволяют сделать предположение об одинаковой эффективности трансляции как более коротких, так и более длинных изоформ титина.
Второе наше предположение, касающееся увеличения содержания мРНК титина в исследуемых мышцах сусликов в период гипотермии (спячки), нашло подтверждение для скелетной мышцы. При относительно незначительном уменьшении (на ~1/4) содержания мРНК титина в сердечной мышце гипотермных сусликов, в скелетной мышце наблюдалось увеличение (почти в 3 раза) содержания мРНК этого гигантского белка. По всей вероятности, эффективность молекулярных механизмов, стабилизирующих мРНК и защищающих ее от деградации в период торпора [16, 17, 25], выше не в сердечной, а в скелетных мышцах, в частности, в m. longissimus dorsi, сократительная активность которой подавлена полностью. Кроме того, температура скелетных мышц во время спячки, как известно, на несколько градусов ниже температуры функционирующей сердечной мышцы, что может быть дополнительным фактором, уменьшающим деградацию мРНК вследствие более сильного ингибирования активности РНКаз.
Третье наше предположение также подтвердилось. В частности, обнаружено не только поддержание стабильно повышенного уровня мРНК титина, но и его увеличение в m. longissimus dorsi длиннохвостого суслика в период “зимней” активности. В этот период в поперечно-полосатых мышцах длиннохвостого суслика, в том числе в m. longissimus dorsi, наблюдается преимущественный синтез гигантских белков саркомерного цитоскелета, в частности, титина [12], что приводит к восстановлению содержания этого белка, уменьшенного во время спячки. При этом в период “зимней” активности происходит и процесс быстрого обновления/оборота (turnover) титина, на что указывает увеличение содержания протеолитических Т2-фрагментов, уменьшение содержания которых (в 1.5–2 раза) также зарегистрировано в мышцах длиннохвостого суслика в период гипотермии (спячки) [12, 14]. Такие адаптационные изменения способствуют сохранению высокоупорядоченной структуры саркомеров и поддержанию нормальной сократительной активности мышц, атрофированных в период спячки. Увеличенное содержание мРНК титина в m. longissimus dorsi соответствует повышенным “запросам” синтетического аппарата мышцы и будет способствовать увеличению трансляции титина в этот период. Изменения, направленные на восстановление нормального содержания титина, а также его обновление, происходят и в сердечной мышце “зимних” активных сусликов [12]. При этом, как показано нами в текущем исследовании, происходит восстановление и даже незначительное увеличение содержания мРНК в левом желудочке сердца сусликов вышеуказанной группы (рис. 1). Полученные результаты свидетельствуют о дифференциальной экспрессии мРНК титина в исследованных поперечно-полосатых мышцах, в особенности в m. longissimus dorsi, у длиннохвостого суслика.
Обсуждая результаты по обскурину, отметим, что все наши предположения нашли подтверждения. В частности, мы обнаружили трехкратное и более увеличение содержания мРНК обскурина в сердечной мышце сусликов трех экспериментальных групп (“осенняя активность”, “гипотермия”, “зимняя активность”), а также в скелетной мышце этих животных из групп “гипотермия” и “зимняя активностьн”.
Обскурин (“obscure” – неизвестный, неясный) – гигантский белок семейства титина – семейства белков, экспрессирующихся в поперечно-полосатых мышцах позвоночных и беспозвоночных животных и состоящих преимущественно из Ig- и Fn3-доменов, одного или двух киназных доменов, а также содержащих уникальные упруго-эластичные или сигнальные домены [19, 20, 26, 27]. В поперечно-полосатых мышцах млекопитающих обскурин был открыт 21 год назад [28]. Как и титин, обскурин кодируется одним геном и подвергается альтернативному сплайсингу, вследствие которого экспрессируются более длинные (~720–970 кДа) и более короткие (~40–500 кДа) изоформы этого белка [20, 27]. Показано, что в саркомере обскурин локализуется в М-линии, Z-диске и в А/I-зоне [20, 29]. Обнаружена локализация обскурина во вставочных дисках кардиомиоцитов, в костамерах, саркоплазматическом ретикулуме, а также в ядре [20]. Считается, что обскурин, в отличие от титина, участвующего в формировании длины толстых нитей и продольных размеров саркомеров, определяет поперечные размеры саркомеров и мышечных волокон в целом. Кроме этого, обсуждается участие обскурина в миофибриллогенезе, сборке толстых нитей и поддержании кальциевого гомеостаза [19, 20]. Взаимодействие обскурина с титином в саркомере [29] и участие обскурина во встраивании титина в Z-диск [30] свидетельствуют о тесной структурной и функциональной взаимосвязи этих двух гигантских белков. Обсуждается сопряженное участие этих белков, формирующих в районе Z-диска/I-зоны саркомера упруго-эластичный комплекс, в регуляции процессов внутриклеточной сигнализации [29].
Полученные нами данные свидетельствуют о сопряженных изменениях титина и обскурина в поперечно-полосатых мышцах длиннохвостого суслика в периоды “осенней” и “зимней” активности. Можно предположить, что в эти периоды происходит не только обновление обскурина и восстановление возможно уменьшенного при спячке содержания этого белка, но и синтез его новых изоформ, участвующих совместно с более длинными изоформами титина в реконструкции трехмерного упруго-эластичного каркаса. Нельзя исключить, что при этом происходит увеличение содержания обскурина – больше такового, имеющегося в мышцах “летних” активных (контрольных) животных. В пользу этого предположения можно привести следующие данные. Обскурин, несмотря на то что считается миофибриллярным белком, взаимодействует не только с белками саркомеров, но и с белками саркоплазматического ретикулума, а также субсарколеммальными белками, участвуя, тем самым, в поддержании целостности сарколеммы [20, 31–33]. Согласно исследованию [34], содержание несаркомерных белков (субсарколемальных, белков костамеров), которые не участвуют в формировании высокоупорядоченной саркомерной структуры с четко выверенной белковой стехиометрией, может увеличиваться в мышцах. В частности, Chopard и соавт. [34] зарегистрировали значительное увеличение содержания дисферлина и белков костамера в двух скелетных мышцах человека после 84-суточного длительного постельного режима. Учитывая эти данные, можно предположить, что обнаруженное нами повышенное содержание мРНК обскурина в поперечнополосатых мышцах сусликов в период “осенней” и “зимней” активности будет приводить к увеличению содержания этого белка. Адаптационное значение подобных изменений, наряду с изменениями в титине, может заключаться в поддержании структурной целостности мышечных клеток, а также обеспечении необходимого уровня сократительной активности мышц в разные фазы гибернационного цикла: вход в спячку, спячка, выход из спячки, межбаутная/ “зимняя” активность.
Итак, мы впервые получили данные о дифференциальной экспрессии мРНК титина и обскурина в сердечной и скелетной (m. longissimus dorsi) мышцах истинного гибернанта длиннохвостого суслика. В совокупности с полученными нами ранее данными [9], новые результаты позволяют говорить о сопряженных изменениях изоформного состава и содержания титина и обскурина – двух гигантских белков, участвующих в формировании и поддержании высокоупорядоченной структуры миофибрилл, целостности сарколеммы и мышцы в целом, а также играющих важную роль в регуляции процессов внутриклеточной сигнализации. В связи с этим будущие исследования изменений изоформного состава и содержания обскурина в мышцах гибернантов с целью выяснения роли этих изменений являются перспективной научной задачей.
Список литературы
Brauch KM, Dhruv ND, Hanse EA, Andrews MT (2005) Digital transcriptome analysis indicates adaptive mechanisms in the heart of a hibernating mammal. Physiol Genomics 23 (2): 227–234. https://doi.org/10.1152/physiolgenomics.00076.2005
Williams DR, Epperson LE, Li W, Hughes MA, Taylor R, Rogers J, Martin SL, Cossins AR, Gracey AY (2005) Seasonally hibernating phenotype assessed through transcript screening. Physiol Genomics 24 (1): 13–22. https://doi.org/10.1152/physiolgenomics.00301.2004
Yan J, Barnes BM, Kohl F, Marr TG (2008) Modulation of gene expression in hibernating arctic ground squirrels. Physiol Genomics 32 (2): 170–181. https://doi.org/10.1152/physiolgenomics.00075.2007
Hampton M, Melvin RG, Kendall AH, Kirkpatrick BR, Peterson N, Andrews MT (2011) Deep sequencing the transcriptome reveals seasonal adaptive mechanisms in a hibernating mammal. PLoS One 6 (10): e27021. https://doi.org/10.1371/journal.pone.0027021
Vermillion KL, Anderson KJ, Hampton M, Andrews MT (2015) Gene expression changes controlling distinct adaptations in the heart and skeletal muscle of a hibernating mammal. Physiol Genomics 47 (3): 58–74. https://doi.org/10.1152/physiolgenomics.00108.2014
Bogren LK, Grabek KR, Barsh GS, Martin SL (2017) Comparative tissue transcriptomics highlights dynamic differences among tissues but conserved metabolic transcript prioritization in preparation for arousal from torpor. J Comp Physiol B 187: 735–748https://doi.org/10.1007/s00360-017-1073-x
Chang H, Jiang S, Ma X, Peng X, Zhang J, Wang Z, Xu S, Wang H, Gao Y (2018) Proteomic analysis reveals the distinct energy and protein metabolism characteristics involved in myofiber type conversion and resistance of atrophy in the extensor digitorum longus muscle of hibernating Daurian ground squirrels. Comp Biochem Physiol Part D: Genomics Proteomics 26: 20–31. https://doi.org/10.1016/j.cbd.2018.02.002
Andrews MT (2019) Molecular interactions underpinning the phenotype of hibernation in mammals. J Exp Biol 222 (2): jeb160606. https://doi.org/10.1242/jeb.160606
Vikhlyantsev IM, Karaduleva EV., Podlubnaya ZA (2008) Seasonal changes in the composition of titin isoforms in muscles of hibernating ground squirrels. Biophysics 53: 598–603. https://doi.org/10.1134/S0006350908060249
Salmov NN, Vikhlyantsev IM, Ulanova AD, Gritsyna YV, Bobylev AG, Saveljev AP, Makariushchenko VV, Maksudov GY, Podlubnaya ZA (2015) Seasonal changes in isoform composition of giant proteins of thick and thin filaments and titin (connectin) phosphorylation level in striated muscles of bears (Ursidae, Mammalia). Biochemistry (Mosc) 80 (3): 343–355https://doi.org/10.1134/S0006297915030098
Salmov NN, Gritsyna YV, Ulanova AD, Vikhlyantsev IM, Podlubnaya ZA (2015) On the role of titin phosphorylation in the development of muscular atrophy. Biophysics 60: 684–686. https://doi.org/10.1134/S0006350915040193
Popova S, Ulanova A, Gritsyna Y, Salmov N, Rogachevsky V, Mikhailova G, Bobylev A, Bobyleva L, Yutskevich Y, Morenkov O, Zakharova N, Vikhlyantsev I (2020) Predominant synthesis of giant myofibrillar proteins in striated muscles of the long-tailed ground squirrel Urocitellus undulatus during interbout arousal. Sci Rep 10 (1): 15185. https://doi.org/10.1038/s41598-020-72127-y
Popova SS, Yurshenas DA, Mikhailova GZ, Bobyleva LG, Salmov NN, Tyapkina OV, Nurullin LF, Gazizova GR, Nigmetzyanov IR, Gusev OA, Zakharova NM, Vikhlyantsev IM (2021) Stable Level of Giant Sarcomeric Cytoskeletal Proteins in Striated Muscles of the Edible Dormouse Glis glis during Hibernation. J Evol Biochem Phys 57: 886–895. https://doi.org/10.1134/S0022093021040128
Vikhlyantsev IM, Podlubnaya ZA (2012) New titin (connectin) isoforms and their functional role in striated muscles of mammals: facts and suppositions. Biochemistry (Mosc) 77 (13): 1515–1535https://doi.org/10.1134/S0006297912130093
Loescher CM, Hobbach AJ, Linke WA (2021) Titin (TTN): from molecule to modifications, mechanics and medical significance. Cardiovasc Res cvab328https://doi.org/10.1093/cvr/cvab328
Knight JE, Narus EN, Martin SL, Jacobson A, Barnes BM, Boyer BB (2000) mRNA stability and polysome loss in hibernating Arctic ground squirrels (Spermophilus parryii). Mol Cell Biol 20 (17): 6374–6379. https://doi.org/10.1128/MCB.20.17.6374-6379.2000
Grabek KR, Diniz Behn C, Barsh GS, Hesselberth JR, Martin SL (2015) Enhanced stability and polyadenylation of select mRNAs support rapid thermogenesis in the brown fat of a hibernator. eLife 4: e04517. https://doi.org/10.7554/eLife.04517
van Breukelen F, Martin SL (2002) Reversible depression of transcription during hibernation. J Comp Physiol B 172 (5): 355–361. https://doi.org/10.1007/s00360-002-0256-1
Kontrogianni-Konstantopoulos A, Ackermann MA, Bowman AL, Yap SV, Bloch RJ (2009) Muscle giants: molecular scaffolds in sarcomerogenesis. Physiol Rev 89 (4): 1217–1267. https://doi.org/10.1152/physrev.00017.2009
Manring HR, Carter OA, Ackermann MA (2017) Obscure functions: the location-function relationship of obscurins. Biophys Rev 9 (3): 245–258. https://doi.org/10.1007/s12551-017-0254-x
Захарова Н (2014). Некоторые особенности разогрева гибернирующих сусликов Spermophilus undulatus при вызванном пробуждении. Фундамент исслед 6: 1401–1405. [Zakharova NM (2014) Some features of body warming at provoked awakening of hibernating ground squirrels Spermophilus undulatus. Fundament Issled 6: 1401–1405. (In Russ)].
Livak KJ, Schmittgen TD (2001) Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C (T)) Method Methods 25 (4): 402–408. https://doi.org/10.1006/meth.2001.1262
Cotton CJ (2016) Skeletal muscle mass and composition during mammalian hibernation. J Exp Biol 219 (2): 226–234. https://doi.org/10.1242/jeb.125401
Lazareva MV, Trapeznikova KO, Vikhliantsev IM, Bobylev AG, Klimov AA, Podlubnaia ZA (2012) Seasonal changes in the isoform composition of the myosin heavy chains in skeletal muscles of hibernating ground squirrels Spermophilus undulatus. Biophysics 57: 764–768https://doi.org/10.1134/S0006350912060085
Morin P Jr, Storey KB (2009) Mammalian hibernation: differential gene expression and novel application of epigenetic controls. Int J Dev Biol 53 (2–3): 433–442. https:// pubmed.ncbi.nlm.nih.gov/19412897/
Benian GM, Mayans O (2015) Titin and obscurin: giants holding hands and discovery of a new Ig domain subset. J Mol Biol 427 (4): 707–714https://doi.org/10.1016/j.jmb.2014.12.017
Ackermann MA, Shriver M, Perry NA, Hu LY, Kontrogianni-Konstantopoulos A (2014) Obscurins: Goliaths and Davids take over non-muscle tissues. PLoS One 9 (2): e88162. https://doi.org/10.1371/journal.pone.0190842
Young P, Ehler E, Gautel M (2001) Obscurin, a giant sarcomeric Rho guanine nucleotide exchange factor protein involved in sarcomere assembly. J Cell Biol 154 (1): 123–136. https://doi.org/10.1083/jcb.200102110
Bang ML, Centner T, Fornoff F, Geach AJ, Gotthardt M, McNabb M, Witt CC, Labeit D, Gregorio CC, Granzier H, Labeit S (2001) The complete gene sequence of titin, expression of an unusual approximately 700-kDa titin isoform, and its interaction with obscurin identify a novel Z-line to I-band linking system. Circ Res 89 (11): 1065–10672. https://doi.org/10.1161/hh2301.100981
Bowman AL, Catino DH, Strong JC, Randall WR, Kontrogianni-Konstantopoulos A, Bloch RJ (2008) The rho-guanine nucleotide exchange factor domain of obscurin regulates assembly of titin at the Z-disk through interactions with Ran binding protein 9. Mol Biol Cell 19 (9): 3782–3792https://doi.org/10.1091/mbc.e08-03-0237
Bagnato P, Barone V, Giacomello E, Rossi D, Sorrentino V (2003) Binding of an ankyrin-1 isoform to obscurin suggests a molecular link between the sarcoplasmic reticulum and myofibrils in striated muscles. J Cell Biol 160 (2): 245–253. https://doi.org/10.1083/jcb.200208109
Kontrogianni-Konstantopoulos A, Jones EM, Van Rossum DB, Bloch RJ (2003) Obscurin is a ligand for small ankyrin 1 in skeletal muscle. Mol Biol Cell 14 (3): 1138–1148https://doi.org/10.1091/mbc.e02-07-0411
Randazzo D, Giacomello E, Lorenzini S, Rossi D, Pierantozzi E, Blaauw B, Reggiani C, Lange S, Peter AK, Chen J, Sorrentino V (2013) Obscurin is required for ankyrinB-dependent dystrophin localization and sarcolemma integrity. J Cell Biol 200 (4): 523–536.https://doi.org/10.1083/jcb.201205118
Chopard A, Arrighi N, Carnino A, Marini JF (2005) Changes in dysferlin, proteins from dystrophin glycoprotein complex, costameres, and cytoskeleton in human soleus and vastus lateralis muscles after a long-term bedrest with or without exercise. FASEB J 19 (12): 1722–1724. https://doi.org/10.1096/fj.04-3336fje
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


