Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 5, стр. 434-446
ВЛИЯНИЕ Ni2+ НА СЕРДЕЧНЫЙ И ДЫХАТЕЛЬНЫЙ РИТМЫ У НОВОРОЖДЕННЫХ КРЫСЯТ
С. В. Кузнецов 1, *, Н. Н. Кузнецова 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: ksv@iephb.ru
Поступила в редакцию 19.05.2022
После доработки 21.07.2022
Принята к публикации 22.07.2022
- EDN: YIYFQN
- DOI: 10.31857/S0044452922050060
Аннотация
На новорожденных крысятах 3–16-дневного возраста (Р3–16) изучено влияние Ni2+, блокатора низкопороговых кальциевых каналов Т-типа (T-VDCC) и натрий-кальциевого обменника (NCX), на параметры сердечного и дыхательного ритмов. Обнаружена четкая возрастная зависимость выраженности аритмогенного эффекта, возникающего при блокаде кальциевых каналов. У 100% 3-дневных крысят при инъекции NiCl2 в дозе 109 мг/кг (ED100) возникает преходящий атипичный сердечный ритм, представляющий собой чередование периодов умеренной брадикардии с патологически медленным (до 20–60 сокр/мин) сердечным ритмом. Параллельно развивается выраженная дисфункция дыхательной системы с пачечной формой дыхания. Данный симптомокомплекс возникает у 75% 10–14-суточных крысят и полностью отсутствует у 15–16-суточных. Феноменологически сходные нарушения сердечного ритма наблюдаются у новорожденных крысят после инъекции хлорида никеля, при отравлении ингибиторами ацетилхолинэстеразы и при активации центральных Н-холинергических структур. Полученные данные позволяют предполагать, что в ранний период постнатального онтогенеза крыс нарушение механизмов кальциевого обмена может играть определенную роль в развитии нарушений ритмогенеза.
В раннем постнатальном онтогенезе у крысят могут возникать эпизоды атипичного сердечного ритма, представляющие собой чередование периодов умеренной брадикардии с периодами еще более медленного (до 20 сокр/мин) ритма. Аналогичные нарушения сердечного ритма возникают в условиях активации холинергической системы, вызванной рядом фармакологических воздействий [1–3]. Нами был проведен цикл исследований, направленных на выявление возможной роли дисфункции ионных каналов в развитии данного вида аритмии. В опытах на новорожденных крысятах было проведено изучение влияния блокады медленных кальциевых каналов L-типа [4] и Na+/K+-АТФазы [5], а также блокады и активации рианодиновых рецепторов (RyR) [6] на параметры сердечного и дыхательного ритмов. Было установлено, что нарушение этих ионообменных процессов у новорожденных крысят к значимым нарушениям сердечного ритма не приводит. Вместе с тем в сердце есть еще один тип кальциевых каналов, который может принимать участие в нарушении нормального ритмогенеза.
Кальциевые потенциал-зависимые каналы Т‑типа (T-type voltage-dependent Ca2+ channel, T-VDCC) наиболее многочисленны в клетках, не имеющих системы поперечных канальцев, таких как узловые и эмбриональные сердечные миоциты. T-VDCC расположены преимущественно в синоатриальном и атриовентрикулярном узлах, клетках Пуркинье и участвуют в работе сердечного пейсмекера [7]. В спонтанно сокращающихся пейсмекерных клетках увеличение субсарколеммальной внутриклеточной концентрации Ca2+ происходит одновременно с последней третью диастолической деполяризации из-за локального спонтанного высвобождения Ca2+ из саркоплазматического ретикулума, т.е. быстрого подъема уровня ионов Са2+ (спарков). Спонтанный выброс Са2+ приводит к активации Na+/Ca2+ обменника в прямом режиме (1 Са2+ – наружу, 3 Na+ – внутрь клетки), создающего входящий деполяризующий ток INa–Ca, ускоряющий диастолическую деполяризацию. В то же время активация кальциевого тока Т-типа (ICaT) с одной стороны сама по себе приводит к еще большему ускорению диастолической деполяризации, а с другой – дополнительно усиливает входящий INa–Ca. В итоге диастолическая деполяризация переходит из линейной фазы в экспоненциальную, в результате чего мембрана пейсмекерного миоцита деполяризуется до порога запуска потенциала действия. Этот механизм указывает на важную роль ICaT и субсарколеммального внутриклеточного высвобождения Ca2+ в нормальной деятельности сердечного пейсмекера, а при определенных условиях может способствовать развитию эктопических предсердных аритмий. Помимо участия в обеспечении пейсмекерной активности, вход Ca2+ через T–VDCC может напрямую регулировать внутриклеточные концентрации Ca2+, являющегося важным вторичным мессенджером для различных клеточных процессов [8, 9]. Локализующиеся в сердечно-сосудистой системе T-VDCC подразделяются на подтипы Cav3.1 и Cav3.2, которые имеют различные функциональные особенности. Вместе с тем анализ литературы не дает однозначного ответа о роли этих подтипов в работе миокарда [10, 11].
Как правило, кальциевые каналы Т-типа экспрессируются в неонатальных кардиомиоцитах, клетках синоатриального и атриовентрикулярного узла, но практически не экспрессируются во взрослых желудочковых миоцитах [12, 13]. T–VDCC могут повторно экспрессироваться в гипертрофированном миокарде, это позволяет предположить, что данные каналы являются частью фетальной генной программы, возникающей вновь во время гипертрофического процесса [13]. Кроме того, при различных патологических состояниях ICaT часто регистрируется в локальной области миокарда на некоторых стадиях ремоделирования, при этом происходит выраженная экспрессия одного или нескольких канальных белков Cav3.1–3.3 [14]. Предполагается, что у кардиомиопатических хомяков, крыс и кошек чрезмерная перегрузка кальцием может быть связана с аномальной экспрессией T–VDCC во время развития сердечной недостаточности [15]. Сходные данные получены и при анализе динамики созревания натрий-кальциевого обменника (Na+/Ca2+ exchanger, NCX). Экспрессия и функция NCX в сердечных миоцитах наиболее высоки у новорожденных крыс и постепенно снижаются при постнатальном развитии. При гипертрофии, вызванной экспериментальной перегрузкой давлением или при сердечной недостаточности у человека, экспрессия NCX увеличивается и переходит в повышенную активность, аналогично ранней фазе постнатального развития крысы, что позволяет предположить наличие общего базового механизма в контроле экспрессии NCX в незрелом и гипертрофированном миокарде [16].
Установлено, что подтипы T–VDCC можно различать по их чувствительности к блокированию Ni2+, причем изоформа Cav3.2 приблизительно в 20 раз более чувствительна к никелю, чем Cav3.1 и Cav2.3 [17–21]. NCX также может блокироваться Ni2+, но необходимая для этого концентрация никеля должна быть более, чем в 10 раз выше, чем в случае с T-VDCC [22–24]. Исследования спонтанных потенциалов действия с помощью метода фиксации тока показали, что Ni2+ замедляет позднюю фазу деполяризации и, следовательно, замедляет срабатывание пейсмекерных синоатриальных клеток у кролика или латентных пейсмекерных клеток у кошки. В опытах in vivo изменения чувствительности T–VDCC к никелю в перинатальном онтогенезе не исследовались, но могли бы представлять интерес [9], в том числе и для анализа безопасности фармакологических средств для новорожденных и недоношенных детей [21].
Целью настоящего исследования стало изучение последствий блокады кальциевых каналов Т-типа ионами Ni2+ у крысят 3–16-дневного возраста.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования
Работа выполнена на крысятах Rattus norvegicus f. domestica 3-, 10-, 11-, 12-, 13-, 14-, 15- и 16-дневного возраста (Р3–Р16). В каждой возрастной группе было от 6 до 62 животных без разделения по полу. Всего в опытах использовано 308 крысят. Все экспериментальные процедуры соответствовали требованиям Комитета по биоэтике Института эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук, основанным на директиве Европейского парламента 2010/63/EU “О защите животных, используемых в экспериментальных целях”.
Экспериментальная установка и методы регистрации
Животных помещали в экранированную камеру с температурой 26 ± 0.5°С. Контроль температуры осуществляли с помощью цифрового термометра RST-02100 (RST, Швеция). Регистрацию физиологических показателей проводили на ненаркотизированных крысятах в условиях мягкой фиксации животных.
Исследовали ЭКГ, показатели внешнего дыхания. В целях снижения уровня артефактов, при регистрации ЭКГ у крысят применяли нестандартное отведение от теменной части головы и крестцовой области. Для анализа частоты дыхания (ЧДД) осуществляли регистрацию экскурсии грудной клетки с использованием пьезоэлектрического датчика VP-102 (RTF, Германия). В экспериментах использовали усилители биопотенциалов ИУ-40 (производство ЭПМ НИИЭМ РАМН). ЧДД регистрировали при полосе пропускания усилителя от 0.15 до 30 Гц, ЭКГ – от 5 до 50 Гц, ЭМГ – от 5 до 150 Гц. Для ввода аналоговых сигналов в компьютер использовали АЦП E14–440 (L-card, Россия) с периодом дискретизации 1 мс. Анализ регистрируемых сигналов проводили в программе “PowerGraph 3.3.10” (ООО “ДИСофт”, Россия) и “Origin 2019” (OriginLab Corporation, США).
У интактных крысят после 15-минутного периода адаптации в течение 30 мин регистрировали сердечный и дыхательный ритм. После регистрации физиологических показателей у интактных животных крысятам внутрибрюшинно вводили шестиводный хлористый никель (7791-20-0 Sigma-Aldrich) в дозах от 8 до 273 мг/кг (в пересчете на безводный NiCl2). Общее время исследования каждого животного составляло от 75 до 90 мин в зависимости от состояния животного. У части крысят осуществляли дополнительную регистрацию ЭКГ и дыхания через 6–8 ч после инъекции препарата.
Определение эффективной дозы хлорида никеля
В доступной литературе имеется очень мало сведений об острых отравлениях соединениями никеля. Установленные в экспериментах на взрослых крысах среднесмертельные (LD50) дозы хлорида никеля существенно различаются у разных исследователей. В частности, исследования острой пероральной токсичности девяти соединений никеля, проведенные на взрослых белых крысах, подтвердили общую низкую пероральную токсичность этих соединений и продемонстрировали широкий диапазон значений LD50 от 310 до >11 000 мг/кг. Шестиводный хлорид никеля, растворенный в дистиллированной воде, вводили крысам перорально в дозах от 159 до 2000 мг/кг. В течение 14 дней исследования не наблюдалось смертельных исходов в дозах до 400 мг/кг. Острая пероральная LD50 была определена как 500 мг/кг, с 95% доверительным интервалом 397–624 мг/кг [25]. По данным другой группы исследователей, – LD50 при пероральном введении крысам составляет 681 мг/кг, при внутривенном – ровно на порядок ниже (68.1 мг/кг) [26]. Внутрибрюшинное введение хлористого никеля мышам в дозе 500 мг/кг приводит к их гибели на 3‑й день после инъекции. За время наблюдения у подопытных мышей отмечено возникновение респираторного дистресса. Среднесмертельная доза, установленная в этом же исследовании при внутривенном введении NiCl2 крысам, составила 38.8 мг/кг [27].
Так как в перинатальном онтогенезе крыс токсические дозы никеля ранее не были установлены, то мы провели серию опытов с внутрибрюшинным введением NiCl2 в дозах 8, 14, 27, 55, 82, 109, 164, 218 и 273 мг/кг. Для установления действующей (эффективной) дозы было использовано несколько групп, состоящих из 4–12 крысят 3-, 10- и 16-дневного возраста. За период наблюдения в течение 8–10 ч после введения препарата была зафиксирована гибель одного 13-дневного животного при инъекции ему никеля в дозе 109 мг/кг и одного 16-дневного – при введении никеля в дозе 273 мг/кг. Таким образом, несмотря на наличие выраженных изменений ряда физиологических показателей, нам не удалось установить среднесмертельную дозу препарата. Средняя эффективная доза (ED50) хлористого никеля, вызывающая нарушения сердечного или дыхательного ритма, составила для 3–16-дневных крысят 14 мг/кг.
Статистическая обработка данных
Статистическую обработку данных осуществляли в программе “Origin 2019”. Статистически обработанные данные представлены как среднее ± ± стандартная ошибка (M ± SEM). Для определения достоверности различий между группами использовали парный тест Стьюдента. Все изменения рассматривали по отношению к фоновым показателям до введения препарата. Различия считали статистически значимыми при р < 0.05. Расчет коэффициента сердечной аритмии (КА) осуществляли по формуле КА = (RRmax-RRmin)/RRmean, где RR – длительность кардиоинтервалов. Расчеты показателей частоты сердечных сокращений (ЧСС) и ЧДД осуществляли как за всю эпоху анализа, так и дополнительно в первые и последние три минуты регистрации после инъекции хлорида никеля. При анализе периодограмм сердечного ритма вычисляли коэффициент асимметрии (Skewness) и коэффициент эксцесса (Kurtosis), который для обеспечения сравнения со стандартным нормальным распределением, рассчитывали как куртозис Пирсона (куртоз – 3).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ предварительных данных показал, что, начиная с дозы 109 мг/кг, у 100% 3-дневных крысят возникают единообразные изменения сердечного и дыхательного ритма. Поэтому доза 109 мг/кг была нами выбрана в качестве основной, используемой для тестирования на животных всех возрастных групп (табл. 1).
Таблица 1.
Физиологические показатели у крысят в фоне и после инъекции NiCl2 в дозе 109 мг/кг
| Показатели | Фон | NiCl2 | |||
|---|---|---|---|---|---|
| M ± SEM | M ± SEM | Mediana, (first – last) | % к фону | % животных с наличием комплексов | |
| 3 сут (n = 12) | |||||
| ЧСС в мин | 322.1 ± 3.4 | 256.1 ± 6.8* | 260 (267–185) | 80 | 100 |
| ЧДД в мин | 114.0 ± 2.6 | 71.8 ± 1.4* | 71 (78–29) | 63 | |
| КА, у.е. | 0.29 ± 0.05 | 5.21 ± 0.75* | – | 1797 | |
| 10–14 сут (n = 16) | |||||
| ЧСС в мин | 461.6 ± 11.4 | 296.1 ± 8.1* | 293 (423–264) | 64 | 73 |
| ЧДД в мин | 120.6 ± 5.0 | 68.2 ± 3.5* | 70 (76–41) | 57 | |
| КА, у.е. | 0.12 ± 0.01 | 3.93 ± 0.56* | – | 3275 | |
| 15–16 сут (n = 12) | |||||
| ЧСС в мин | 494.5 ± 7.9 | 352.0 ± 15.2* | 366 (451–317) | 71 | 0 |
| ЧДД в мин | 123.5 ± 5.3 | 57.8 ± 2.3* | 56 (69–50) | 47 | |
| КА, у.е. | 0.13 ± 0.02 | 0.50 ± 0.04* | – | 385 | |
Здесь и в табл. 2: *р < 0.05 – достоверность различий между фоном и препаратом.
ЧДД – частота дыхательных движений, ЧСС – частота сердечных сокращений. КА – коэффициент аритмии. Mediana – медиана для среднего значения показателя по группе; (first – last) – средние значения ЧСС или ЧДД в первые и последние три минуты регистрации после инъекции NiCl2.
После проведения оценки изменений показателей сердечного ритма в экспериментальных группах животных, мы объединили для дальнейшего анализа несколько однородных по характеру реакции возрастных групп крысят. В результате были получены три группы крысят: 3- (масса тела 10.1 ± ± 0.2 г), 10–14- (масса тела 27.1 ± 0.9 г) и 15–16-дневные (масса тела 32.3 ± 1.0 г).
Первые признаки нарушения ритма дыхания возникают у крысят приблизительно через 3 мин после инъекции хлористого никеля. Еще через 30‒60 с начинается развитие брадикардии, переходящее в пачечную форму активности, где установившийся медленный сердечный ритм чередуется с периодами еще более медленных сердечных сокращений (рис. 1). Через 15–25 мин происходит восстановление регулярного дыхательного и сердечного ритма. Следует отметить, что, несмотря на стабилизацию ритма сердца, восстановления до нормальной ЧСС не происходит на протяжении 6–8 ч после инъекции.
Рис. 1.
Преходящие нарушения сердечного (верхняя кривая) и дыхательного (нижняя кривая) ритма у 11-дневного крысенка в фоне (а) и через 140 с (b), 660 с (c), 930 с (d) после инъекции NiCl2 в дозе 109 мг/кг.
Здесь и на рис. 2, 3: по оси абсцисс – время (с), по оси ординат – амплитуда ЭКГ (мВ) и пьезограммы дыхания (у.е.).
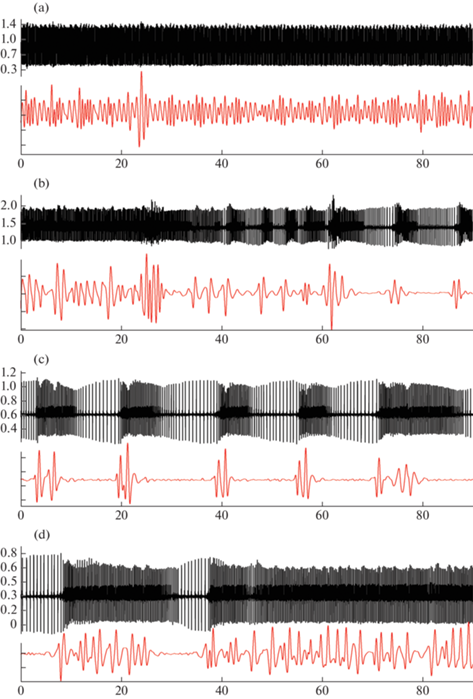
Примечательно, что увеличение дозы препарата до 273 мг/кг вызывает у животных изменения физиологических показателей, сопоставимые по клинической картине, времени наступления и продолжительности с наблюдаемыми при введении NiCl2 в дозе 109 мг/кг (табл. 2, рис. 2).
Таблица 2.
Изменение физиологических показателей у крысят в фоне и после инъекции NiCl2 в разных дозах
| Показатели | Фон | NiCl2 | ||
|---|---|---|---|---|
| M ± SEM | M ± SEM | % к фону | % животных с наличием комплексов | |
| 3-и сутки, 14–27 мг/кг (n = 12) | ||||
| ЧСС в мин | 311.0 ± 18.9 | 235.9 ± 9.2* | 76 | 75 |
| ЧДД в мин | 110.1 ± 7.0 | 76.6 ± 3.6* | 70 | |
| КА, у.е. | 0.26 ± 0.09 | 1.87 ± 0.45* | 719 | |
| 3-и сутки, 55 мг/кг (n = 8) | ||||
| ЧСС в мин | 286.4 ± 13.2 | 214 ± 25.4* | 75 | 67 |
| ЧДД в мин | 96.4 ± 8.9 | 71.4 ± 7.6* | 74 | |
| КА, у.е. | 0.29 ± 0.06 | 3.92 ± 0.99* | 1352 | |
| 3-и сутки, 273 мг/кг (n = 8) | ||||
| ЧСС в мин | 287.7 ± 2.0 | 134.7 ± 2.3* | 47 | 100 |
| ЧДД в мин | 110.3 ± 5.0 | 75.3 ± 7.4* | 68 | |
| КА, у.е. | 0.24 ± 0.01 | 4.73 ± 0.70* | 1971 | |
| 15–16-е сутки, 273 мг/кг (n = 8) | ||||
| ЧСС в мин | 487.0 ± 11.2 | 332.0 ± 36.7* | 68 | 0 |
| ЧДД в мин | 135.7 ± 15.0 | 67.7 ± 5.2* | 50 | |
| КА, у.е. | 0.11 ± 0.02 | 0.74 ± 0.19* | 673 | |
Рис. 2.
Преходящие нарушения сердечного (верхняя кривая) и дыхательного (нижняя кривая) ритма у 3-дневного крысенка через 170 с (а) и 1250 с (b) после инъекции NiCl2 в дозе 273 мг/кг.
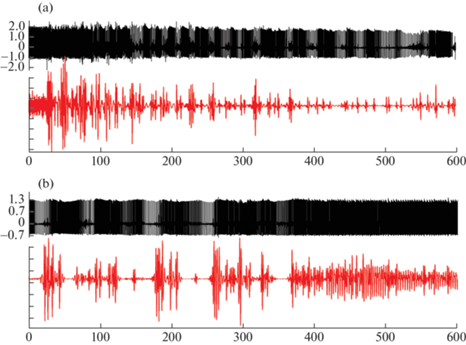
Как мы уже указывали выше, возникновение нарушений ритма дыхания на несколько секунд опережает начало развития брадикардии и появление пачечной аритмии (рис. 1, 2). У 37% 3-дневных и 90% 10–14-дневных крысят на протяжении периода воспроизведения атипичного сердечного ритма отслеживается устойчивая взаимосвязь между комплексами сердечных сокращений и вспышками высокоамплитудного дыхания (рис. 3). В период между комплексами дыхательных движений может наблюдаться или нерегулярное поверхностное дыхание (рис. 3с), или периоды апноэ. У крысят на Р15–16 после инъекции NiCl2 пачечная форма дыхания отсутствует, хотя ритм дыхания замедляется и имеет нерегулярный характер (табл. 1).
Рис. 3.
Синхронизация комплексов сердечных сокращений (верхняя кривая) и вспышек дыхательного ритма (нижняя кривая) у 13-дневного крысенка через 150 с (a, b, c) и 1100 с (d, e) после инъекции NiCl2 в дозе 109 мг/кг.
На (b, d) – фрагменты записей (a, c), отмеченные прямоугольником; на (с) – фрагмент (b) с амплитудой пьезограммы дыхания, умноженной в 5 раз.
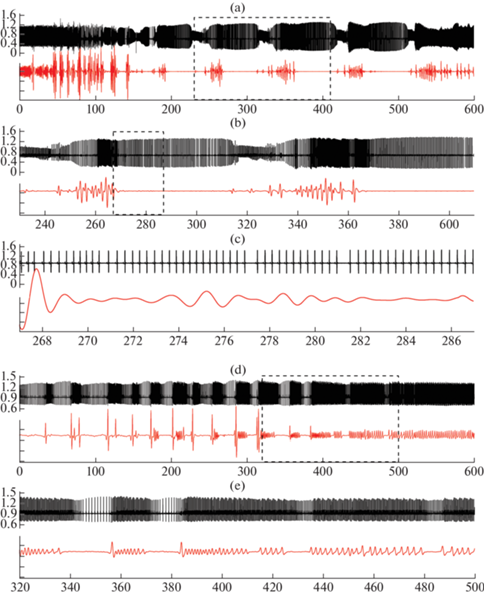
У 3–14-дневных крысят в период аритмии ЧСС имеет большую вариабельность. В разных возрастных группах разброс RR-интервалов существенно различается. Наблюдается четкая возрастная зависимость выраженности аритмогенного эффекта препарата, максимального на 3-и сутки и отсутствующего у 15-дневных крысят (рис. 4). Более выраженный прирост величины коэффициента аритмии на Р10–14, представленный в табл. 1, обусловлен меньшим разбросом длительности сердечного цикла в фоне по сравнению с Р3, когда и у интактных крысят возникают характерные для этого возраста преходящие короткие периоды брадикардии.
Рис. 4.
Скаттерограмма RR-интервалов у крысят разных возрастных групп в фоне и после введения NiCl2 в дозе 109 мг/кг.
По оси абсцисс – группы животных: 1 – 3 сут, фон; 2 – 3 сутки, NiCl2, 3 – 10–14 сут, фон; 4 – 10–14 сут, NiCl2; 5 – 15–16 сут, фон; 6 – 15–16 сут, NiCl2. По оси ординат – длительность сердечного цикла (с).
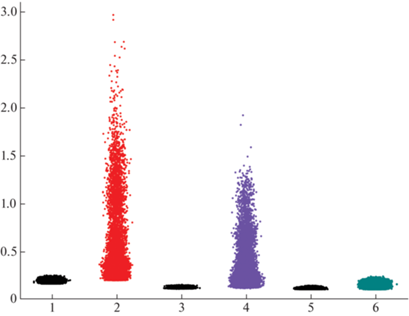
На рис. 5 представлены гистограммы распределения RR-интервалов у интактных и подвергшихся воздействию никеля крысят. В фоне у 3-дневных крысят наблюдается распределение с незначительным сдвигом в высокочастотную область, бимодальное распределение интервалов на 10–14-е сутки связано с возрастными различиями ЧСС, а у 15–16-дневных распределение приближается к нормальному (табл. 3). После введения препарата в первые две недели постнатального развития у крысят происходит смещение интервалов в медленноволновой диапазон, а также их выраженная локализация в области 360–180 мс. Интересный результат наблюдается на Р15–16. Введение никеля сопровождается развитием брадикардии и, одновременно, стабилизацией сердечного ритма, при которой коэффициент асимметрии становится близким к нулю, а снижение коэффициента эксцесса может быть связано с постепенным развитием отрицательного хронотропного эффекта (табл. 3, рис. 5).
Рис. 5.
Гистограммы распределения RR-интервалов у крысят разного возраста в фоне и после введения NiCl2 в дозе 109 мг/кг.
По оси абсцисс – время (с), по оси ординат – совокупное количество циклов (Count bins).
Так как по оси абсцисс диапазоны значений в фоне и опыте различаются, для облегчения сопоставления результатов, горизонтальной линией над гистограммами показано расположение и диапазон RR-интервалов, соответствующий исходному (фоновому) состоянию.
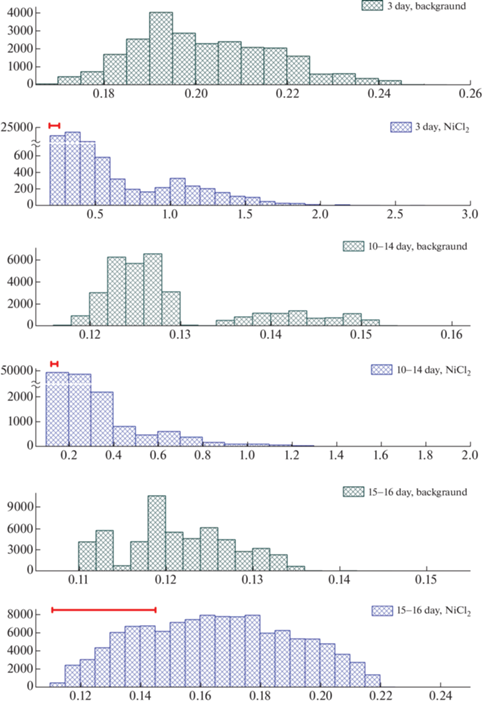
Таблица 3.
Показатели распределения RR-интервалов у крысят в фоне и после инъекции NiCl2 в дозе 109 мг/кг
| Возраст, сутки | Состояние | M ± SEM | Мода | Медиана | Коэффициент асимметрии |
Kоэффициент эксцесса |
|---|---|---|---|---|---|---|
| 3 | фон | 0.202 ± 0.0001 | 0.192 | 0.199 | 0.388 | –0.367 |
| NiCl2 | 0.376 ± 0.0012* | 0.363 | 0.346 | 4.145 | 20.892 | |
| 10–14 | фон | 0.129 ± 0.0001 | 0.126 | 0.126 | 1.187 | 0.178 |
| NiCl2 | 0.214 ± 0.0003* | 0.203 | 0.199 | 4.885 | 34.392 | |
| 15–16 | фон | 0.121 ± 0.00003 | 0.118 | 0.120 | 0.235 | –0.473 |
| NiCl2 | 0.165 ± 0.0001* | 0.177 | 0.165 | 0.056 | –0.891 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Итак, нами обнаружена четкая возрастная зависимость выраженности аритмогенного эффекта, возникающего при блокаде T-VDCC и, возможно, NCX. У 100% крысят на Р3 при инъекции NiCl2 в дозе 109 мг/кг возникает преходящий атипичный сердечный ритм, параллельно развивается выраженная дисфункция дыхательной системы с пачечной формой дыхания. Данный симптомокомплекс возникает у 75% 10–14-суточных крысят и полностью отсутствует у 15–16-суточных. Возрастная динамика выраженности разброса кардиоинтервалов после введения блокатора (рис. 4) коррелирует с экспрессией кальциевых каналов Cav3.2, описанной в ранний период перинатального онтогенеза [10, 17, 28].
В процессе развития происходят изменения ICaT, который регистрируется во всех исследованных эмбриональных и неонатальных клетках, но сохраняется лишь у нескольких видов животных во взрослых интактных клетках желудочков миокарда. В предсердиях крысы изменения плотности ICaT связаны в основном с изменением плотности каналов без изменения проводимости или стробирования (гейтинга) одного канала. В отличие от относительно стабильного уровня плотности кальциевого тока L-типа, плотность ICaT в предсердных миоцитах крыс достигает максимального уровня к 5-й неделе после рождения и затем начинает резко снижаться [29]. В опытах на изолированных миоцитах предсердий и желудочков крыс было осуществлено измерение плотности кальциевых токов L- и Т-типа, начиная с 4-дневного (Р4) и до взрослого (Р120) возраста. Установлено, что ICaT в клетках предсердия регистрируется уже в 4-дневных миоцитах предсердий крыс и достигает максимального уровня в 8-дневных. Плотность ICaT снижается через 3 недели и остается низкой в миоцитах предсердий взрослых крыс. В клетках желудочков ситуация иная. Протекающий через T-VDCC ток также наблюдается у 8-дневных крысят, но затем исчезает у 3-недельных крыс, несмотря на наличие мРНК субъединиц α1G (Cav3.1) и α1H (Cav3.2) [25]. Сходные результаты получили и авторы другого исследования, в котором было показано, что ICaT выражен в основном в кардиомиоцитах желудочков плода (E16–E18) и остается стабильным до рождения. Плотность ICaT снижается вскоре после рождения (Р1–P5) и не обнаруживается у 21-дневных крысят [17].
Во время созревания сердца существует взаимная связь между его морфогенезом и сократимостью. В раннем эмбриональном миокарде саркоплазматический ретикулум развит слабо, и кальциевые каналы плазматической мембраны имеют решающее значение для поддержания как сократимости, так и возбудимости. На 6–9-е сутки постнатального периода в кардиомиоцитах крыс впервые визуализируются короткие Т-трубочки, которые проникают вглубь цитоплазмы к 14–15-м суткам постнатального периода. Поперечная исчерченность саркоплазмы кардиомиоцитов крыс полностью формируется к 21-м суткам после рождения [30]. В первые 5 дней после рождения преобладает сарколеммальный поток Ca2+, тогда как в возрасте 3 нед наиболее важным является Са2+-индуцированный выброс Са2+ (Са2+-induced Са2+ release, CICR) из саркоплазматического ретикулума. Исчезновение ICaT совпадает с появлением CICR механизма электромеханической связи. У новорожденного животного сарколеммальный Са2+ почти в равной степени проходит через Са2+-каналы Т- и L-типа, а также через NCX. В опытах на изолированных сердцах крыс было показано, что введение Ni2+ вызывает снижение кальциевого транзиента на 93% в 1–3-и сутки и на 35% – на 3-й неделе. Мибефрадил, блокирующий преимущественно T-VDCC, снижает кальциевые токи на 75 и 16% соответственно. Это может свидетельствовать о возрастном снижении ICaT при сохранении INa–Ca [31]. Следует отметить, что исчезновение атипичного сердечного ритма, наблюдаемого нами на Р15–16 после инъекции крысятам NiCl2, совпадает по времени с описанным выше торможением ICaT.
Обращает на себя внимание отсутствие явных различий в характере нарушений сердечного и дыхательного ритмов при введении хлорида никеля в дозе 109 мг/кг и выше (164–273). В работе Kang и соавт., выполненной в условиях in vitro на ооцитах лягушки, было показано, что дозозависимое ингибирующее действие никеля на Cav3.2 носит обратный экспоненциальный характер [20]. Это в какой-то мере согласуется и с тем, что влияние никеля на Cav3.2 характеризуется низким значением концентрации полумаксимального ингибирования [9]. Не исключено, что и на уровне целого организма сохраняется подобная зависимость “доза–эффект”, при которой дальнейшее увеличение дозы препарата не вызывает значимых изменений в характере реакций. Замещение первоначально возникающей пачечной формы сердечного ритма длительной многочасовой брадикардией может быть связано с различной аффинностью Cav3.1 и Cav3.2 подтипов T-VDCC или других ионных каналов (Cav2.3, NCX) к ионам никеля и, как следствие, с разделенным по времени нарушениям механизмов симпатической и парасимпатической иннервации.
Возникающий у крысят после введения хлористого никеля атипичный сердечный ритм феноменологически сходен с тем, который мы наблюдали ранее при отравлении крысят ингибиторами ацетилхолинэстеразы фосфаколом или эзерином [2, 3], а также при активации центральных Н-холинореактивных структур [1, 32]. Участие холинорецепторов в регуляции кальциевого гомеостаза подтверждено опытами, выполненными в условиях in vitro. В экспериментах на морских свинках было показано, что NiCl2, как и М-холинолитик атропин, частично блокирует дополнительно усиленное параоксоном (фосфаколом) неквантовое высвобождение (non-quantal release, NQR) ацетилхолина из парасимпатических нейронов гладкой мускулатуры дыхательных путей, в которых присутствует и Ca2+-зависимое неквантовое высвобождение ацетилхолина. Установлено, что торможение сократительной способности гладких мышц не связано с истощением нейронных везикул, а реализуется через неспецифические катионные каналы, в том числе и кальциевые [33].
Наряду с определенным сходством развития патологического процесса после введения хлорида никеля или после инъекции холиномиметиков [2, 3], существуют и явные различия. Так, при активации холинореактивных структур характерно возникновение синоатриальных и атриовентрикулярных блокад, которых не обнаружено после введения NiCl2. Еще одним отличием является длительность эффекта. После введения холиномиметиков нарушение ритма начинается через 10–15 мин и может продолжаться до 1.5–2 ч, часто заканчиваясь возникновением длительных периодов асистолии и остановкой сердца и дыхания. В случае инъекции хлорида никеля, амплитуда QRS комплекса ЭКГ сохраняется, аритмия возникает через 5–10 мин и, независимо от дозы препарата, заканчивается не более чем через 20–25 мин. Возникающая у 3–14-дневных крысят пачечная форма дыхания никогда нами не наблюдалась у животных после холинергической активации. Данные факты могут свидетельствовать как о наличии общих звеньев, так и различий в механизмах развития дизритмии. Мы надеемся, что дальнейшее исследование с предварительной блокадой холинорецепторов и последующим введением NiCl2 позволит нам получить более четкое представление о возможных механизмах возникновения атипичного сердечного ритма у крысят.
Нам не удалось найти публикаций, свидетельствующих о возникновении функциональных нарушений дыхательной системы при отравлении хлоридом никеля. В опытах на взрослых крысах линии Sprague-Dawley, находящихся под уретановой анестезией и искусственной вентиляцией легких, было показано, что билатеральная микроинъекция NiCl2 в каудальный отдел вентролатеральной области продолговатого мозга и комплекс пре-Бетцингера (preBötC) сопровождается уменьшением амплитуды разрядов диафрагмального нерва, но не вызывает замедления фазы выдоха и последующего прекращения дыхания, как это происходит в случае применения антагониста NMDA-рецепторов кинурената или блокаторов высокопороговых Ca2+ каналов P/Q- и L-типа [34]. Кроме того, в опытах на изолированных срезах каудального гипоталамуса взрослых крыс обнаружено угнетение никелем ICaT, а также ритмической активности нейронов, в условиях in vivo разряжающихся синхронно с дыхательными и сердечно-сосудистыми циклами [35]. Показано, что в первые 5 сут постнатального развития у крыс в preBötC обнаруживается очень мало пейсмекерных нейронов, у которых в основе генерации разрядов лежит Ca2+-активируемый внутренний катионный ток [36], а функциональная значимость Са2+ токов Т-типа возрастает во время онтогенетических преобразований механизмов генерации дыхательных ритмов [37]. Нельзя исключить, что наблюдаемые нами на Р3–14 изменения ритма дыхания после воздействия хлоридом никеля связаны с возрастными особенностями колебаний кальциевых токов и перестройками нейрональной активности в preBötC. Вопрос о природе кардиореспираторных взаимодействий остается открытым и требует отдельного исследования.
Вопрос об участии NCX в возникновении атипичного сердечного ритма после введения NiCl2 остается открытым и требует дальнейшего изучения. У крыс экспрессия натрий-кальциевого обменника возрастает в ходе эмбриогенеза, достигая максимальных значений на 18-е сутки пренатального периода и снижаясь до уровня взрослых к 20‑му дню после рождения [38]. По данным других авторов максимальный уровень экспрессии NCX наблюдается у крысят в первые сутки после рождения и снижается до уровня взрослых уже к 12-му дню [16]. Ситуация осложняется еще и тем, что в нашем исследовании, при использовании системного введения ингибитора кальциевых каналов, мы неизбежно провоцируем изменения внутриклеточного гомеостаза кальция и, как следствие, изменения сопряженных с ним других ионных токов.
ЗАКЛЮЧЕНИЕ
В раннем постнатальном онтогенезе системное введение хлорида никеля, вызывающее нарушения кальциевого обмена, приводит к развитию патологического состояния с атипичным сердечным ритмом и нарушением дыхания. Возникающие дизритмии сходны с наблюдаемыми в перинатальный период у крыс после активации холинореактивных структур. Однако имеющиеся различия в характере возникающих патологических реакций могут свидетельствовать как о наличии общих звеньев, так и различий в механизмах развития аритмий.
Список литературы
Kuznetsov SV (1994) Reproduction of the Primary Rhythms of Excitation in Cardiac Activity of Neonatal Rat Pups. Bull Exp Biol Med 117 (4): 421–423. https://doi.org/10.1007/BF02444201
Kuznetsov SV, Goncharov NV, Glashkina LM (2005) Change of Parameters of Functioning of the Cardiovascular and Respiratory Systems in Rats of Different Ages under Effects of Low Doses of the Cholinesterase Inhibitor Phosphacol. J Evol Biochem Physiol 41 (2): 201–210. https://doi.org/10.1007/s10893-005-0055-x
Sizonov VA, Dmitrieva LE (2018) Heart Rhythm Disturbances Caused by Injection of Cholinesterase Inhibitor Physostigmine to Rats during the Early Ontogeny. Bull Exp Biol Med 165 (1): 44–47https://doi.org/10.1007/s10517-018-4095-9
Кузнецов СВ, Кузнецова НН, Гайдукова ПА (2019) Влияние блокады медленных кальциевых каналов L-типа на показатели сердечной, дыхательной и моторной деятельности у интактных и подвергшихся интоксикации эзерином новорожденных крысят. Обзоры клин фармакол и лекарств терапии 17: 39–49. [Kuznetsov SV, Kuznetsova NN, Gaydukova PA (2019) Influence of L-type slow calcium channels blockers on cardiac, respiratory and motor activity at the intact and poisoned by physostigmine (eserine) of rats during the early ontogeny. Rev Clin Pharmacol Drug Therapy 17: 39–49. (In Russ)]. https://doi.org/10.17816/RCF17339-49
Кузнецов СВ, Кузнецова НН (2021) Влияние высоких доз уабаина на показатели сердечной, дыхательной и моторной деятельности у новорожденных крысят. Обзоры клин фармакол и лекарств терапии 19: 395–403. [Kuznetsov SV, Kuznetsova NN (2021) Effects of high doses of ouabain on cardiac, respiratory, and motor activity at newborn rats. Rev Clin Pharmacol Drug Therapy 19: 395–403. (In Russ)]. https://doi.org/10.17816/RCF194395-403
Кузнецов СВ, Кузнецова НН (2020) Онтогенетические особенности влияния дантролена и кофеина на показатели сердечной, дыхательной и моторной деятельности у интактных и подвергшихся интоксикации эзерином крысят. Обзоры клин фармакол и лекарств терапии 18: 139–148. [Kuznetsov SV, Kuznetso-va NN (2020) Ontogenetic peculiarities of the effect of dantrolene and caffeine on the cardiac, respiratory and motor performance of intact and poisoned by physostigmine of rats. Rev Clin Pharmacol Drug Therapy 18: 139–148. (In Russ)]. https://doi.org/10.17816/RCF182139-148
Massie BM (1997) Mibefradil: A Selective T-Type Calcium Antagonist. Am J Cardiol 80 (9A): 23I–32I. https://doi.org/10.1016/s0002-9149 (97)00791-1
Hüser J, Blatter LA, Lipsius SL (2000) Intracellular Ca2+ release contributes to automaticity in cat atrial pacemaker cells. J Physiol 524 (Pt2): 415–422. https://doi.org/10.1111/j.1469-7793.2000.00415.x
Perez-Reyes E (2003) Molecular physiology of low-voltage-activated T-type calcium channels. Physiol Rev 83: 117–161https://doi.org/10.1152/physrev.00018.2002
Mangoni ME, Traboulsie A, Leoni AL, Couette B, Marger L, Le Quang K, Kupfer E, Cohen-Solal A, Vilar J, Shin HS, Escande D, Charpentier F, Nargeot J, Lory P (2006) Bradycardia and slowing of the atrioventricular conduction in mice lacking CaV3.1/α1G T-type calcium channels. Circ Res 98: 1422–1430. https://doi.org/10.1161/01.RES.0000225862.14314.49
Mangoni ME, Nargeot J (2008) Genesis and regulation of the heart automaticity. Physiol Rev 88: 919–982. https://doi.org/10.1152/physrev.00018.2007
Ferron L, Capuano V, Ruchon Y, Deroubaix E, Coulombe A, Renaud JF (2003) Angiotensin II signaling pathways mediate expression of cardiac T-type calcium channels. Circ Res 93: 1241–1248https://doi.org/10.1161/01.RES.0000106134.69300.B7
Schaffer SW, Jong CJ (2015) Regulation of Cardiac Hypertrophy by T-Type Ca2+ Channel. In: T-type Calcium Channels in Basic and Clinical Science Springer-Verlag Wien 73–84.https://doi.org/10.1007/978-3-7091-1413-1
Vassort G, Talavera K, Alvarez JL (2006) Role of T-type Ca2+ channels in the heart. Cell Calcium 640: 205–220. https://doi.org/10.1016/j.ceca.2006.04.025
Suzuki S, Ohkusa T, Ono K, Sato T, Yoshida M, Yano M, Takebayashi S, Matsuzaki M (2007) Beneficial effects of the dual L- and T-type Ca2+ channel blocker efonidipine on cardiomyopathic hamsters. Circ J 71 (12): 1970–1976https://doi.org/10.1253/circj.71.1970
Studer R, Reinecke H, Vetter R, Holtz J, Drexler H (1997) Expression and function of the cardiac Na+/Ca2+ exchanger in postnatal development of the rat, in experimental-induced cardiac hypertrophy and in the failing human heart. Basic Res Cardiol 92 (1): 53–58. https://doi.org/10.1007/BF00794068
Ferron L, Capuano V, Deroubaix E, Coulombe A, Renaud JF (2002) Functional and molecular characterization of a T-type Ca (2+) channel during fetal and postnatal rat heart development. J Mol Cell Cardiol 34: 533–546. https://doi.org/10.1006/jmcc.2002.1535
Satoh H (1995) Role of T-type Ca2+ channel inhibitors in the pacemaker depolarization in rabbit sino-atrial nodal cells. Gen Pharmacol 26 (3): 581–587. https://doi.org/10.1016/0306-3623 (94)00214-8
Lee JH, Gomora JC, Cribbs LL, Perez-Reyes E (1999) Nickel block of three cloned T-type calcium channels: low concentrations selectively block alpha1H. Biophys J 77 (6): 3034–3042.https://doi.org/10.1016/S0006-3495 (99)77134-1
Kang HW, Park JY, Jeong SW, Kim JA, Moon HJ, Perez-Reyes E, Lee JH (2006) A Molecular Determinant of Nickel Inhibition in Cav3.2 T-type Calcium Channels. J Biol Chem 281 (8): 4823–4830. https://doi.org/10.1074/jbc.M510197200
Haverinen J, Hassinen M, Dash NS, Vornanen M (2018) Expression of calcium channel transcripts in the zebrafish heart: dominance of T-type channels. J Exp Biol 221 (Pt10): jeb179226.https://doi.org/10.1242/jeb.179226
Kimura J, Miyamae S, Noma A (1987) Identification of sodium-calcium exchange current in single ventricular cells of guinea-pig. J Physiol 384: 199–222. https://doi.org/10.1113/jphysiol.1987.sp016450
Reppel M, Fleischmann BK, Reuter H, Pillekamp F, Schunkert H, Hescheler J (2007) Regulation of Na+/Ca2+ exchange current in the normal and failing heart. Ann N Y Acad Sci 1099: 361–372. https://doi.org/10.1196/annals.1387.065
Cheng H, Smith GL, Hancox JC, Orchard CH (2011) Inhibition of spontaneous activity of rabbit atrioventricular node cells by KB-R7943 and inhibitors of sarcoplasmic reticulum Ca2+ ATPase. Cell Calcium 49 (1): 56–65. https://doi.org/10.1016/j.ceca.2010.11.008
Henderson RG, Durando J, Oller AR, Merkel DJ, Marone PA, Bates HK (2012) Acute oral toxicity of nickel compounds. Regul Toxicol Pharmacol 62 (3): 425–432. https://doi.org/10.1016/j.yrtph.2012.02.002
Singh PP, Junnarkar AY (1991) Behavioural and toxic profile of some essential trace metal salts in mice and rats. Ind J Pharmacol 23: 153–159.
Yan XM, Tao ZQ, Liang YY, Chen ZJ, Zhang JS, Xu XH (1998) Effect of catecholamic acid on detoxication and distribution of NiCl2 in mice and rats. Acta Pharmacol Sinica 19 (1): 80–84.
Leuranguer V, Monteil A, Bourinet E, Dayanithi G, Nargeot J (2000) T-type calcium currents in rat cardiomyocytes during postnatal development: contribution to hormone secretion. Am J Physiol Heart Circ Physiol 279: H2540–H2548https://doi.org/10.1152/10.1152/ajpheart.2000.279.5.H2540
Xu X, Best PM (1992) Postnatal changes in T-type calcium current density in rat atrial myocytes. J Physiol 454 (1): 657–672.https://doi.org/10.1113/jphysiol.1992.sp019285
Seki S, Nagashima M, Yamada Y, Tsutsuura M, Kobayashi T, Namiki A, Tohse N (2003) Fetal and postnatal development of Ca2+ transients and Ca2+ sparks in rat cardiomyocytes. Cardiovasc Res 58 (3): 535–548. https://doi.org/10.1016/s0008-6363 (03)00255-4
Escobar AL, Ribeiro-Costa R, Villalba-Galea C, Zoghbi ME, Perez CG, Mejia-Alvarez R (2004) Developmental changes of intracellular Ca2+ transients in beating rat hearts. Am J Physiol Heart Circ Physiol 286 (3): H971–H978. https://doi.org/10.1152/ajpheart.00308.2003
Kuznetsov SV (1995) N-cholinergic activation of periodic activity of excitable structures in early postnatal ontogenesis. J Evol Biochem Physiol 31 (2): 100–105.
Chavez J, Vargas MH, Cruz-Valderrama JE, Montaño LM (2011) Non-quantal release of acetylcholine in guinea-pig airways: role of choline transporter. Exp Physiol 96 (4): 460–467. https://doi.org/10.1113/expphysiol.2010.056440
Miyawaki T, Goodchild AK, Pilowsky PM (2003) Maintenance of sympathetic tone by a nickel chloride-sensitive mechanism in the rostral ventrolateral medulla of the adult rat. Neuroscience 116 (2): 455–464. https://doi.org/10.1016/s0306-4522 (02)00705-4
Fan Y-P, Horn EM, Waldrop TG (2000) Biophysical characterization of rat caudal hypothalamic neurons: calcium channel contribution to excitability. J Neurophysiol 84: 2896–2903https://doi.org/10.1152/jn.2000.84.6.2896
Del Negro CA, Morgado-Valle C, Hayes JA, Mackay DD, Pace RW, Crowder EA, Feldman JL (2005) Sodium and Calcium Current-Mediated Pacemaker Neurons and Respiratory Rhythm Generation. J Neurosci 25 (2): 446–453. https://doi.org/10.1523/JNEUROSCI.2237-04.2005
Onimaru H, Ballanyi K, Richter DW (1996) Calcium-dependent responses in neurons of the isolated respiratory network of newborn rats. J Physiol 491 (Pt 3): 677–695. https://doi.org/10.1113/jphysiol.1996.sp021249
Koban MU, Moorman AF, Holtz J, Yacoub MH, Boheler KR (1998) Expressional analysis of the cardiac Na-Ca exchanger in rat development and senescence. Cardiovasc Res 37 (2): 405–423. https://doi.org/10.1016/s0008-6363 (97)00276-9
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


