Журнал физической химии, 2019, T. 93, № 1, стр. 23-27
Влияние растворителей на кислотнокатализируемую амино-перегруппировку Кляйзена N-(1-метил-2-бутенил)анилинаИ. Б. Абдрахманов, В. М. Шарафутдинов, А. Г. Мустафин, Ю. С. Зимин, Р. Р. Даминев
И. Б. Абдрахманов a, В. М. Шарафутдинов b, А. Г. Мустафин c, Ю. С. Зимин c, *, Р. Р. Даминев b
a Уфимский институт химии Российской академии наук
450076 Уфа, Россия
b Уфимский государственный нефтяной технический университет
450095 Уфа, Россия
c Башкирский государственный университет
450095 Уфа, Россия
* E-mail: ZiminYuS@mail.ru
Поступила в редакцию 13.02.2018
Аннотация
Изучено влияние растворителей на процессы перегруппировки и элиминирования N-(1-метил-2-бутенил)анилина (I) в присутствии HCl. Показано, что зависимость констант скоростей перегруппировки и элиминирования (I) · HCl от природы растворителей хорошо описывается в рамках уравнения Коппеля–Пальма, учитывающего как неспецифическую, так и специфическую сольватации. Тормозящий эффект нуклеофильности растворителя объяснен протеканием процесса комплексообразования между (I) · HCl и молекулами растворителя. Путем анализа продуктов превращения (I) · HCl в смешанном растворителе (м-толуидин + нитробензол) обнаружено явление межмолекулярного переноса аллильного фрагмента, что подтверждает образование аллильного катиона в амино-перегруппировке Кляйзена.
Катализируемая кислотами перегруппировка Кляйзена в ряду N-аллиланилинов является удобным способом синтеза орто-замещенных ариламинов [1]. Как считает ряд исследователей [2–4], реакция протекает по внутримолекулярному 3,3-сигматропному механизму. Ранее [5, 6] нами показано, что механизм перегруппировки N-(1-метил-2-бутенил)анилина отличается от общепринятого. Относительно низкая энтальпия активации, положительная энтропия активации [5], образование пара-продуктов и перекрестных продуктов перегруппировки при совместном превращении двух субстратов [6] свидетельствуют о более сложном механизме процесса.
Известно, что согласованные реакции слабо зависят от природы растворителей [7]. С целью дальнейшего исследования перегруппировки N-(1-метил-2-бутенил)анилина нами изучены кинетические закономерности этой реакции в присутствии HCl в среде различных растворителей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
N-(1-метил-2-бутенил)анилин (I) и 2-(1-метил-2-бутенил)анилин (II) синтезировали по известным методикам, описанным в работах [8] и [9] соответственно. Физико-химические характеристики синтезированных соединений соответствовали литературным данным. Для опытов использовали свежеперегнанные растворители.
Кинетику превращения N-(1-метил-2-бутенил)анилина изучали методом “опыт–точка”. Опыты проводили при 126°С в стеклянных запаянных ампулах (объем реакционной смеси составлял ∼1 мл). Катализатор (HCl) вводили в реакционную систему в виде гидрохлорида (I). Свежеприготовленную реакционную смесь разливали по ампулам, запаивали их, помещали в термостат, в котором поддерживалась температура с точностью ±0.2 К. Затем, после нагревания в течение 2 мин, отбирали первую пробу (нулевая точка). Ампулу охлаждали до 20°С, вскрывали и для превращения гидрохлоридов ароматических аминов в свободные основания добавляли избыток триэтиламина. Далее реакционную смесь анализировали методом ГЖХ, внутренний стандарт – пентадекан. Остальные ампулы отбирали через определенные промежутки времени и анализировали по этой же методике.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
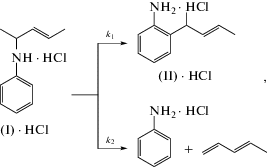
Ранее [5] было показано, что превращение N-(1-метил-2-бутенил)анилина в присутствии HCl подчиняется закономерностям параллельной реакции первого порядка:
где k1 – константа скорости перегруппировки, k2 – константа скорости элиминирования, k = = k1 + k2 – константа скорости расходования (I) · HCl в обоих процессах. Нами установлено, что с изменением природы растворителей направления превращения (I) · HCl не изменяются.Результаты исследований по влиянию растворителей на константы скоростей перегруппировки и элиминирования (I) · HCl приведены в табл. 1. Из полученных данных следует, что наибольшая скорость процесса перегруппировки наблюдается в нитробензоле, а процесса элиминирования – в смеси двух растворителей (хлорбензол + нитробензол). Наименьшие значения скоростей обоих процессов наблюдаются в N,N-диметиланилине. Следует отметить, что природа растворителей сильнее влияет на перегруппировку (k1 изменяется в 30 раз), чем на элиминирование (k2 изменяется в 18 раз) (табл. 1).
Таблица 1.
Зависимость констант скоростей перегруппировки (k1) и элиминирования (k2) N-(1-метил-2-бутенил)анилина от природы растворителей; 126°С
| Растворитель | k1 × 105, c–1 | k2 × 105, c–1 | Y | Р | Е | В |
|---|---|---|---|---|---|---|
| Хлорбензол | 3.49 ± 0.05 | 4.90 ± 0.49 | 0.3775 | 0.3968 | 0 | 38.0 |
| Хлорбензол + нитробензол | 7.76 ± 0.59 | 5.66 ± 0.23 | 0.4285 | 0.4058 | 0 | 52.6 |
| Нитробензол | 12.4 ± 1.6 | 5.45 ± 0.24 | 0.4788 | 0.4147 | 0 | 67.0 |
| Ацетофенон | 7.17 ± 0.13 | 3.21 ± 0.14 | 0.4581 | 0.4041 | 0.70 | 202.0 |
| N,N-Диметилформамид + ацетофенон | 4.41 ± 0.27 | 3.61 ± 0.70 | 0.4690 | 0.3728 | 1.65 | 246.5 |
| N,N-Диметилформамид | 5.10 ± 0.27 | 2.90 ± 0.45 | 0.4798 | 0.3414 | 2.60 | 291.0 |
| N,N-Диметиланилин | 0.41 ± 0.01 | 0.31 ± 0.03 | 0.3641 | 0.4166 | 0 | 422.0 |
Примечание. Параметры растворителей взяты из монографии [9].
Влияние растворителей на величины констант скоростей перегруппировки и элиминирования хорошо описывается в рамках уравнения Коппеля–Пальма, учитывающего как неспецифическую, так и специфическую сольватации [10]:
где ki – константа скорости реакции в растворителе; k0i – константа скорости реакции в газовой фазе; Y – полярность растворителя; Р – поляризуемость растворителя; Е и В – эмпирические параметры электрофильности и нуклеофильности растворителя; y, р, е, в – коэффициенты, характеризующие чувствительность реакции к влиянию неспецифической (Y, Р) и специфической (Е, В) сольватации. Величина Y выражается функцией Кирквуда: Y = (ε – 1)/(2ε + 1), где ε – диэлектрическая проницаемость растворителя. Величина Р определяется по формуле: Р = (n2 – 1)/(n2 + 2), где n – показатель преломления растворителя.Применение уравнения Коппеля–Пальма для описания кинетических результатов в приведенных в табл. 1 растворителях приводит к следующим выражениям:
для перегруппировки
для элиминирования
Согласно расчетам, константы скоростей перегруппировки и элиминирования в газовой фазе на 5–8 порядков ниже, чем в растворителях. По-видимому, в газовой фазе из-за отсутствия сольватации протон Н+ сильнее связан с анионом Cl–, чем с амином, вследствие чего снижается каталитический эффект Н+ на превращение (I).
Величину вклада отдельных параметров растворителей на реакционную способность исходного реагента можно оценить по данным табл. 2 и 3.
Таблица 2.
Вклад составляющих неспецифической и специфической сольватаций растворителей на величину lg k1; 126°С
| Растворитель | уY | рР | еЕ | вВ |
|---|---|---|---|---|
| Хлорбензол | 1.4850 | 5.3631 | 0 | –0.1156 |
| Хлорбензол + нитробензол | 1.6856 | 5.4848 | 0 | –0.1599 |
| Нитробензол | 1.8835 | 5.6051 | 0 | –0.2037 |
| Ацетофенон | 1.8020 | 5.4618 | 0.3263 | –0.6143 |
| N,N-Диметилформамид + ацетофенон | 1.8449 | 5.0388 | 0.7691 | –0.7496 |
| N,N-Диметилформамид | 1.8874 | 4.6144 | 0.2119 | –0.8850 |
| N,N-Диметиланилин | 1.4323 | 5.6308 | 0 | –1.2833 |
Таблица 3.
Вклад составляющих неспецифической и специфической сольватаций растворителей на величину lg k2; 126°С
| Растворитель | уY | рР | еЕ | вВ |
|---|---|---|---|---|
| Хлорбензол | –0.3195 | 5.4282 | 0 | –0.1479 |
| Хлорбензол + нитробензол | –0.3627 | 5.5313 | 0 | –0.2046 |
| Нитробензол | –0.4053 | 5.6731 | 0 | –0.2607 |
| Ацетофенон | –0.3877 | 5.5281 | 0.4340 | –0.7860 |
| N,N-Диметилформамид + ацетофенон | –0.3970 | 5.0999 | 1.0230 | –0.9591 |
| N,N-Диметилформамид | –0.4061 | 4.6703 | 1.6920 | –1.1323 |
| N,N-Диметиланилин | –0.3082 | 5.6991 | 0 | –1.6420 |
Ускоряющее действие поляризуемости на lg k1 и lg k2 указывает на то, что переходные состояния обеих реакций имеют полярный характер [11]. Разные знаки коэффициента полярности у для перегруппировки и элиминирования, по-видимому, свидетельствуют о том, что лимитирующие стадии этих реакций отличаются.
Возрастание k1 с увеличением полярности растворителя свидетельствует о большем разделении зарядов в активированном комплексе по сравнению с исходным реагентом, суммарный заряд которого является более компактным [12]. Вероятно, это возможно на стадии образования σ-комплекса, положительный заряд которого стабилизирован в результате сольватации растворителем.
Тормозящий эффект нуклеофильности растворителя, вероятно, связан с комплексообразованием между (I) · HCl и молекулами растворителя состава [(I) · HCl] : [растворитель] = 1 : 1, что приводит к уменьшению протонированной формы (I), в результате чего снижается каталитический эффект HCl.
Избыток свободного основания (I) оказывает ингибирующий эффект как на перегруппировку, так и на элиминирование. В данном случае, вероятно, образуется неактивный комплекс состава [амин] : [HCl] = 2 : 1
где R – аллильный фрагмент. Константа такого равновесия для различных аминов изменяется от 50 до 104 [13]. Аналогичные процессы комплексообразования возможны в любом другом растворителе, обладающем значительной нуклеофильностью.С целью выявления эффекта специфической сольватации нами исследована кислотнокатализируемая перегруппировка (I) в смешанном растворителе м-толуидин + нитробензол. С увеличением мольной доли м-толуидина суммарная константа скорости k расходования (I) · HCl снижается (рис. 1).
Рис. 1.
Зависимость lg k от мольной доли (x) м-толуидина для кислотнокатализируемого превращения (I) в смешанном растворителе м-толуидин + нитробензол; 132°С. Обозначения см. текст.
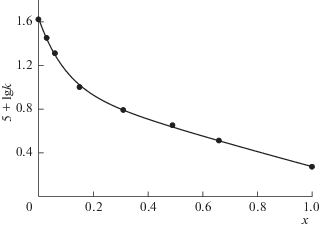
Такая нелинейная зависимость свидетельствует о том, что в системе смешанного растворителя один из его компонентов является инертным, а второй – способным к специфической сольватации реагентов. В рассматриваемой системе нитробензол является инертным растворителем, так как по данным авторов [14] все ароматические амины в нем мономеризованы, а в сильноосновных растворителях ассоциативное состояние аминов зависит от разности основности амина и растворителя.
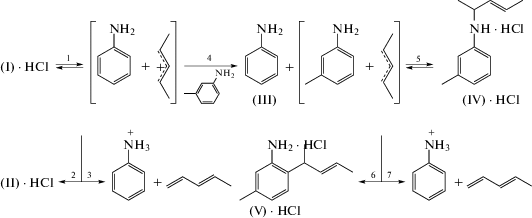
Анализ продуктов превращения (I) в смешанном растворителе (м-толуидин + нитробензол) выявил явление межмолекулярного переноса аллильного фрагмента, что еще раз доказывает образование аллильного катиона в амино-перегруппировке Кляйзена. Кинетические кривые накопления продуктов изомеризации амина (I) приведены на рис. 2 и 3.
Рис. 2.
Кинетические кривые изменения концентраций компонентов превращения (I) в смешанном растворителе м-толуидин + нитробензол; 132°С, [м-толуидин]0 = 1.54 моль/л. Обозначения см. текст.
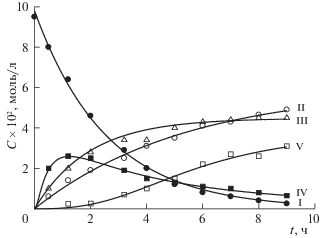
Рис. 3.
Кинетические кривые изменения концентраций компонентов превращения (I) в смешанном растворителе м-толуидин + нитробензол; 132°С, [м-толуидин]0 = 6.0 моль/л. Обозначения см. текст.
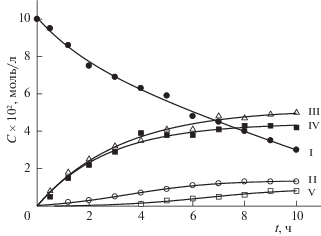
При высоких концентрациях м-толуидина (6.0 моль/л) аллильный катион с амина (I) переносится на атом азота м-толуидина, что приводит к высоким выходам анилина (III) и N-(1-метил-2-бутенил)-3-метиланилина (IV) (путь 1 – 4 – 5)
Перегруппировка (IV) (путь 5 – 6) затруднена вследствие образования неактивного комплекса в избытке м-толуидина. При его меньших концентрациях (1.54 моль/л) возможны и перегруппировки (пути 1 – 2 и 5 – 6), о чем свидетельствуют достаточно высокие выходы продуктов (II) и (V). Кинетические кривые изменения концентраций (IV) и (V) характерны для последовательной реакции, в которой сначала образуется N-алкенильное соединение (IV), приводящее в результате перегруппировки к амину (V).
Таким образом, при проведении кислотнокатализируемой амино-перегруппировки Кляйзена N-(1-метил-2-бутенил)анилина в различных растворителях обнаружены явления комплексообразования, специфической сольватации и межмолекулярного переноса аллильного катиона.
Список литературы
Абдрахманов И.Б., Мустафин А.Г., Шарафутдинов В.М. Перегруппировка Кляйзена в ряду ароматических аминов. Уфа: Гилем, Башк. энцикл., 2014. 168 с.
Jolidon S., Hansen H.-J. // Helv. chim. acta. 1977. V. 60. P. 978.
Castro A.M. // Chem. Rev. 2004. V. 104. № 6. P. 2939.
Majumdar K.C., Brattacharyya T.J., Chattopadhyay B. et al. // Synthesis. 2009. № 13. P. 2117.
Абдрахманов И.Б., Шарафутдинов В.М., Нигматуллин Н.Г. и др. // Изв. АН СССР. Сер. хим. 1983. № 6. С. 1273.
Абдрахманов И.Б., Шарафутдинов В.М., Толстиков Г.А. // Журн. орган. химии. 1984. Т. 20. № 3. С. 620.
Темникова Т.И., Семенова С.И. Молекулярные перегруппировки в органической химии. М.: Химия, 1983. С. 256.
Абдрахманов И.Б., Шарафутдинов В.М., Джемилев У.М. и др. // Журн. прикл. химии. 1982. Т. 55. № 9. С. 2121.
Абдрахманов И.Б., Шарафутдинов В.М., Сагитдинов И.А. и др. // Журн. орган. химии. 1982. Т. 18. № 7. С. 1466.
Пальм В.А. Основы количественной теории органических реакций. Л.: Химия, 1977. С. 360.
Райхардт Х. Растворители в органической химии. Л.: Химия, 1973. С. 152.
Салем Л. Электроны в химических реакциях. М.: Мир, 1985. С. 288.
Feakins D., Last W., Shaw R. // J. Chem. Soc. 1964. P. 2387.
Царевская М., Акимова З., Андреева А. // Укр. хим. журн. 1984. Т. 50. № 4. С. 346.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии