Журнал физической химии, 2019, T. 93, № 1, стр. 142-149
Равновесия в системе ZnCl2–H2O–NaOH по данным потенциометрического титрования и выбор условий гидрохимического синтеза пленок ZnS и ZnSeЕ. А. Федорова, Л. Н. Маскаева, В. Ф. Марков, С. А. Бахтеев, Р. А. Юсупов
Е. А. Федорова a, Л. Н. Маскаева a, b, *, В. Ф. Марков a, b, С. А. Бахтеев c, Р. А. Юсупов c
a Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
b Уральский институт ГПС МЧС России
Екатеринбург, Россия
c Казанский национальный исследовательский технологический университет
Казань, Россия
* E-mail: mln@ural.ru
Поступила в редакцию 19.02.2018
Аннотация
Методом потенциометрического титрования хлорида цинка в диапазоне концентраций 0.00006–1.01 моль/л изучены равновесные процессы в системе ZnCl2–H2O–NaOH. На основе математического моделирования в данной системе выявлен ряд полиядерных структур и малорастворимых фаз цинка. Рассчитаны значения констант нестойкости комплексных форм и динамического равновесия труднорастворимых соединений цинка, а также их стехиометрические составы и области устойчивого существования. Расчетным путем определены уточненные граничные условия и области образования ZnSe и ZnS при осаждении селеносульфатом натрия и тиокарбамидом соответственно. Гидрохимическим осаждением на ситалловых подложках получены слои ZnSe и ZnS толщиной ~1000 нм и ~200 нм. На основании данных электронной микроскопии сделан вывод, что слои состоят из агрегатов шаровидной формы со средними размерами для ZnSe (~350–450 нм) и ZnS (50–200 нм), сформированных из первичных частиц ~20–60 нм и ~20–30 нм.
Пленки широкозонных бинарных полупроводников группы АIIBVI, прозрачны в видимой и ИК-областях спектра: сульфид ZnS до 12.5 мкм и селенид ZnSe до 22 мкм с низким коэффициентом отражения, высокой химической стойкостью и термостабильностью – привлекают повышенное внимание исследователей. Сочетание этих свойств обеспечивает применение пленкам ZnS в лазерной технике в качестве активного и пассивного элементов, в наноэлектронике и нанофотонике [1–3], а слоев ZnSe в тепловизионных системах переднего обзора (FLIR-системы), в оптоэлектронных устройствах, лазерных диодах, для изготовления фокусирующей и проходной оптики в системах СО2-лазеров высокой мощности [4–7]. Оба халькогенида цинка востребованы в качестве прекурсорных слоев для синтеза соединений с кестеритной структурой Cu2ZnSnSe4, Cu2ZnSn(SxSe1 – x)4 и Cu2ZnSnS4 [8–11].
Ряд исследователей предпочитает низкотемпературный метод получения пленок сульфида и селенида цинка – химическое осаждение из водных сред (CBD) [1, 10–18]. Наиболее распространенными являются щелочные реакционные смеси, в которых в качестве халькогенизатора выступают тио-, селенокарбамид или тио-селеносульфат натрия. В качестве солей цинка используют хлорид [13], нитрат [14], сульфат [15], ацетат [16–18].
Состояние цинка в водных растворах различных солей изучено различными методами весьма подробно в широком интервале концентраций [19–21]. Однако в обзорах, посвященных исследованию гидролиза солей цинка, практически отсутствуют сведения о моноядерных комплексных ионах с координационными числами 5 и 6, а также о полиядерных гидроксокомплексах и малорастворимых соединениях цинка.
Проведенные нами ранее исследования [21, 22] показали, что игнорирование возможности образования полиядерных комплексных форм и малорастворимых соединений металлов снижает надежность прогнозирования концентрационных областей образования их халькогенидов при гидрохимическом осаждении. Отсюда для обоснованного выбора условий осаждения пленок ZnS и ZnSe актуальным является получение более полной информации о “поведении” цинка в водных растворах.
В настоящей работе продемонстрирована необходимость учета полиядерных комплексных форм и твердофазных соединений цинка при определении концентрационных областей гидрохимического осаждения пленок его сульфида и селенида. В основу были положены результаты анализа ионных равновесий и потенциометрического титрования хлорида ZnCl2, используемого в составе реакционных смесей, для их получения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экспериментальный массив данных потенциометрического титрования растворов ZnCl2 (0.00006–1.01 моль/л) гидроксидом NaOH (0.001–9.60 моль/л) получен с использованием pH-метра марки “рН-121”. Обработку результатов титрования осуществляли с помощью программного пакета EQ-5, предложенного в работе [23]. Экспериментальную проверку установленных концентрационных областей осаждения твердой фазы проводили путем конденсации пленок ZnSe (ZnS) на предварительно обезжиренные ситалловые подложки марки СТ-50-1. Реакционная смесь для получения пленок селенида цинка содержала хлорид цинка ZnCl2, гидроксид натрия NaOH, селеносульфат натрия Na2SeSO3. При формировании пленок сульфида цинка использовали аналогичную реакционную ванну, заменив в ней селеносульфат натрия на тиокарбамид N2H4CS, играющий роль халькогенизатора. Процесс проводили при 343 K в реакторах из молибденового стекла, которые помещали в термостат ТС-ТБ-10. Продолжительность осаждения пленок составляла 120 мин.
Оценку толщины пленок халькогенидов цинка проводили с помощью микроинтерферометра Линника МИИ–4М.
Для изучения структурно-морфологических характеристик полученных пленок использовали метод растровой электронной микроскопии с использованием микроскопа MIRA3LMV.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
По справочным данным [24–26] в разбавленных водных растворах цинк образует моноядерные гидроксокомплексы с координационным числом от 1 до 4. В работе был проведен анализ ионных равновесий по методике [27]. При количественной оценке концентраций комплексов ZnOH+, Zn(OH)2, Zn(OH)$_{3}^{ - }$, Zn(OH)$_{4}^{{2 - }}$ были использованы численные значения показателей констант нестойкости, приведенные в [24]. Графические зависимости долевых концентраций ионных форм в системе Zn2+–H2O–OH– от pH представлены на рис. 1. Из рисунка видно, что активный гидролиз цинка начинается при pH > 5, что приводит к преобладанию в растворе ZnOH+. Далее с ростом щелочности среды в диапазоне рН 7.0–13.7 максимальной становится доля комплексной формы Zn(OH)2. Гидроксокомплексы Zn(OH)$_{3}^{ - }$ и Zn(OH)$_{4}^{{2 - }}$ начинают образовываться при pH ≈ 9.7 и 11.0 соответственно. Комплекс ${\text{Zn(OH)}}_{4}^{{2 - }}$ становится преобладающим в более щелочных растворах. Заметим, что авторы работы [28] провели успешное химическое осаждение пленок ZnSe из растворов с pH 13.01 ± 0.01, полагая, что образующийся в этих условиях гидроксокомплекс ${\text{Zn(OH)}}_{4}^{{2 - }}$, предотвратит быстрое выпадение цинка в осадок.
Рис. 1.
Зависимости долевых концентраций ионов Zn2+ и моноядерных комплексных форм металла от pH среды в системе Zn2+–H2O–OH– при аналитической концентрации цинка в растворе 0.1 моль/л. Температура 298 K.
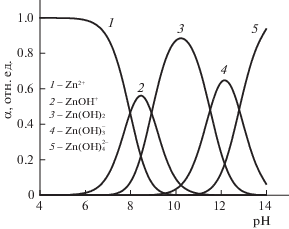
Проанализировав публикации, посвященные исследованию водных растворов солей цинка, мы обнаружили единственную работу [29], в которой упоминается об образовании полиядерных комплексов металла, в частности, ${\text{Z}}{{{\text{n}}}_{{\text{2}}}}{\text{(OH)}}_{6}^{{2 - }}$. Причем эти комплексы авторы определили как промежуточные кинетические продукты при переходе растворимых форм металла в твердофазные соединения. Несомненно, что формирование полиядерных структур цинка в пограничной с образованием осадков области рН является закономерной тенденцией. При этом вклад этих структур в развитие процесса химического осаждения твердофазных пленок может быть определяющим. Более полную информацию о комплексных формах цинка в растворе могли бы дать результаты потенциометрического титрования соли металла.
Экспериментальный массив данных потенциометрического титрования, проведенного в системе ZnCl2–H2O–NaOH при исходных концентрациях ZnCl2 (0.00006–1.01 моль/л) и NaOH (0.001–9.60 моль/л), представлен на рис. 2 в координатах ${{n}_{{{\text{O}}{{{\text{H}}}^{ - }}}}} = f{\text{(pH),}}$ где ${{n}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}$ – функция образования или лигандное число по гидроксид-иону. На рисунке видно смещение кривых титрования в сторону меньших значений pH с ростом исходной концентрации хлорида цинка в растворе. Так, при содержании соли в рассматриваемой системе 0.00006 моль/л (рис. 2а) величина pH, соответствующая началу процесса гидролиза, составила 5.6, в то время как с повышением концентрации цинка до 1.00 моль/л (рис. 2д) ее значение снизилось до 3.0, что вполне объяснимо.
Рис. 2.
Зависимости функции образования по гидроксид-иону ${{n}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}$ от pH по результатам обработки экспериментальных (крестики) и теоретических (сплошные линии) кривых потенциометрического титрования раствора хлорида цинка при 298 K. Исходные концентрации соли цинка и гидроксида натрия, моль/л: CZn(II) = 0.00006, CNaOH = 0.001 (а); CZn(II) = 0.001, CNaOH = 0.010 (б); CZn(II) = 0.01, CNaOH = 0.11 (в); CZn(II) = 0.11, CNaOH = 1.00 (г); CZn(II) = 1.00, CNaOH = 9.60 (д).
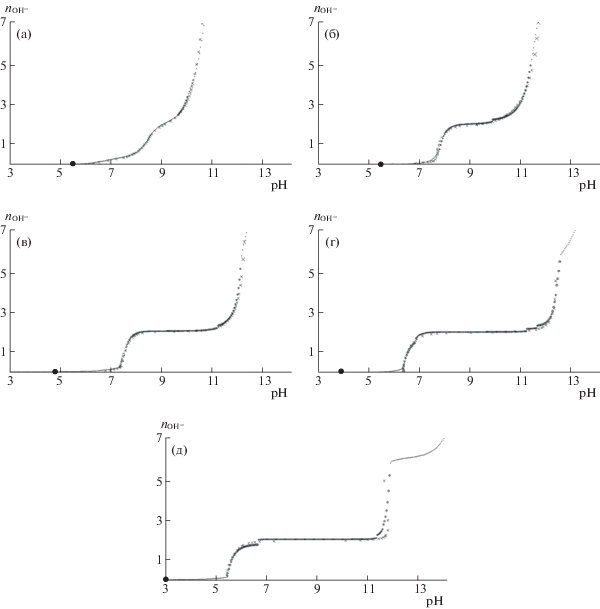
Если обратить внимание на наклонную часть кривых титрования (рис. 2а–в), то можно заметить незначительное увеличение угла их наклона, что может свидетельствовать о возрастании значения стехиометрического коэффициента по иону металла в образующихся гидроксокомплексах. Например, значительный наклон при концентрации соли 0.00006 моль/л (рис. 2а) связан с последовательным образованием целого ряда как моноядерных, так и полиядерных комплексных форм металла. С увеличением содержания металла до 0.01 моль/л (рис. 2б, в) происходит некоторое “выпрямление” наклонной части кривой титрования за счет формирования в растворе меньшего количества полиядерных комплексов. Концентрации соли цинка в анализируемом растворе выше 0.11 моль/л (рис. 2г, д) вновь приводят к изменению угла наклона кривой за счет появления в системе новой полиядерной комплексной формы цинка с большей нуклеарностью.
По проекции плато на ось ординат можно более точно оценить состав формирующейся твердой фазы. Из рис. 2 видно, что для исследуемой системы характерно выделение из раствора соединения Znx(OH)2xS, о чем свидетельствует функция образования по гидроксид иону ${{n}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}$, равная двум. Диапазон рН формирования фазы Znx(OH)2xS заметно увеличивается для более концентрированных растворов. Так, если при содержании соли 0.001 моль/л (рис. 2б) он ограничен пределами 7.7–9.8, то при CZn(II) = 1.00 моль/л (рис. 2д) происходит его расширение от 6.6 до 11.3.
Поскольку на теоретической кривой, описывающей экспериментальную кривую потенциометрического титрования соли с минимальной концентрацией 0.00006 моль/л (рис. 2а), отсутствуют утолщенные линии, то можно сказать, что формирование каких-либо твердофазных соединений в этих условиях не происходит. Отметим, что на кривых титрования при pH > 9.8 (рис. 2б–д) появляется дополнительная ступень с функцией образования ${{n}_{{{\text{O}}{{{\text{H}}}^{ - }}}}} = 2.125$, что свидетельствует о формировании фазы состава Na0.125x[Znx(OH)2.125x]S. Причем увеличение концентрации цинка в растворе приводит к сужению pH области ее существования с 9.8–11.3 при содержании ZnCl2 0.001 моль/л (рис. 2б) до 11.3–11.4 при максимальной используемой концентрации (рис. 2д). При pH > 11 на кривых титрования (рис. 2 г и д) можно увидеть также ступень с функцией образования по гидроксид-иону, равной 2.25, которая соответствует области образования труднорастворимого соединения Na0.25x[Znx(OH)2.25x]S.
Для концентраций хлорида цинка 0.11 и 1.00 моль/л (рис. 2 г и д) при pH < 6.8 на кривых потенциометрического титрования появляется ступень, соответствующая функции образования по гидроксид-иону ${{n}_{{{\text{O}}{{{\text{H}}}^{ - }}}}} = 1.75,$ что характеризует выделение из раствора гидроксидсодержащей соли металла Znx(OH)1.75xCl0.25xS, причем начало ее образования с увеличением содержания цинка в системе смещается в более кислую область. Обработка кривых потенциометрического титрования позволила составить базовые уравнения для основных равновесных процессов в системе ZnCl2–H2O–NaOH:
(1)
$[{\text{ZnO}}{{{\text{H}}}^{ + }}] \cdot {{k}_{{{\text{н 1}}}}} = [{\text{Z}}{{{\text{n}}}^{{2 + }}}] \cdot [{\text{O}}{{{\text{H}}}^{--}}],$(2)
$[{\text{Zn(OH}}{{{\text{)}}}_{2}}] \cdot {{k}_{{{\text{н 2}}}}} = [{\text{ZnO}}{{{\text{H}}}^{ + }}] \cdot [{\text{O}}{{{\text{H}}}^{--}}],$(3)
$[{\text{Zn(OH)}}_{3}^{ - }] \cdot {{k}_{{{\text{н 3}}}}} = \left[ {{\text{Zn(OH}}{{)}_{2}}} \right] \cdot [{\text{O}}{{{\text{H}}}^{--}}],$(4)
$[{\text{Zn}}({\text{OH}})_{{\text{4}}}^{{{\text{2}} - }}] \cdot {{k}_{{{\text{н 4}}}}} = [{\text{Zn}}({\text{OH}})_{{\text{3}}}^{ - }] \cdot [{\text{O}}{{{\text{H}}}^{--}}],$(5)
${\text{[Zn}}({\text{OH}})_{5}^{{3 - }}{\text{]}} \cdot {{k}_{{{\text{н 5}}}}} = [{\text{Zn}}({\text{OH}})_{4}^{{2 - }}] \cdot [{\text{O}}{{{\text{H}}}^{--}}],$(6)
$[{\text{Zn}}({\text{OH}})_{6}^{{4 - }}] \cdot {{k}_{{{\text{н 6}}}}} = [{\text{Zn}}({\text{OH}})_{5}^{{3 - }}] \cdot [{\text{O}}{{{\text{H}}}^{--}}],$(7)
$[{\text{Z}}{{{\text{n}}}_{{\text{3}}}}{{({\text{OH}})}^{{5 + }}}] \cdot {{k}_{{{\text{н 7}}}}} = {{[{\text{Z}}{{{\text{n}}}^{{2 + }}}]}^{2}} \cdot [{\text{Zn}}{{({\text{OH}})}^{ + }}],$(8)
$[{\text{Z}}{{{\text{n}}}_{{\text{2}}}}{{({\text{OH}})}^{{3 + }}}] \cdot {{k}_{{{\text{н 8}}}}} = [{\text{Z}}{{{\text{n}}}^{{{\text{2 + }}}}}] \cdot [{\text{Zn}}{{({\text{OH}})}^{ + }}],$(9)
$[{\text{Z}}{{{\text{n}}}_{{\text{4}}}}{\text{(OH)}}_{6}^{{2 + }}] \cdot {{k}_{{{\text{н 9}}}}} = {{[{\text{Zn(OH}}{{{\text{)}}}^{ + }}]}^{2}} \cdot {{[{\text{Zn(OH}}{{{\text{)}}}_{2}}]}^{2}},$(10)
$[{\text{Z}}{{{\text{n}}}_{{\text{8}}}}{\text{(OH)}}_{{14}}^{{2 + }}] \cdot {{k}_{{{\text{н 10}}}}} = {{[{\text{Zn(OH}}{{{\text{)}}}_{2}}]}^{6}} \cdot {{[{\text{Zn(OH}}{{{\text{)}}}^{ + }}]}^{2}},$(11)
$[{\text{Z}}{{{\text{n}}}_{8}}{{{\text{(OH)}}}_{{16}}}] \cdot {{k}_{{{\text{н 11}}}}} = {{[{\text{Zn(OH}}{{{\text{)}}}_{2}}]}^{8}},$(12)
$[{\text{Z}}{{{\text{n}}}_{{\text{8}}}}{\text{(OH)}}_{{17}}^{ - }] \cdot {{k}_{{{\text{н 12}}}}} = {{[{\text{Zn(OH}}{{{\text{)}}}_{2}}]}^{8}} \cdot [{\text{O}}{{{\text{H}}}^{--}}],$(13)
$[{\text{Z}}{{{\text{n}}}_{{\text{8}}}}{\text{(OH)}}_{{18}}^{{2 - }}] \cdot {{k}_{{{\text{н 13}}}}} = {{[{\text{Zn(OH}}{{{\text{)}}}_{2}}]}^{8}} \cdot {{[{\text{O}}{{{\text{H}}}^{--}}]}^{2}},$В изучаемой системе возможно формирование как моно-, так и полиядерных труднорастворимых соединений: Zn(OH)2 (kн2S), Zn8(OH)14Cl2 (kн10S), NaZn8(OH)17 (kн12S), Na2Zn8(OH)18 (kн13S), где kн2S, kн10S–kн12S – константы равновесия процессов образования соответствующих соединений.
В таблице 1 приведены рассчитанные нами и справочные значения показателей констант нестойкости рассмотренных выше процессов. Наблюдаются значительные различия не только между расчетными и справочными показателями констант нестойкости комплексных ионов и соединений цинка, но и между самими справочными значениями, что связано, вероятно, с использованием различных методов и условий их определения.
Таблица 1.
Рассчитанные по данным потенциометрического титрования значения показателей констант нестойкости гидроксокомплексов цинка и констант динамического равновесия малорастворимых соединений
| Показатели констант нестойкости | Расчетное значение | Справочное значение | ||
|---|---|---|---|---|
| [25] | [26] | [27] | ||
| pkн1 | 5.8 ± 0.5 | 6.04 | 6.31 | 5.04 |
| pkн2 | 11.0 ± 0.2 | 11.1 | 11.19 | 12.90 |
| pkн3 | 15.3 ± 0.5 | 13.6 | 14.31 | 15.00 |
| pkн4 | 18.5 ± 0.2 | 14.8 | 17.70 | 16.63 |
| pkн5 | 21.1 ± 0.9 | – | – | – |
| pkн6 | 23.3 ± 0.8 | – | – | – |
| pkн7 | 2.9 ± 0.6 | – | – | – |
| pkн8 | 4.0 ± 0.5 | – | – | – |
| pkн9 | 14.5 ± 0.5 | – | – | – |
| pkн10 | 19.0 ± 0.8 | – | – | – |
| pkн11 | 33.5 ± 0.5 | – | – | – |
| pkн12 | 41.0 ± 0.3 | – | – | – |
| pkн13 | 46.0 ± 0.2 | – | – | – |
| pkн2S | –5.2 ± 0.4 | – | – | – |
| pkн10S | –1.6 ± 0.3 | – | – | – |
| pkн12S | –10.5 ± 0.5 | – | – | – |
| pkн13S | –8.0 | – | – | – |
Долевое распределение комплексных форм и малорастворимых соединений, образующихся в системе ZnCl2–H2O–NaOH в зависимости от pH и исходных концентраций реагентов, представлены на рис. 3. Из рис. 3а видно, что при минимальной концентрации цинка в растворе (0.00006 моль/л) формирование труднорастворимых соединений не происходит, что подтверждают данные, полученные из графической зависимости функции образования по гидроксид-иону от pH (рис. 2а). Однако в растворе возникает большое количество полиядерных гидроксокомплексов металла вида Zn2(OH)3+, ${\text{Z}}{{{\text{n}}}_{{\text{4}}}}{\text{(OH)}}_{6}^{{2 + }}$, Zn8(OH)16 и Zn8(OH)$_{{17}}^{ - }$. Отсюда сложно согласиться с выводами авторов [29], утверждающих, что в разбавленных растворах полиядерные гидроксокомплексы присутствуют лишь в незначительном количестве.
Рис. 3.
Расчетные перекрывающиеся области образования Zn2+ (1), гидроксокомплексов Zn2(OH)3+ (2), ${\text{Z}}{{{\text{n}}}_{{\text{4}}}}{\text{(OH)}}_{6}^{{2 + }}$ (3), ZnOH+ (4), Zn8(OH)16 (5), Zn(OH)2 (6), ${\text{Z}}{{{\text{n}}}_{{\text{8}}}}{\text{(OH}})_{{17}}^{ - }$ (7), Zn(OH)3– (8), ${\text{Zn(OH)}}_{4}^{{2 - }}$ (9), ${\text{Zn(OH)}}_{5}^{{3 - }}$ (10), ${\text{Zn(OH)}}_{6}^{{4 - }}$ (11), ${\text{Z}}{{{\text{n}}}_{{\text{8}}}}{\text{(OH)}}_{{18}}^{{2 - }}$ (14), Zn3(OH)5+ (15), ${\text{Z}}{{{\text{n}}}_{{\text{8}}}}{\text{(OH)}}_{{14}}^{{2 + }}$ (16) и малорастворимых соединений Zn(OH)2S (12), Na[Zn8(OH)17]S (13), Zn8(OH)14Cl2S (17), Na2[Zn8(OH)18]S (18) в растворе при следующих исходных концентрациях соли цинка и гидроксида натрия, моль/л: CZn(II) = 0.00006, CNaOH = 0.001 (а); CZn(II) = 0.001, CNaOH = 0.010 (б); CZn(II) = 0.01, CNaOH = = 0.11 (в); CZn(II) = 0.11, CNaOH = 1.00 (г); CZn(II) = 1.00, CNaOH = 9.60 (д); Т = 298 K.
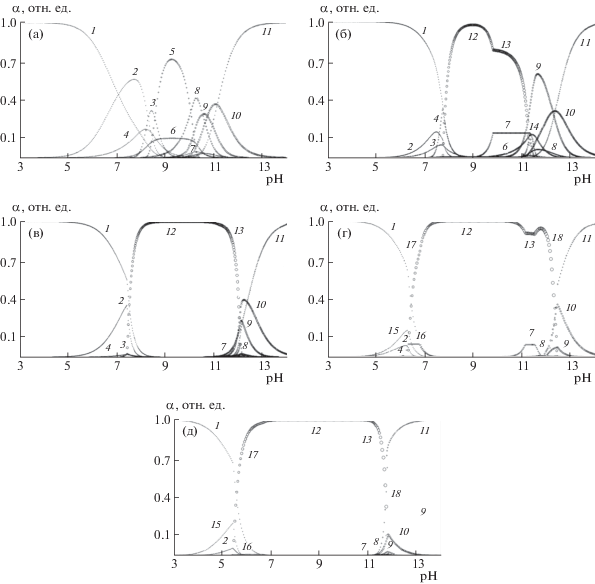
Ранее отмечалось, что при концентрации хлорида цинка выше 0.001 моль/л характерно выделение из раствора труднорастворимой фазы Znx(OH)2xS, в частности, Zn(OH)2S и расширение области ее существования с ростом содержания металла, что четко прослеживается на рис. 3б–д.
При потенциометрическом титровании соли цинка в диапазоне концентраций от 0.001 до 0.010 моль/л (рис. 3б и в) и pH > 9.8 происходит формирование фазы октогидроксоцинката Na[Zn8(OH)17]S, описываемого общей формулой Na0.125x[Znx(OH)2.125x]S. С увеличением содержания соли металла до 1.00 моль/л при pH > 11 происходит образование еще одного труднорастворимого соединения Na2[Zn8(OH)18]S. Отметим также, что на начальной стадии титрования (pH < < 6.8) при концентрации цинка больше 0.11 моль/л (рис. 3г) возникает твердая фаза Zn8(OH)14Cl2S.
В сильнощелочной среде (pH > 11.5), образованные ранее труднорастворимые соединения, подвергаются гидролитическому разложению до моноядерных форм Zn(OH)$_{3}^{ - }$, ${\text{Zn(OH)}}_{4}^{{2 - }}$, ${\text{Zn(OH)}}_{5}^{{3 - }}$ и ${\text{Zn(OH)}}_{6}^{{4 - }}$. Обратим внимание, что в литературе отсутствуют сведения о моноядерных ионах цинка с координационным числом пять и шесть.
На примере селенида и гидроксида цинка проведем сравнительный анализ ионных равновесий и определение граничных условий их образования в системе ZnCl2–H2O–NaOH–Na2SeSO3 с учетом только базисных гидроксокомплексов цинка [25], а также, принимая во внимание полиядерные формы и соединения, установленные потенциометрическим титрованием.
Механизм разложения селеносульфата натрия с образованием селенидов металлов был описан ранее в [30, 31]. Для определения граничных условий осаждения ZnSe и Zn(OH)2 в рассматриваемой системе была использована методика, приведенная нами в [32]. Для расчета использовались константы и значения величин, взятые в [12, 24, 30], а также приведенные выше в таблице 1.
Графическая зависимость в координатах pCн = = f(pH), построенная для реакционной смеси, содержащей [Na2SeSO3] = 0.1 моль/л, характеризующая равновесие между твердыми фазами ZnSe, Zn(ОН)2 и комплексными формами цинка, приведена на рис. 4. Расчетная концентрация Сн в ней определяет минимально необходимое содержание соли цинка, обеспечивающее образование твердой фазы в системе.
Рис. 4.
Граничные условия образования ZnSe (1) и Zn(ОН)2 (2) в системе ZnCl2–H2O–NaOH–Na2SeSO3 при [ZnCl2] = = 0.1 моль/л, [Na2SeSO3] = 0.1 моль/л и T = 298 K с использованием: а – справочных значений констант нестойкости [24]; б – значений констант, полученных по результатам потенциометрического титрования.
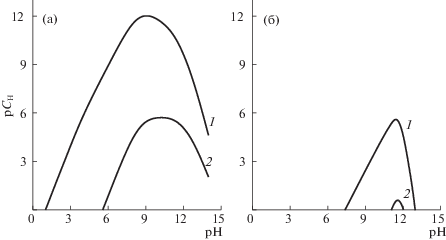
Из рис. 4 видно, что осаждение ZnSe при учете только моноядерных комплексов цинка (рис. 4а) возможно практически во всем диапазоне pH от 1 до 14. Формирование селенида цинка с одновременным образованием его гидроксида происходит при pH больше 5.8 (в области, ниже кривой 2).
В отличие от вышеприведенных результатов учет полиядерных гидроксокомплексов и труднорастворимых соединений цинка показал, что образование твердой фазы ZnSe происходит в более узком диапазоне pH: от 7.5 до 12.8, а примесной фазы Zn(OH)2 только в диапазоне рН от 11 до 12 (рис. 4б). Приведенные зависимости свидетельствуют о том, что учет выявленных полиядерных комплексных форм и труднорастворимых соединений цинка снижает показатель минимально необходимой концентрации хлорида цинка рСн, примерно на шесть порядков по сравнению с расчетными данными на основе только моноядерных комплексов металла (рис. 4а). Аналогичные расчеты по определению условий образования сульфида и гидроксида цинка в системе ZnCl2–H2O–NaOH–N2Н4СS также показывают, что учет полиядерных комплексов и труднорастворимых соединений металла значительно (на пять порядков) снижает требуемое значений рСн образования сульфида металла. Таким образом, в обоих случаях за счет учета всех комплексных форм цинка удалось обеспечить более точное прогнозирование условий образования, как селенида, так и сульфида цинка и выбрать оптимальную область pH их получения.
Микроизображения пленок ZnSe и ZnS, осажденных соответственно селеносульфатом и тиокарбамидом в рассчитанных с использованием результатов потенциометрического титрования условиях, приведены на рис. 5 а, б. Толщины пленок соответственно составили ~1000 нм и ~200 нм.
Рис. 5.
Электронно-микроскопические изображения пленок ZnSe (а) и ZnS (б), полученных химическим осаждением на ситалловых подложках в течение 120 минут из реакционных систем ZnCl2–H2O–NaOH–Na2SeSO3 (а) и ZnCl2–H2O–NaOH–N2H4CS (б).

Анализ микроструктуры пленки ZnSe показал, что наблюдаемый средний размер зерен составляет ~350–450 нм, которые являются агломератами глобульных наночастиц диаметром ~20–60 нм (рис. 5а).
Основными структурными элементами пленки ZnS (рис. 5б) являются преимущественно неоднородные по размерам шарообразные глобулы (50–200 нм), неплотно прилегающие друг к другу и представляющие собой совокупность первичных частиц диаметром ~20–30 нм.
Таким образом, потенциометрическим титрованием растворов хлорида цинка установлено, что повышение его концентрации сопровождается увеличением количества образующихся полиядерных структур и малорастворимых соединений металла.
Рассчитанные по данным титрования значения констант нестойкости полиядерных гидроксокомплексов цинка и величины констант равновесия малорастворимых соединений были использованы для определения концентрационных областей образования ZnS и ZnSe, а также Zn(ОН)2.
Химическим осаждением селеносульфатом натрия и тиокарбамидом на ситалловых подложках получены пленки сульфида и селенида цинка толщиной ~1000 и ~200 нм. По результатам электронно-микроскопических исследований слои состоят из агрегатов шаровидной формы со средними размерами ~350–450 нм для ZnSe и 50–200 нм для ZnS, сформированных, в свою очередь, из первичных частиц диаметром ~20–60 нм и ~20–30 нм соответственно.
Работа выполнена при финансовой поддержке программы 211 Правительства Российской Федерации № 02.А03.21.0006.
Список литературы
Lokhande C.D., Patil P.S., Tributsch H., Ennaoui A. // Energy Mater. Sol. Cells. 1998. V. 55. P. 379.
Omran Al-khayatt A.H., Jaafer M.D. // J. of Appl. Phys. 2014. V. 6. Iss. 1. P. 27.
Santos Cruz J., Santos Cruz D., ArenaS-Arrocena M.C. et al. // Chalcog. Lett. 2015. V. 12. № 5. P. 277.
Bacaksız E., Aksu S., Polat I. et al. // J. Alloys and Compd. 2009. V. 87. P. 280.
Mitzi D.B., Gunawan O., Todorov T.K. et al. // Sol. Ener. Mater. & Sol. Cells. 2011. V. 95. P. 1421.
Shin S.W., Pawar S.M., Park C.Y. et al. // Ibid. 2011. V. 95. № 12. P. 3202.
Кульчицкий Н.А., Наумов А.В., Семенов В.С. // Фотоника. 2015. Т. 54. В. 6. С. 90.
Todorov T.K., Tang J., Bag S. et al. // Adv. Ener. Mater. 2013. V. 3. № 1. P. 34.
Vigil-Galán O., Espíndola-Rodríguez M., Courel M. et al. // Sol. Ener. Mater. & Sol. Cells. 2013. V. 117. № 1. P. 246.
Redinger A., Groiss H., Sendler J. et al. // Thin Solid Films. 2015. V. 582. P. 193.
Demircioğlu Ö., Salas J.F. L., Rey G. et al. // Optics express. 2017.V. 25. № 5. P. 5327.
Марков В.Ф., Маскаева Л.Н., Иванов П.Н. Гидрохимическое осаждение пленок сульфидов металлов: моделирование и эксперимент. Екатеринбург: УрО РАН, 2006. 218 с.
Маскаева Л.Н., Шемякина А.И., Марков В.Ф., Сарыева Р.Х. // Журн. прикл. химии. 2015. Т. 88. Вып. 9. С. 115.
Okereke N.A., Ekpunobi A.J. // J. of Non-Oxide Glasses. 2011. V. 3. № 1. P. 31.
Yildirim E., Gubur H.M., Alpdogan S. et al. // Ind. J. Phys. 2016. V. 90. № 7. P. 793.
Shikha D., Sharma J.K., Sharma J. // Sch. J. Eng. Tech. 2014. V. 2. № 5B. P. 761.
Ho Soonmin // Amer. Chem. Sci. J. 2016. V. 14. № 4. P. 1.
Kavitha M., Saroja M., Jenifer G. // Intern. J. of Mater. Sci. and Eng. 2017. V. 5. № 3. P. 110.
Назаренко В.А., Антонович В.П., Невская Е.М. Гидролиз ионов металлов в разбавленных растворах. М.: Атомиздат, 1979. 192 с.
Ваганова Ю.В., Миролюбов В.Р., Николаенко И.В. // Журн. неорган. химии. 2014. № 2. С. 1.
Туленин С.С., Бахтеев С.А., Юсупов Р.А. и др. // Журн. физ. химии. 2013. Т. 87. № 10. С. 1791.
Федорова Е.А., Бахтеев С.А., Маскаева Л.Н. и др. // Там же. 2016. Т. 90. № 6. С. 944.
Yusupov R.A., Bakhteev S.A. // Russ. J. Phys Chem. A. 2009. V. 83. № 12. P. 2188.
Лурье Ю.Ю. Справочник по аналитической химии М.: Химия, 1989. 448 с.
Гусева А.Ф., Закс Е.В. Справочник по общей и неорганической химии. Екатеринбург: УрГУ, 2001. 39 с.
Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ М.: Дрофа, 2006. 685 с.
Батлер Дж.Н. Ионные равновесия. Л.: Химия, 1973. 448 с.
Mehta C., Saini G.S.S., Abbas J.M., Tripathi S.K. // Appl. Surf. Sci. 2009. V. 256. P. 608.
Krężela A., Maret W. // Arch. of Biochem. and Biophys. 2016. P. 1.
Китаев Г.А., Хворенкова А.Ж. // Журн. прикл. химии. 1999. Т. 71. № 8. С. 1261.
Тимина А.А., Маскаева Л.Н., Марков В.Ф. и др.// Бутлер. сообщения. 2017. Т. 52. № 11. С. 79.
Марков В.Ф., Маскаева Л.Н. // Журн. физ. химии. 2010. Т. 86. № 8. С. 1421.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


