Журнал физической химии, 2019, T. 93, № 1, стр. 59-66
Особенности межмолекулярных взаимодействий в водно-ацетонитрильных растворах производных хинолинаН. А. Некрасова, С. В. Курбатова
Н. А. Некрасова a, С. В. Курбатова a, *
a Самарский национальный исследовательский университет им. академика С.П. Королёва
Самара, Россия
* E-mail: curbatsv@gmail.com
Поступила в редакцию 07.02.2018
Аннотация
Методами аb initio молекулярной динамики исследована структура водно-ацетонитрильных растворов некоторых производных хинолина и тетрагидрохинолина. Показано, что склонность их молекул к образованию различных типов водородных связей существенно зависит как от природы функциональных групп, так и от стерических факторов. Получена линейная зависимость между долей конфигураций с водородными связями и логарифмом факторов удерживания в условиях обращенно-фазовой жидкостной хроматографии при использовании в качестве сорбента пористого графитированного углерода.
В жидкостной хроматографии сорбция из жидкой фазы, как известно, осуществляется за счет конкурентных межмолекулярных взаимодействий участников хроматографического процесса как на поверхности сорбента, так и в объеме подвижной фазы. В условиях обращенно-фазового варианта высокоэффективной жидкостной хроматографии (ОФ ВЭЖХ) вещества сорбируются преимущественно за счет дисперсионных взаимодействий молекул сорбата с неполярной поверхностью сорбента. Основными типами взаимодействия в объеме подвижной фазы при реализации такого метода являются, как правило, ориентационные и индукционные, либо водородные связи и другие специфические взаимодействия полярных компонентов элюента и молекул аналитов. Как известно, компоненты подвижной фазы также способны к прочной сорбции на поверхности сорбента, что может существенно изменить его свойства [1].
Таким образом, природа и состав элюента в условиях ОФ ВЭЖХ оказываются весьма важными факторами, влияющими на хроматографический процесс в целом. При этом разнообразие межмолекулярных взаимодействий, которые могут быть реализованы в объеме раствора элюента, позволяет, с одной стороны, в сравнительно широком диапазоне варьировать характеристики удерживания и селективность разделения за счет изменения качественного и количественного составов подвижной фазы, но, с другой стороны, существенно усложняет вид зависимости удерживания от свойств сорбатов, которую в большинстве используемых в настоящее время моделей удерживания аппроксимируют линейной функцией [2]. В связи с этим обстоятельством в публикациях последних лет все большее внимание уделяется исследованию не только непосредственно механизмов сорбции, но и процессов, протекающих в объемном растворе элюента и в конечном итоге также влияющих на реализацию определенного сорбционного механизма [3, 4].
Значительные отклонения от известных моделей удерживания наблюдаются, как правило, при хроматографировании сложных полифункциональных веществ, к которым можно отнести гетероциклические соединения, в частности, производные хинолина и тетрагидрохинолина, интерес к которым не ослабевает, прежде всего, в связи с их ценными практическими свойствами [5, 6]. Производные хинолина находят применение в качестве красителей, растворителей, консервантов и т.п. Однако, основная практическая ценность этих соединений обусловлена их фармакологическими свойствами, поскольку гетероциклическая система хинолина является структурной основой многих природных биологически активных веществ и ряда синтетических лекарственных препаратов.
В связи с изложенным цель настоящей работы – исследование процессов, протекающих в объеме водно-ацетонитрильного элюента при хроматографировании производных хинолина в условиях ОФ ВЭЖХ, с помощью методов молекулярно-динамического моделирования. Ранее нами изучены особенности сорбции этих соединений на поверхности сорбентов различной химической природы, представленные в публикациях [7, 9], в которых отмечены существенные отклонения от традиционных зависимостей “удерживание–состав элюента” для отдельных производных хинолина и тетрагидрохинолина, что побудило нас к исследованию процессов в объеме подвижной фазы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методика проведения хроматографического эксперимента подробно описана в [10]. В качестве сорбента использовали пористый графитированный углерод (ПГУ) – Hypercarb (размеры колонки 50 × 3 мм, размер зерен сорбента 5 мкм). В качестве подвижной фазы применяли смесь ацетонитрил – вода (80 об. %).
Формулы исследованных соединений, а также значения фактора удерживания, рассчитанные известным способом [1], представлены в таблице 1.
Таблица 1.
Формулы исследованных соединений и значения их фактора удерживания (k)
| № | Формула | k | № | Формула | k |
|---|---|---|---|---|---|
| 1 | 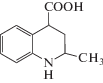 |
0.78 | 4 | 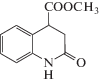 |
0.51 |
| 2 | 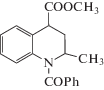 |
2.78 | 5 | 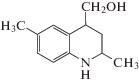 |
1.34 |
| 3 | 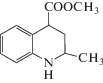 |
1.57 | 6 | 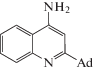 |
1.62 |
Оптимизацию геометрии молекул исследуемых сорбатов проводили с помощью пакета программ Gaussian 09 методом функционала плотности с использованием функционала B3LYP [11, 12] в базисном наборе 6-31G(d). Исходную конфигурацию для молекулярно-динамического моделирования получали с помощью программы Packmol [13]. Ячейка содержала одну оптимизированную молекулу сорбата, 50 молекул воды и 50 молекул ацетонитрила; размеры ячейки составляли 19 × 19 Å. Молекулярно-динамическое моделирование проводили с помощью программы Cp2k [14] при использовании гибридных базисов гауссовых функций и плоских волн в рамках функционала PBE с дисперсионной поправкой DFT-D3 [15].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Достоинства и недостатки растворителей, используемых в качестве элюентов в ВЭЖХ, достаточно подробно описаны в литературе [16–18]. Одним из наиболее часто используемых растворителей в условиях ОФ ВЭЖХ является смесь вода – ацетонитрил с различным содержанием ацетонитрила. Многие авторы при этом отмечают ряд особенностей водно-ацетонитрильных растворов, обусловленных, как предполагается, их структурой, приводящей к определенным аномалиям физико-химических характеристик этой смеси и, в частности, хроматографического поведения некоторых соединений при использовании в качестве элюента системы ацетонитрил – вода [8, 9, 19]. Предполагается, что такие отклонения от традиционных зависимостей вызваны, прежде всего, процессами гомо- и гетероассоциации в водно-ацетонитрильном растворе, приводящими к изменению свойств раствора.
Исследование возможных межмолекулярных взаимодействий в водно-ацетонитрильных растворах производных тетерагидрохинолина проведено нами посредством моделирования данных смесей с помощью аb initio молекулярной динамики. Мы предполагали, что использование данного метода позволит оценить тип взаимодействия тетрагидрохинолинов с компонентами водно-ацетонитрильной смеси и установить характер образующихся комплексов без привлечения эмпирических параметров, необходимых для классической молекулярной динамики.
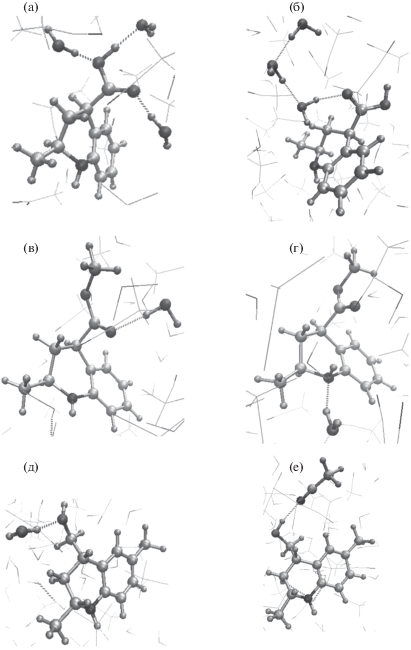
Из рис. 1 следует, что соединение 1 взаимодействует с компонентами подвижной фазы при участии карбоксильной группы, оба атома кислорода которой образуют водородные связи с молекулами воды (рис. 1а). При этом молекулы растворителя, не участвующие в таком связывании, располагаются вблизи образованного комплекса в виде цепочек (рис. 1б). Молекулы вещества 3 взаимодействуют с молекулами воды через атом кислорода карбонильной группы (рис. 1в), а также посредством образования водородной связи с участием атома азота гетероцикла, в отличие от вещества 1, для которого образование такой связи не характерно (рис. 1г). Соединение 5 взаимодействует с компонентами водно-ацетонитрильного раствора преимущественно за счет гидроксильной группы, образуя водородную связь как с молекулами воды (рис. 1д), так и с атомом азота ацетонитрила (рис. 1е).
Рис. 1.
Строение комплексов, образованных молекулами исследованных соединений и молекулами подвижной фазы за счет водородных связей (а, б – соединение 1; в, г – соединение 3; д, е – соединение 5).
Для оценки относительной силы межмолекулярных взаимодействий в исследуемых системах “производное хинолина–ацетонитрил–вода” нами были получены функции радиального распределения для атомов сорбатов, участвующих в образовании водородных связей, и молекул подвижной фазы, графическое изображение которых приведено на рис. 2–5. Из анализа полученных функций следует возможность связывания молекул аналитов с компонентами подвижной фазы различными способами и соответственно разное число конфигураций образующихся комплексов.
Рис. 2.
Функции радиального распределения для пары атомов D и А соединения 1 и молекул подвижной фазы, образующих связь D–H···A; а: D – гидроксильный атом кислорода карбоксильной группы, А – атом кислорода молекулы воды; б: D – атом кислорода молекулы воды, А – карбонильный атом кислорода карбоксильной группы; в: D – атом кислорода молекулы воды, А – гидроксильный атом кислорода карбоксильной группы; г: D – углерод молекулы ацетонитрила, А – карбонильный атом кислорода карбоксильной группы.
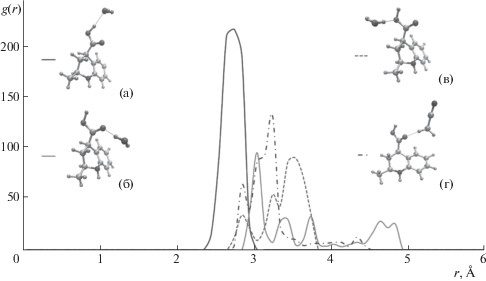
Рис. 3.
Функции радиального распределения для пары атомов D и А соединения 3 и молекул подвижной фазы, образующих связь D–H···A; а: D – атом кислорода молекулы воды, А – атом азота в гетероцикле; б: D – атом кислорода молекулы воды, А – карбонильный атом кислорода сложноэфирной группы.
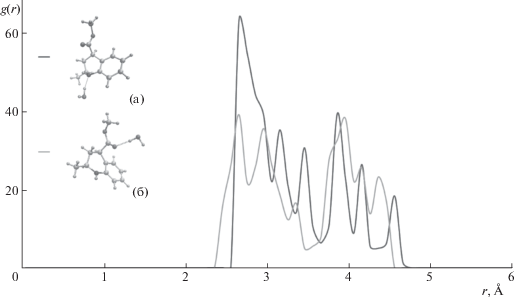
Рис. 4.
Функция радиального распределения для пары атомов D и А соединения 4 и молекул подвижной фазы, образующих связь D–H···A; а: D – атом кислорода молекулы воды, А – карбонильный атом кислорода сложноэфирной группы; б, в: D – атом кислорода молекулы воды, А – атом кислорода карбонильной группы; г: D – атом азота гетероцикла, А – атом кислорода молекулы воды; д: D – атом кислорода молекулы воды, А – эфирный атом кислорода сложноэфирной группы.
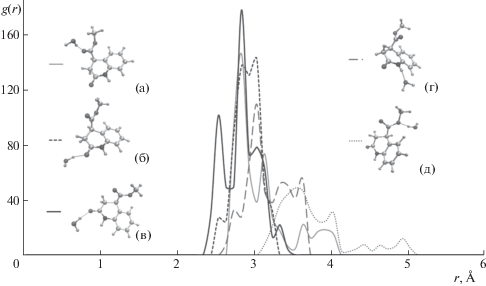
Рис. 5.
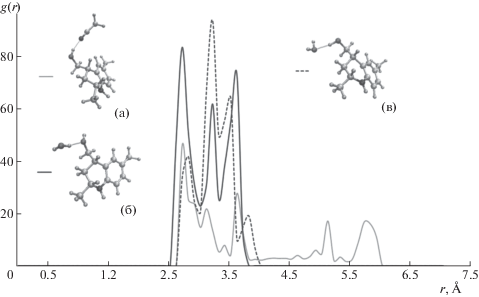
Функции радиального распределения для пары атомов D и А соединения 5 и молекул подвижной фазы, образующих связь D–H···A; а: D – атом кислорода гидроксильной группы, А – атом азота молекулы ацетонитрила; б: D – атом кислорода молекулы воды, А – атом кислорода гидроксильной группы; в: D – атом кислорода гидроксильной группы, А – атом кислорода молекулы воды.
Как видно из рис. 2, соединение 1 взаимодействует с комонентами подвижной фазы посредством атомов кислорода карбоксильной группы, образуя водородные связи либо с молекулами воды (а, б, в), либо с ацетонитрилом (д). При этом возникающая между молекулами сорбата и ацетонитрила связь СН···О относится к слабым водородным связям [20]. Наиболее вероятным оказывается взаимодействие атомов водорода карбоксильной группы и кислорода молекулы воды с образованием водородной связи средней силы преимущественно электростатической природы по классификации Джеффри [21].
Для системы “соединение 3–ацетонитрил–вода” вид функции радиального распределения имеет иной вид. Из рис. 3 следует преобладание в этом случае водородной связи атома азота гетероцикла с молекулой воды (комплекс (а)), в которой азот выступает акцептором водорода. Взаимодействия с карбонилом сложноэфирной группы (комплекс (б)) характеризуются практически такой же длиной связи, как и в случае атома азота, однако, они выражены в значительно меньшей степени, о чем свидетельствует небольшая высота соответствующего пика.
На рис. 4 приведены графики функций радиального распределения для системы “соединение 4–ацетонитрил–вода”, которые наглядно демонстрируют образование водородных связей в комплексах (а), (б), (в) и (г): максимальные пики на кривых соответствуют расстоянию между атомами r ≤ 3Å, что весьма близко к характерным значениям длин водородных связей (~2.8 Å между атомами О–О, ~2.9 Å между атомами N–O). Однако такое взаимодействие в комплексе (г) оказывается, по-видимому, более слабым, что выражается в заметно меньшей доле конфигураций с расстоянием N–O, не превышающем 3.2 Å. Этот факт обусловлен, вероятно, меньшей электроотрицательностью атома азота по сравнению с кислородом и, как следствие, меньшим частичным положительным зарядом на водороде, связанном с ним. Водородная связь в комплексе (д) оказывается наиболее слабой для рассмотренных конфигураций. В данном случае причиной может быть наличие сопряжения между двумя атомами кислорода сложноэфирной группы, причем атом кислорода, образующий водородную связь в комплексе (д), в отличие от карбонильных атомов кислорода комплексов (а), (б) и (в) проявляет положительный мезомерный эффект. В результате он теряет часть электронной плотности и притягивает атом водорода молекулы воды в меньшей степени. Карбонил в положении 2 тетрагидрохинолинового каркаса способен образовывать водородные связи с двумя молекулами воды, что иллюстрируют представленные на графике оба соответствующих ассоциата (комплексы (б) и (в)). В обоих случаях образуется сравнительно сильная водородная связь, при этом длина связи в ассоциате (в) может быть существенно меньше и составлять ~2.5 Å, что соответствует сильной, преимущественно ковалентной водородной связи по классификации Джеффри [21]. Водородные связи между молекулами содинения 4 и ацетонитрила при молекулярно-динамическом моделировании не были обнаружены.
Как следует из графика функции радиального распределения для ассоциатов молекулы соединения 5 с компонентами подвижной фазы (рис. 5), одни и те же связи могут значительно варьироваться по силе, что может свидетельствовать о значительном влиянии конфигурации молекул, окружающих данные комплексы. Так, гидроксильный кислород может связываться и с водой (комплексы (б), (в)), и с ацетонитрилом (комплекс (а)), проявляя себя как в качестве донора, так и в качестве акцептора атома водорода. В обоих случаях длина соответствующей связи составляет ~2.6–3.6 Å, т.е. охватывает диапазон как сильных, так и слабых водородных связей. При этом для ассоциата с молекулой воды преобладающей оказывается доля сильных взаимодействий. Связь гидроксил–вода, в которой гидроксильная группа выступает донором водорода (комплекс (в)) оказывается менее выраженной, хотя и характеризуется приблизительно такой же длиной связи, как и в случае проявления им роли акцептора (комблекс (б)). Преобладание акцепторной функции можно объяснить положительным индуктивным влиянием связанного с гидроксилом метилентетрагидрохинолинового скелета, что приводит к повышению электронной плотности на атоме кислорода по сравнению с кислородом молекулы воды.
Таким образом, результаты молекулярно-динамического моделирования показывают возможность образования исследуемыми производными хинолина и тетагидрохинолина водородных связей с молекулами подвижной фазы, причем их число и сила значительно различаются для разных сорбатов и функциональных групп в их составе.
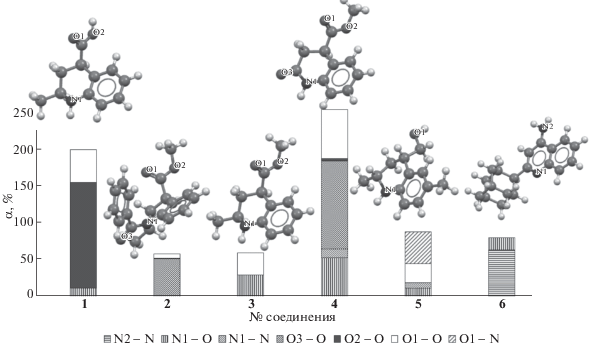
Различие в силе межмолекуляных взаимодействий, характеризуемое долей конфигураций с водородными связями “сорбат–компоненты раствора” относительно всех конфигураций, полученных в ходе молекулярно-динамического моделирования, наглядно демонстрирует диаграмма на рис. 6. Максимальная склонность к образованию водородных связей с молекулами воды и ацетонитрила наблюдается у соединения 4, минимальная – у соединения 2. Эти данные согласуются с результатами хроматографического эксперимента: для соединения 4 характерно наименьшее удерживание в ряду исследуемых сорбатов, а для соединения 2 – наибольшее. Интересно отметить при этом, что в молекулах обоих соединений присутствует одинаковый набор полярных функциональных групп; их строение различается только положением заместителей и наличием в структуре соединения 2 фенильного и метильного радикалов. По-видимому, их экранирующим действием и объясняется столь сильное различие в способности молекул к образованию водородных связей.
Кроме того, как видно из диаграммы, атом азота аминогруппы соединения 6 преимущественно образует водородные связи с молекулами ацетонитрила, что согласуется с более выраженными электронодонорными способностями атома азота ацетонитрила по сравнению с таковыми для кислорода воды. Однако, гетероциклический атом азота тетрагидрохинолинового каркаса более сколонен к образованию связей с молекулами воды, наиболее вероятная причина этого – стерический фактор: молекулы ацетонитрила больше молекул воды, и заместитель в положении 2 в структуре сорбатов препятствует их приближению на достаточные расстояния.
Различие в способности к образованию водородных связей карбонильным кислородом карбоксильной (соединение 1) и сложноэфирной (соединения 2–4) групп также оказывается довольно заметным. При этом исходя из электронных эффектов заместителей можно ожидать большей склонности к ее образованию для сложноэфирной группы вследствие положительного индуктивного влияния метильного радикала и соответственно увеличения электронной плотности на атомах кислорода. Однако, для соединения 2 соответствующие связи оказываются значительно слабее, чем для соединения 1. Этот факт, вероятно, также связан с пространственным строением молекулы соединения 2: расположение фенильного радикала в его структуре приводит к значительному экранированию карбонильного кислорода сложноэфирной группы.
Таким образом, стерические факторы оказывают не меньшее влияние на межмолекулярные взаимодействия в системе “производное хинолина–ацетонитрил–вода”, чем электронные эффекты заместителей, входящих в структуру молекул аналитов.
Способность гидроксильного атома кислорода карбоксильной (соединение 1) и гидроксильной (соединение 5) групп к образованию водородных связей также заметно различается, и оказывается более выраженой для карбоксильной группы. Это согласуется с представлениями теоретической органической химии: карбонил в карбоксигруппе проявляет электроноакцепторное влияние за счет отрицательного мезомерного эффекта; в результате электронная плотность на гидроксильном кислороде понижается, связанный с ним водород приобретает больший частичный положительный заряд и сильнее притягивается кислородом молекул воды.
Влияние различной способности производных хинолина к образованию водородных связей с компонентами водно-ацетонитрильного раствора элюента на их хроматографическое поведение представлено на рис. 7. Из представленного графика следует удовлетворительная линейная корреляция между логарифмом факторов удерживания и склонностью молекул сорбатов к образованию водородных связей с компонентами элюента. При этом с усилением межмолекулярных взаимодействий в водно-ацетонитрильном растворе удерживание, как и следовало ожидать, уменьшается.
Рис. 7.
Зависимость удерживания производных хинолина (lg k) от доли конфигураций с водородными связями “сорбат–компоненты раствора” (α).
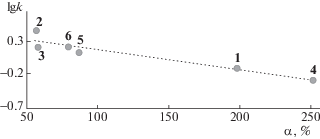
В целом на основании анализа полученных результатов можно сделать заключение о способности молекул аналитов образовывать специфические связи с компонентами раствора различными способами, реализация которых определяется как электронными эффектами заместителей в молекулах аналитов, так и стерическими факторами. При этом доля конфигураций с водородными связями “аналит–компоненты раствора” линейно коррелирует с хроматографическим удерживанием соединений при сорбции из растворов соответствующего состава на неполярных сорбентах, что позволяет использовать данный параметр в качестве дескриптора при прогнозировании хроматографического поведения близких по структуре веществ.
Работа выполнена при поддержке Министерства образования и науки Российской Федерации в рамках государственного задания по гранту №№ 4.5883.2017/8.9 и Мегагранту № 14.В25.31.0005.
Список литературы
Шатц В.Д., Сахартова О.В. Высокоэффективная жидкостная хроматография: Основы теории. Методология. Применение в лекарственной химии. Рига: Зинатне, 1988. 390 с.
Kaliszan R. // Chem. Rev. 2007. V. 107. P. 3212.
Chirkin V.A., Karpov S.I., Selemenev V.F. // J. Anal. Chem. 2013. V. 68. № 4. P. 341.
Saifutdinov B.R. // Russ. Chem. Bull. 2015. V. 63. № 12. P. 2609.
Kumar S., Bawa S., Gupta H. // Mini-Reviews Med. Chem. 2009. V. 9. № 14. P. 1648.
Sridharan V., Suryavanshi P.A., Menendez J.C. // Chem. Rev. 2011. V. 111. P. 7157.
Савченкова А.С., Курбатова С.В., Земцова М.Н. // Сорбционные и хроматографические процессы. 2014. Т. 14. С. 468.
Парамонова А.С., Андреева А.А., Курбатова С.В. и др. // Бутлеровские сообщения. 2012. Т. 32. № 10. С. 42.
Парамонова А.С., Курбатова С.В., Земцова М.Н. // Журн. физ. химии. 2014. Т. 88. № 2. С. 333.
Некрасова Н.А., Курбатова С.В., Земцова М.Н. // Там же. 2016. Т. 90. № 12. С. 1883.
Lee C., Yang W., Parr R.G. // Phys. Rev. B. 1988. V. 37. № 2. P. 785.
Becke A.D. // J. Chem. Phys. 1993. V. 98. № 7. P. 5648.
Martinez L., Andrade R., Birgin E.G. et al. // J. Comput. Chem. 2009. V. 30. № 13. P. 2157.
Hutter J., Iannuzzi M., Schiffmann F. et al. // WIREs Comput. Mol. Sci. 2014. V. 4. P. 15.
Grimme S., Antony J., Ehrlich S. et al. // J. Chem. Phys. 2010. V. 132. № 15. P. 154104.
Prache N., Abreu S., Sassiat P. et al. // J. Chromatogr. A. 2016. V. 1464. P. 55.
Shen Y., Chen B., Van Beek T.A. // Green Chem. 2015. V. 17. № 7. P. 4073.
Melnikov S.M., Höltzel A., Seidel-Morgenstern A. et al. // J. Phys. Chem. 2015. V. 119. № 1. P. 512.
Galaon T., Anghel D.-F., David V. et al. // Chromatographia. 2013. V. 76. № 23–24. P. 1623.
Steiner T. // Implic. Mol. Mater. Struct. New Technol. 1999. V. 360. P. 185.
Jeffrey G.A. An Introduction to Hydrogen Bonding. Oxford University Press, 1997. 320 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии