Журнал физической химии, 2019, T. 93, № 1, стр. 67-73
Структурные особенности сольватации метилксантинов в бинарных смесях тетрахлорметан–метанол на основе молекулярно-динамического моделированияД. Л. Гурина, В. А. Голубев
Д. Л. Гурина a, *, В. А. Голубев a
a Российская академия наук, Институт химии растворов им. Г.А. Крестова
Иваново, Россия
* E-mail: gdl@isc-ras.ru
Поступила в редакцию 12.02.2018
Аннотация
Методом молекулярной динамики исследована сольватация метилксантинов (кофеина, теофиллина, теобромина) в смесях тетрахлорметан–метанол во всем диапазоне концентраций при стандартных условиях. Показано, что молекулы метилксантинов образуют водородные связи с молекулами метанола посредством двух атомов кислорода и атома азота и слабо взаимодействуют посредством атома водорода, связанного с углеродом имидазольного цикла. Распределение числа водородных связей, образованных между различными атомами метилксантинов и атомами метанола, не зависит от концентрации полярного сорастворителя. При низком содержании метанола метилксантины проявляют тенденцию к образованию стопочных стэкинг-агрегатов.
Ксантины представляют собой пуриновые основания, которые встречаются в тканях и жидкостях организма человека, большинства млекопитающих и некоторых растениях. Метилированные производные ксантина, такие как кофеин (КФ), теофиллин (ТФ) и теобромин (ТБ) находят широкое применение в медицине. В последние годы метилксантины (МК) являлись объектом как экспериментальных, так и теоретических исследований. Так, методом молекулярной динамики была исследована сольватация пуриновых алкалоидов в сверхкритическом СО2 [1] и кофеина в водных растворах [2–6]. С использованием методов 13C и 1H ЯМР-спектроскопии [7], ИК-фурье-спектроскопии [8] были изучены процессы агрегации кофеина в чистой воде и с добавлением сорастворителей [9]. Тем не менее, детального исследования поведения метилксантинов в смеси растворителей различной природы (полярный + неполярный) до сих пор не проводилось.
В работе [10] нами были представлены результаты исследования самодиффузии кофеина и метанола в тройных системах кофеин–метанол–тетрахлорметан при температурах 298 К и 313 К методом ЯМР-спектроскопии. В настоящей работе, которая является продолжением [10], мы сфокусировали внимание на изучении особенностей межмолекулярных взаимодействий в этих системах (водородного связывания, стэкинг-взаимодействий, само- и гетероассоциации) методом классической молекулярной динамики при температуре 298 К и плотностях, соответствующих атмосферному давлению.
ДЕТАЛИ МОДЕЛИРОВАНИЯ
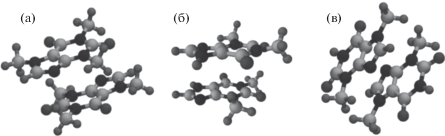
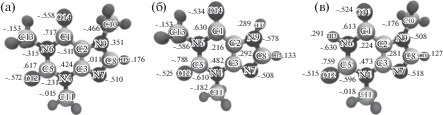
Моделирование методом классической молекулярной динамики было проведено в программном пакете Gromacs-5.0.7 [11] в силовом поле OPLSAA [12]. Недостающие параметры (длины связей, валентные и тетраэдрические углы, заряды) для молекул кофеина (КФ), теобромина (ТБ) и теуфиллина (ТФ) (рис. 1) были взяты из [13]. Расчеты проводили в NVT-ансамбле. Уравнения Ньютона интегрировались с помощью алгоритма Верле [14] с шагом по времени 1 фс. Постоянная температура поддерживалась термостатом Нозе–Хувера [15, 16]. Учет дальнодействующих электростатических взаимодействий проводился с использованием модифицированного метода суммирования Эвальда [17, 18]. Радиус обрезания кулоновских и короткодействующих вандерваальсовых взаимодействий принимался равным 1.5 нм. Для ограничения по длинам связей использовали алгоритм LINCS [19]. Для визуализации данных пользовались графической программой VMD [20].
Рис. 1.
Молекулы метилксантинов с обозначениями атомов и зарядами: а – кофеин (КФ), б – теофиллин (ТФ), в – теобромин (ТБ).
Кубическая ячейка с периодическими граничными условиями содержала пять молекул КФ, ТБ или ТФ и более 4000 тысяч молекул чистого или смешанного растворителя (табл. 1). Ограничение на количество молекул исследуемых соединений вводилось ввиду малой растворимости метилксантинов в чистых растворителях. Расчеты проводились при постоянной температуре 298 К во всей области концентраций метанола при плотностях, соответствующим экспериментальным для бинарных смесей CCl4–CH3OH [21]. После минимизации энергии проводили уравновешивание систем в течение 10 нс, затем в течение 10 нс с шагом 0.1 пс осуществляли сбор данных для последующего анализа.
Таблица 1.
Мольная доля метанола (xСН3OH), число молекул метанола (N(СН3OH)) и тетрахлорметана (N(CCl4)) в моделируемой ячейке, плотности (ρ) моделируемых систем при 298 K и атмосферном давлении [21]
| xСН3OH, мол. доли | N(СН3OH) | N(CCl4) | ρ, кг/м3 |
|---|---|---|---|
| 0 | 0 | 4096 | 1588.23 |
| 0.05 | 205 | 3871 | 1568.02 |
| 0.1 | 410 | 3669 | 1548.09 |
| 0.3 | 1232 | 2846 | 1463.24 |
| 0.5 | 2050 | 2032 | 1351.18 |
| 0.7 | 2877 | 1213 | 1186.53 |
| 0.9 | 3667 | 401 | 943.92 |
| 1 | 4096 | 0 | 785.46 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Структура бинарных растворов тетрахлорметан–метанол широко изучена как экспериментально, так и методами компьютерного моделирования [22–26], поэтому в данной работе мы не будем детально рассматривать взаимодействия CCl4–CH3OH, а сфокусируем внимание на взаимодействиях метилксантинов с полярным компонентом бинарного растворителя и друг с другом.
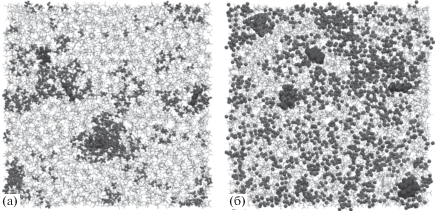
На рис. 2 представлены ФРР атомов кислорода и гидроксильного атома водорода метанола вокруг пяти атомов молекул метилксантинов. На рис. 2а показана зависимость распределения атомов Н метанола вокруг атома кислорода О12 ТБ при различном содержании полярного сорастворителя в системе (0.05, 0.1, 0.3, 0.5, 0.7, 0.9 и 1 мол. доли). При увеличении мольной доли метанола от 0.05 до 0.1 высота пика уменьшается в 1.64 раза, а при переходе от раствора с мольной долей метанола 0.5 к чистому растворителю высота первого пика меняется незначительно. Это свидетельствует о том, что при низких концентрациях метанола молекулы полярного сорастворителя не распределены равномерно по объему раствора, а локализованы вблизи молекул метилксантинов. Мгновенные снимки молекулярно-динамических ячеек наглядно иллюстрируют это явление (рис. 3а).
Рис. 2.
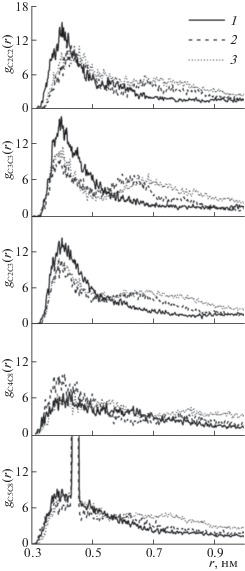
Функции радиального распределения атомов кислорода (Оm) и гидроксильного атома водорода (Hm) метанола вокруг атомов молекул метилксантинов: а – gO12Hm(r) вокруг атома О12 ТБ при различном содержании метанола в растворе: xCH3OH = 0.05 (1), 0.1 (2), 0.3 (3), 0.5 (4), 0.7 (5), 0.9 (6), 1 мол. доли (7) вокруг атомов КФ (I), ТФ ( II) и ТБ (III) при xCH3OH = = 0.3 мол. доли: б – gN7Hm(r) вокруг атома N7; в – gO12Hm(r) вокруг атома О12; г – gH15Om(r) вокруг атома Н15; д – gO14Hm(r) вокруг атома О14; е – gH10Om(r) вокруг атома Н10 для ТФ и gH13Om(r) вокруг атома Н13 для ТБ.
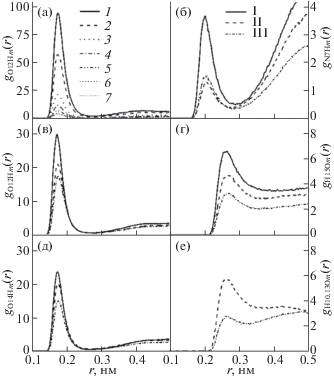
Рис. 3.
Мгновенные снимки молекулярно-динамических ячеек: а – xCH3OH = 0.1 мол. доли; б – xCH3OH = 0.9 мол. доли.
Поведение всех ФРР для КФ и ТФ с увеличением концентрации метанола такое же, как для ТБ, поэтому для них ФРР показаны только для концентрации метанола 0.3 мол. доли (рис. 2б–е). Молекулы метилксантинов имеют несколько атомов акцепторов протонов (N7, O12, O14) и могут одновременно выступать в качестве доноров протонов (атомы H10, H13). Действительно, на рис. 2б, в, д видно, что все ФРР имеют высокие пики на расстоянии, не превышающем пороговое значение геометрического критерия водородной связи (rA···H ≤ 0.26 нм): rO12,O14···Hm = 0.174 нм и rN7···Hm = 0.202 нм для КФ; rO12,O14···Hm = 0.176 нм и rN7···Hm = 0.204 нм для ТБ; rO12···Hm = 0.176 нм, rO14···Hm = 0.174 нм и rN7···Hm = 0.208 нм для ТФ. Для всех трех соединений пики на ФРР атомов Hm вокруг O12 и O14 выше, чем на gN7Hm(r), что может быть связано с большей электроотрицательностью атомов кислорода по сравнению с атомом азота. Основное различие между КФ и ТФ, КФ и ТБ − существенное увеличение числа атомов Hm вблизи O12 и O14, что может быть обусловлено меньшей величиной заряда на атомах O12 и O14 КФ (рис. 1). Метильная группа в положении N6 и N9 замещена атомами H13 и H10 для ТБ и ТФ соответственно. Это дает дополнительную возможность для специфического взаимодействия с полярным сорастворителем. Наличие ярко выраженных пиков на расстоянии 0.26 нм на ФРР gH10Om(r) и gH13Om(r) (рис. 2е) позволяет предположить возможность возникновения слабых водородных связей с метанолом. Для молекулы ТФ вероятность найти атом Оm вблизи H10 значительно выше, чем вблизи атома H13 ТБ. Это связано с наличием атомов O12 и O14 по соседству с H13, которые притягивают молекулы растворителя к себе. Протон H15 также взаимодействует с атомом кислорода метанола, но максимум на соответствующих ФРР (рис. 2г) находится на расстояниях 0.264 нм для КФ, 0.266 нм для ТФ, 0.27 нм для ТБ, что превышает пороговое значение геометрического критерия ВС. Такой тип взаимодействия ранее наблюдали авторы [2] для КФ в водном растворе, и авторы [27] для пуриновых оснований, входящих в состав нуклеиновых кислот, с топологически и химически подобными протонами.
В недавних экспериментальных и теоретических работах [2–4] было показано, что кофеин проявляет тенденцию к агрегации в воде, которая происходит путем образования не только стопочных агрегатов, но и неупорядоченных разветвленных агрегатов, достигающих размеров 1000–3000 Å. В изученных нами системах образование аналогичных разветвленных агрегатов невозможно из-за небольшого количества метилксантинов в растворе (пять молекул), однако, возможно образование стопочных агрегатов. Для проверки наличия таких молекулярных образований в рассмотренных системах, мы рассчитали ФРР gC2C2(r), gC3C3(r) и gC2C3(r) (условно центр гидрофобных граней растворенных веществ представлен связью C2 = C3, которая является общей для двух циклов) и соответствующие координационные числа nαβ(r) (табл. 2).
Таблица 2.
Координационные числа nC2C2, nC3C3, nC2C3, полученные интегрированием (рис. 4) до первого минимума соответствующих ФРР
| xСН3OH, мол. доли | КФ | ТФ | ТБ | ||||||
|---|---|---|---|---|---|---|---|---|---|
| nC2C2 | nC3C3 | nC2C3 | nC2C2 | nC3C3 | nC2C3 | nC2C2 | nC3C3 | nC2C3 | |
| 0 | 0.22 | 0.22 | 0.22 | 0.14 | 0.11 | 0.12 | 0.12 | 0.10 | 0.10 |
| 0.05 | 0.15 | 0.14 | 0.14 | 0.09 | 0.08 | 0.08 | 0.08 | 0.07 | 0.07 |
| 0.1 | 0.05 | 0.06 | 0.05 | 0.06 | 0.04 | 0.05 | 0.05 | 0.05 | 0.05 |
| 0.3 | 0.03 | 0.03 | 0.03 | 0.02 | 0.01 | 0.02 | 0.02 | 0.02 | 0.02 |
| 0.5 | 0.03 | 0.04 | 0.04 | 0.03 | 0.02 | 0.03 | 0.03 | 0.03 | 0.03 |
| 0.7 | 0.04 | 0.04 | 0.04 | 0.01 | 0.01 | 0.01 | 0.03 | 0.03 | 0.03 |
| 0.9 | 0.02 | 0.02 | 0.02 | 0.01 | 0.01 | 0.01 | 0.03 | 0.03 | 0.03 |
| 1 | 0.01 | 0.01 | 0.01 | 0.01 | 0.01 | 0.01 | 0.04 | 0.04 | 0.04 |
ФРР gC2C2(r), gC3C3(r), gC2C3(r), gC8C8(r) и gC5C8(r) представлены на рис. 4 для метилксантинов, растворенных в бинарном растворе с мольной долей метанола 0.5 (ФРР для других растворов проявляют сходное поведение и не представлены здесь). Как можно видеть, все ФРР имеют высокий ярко выраженный пик, который находится на ≈0.4 нм, что свидетельствует о наличии стэкинг-агрегатов. Наличие объемных CH3-групп препятствует расположению молекул метилксантинов строго друг над другом. Чтобы избежать стерических затруднений между метильными фрагментами молекулы МК поворачиваются вокруг нормали к плоскости ароматических колец, в результате взаимная ориентация молекул МК друг относительно друга может быть как параллельная, так и антипараллельная. Более высокий пик на ФРР gC8C8(r) по сравнению с gC5C8(r) для ТФ (рис. 4) позволяет предположить, что ТФ образует большее количество параллельных стэкинг-агрегатов, напротив, КФ и ТБ преимущественно ориентированы антипараллельно. На рис. 5 показаны мгновенные снимки стэкинг-димеров метилксантинов в моделируемой ячейке. Координационные числа, представленные в табл. 2, свидетельствуют о том, что КФ проявляет более сильную тенденцию к агрегации по сравнению с ТФ и ТБ. Однако с увеличением концентрации метанола в растворе количество стэкинг-агрегатов становится незначительным для всех растворенных веществ. Этот факт можно объяснить образованием прочных водородных связей с молекулами метанола.
Рис. 4.
Функции радиального распределения атомов углерода молекул метилксантинов: КФ (1), ТФ (2) и ТБ (3) при xCH3OH = 0.5 мол. доли.
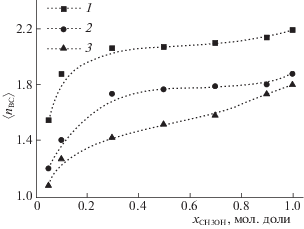
Являясь электроно- и протонодонорными, молекулы метилксантинов образуют водородные связи с метанолом в бинарном и в чистом полярном растворителе. Мы рассчитали среднее число ВС на молекулу метилксантина 〈nВС〉 (рис. 6) с использованием геометрического критерия ВС (rA··A ≤ ≤ 3.5 Å, rH···A ≤ 2.6 Å, и ∠(H–A⋅⋅⋅A) ≤ 30° , где A – акцептор протона). Во всех системах 〈nВС〉 КФ –метанол выше, чем 〈nВС〉 ТФ-метанол и ТБ-метанол, несмотря на то, что ТФ и ТБ имеют дополнительный центр специфического взаимодействия: атомы H10 и H13 соответственно. Эти результаты коррелируют с недавно полученными данными по растворимости исследуемых соединений [28]: в чистом метаноле растворимость КФ выше, чем ТФ, и растворимость ТБ довольно низкая по сравнению с растворимостью ТФ и КФ. Видно (рис. 6), что с увеличением содержания метанола в растворе до 0.3 мол. доли 〈nВС〉 резко возрастает, а затем монотонно увеличивается.
Для лучшего понимания данной тенденции были рассчитаны вероятности образования i (i = = 0–4) ВС молекулами растворенного вещества с метанолом. Как видно из табл. 3, вероятность f2 образования 2 ВС КФ с метанолом незначительно возрастает, а рост 〈nВС〉 с содержанием метанола в растворе обусловлен главным образом уменьшением доли свободных молекул (f0) и увеличением доли КФ с 3 ВС. В случае ТФ и ТБ вероятность образования 1 ВС превышает f3. Более того, доля свободных молекул ТФ и ТБ остается достаточно высокой, а вероятность образования 4 ВС не превышает 3% во всем интервале концентраций.
Таблица 3.
Вероятности fi образования i (i = 0 – 4) ВС молекулами метилксантинов с метанолом
| xСН3OH | f0 | f1 | f2 | f3 | f4 |
|---|---|---|---|---|---|
| КФ-Метанол | |||||
| 0.05 | 0.08 | 0.39 | 0.45 | 0.08 | 0.00 |
| 0.1 | 0.04 | 0.28 | 0.48 | 0.18 | 0.03 |
| 0.3 | 0.02 | 0.21 | 0.50 | 0.22 | 0.04 |
| 0.5 | 0.02 | 0.20 | 0.52 | 0.22 | 0.04 |
| 0.7 | 0.02 | 0.19 | 0.52 | 0.23 | 0.04 |
| 0.9 | 0.01 | 0.18 | 0.51 | 0.25 | 0.04 |
| 1 | 0.01 | 0.16 | 0.51 | 0.27 | 0.05 |
| ТФ-Метанол | |||||
| 0.05 | 0.20 | 0.45 | 0.30 | 0.05 | 0.00 |
| 0.1 | 0.13 | 0.43 | 0.36 | 0.08 | 0.01 |
| 0.3 | 0.06 | 0.33 | 0.46 | 0.13 | 0.02 |
| 0.5 | 0.05 | 0.31 | 0.48 | 0.14 | 0.02 |
| 0.7 | 0.05 | 0.31 | 0.49 | 0.14 | 0.02 |
| 0.9 | 0.05 | 0.30 | 0.47 | 0.15 | 0.02 |
| 1 | 0.04 | 0.27 | 0.48 | 0.18 | 0.03 |
| ТБ-Метанол | |||||
| 0.05 | 0.28 | 0.41 | 0.26 | 0.05 | 0.00 |
| 0.1 | 0.20 | 0.39 | 0.34 | 0.06 | 0.01 |
| 0.3 | 0.14 | 0.40 | 0.36 | 0.09 | 0.01 |
| 0.5 | 0.11 | 0.40 | 0.38 | 0.10 | 0.01 |
| 0.7 | 0.12 | 0.34 | 0.40 | 0.12 | 0.02 |
| 0.9 | 0.07 | 0.33 | 0.43 | 0.15 | 0.02 |
| 1 | 0.06 | 0.31 | 0.45 | 0.16 | 0.02 |
Среднее число водородных связей, образованных через различные атомы O, N и H метилксантинов (рис. 1) с атомами H или O метанола, представлено в таблице 4. Для всех молекул метилксантинов атом O12 более активно образует ВС с метанолом, чем атомы O14 и N7. При 0.3 мольной доли метанола наблюдается образование одновременно двух ВС с полярным растворителем для атома O12 молекул кофеина. Для каждого раствора мы рассчитали вероятность образования ВС через атомы O, N и H метилксантинов:
Таблица 4.
Среднее число ВС, образуемых атомами O, N и H метилксантинов (рис. 1) с H- или O-атомами метанола соответственно
| xСН3OH | КФ | |||
|---|---|---|---|---|
| O12 | O14 | N7 | ||
| 0.05 | 0.78 | 0.68 | 0.08 | – |
| 0.1 | 0.90 | 0.80 | 0.18 | – |
| 0.3 | 1.01 | 0.82 | 0.22 | – |
| 0.5 | 1.02 | 0.84 | 0.21 | – |
| 0.7 | 1.02 | 0.85 | 0.22 | – |
| 0.9 | 1.03 | 0.86 | 0.23 | – |
| 1 | 1.05 | 0.89 | 0.25 | – |
| p ± σ, % | 49 ± 1 | 41 ± 1 | 10 ± 2 | |
| xСН3OH | ТФ | |||
| O12 | O14 | N7 | H10 | |
| 0.05 | 0.60 | 0.51 | 0.03 | 0.07 |
| 0.1 | 0.65 | 0.64 | 0.05 | 0.07 |
| 0.3 | 0.80 | 0.76 | 0.09 | 0.08 |
| 0.5 | 0.82 | 0.77 | 0.09 | 0.08 |
| 0.7 | 0.82 | 0.78 | 0.10 | 0.08 |
| 0.9 | 0.82 | 0.79 | 0.10 | 0.08 |
| 1 | 0.86 | 0.81 | 0.12 | 0.08 |
| p ± σ, % | 47 ± 1 | 43 ± 1 | 5 ± 1 | 5 ± 1 |
| xСН3OH | ТБ | |||
| O12 | O14 | N7 | H13 | |
| 0.05 | 0.57 | 0.45 | 0.05 | 0.02 |
| 0.1 | 0.60 | 0.57 | 0.07 | 0.03 |
| 0.3 | 0.72 | 0.57 | 0.10 | 0.04 |
| 0.5 | 0.70 | 0.67 | 0.10 | 0.04 |
| 0.7 | 0.72 | 0.67 | 0.13 | 0.05 |
| 0.9 | 0.81 | 0.72 | 0.14 | 0.06 |
| 1 | 0.82 | 0.74 | 0.16 | 0.08 |
| p ± σ, % | 48 ± 3 | 42 ± 2 | 7 ± 2 | 3 ± 1 |
На основании статистического анализа данных была получена вероятность и соответствующее стандартное отклонение образования ВС через атомы O, N и H метилксантинов (p ± σ, %) (табл. 4).
Результаты показывают, что вероятность образования ВС через каждый атом является почти постоянной величиной для всех концентраций метанола в растворе. А именно, около 50% всех водородных связей метилксантин–метанол образуется через атом O12, около 40% через атом O14 и остальные 10% через атомы N7 и H10, H13. Следует отметить, что являясь одновременно донорами и акцепторами протонов, ТФ и ТБ могут самоассоциироваться посредством ВС. Однако расчет среднего числа ВС метилксантин-метилксантин показывает, что такой тип взаимодействия между растворенными веществами пренебрежимо мал, а 〈nВС〉 не превышает 0.005.
Таким образом, анализ данных, полученных в ходе молекулярно-динамического моделирования метилксантинов (кофеин, теофиллин и теобромин) в чистом тетрахлорметане и в смеси с метанолом в широком диапазоне концентраций при стандартных условиях, показывает, что основными центрами специфического взаимодействия с метанолом являются атомы-акцепторы протонов – O12, O14, N7 и атомы-доноры протонов – H15, H10, H13. С увеличением содержания метанола в смесях уменьшается склонность метилксантинов к самоагрегации, что связано с возрастанием среднего числа водородных связей с полярным сорастворителем. Вероятность самоассоциации ТФ и ТБ посредством ВС пренебрежимо мала по сравнению с образованием стэкинг-димеров. Характер распределения количества ВС, образованных различными атомами метилксантинов с молекулами метанола, не зависит от концентрации последнего. Вероятность образования ВС через атом O12 составляет около 50%, через атом O14 – около 40%, остальные 10% ВС образуются через атомы N7 и H10, H13. КФ образует больше водородных связей с метанолом, чем ТФ и ТБ, что согласуется с экспериментальными данными [28], которые подтверждают лучшую растворимость КФ по сравнению с ТФ и ТБ в чистом метаноле.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (№ проекта 16-33-00248 мол_а).
Выражаем благодарность Межведомственному суперкомпьютерному центру РАН (г. Москва) за предоставленные ресурсы на кластере МВС-100К.
Список литературы
Favero F.W., Skaf M.S. // J. Supercrit. Fluids. 2005. V. 34. № 2. P. 237.
Tavagnacco L., Schnupf U., Mason P. et al. // J. Phys. Chem. B. 2011. V. 115. P. 10957.
Tavagnacco L., Brady J.W., Bruni F. et al. // Ibid. 2015. V. 119. P. 13294.
Tavagnacco L., Gerelli Y., Cesàro A. et al. // Ibid. 2016. V. 120. P. 9987.
Sharma B., Paul S. // J. Chem. Phys. 2013. V. 139. P. 194504.
Sharma B., Paul S. // J. Phys. Chem. B. 2015. V. 119. P. 6421.
Falk M., Chew W., Walter J.A. et al. // Can. J. Chem. 1998. V. 76. P. 48.
Falk M., Gil M., Iza N. // Ibid. 1990. V. 68. P. 1293.
Johnson N.O., Light T.P., MacDonald G., Zhang Y. // J. Phys. Chem. B. 2017. V. 121. № 7. P. 1649.
Golubev V.A., Kumeev R.S., Gurina D.L. et al. // J. Mol. Liq. 2017. V. 241. P. 922.
Abraham M.J., van der Spoel D., Lindahl E. et al. // GROMACS User Manual version 5.0.7. 2015. www.gromacs.org.
Jorgensen W.L., Maxwell D.S., Tirado-Rives J. // J. Am. Chem. Soc. 1996. V. 118. P. 11225.
Malde A.K., Zuo L., Breeze M. et al. // J. Chemical Theory Computation. 2011. V. 7. P. 4026.
Allen M.P., Tildesley D.J. Computer Simulation of Liquids. Clarendon Press. London. 1987.
Nose S. // Molecular Physics. 1984. V. 52. P. 255.
Hoover W.G. // Physical Review A. 1985. V. 31. P. 1695.
Darden T., York D., Pedersen L. // J. Chemical Physics. 1993. V. 98. P. 10089.
Essmann U., Perera L., Berkowitz M.L. // Ibid. 1995. V. 103. P. 8577.
Hess B., Bekker H., Berendsen H.J.C. et al. // J. Computational Chemistry. 1997. V. 18. P. 1463.
Humphrey W., Dalke A., Schulten K. // J. Mol. Graph. 1996. V. 14. P. 33.
Крестов Г.А., Афанасьев В.Н., Ефремова Л.С. Физико-химические свойства бинарных растворителей. 1988. С. 688.
Veldhuizen R., De Leeuw S.W. // J. Chem. Phys. 1996. V. 105. № 7. P. 2828.
Laenen R., Gale G.M., Lascoux N. // The Journal of J. Phys. Chem. A. 1999. V. 103. № 50. P. 10708.
Kecki Z., Sokolowska A., Yarwood J. // J. Mol. Liq. 1999. V. 81. № 3. P. 213.
Musso M., Torii H., Ottaviani P., Asenbaum A. et al. // J. Phys. Chem. A. 2002. V. 106. № 43. P. 10152.
Torii H. // Chem. Phys. Lett. 2004. V. 393. № 1. P. 153.
Teng M.K., Usman N., Frederick C.A. et al. // Nucleic Acids Res. 1988. V. 16. № 6. P. 2671.
Zhong J., Tang N., Asadzadeh B. et al. // J. Chem. Eng. Data. 2017. DOI: https://doi.org/. doi 10.1021/acs.jced.7b00065
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии