Журнал физической химии, 2019, T. 93, № 1, стр. 95-98
Экспериментальное исследование и кинетическое моделирование разложения хлороформа в водных растворах под действием γ-излученияЗ. И. Искендерова, М. А. Курбанов
З. И. Искендерова a, *, М. А. Курбанов a
a Институт радиационных проблем Национальной АН Азербайджана
Баку, Азербайджан
* E-mail: zenfira_iskenderova@mail.ru
Поступила в редакцию 30.03.2018
Аннотация
Изучен радиолиз водных растворов хлороформа (10–3–10–2 М) в присутствии растворенного кислорода с целью установления цепного режима разложения хлороформа. В качестве продуктов радиолиза водных растворов хлороформа идентифицированы CO2, Н2, Н2O2 и хлорированные углеводороды – дихлорметан и дихлорэтан. Изучены изменения pH показателя и ХПК от поглощенной дозы для радиолиза водного раствора хлороформа с концентрацией 4.2 × 10–2 М. Установлено, что с ростом дозы происходит уменьшение рН-показателя и ХПК, что свидетельствует о разложении органических соединений и образования кислот. Показано, что радиационно-химические выходы разложения хлороформа зависят от его начальной концентрации. При ≥4.2 × 10–2 М они находятся в пределе 52–245 молек./100 эВ. На основе полученных данных с учетом имеющихся литературных значений констант скоростей элементарных реакций была составлена формально-кинетическая схема процессов, протекающих при γ-радиолизе водных растворов хлороформа.
Использование хлора с целью дезинфекции питьевой воды приводит к образованию токсичных хлорсодержащих углеводородных примесей, в основном хлороформа. В настоящее время используются разные методы для удаления хлороформа из водных сред, включающие применение физических методов, таких как УФ-свет, его комбинации с озоном [1, 2], ультразвуковое облучение и др. Перспективным является применение ионизирующего излучения для очистки воды от хлороформа, в котором разложение хлороформа инициируется первичными частицами радиолиза воды – атомов H, радикалов OH и егидр [3–5].
В данной работе изучен радиолиз водных растворов хлороформа при его концентрациях (10–3–10–2 М) и в присутствии растворимого кислорода с целью установления цепного режима разложения хлороформа. Исходной предпосылкой поставленной задачи является возможность цепного разложения хлороформа в присутствии кислорода, включающие реакции [6]
CCl3 + O2 → O2CCl3,
O2CCl3 + CHCl3 → CCl3OOH + CCl3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Водные растворы хлороформа (0.03, 0.5, 0.7 и 1.0%) облучались γ-излучением от изотопа 60Со в статических условиях в стеклянных ампулах при комнатной температуре. Образцы облучались в диапазоне поглощенной дозы (4.3–43 кГр) и мощности дозы 0.6 Гр/с.
Измерение рН-показателя проводили рН метром, химическое потребление кислорода (ХПК) по методике перманганатной окисляемости углеводородов и CO2 – хроматографически, Н2O2 – титрованием.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В качестве продуктов радиолиза водных растворов хлороформа идентифицированы CO2, Н2, Н2O2 и хлорированные углеводороды – дихлорметан и дихлорэтан.
В табл. 1 проведены данные по изменения pH показателя и ХПК от поглощенной дозы для радиолиза водного раствора хлороформа с концентрацией 4.2 × 10–2 М.
Таблица 1.
Изменения pH показателя и ХПК от поглощенной дозы для радиолиза водного раствора хлороформа с концентрацией 4.2 × 10–2 М
| Д, кГр | 0 | 4.3 | 8.6 | 13 | 43 |
|---|---|---|---|---|---|
| рН | 7 | 4.6 | 3.9 | 3.5 | 2.3 |
| ХПК, мгО/л | 170 | 153 | 120 | 105 | 53 |
Как видно, с ростом дозы происходит уменьшение рН-показателя и ХПК, что свидетельствует о разложении органических соединений и образования кислот. Из кинетической кривой изменения концентрации CO2, Н2, Н2O2 в зависимости от поглощенной дозы определены их радиационно-химические выходы образования, которые равны 7.2, 1.3, 3 молек./100 эВ соответственно для CO2, Н2, Н2O2. В отличие от газообразных продуктов, образование Н2O2 в зависимости от поглощенной дозы имеет экстремальный характер с максимальной концентрацией Н2O2 при дозе 14 кГр.
На основе полученных данных с учетом имеющихся литературных значений констант скоростей элементарных реакций была составлена формально-кинетическая схема процессов, протекающих при γ-радиолизе водных растворов хлороформа. Формально-кинетическая схема включает элементарные реакции с участием первичных частиц радиолиза воды (38 реакций) [7] и их реакции с молекулами хлороформа и продуктами его превращения (24 реакций), а также реакций гидролиза хлорсодержащих продуктов (промежуточных и конечных 6 реакций) с образованием CO2 и HCl
Начальные параметры расчета приведены в табл. 2. Формально-кинетическая схема приведена в табл. 3. Рассчитаны кинетики образования, как активных частиц, так и молекулярных продуктов радиолиза (табл. 4).
Таблица 2.
Начальные параметры расчета
| J, (Гр/с) | 0.6 |
|---|---|
| GOH, молек./100 эВ | 2.7 |
| GH, молек./100 эВ | 0.6 |
| Ge, молек./100 эВ | 2.6 |
| N, М | 0.25 × 10–2–8.3 × 10–2 |
| N(О2), М | 2.7 × 10–4 |
| T, K | 298 |
Таблица 3.
| Элементарные реакции | k, 1/с, л/(мол с) | Элементарные реакции | k, 1/с, л/(мол с) |
|---|---|---|---|
| H2O =0> OH, | 3.02e–07 | H3O++ HO$_{2}^{ - }$ = H2O2, | 2e+10 |
| H2O =0> H, | 6.7e–08 | H + OH– = e + H2O, | 3e+10 |
| H2O =0> e–, | 2.91e–08 | O$_{2}^{ - }$ + O$_{2}^{ - }$ = O2 + HO$_{2}^{ - }$ + OH–, | 0.3 |
| H2O =0> H2, | 5.03e–09 | O$_{2}^{ - }$ + H2O2 = O2 + OH– + OH, | 16 |
| H2O =0> H2O2, | 7.8e–09 | OH + CHCl3 = H2O + CCl3, | 5e+06 |
| H2O =0> H3O+, | 3.02e–08 | H + CHCl3 = H2 + CCl3, | 7.8e+07 |
| H3O++ OH– = H2O, | 1.4e+11 | e– + CHCl3 = CHCl2 + Cl–, | 1e+10 |
| H2O = H3O++ OH–, | 2.52e–05 | OH + C2H2Cl4 = CCl3CHCl + H2O, | 1e+06 |
| OH + H2 = H2O + H, | 3.74e+07 | H + C2H2Cl4 = CCl3CHCl + H2, | 1e+07 |
| 2OH = H2O2, | 5.3e+09 | e– + C2H2Cl4 = C2H2Cl3 + Cl–, | 1e+10 |
| OH + HO2 = O2 + H2O, | 1.4e+10 | OH + CH2Cl2 = CHCl2 + H2O, | 9e+07 |
| OH + H2O2 = HO2 + H2O, | 3.82e+07 | H + CH2Cl2 = CHCl2 + H2, | 4e+06 |
| OH + HO$_{2}^{ - }$ = HO2 + OH–, | 5e+09 | e– + CH2Cl2 = CH2Cl + Cl–, | 6e+09 |
| OH + O$_{2}^{ - }$ = O2 + OH–, | 9.96e+09 | CCl3 + O2 = CCl3O2, | 4.7e+09 |
| H + OH = H2O, | 7e+09 | CCl3O2 + CHCl3 = CCl3OOH + CCl3, | 1e+04 |
| OH + e = OH–, | 3e+10 | 2CCl3 = C2Cl6, | 3.7e+08 |
| H + O2 = HO2, | 2e+10 | 2CHCl2 = C2H2Cl4, | 1e+08 |
| H + O$_{2}^{ - }$ = HO$_{2}^{ - }$, | 2e+10 | CHCl2 + CHCl3 = CH2Cl2 + CCl3, | 1e+08 |
| H + HO2 = H2O2, | 2e+10 | CHCl2 + O2 = HClO + COCl, | 4.7e+09 |
| 2H = H2, | 7.9e+09 | COCl + CHCl3 = COCl2 + CHCl2, | 1e+04 |
| H + H2O2 = OH + H2O, | 3.44e+07 | 2CCl3O2 = C2Cl6 + O2 + O2, | 1e+08 |
| e– + O2 = O$_{2}^{ - }$, | 1.94e+10 | COCl2 + H2O = 2HCl + CO2, | 1e+05 |
| e– + O$_{2}^{ - }$ = HO$_{2}^{ - }$ + OH–, | 1.3e+10 | CCl3OOH + H2O = 2HCl + HClO + CO2, | 1e+06 |
| e– + HO2 = HO$_{2}^{ - }$, | 2e+10 | H3O++ Cl– = HCl, | 1e+06 |
| e– + H = H2 + OH–, | 2.5e+10 | HCl = H3O++ Cl–, | 1e+10 |
| e– + H2O2 = OH + OH–, | 1.14e+10 | CHCl2 + H2O = CHO + 2HCl, | 1e–04 |
| e– + H3O+= H, | 2.3e+10 | CHO + H2O = HCOOH + H, | 1e–04 |
| 2e– = H2 + OH– + OH–, | 5.6e+09 | CCl3O2 + H2O = OH + PrA + HCl, | 1e–05 |
| HO2 + O$_{2}^{ - }$ = O2 + HO$_{2}^{ - }$, | 9.5e+07 | *CCl2O2 + H2O = 2HCl + CO2, | 1e–05 |
| 2HO2 = O2 + H2O2, | 8.1e+05 | *CCl3 + H2O + H2O = COOH + 3HCl, | 1e–05 |
| HO2 + H2O2 = O2 + OH + H2O, | 3.7 | *2COOH = HOOCCOOH, | 1e–05 |
| HO2 = H3O++ O$_{2}^{ - }$, | 7e+05 | *2COOH = HCOOH + CO2, | 5e+08 |
| H3O++ O$_{2}^{ - }$ = HO2, | 4.5e+10 | *CHCl2 + O2 = CHCl2O2, | 1e+07 |
| H2O2 = H3O++ HO$_{2}^{ - }$, | 0.0356 | *CHCl2O2 + H2O = OH + CO2 + 2HCl | 1e+05 |
Примечание. Значения констант скоростей реакций (k), обозначенные звездочкой выбраны нами по аналогии с литературными данными [10].
Таблица 4.
Продукты радиолиза водных растворов хлороформа, включенные в кинетическую модель
| Активные частицы | Молекулярные продукты |
|---|---|
| OH | CHCl3 |
| H | CH2Cl2 |
| e– | H2 |
| H3O+ | H2O2 |
| OH– | C2H6 |
| O$_{2}^{ - }$ | CO2 |
| CCl3 | HCl |
| CHCl2 | H2O |
| Cl– | O2 |
| HO2 | C2H2Cl4 |
| HO$_{2}^{ - }$ | CH2Cl2 |
| CCl3CHCl | C2Cl6 |
| C2H2Cl3 | HClO |
| CH2Cl | COCl2 |
| CCl3O2 | HCOOH |
| CCl3OOH | HOOCCOOH |
| COCl | PrA |
| CHO | |
| COOH | |
| CCl2O2 | |
| CHCl2O2 |
Результаты расчета приведены на рисунке 1, где представлены изменения концентрации хлороформа от времени облучения при его разных начальных концентрациях.
Рис. 1.
Зависимости концентрации хлороформа от времени облучения при: 2.5 × 10–3 (а), 4.2 × 10–2 (б), 5.8 × 10–2 (в), 8.3 × 10–2 М (г); точки – экспериментальные данные, кривая – расчет, J = 0.6 Гр/с, Т = 300 К.
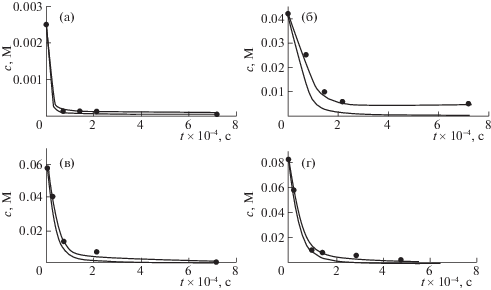
Из сравнения экспериментов и расчетных данных установлено, что модель чувствительна к константе скорости гидратированных электронов с молекулами хлороформа, так как при k = 3 × × 1010 М–1 с–1 расхождение между расчетным и экспериментальным значениям по скорости разложения хлороформа составляет 37%, а при k = 1 × 1010 М–1 с–1 уменьшается до 4%.
Из начальных частей кинетических кривых определены значения радиационно-химических выходов разложения хлороформа при его разных начальных концентрациях, которые представлены в табл. 5. Как видно из табл. 5, радиационно-химические выходы разложения хлороформа зависят от его начальной концентрации. При ≥4.2 × 10–2 М они находятся в пределе 52–245 молек./100 эВ, что намного больше значения начальных выходов активных частиц при радиолизе воды (Gэкс/G0 ~ 40), где G0 = GOH + GH + Gегид = 6) [6]. Полученные значения указывают на цепное разложение хлороформа при концентрациях ≥4.2 × 10–2 М и постоянной концентрации адсорбированного кислорода (~2.7 × 10–4 М).
Таблица 5.
Радиационно-химические выходы разложения хлороформа (молек./100 эВ ) при его разных начальных концентрациях (С) в водном растворе (δ – отклонение)
| С, М | Gэкс | Gрасч | δ, % |
|---|---|---|---|
| 2.5 × 10–3 | 6.5 | 6.5 | 0 |
| 4.2 × 10–2 | 51.6 | 72.2 | 40 |
| 5.8 × 10–2 | 168 | 180 | 7 |
| 8.3 × 10–2 | 245 | 267.8 | 9 |
Предложенная кинетическая модель согласуется с экспериментальными значениями радиационно-химического выхода. Отклонение их значений при выбранной схеме элементарных реакций находится в пределах 7–40%, и уменьшается с ростом концентрации хлороформа в режиме цепной реакции.
Список литературы
Dwivedi A.H., Pande U.C. // Scientific Reviews & Chemical Communications. 2012. V. 2(1). P. 41.
Naffrechoux E., Combet E., Fanget B., Petrier C. // Water Research. 2003. Apr. 37(8). P. 1948–1952.
Rezansoff B.J., Mccallum K.J., Woods R.J. Radiolysis of aqueous chloroform solutions, Department of Chemistry and Chenzical Engineering, University of Saskatchewan, Saskatoon, Saskatchewan. June, 1969.
Mak F.T., Zele S.R., Cooper W.J. et al. Kinetic modeling of carbon tetrachloride, chloroform and methylene chloride removal from aqueous solution using the electron beam process. Drinking Water Research Center, Florida International university, Miami, Fl.33124, U.S.A and High Voltage Environmental Applications, Inc, 9562 Doral Boulevard, Miami, FL 33178, U.S.A, April 1996. P. 219.
Cooper W.J., Cadavid E., Nickelsen M.G. et al. // J. American Water Works Association. 1993. V. 85. № 9. Water Treatment Laboratories (September 1993). P. 106.
Пикаев А.К. Современная радиационная химия. Радиолиз газов и жидкостей. М.: Наука, 1987.
Бугаенко В.Л., Бяков В.М. // Химия высоких энергий. 1998. Т. 32. № 6. С. 407.
Buxton G., Greenstock C., Helman W., Ross A. // J. of Physical and Chemical Reference Data. 1988. V. 17. P. 513–886.
Ross A.B., Mallard W.G., Helman W.P. et al. 1994. NDRL–NIST Solution Kinetics Database Version 2.0. National Institute of Standards and Technology, Gaithersburg, MD.
Lateef A.B., Hyne J.B. Effect of pressure on the rates of hydrolysis of allyl chlorides. Department of Chemistry. The University of Calgary, Calgary, Alberta October, 1968.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


