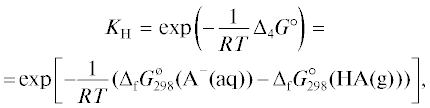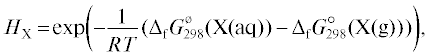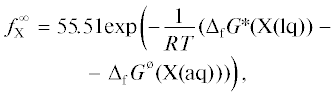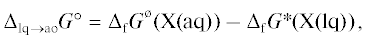Журнал физической химии, 2019, T. 93, № 1, стр. 86-94
Константы диссоциации галогенводородных кислот HCl, HBr и HI в водном раствореА. В. Леванов, У. Д. Курбанова, О. Я. Исайкина, В. В. Лунин
А. В. Леванов a, *, У. Д. Курбанова a, О. Я. Исайкина a, В. В. Лунин a
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: levanov@kge.msu.ru
Поступила в редакцию 19.03.2018
Аннотация
Константы кислотной диссоциации (Ka) HCl, HBr, HI определены с помощью соотношения ${{K}_{{\text{a}}}} = K_{{\text{a}}}^{'}f_{{{\text{HA}}}}^{\infty }$, где $K_{{\text{a}}}^{'}$ – кажущаяся константа диссоциации, $f_{{{\text{HA}}}}^{\infty }$ – коэффициент активности недиссоциированной молекулы кислоты в бесконечно разбавленном водном растворе. Кажущиеся константы диссоциации $K_{{\text{a}}}^{'}$ вычислены на основе надежных справочных данных. Предельные коэффициенты активности $f_{{{\text{HA}}}}^{\infty }$ рассчитаны методом COSMO-RS. Правильность полученных результатов подтверждена сравнением с известными значениями $f_{{{\text{HA}}}}^{\infty }$ аналогичных соединений.
Константы диссоциации представляют собой константы равновесия реакции кислотной диссоциации
(1)
${\text{HA}}({\text{aq}}) \rightleftarrows {{{\text{H}}}^{ + }}({\text{aq}}) + {{{\text{A}}}^{ - }}({\text{aq}}).$Они являются важнейшими характеристиками кислот, однако для сильных кислот, таких как HCl, HBr, и HI в водном растворе, они не доступны экспериментальному определению. В нашей работе [1] показано, что константу диссоциации Ka можно выразить в виде произведения
где $K_{{\text{a}}}^{'}$ – кажущаяся константа, $f_{{{\text{HA}}}}^{\infty }$ – предельный коэффициент активности – коэффициент активности недиссоциированной молекулы кислоты в бесконечно разбавленном растворе, при симметричном выборе стандартного состояния.Значения $K_{a}^{'}$ могут быть рассчитаны на основе общедоступных справочных данных. Действительно, кажущаяся константа диссоциации $K_{{\text{a}}}^{'}$ определяется выражением [1]:
Здесь $p_{{{\text{Н А }}}}^{*}$ – давление (летучесть) пара над чистым веществом НА, бар; KH – константа Генри, отвечающая процессу растворения HA с диссоциацией на ионы, т.е. константа равновесия реакции(4)
${\text{HA}}({\text{g}}) \rightleftarrows {{{\text{H}}}^{ + }}({\text{aq}}) + {{{\text{A}}}^{ - }}({\text{aq}}).$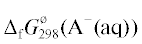 и ${{\Delta }_{{\text{f}}}}G_{{{\text{298}}}}^{^\circ }({\text{HА
}}({\text{g}}))$ – стандартные энергии Гиббса образования ионов A– в водном растворе и молекул HA в газовой фазе при 298.15 К, R = 8.31446 Дж моль–1 К–1 – универсальная газовая постоянная, T – абсолютная температура, К. В настоящей работе все константы равновесия выражены
с использованием моляльностей, т.е. размерность KH – моль2 кг–2 бар–1, Ka и $K_{{\text{a}}}^{'}$ – моль кг–1; используются следующие обозначения стандартных состояний: ° – любое стандартное
состояние или газ в состоянии идеального газа при давлении 1 бар, * – чистый компонент
при температуре и давлении раствора, ø – компонент в бесконечно разбавленном растворе с концентрацией 1 моль кг–1; А–(aq) обозначает ион в водном растворе, X(aq) – недиссоциированную молекулу X в водном
растворе.
и ${{\Delta }_{{\text{f}}}}G_{{{\text{298}}}}^{^\circ }({\text{HА
}}({\text{g}}))$ – стандартные энергии Гиббса образования ионов A– в водном растворе и молекул HA в газовой фазе при 298.15 К, R = 8.31446 Дж моль–1 К–1 – универсальная газовая постоянная, T – абсолютная температура, К. В настоящей работе все константы равновесия выражены
с использованием моляльностей, т.е. размерность KH – моль2 кг–2 бар–1, Ka и $K_{{\text{a}}}^{'}$ – моль кг–1; используются следующие обозначения стандартных состояний: ° – любое стандартное
состояние или газ в состоянии идеального газа при давлении 1 бар, * – чистый компонент
при температуре и давлении раствора, ø – компонент в бесконечно разбавленном растворе с концентрацией 1 моль кг–1; А–(aq) обозначает ион в водном растворе, X(aq) – недиссоциированную молекулу X в водном
растворе.
Предельные коэффициенты сильных кислот $f_{{{\text{HA}}}}^{\infty }$ можно определить лишь с помощью теоретических методов. Цель настоящей работы – оценка предельных коэффициентов активности HCl(aq), HBr(aq), и HI(aq), и нахождение на их основе констант диссоциации галогенводородных кислот в водном растворе при температуре 298.15 К. В отличие от предшествующих работ по данной теме теоретические расчеты используются в минимальной необходимой степени, только для оценки $f_{{{\text{HA}}}}^{\infty }$, что принципиально уменьшает вклад связанных с расчетами неопределенностей и ошибок в значение константы диссоциации Ка.
Определению констант диссоциации галогенводородных кислот посвящена обширная литература. В работах [2–4], а также [5], при нахождении константы кислотной диссоциации хлористоводородной кислоты в водном растворе мольную долю недиссоциированной HCl предложено оценивать с помощью закона Рауля, по парциальному давлению HCl (pHCl) над раствором, ${{x}_{{{\text{HCl}}}}} = {{p}_{{{\text{HCl}}}}}{\text{/}}p_{{{\text{HCl}}}}^{*}$. Считается, что в растворе присутствуют лишь частицы (гидратированные) H+, Cl– и HCl. Авторы [2–5] предполагают, что коэффициент активности недиссоциированной HCl (при выражении концентрации в мольных долях и симметричном выборе стандартного состояния) fHCl = 1. Тогда моляльность недиссоциированной HCl рассчитывается с помощью соотношения:
(6)
$\begin{gathered} {{m}_{{{\text{HCl}}}}} = ({\text{2}}{{M}_{{{\text{HCl}}}}} + {\text{55}}.{\text{51}})\frac{{{{x}_{{{\text{HA}}}}}}}{{{\text{1}} + {{x}_{{{\text{HA}}}}}}} \simeq \\ \simeq \;({\text{2}}{{M}_{{{\text{HCl}}}}} + {\text{55}}.{\text{51}}){{p}_{{{\text{HCl}}}}}{\text{/}}p_{{{\text{HCl}}}}^{*}, \\ \end{gathered} $(7)
${{\gamma }_{{{\text{HCl}}}}} = {\text{55}}.{\text{51/}}({\text{2}}{{M}_{{{\text{HCl}}}}} + {\text{55}}.{\text{51}}).$Константа диссоциации кислоты (константа равновесия реакции (1)) определяется равенством
(8)
${{K}_{{\text{a}}}} = \frac{{{{m}_{{{{{\text{H}}}^{ + }}}}}{{\gamma }_{{{{{\text{H}}}^{ + }}}}}{{m}_{{{{{\text{A}}}^{ - }}}}}{{\gamma }_{{{{{\text{A}}}^{ - }}}}}}}{{{{m}_{{{\text{HA}}}}}{{\gamma }_{{{\text{HA}}}}}}},$(9)
${{m}_{{{{{\text{H}}}^{ + }}}}}{{\gamma }_{{{{{\text{H}}}^{ + }}}}}{{m}_{{{{{\text{A}}}^{ - }}}}}{{\gamma }_{{{{{\text{A}}}^{ - }}}}} = {{({{M}_{{{\text{HA}}}}}{{\gamma }_{ \pm }})}^{{\text{2}}}}$(10)
${{K}_{{\text{a}}}} = \frac{{{{{({{M}_{{{\text{HA}}}}}{{\gamma }_{ \pm }})}}^{2}}}}{{{{m}_{{{\text{HA}}}}}{{\gamma }_{{{\text{HA}}}}}}},$(11)
$K_{{\text{a}}}^{{''}} = \frac{{{{{{\text{(}}{{M}_{{{\text{HCl}}}}}{{{\gamma }}_{{ \pm }}}{\text{)}}}}^{{\text{2}}}}p_{{{\text{HCl}}}}^{*}}}{{55.51{{p}_{{{\text{HCl}}}}}}}.$В работе [7] выполнен детальный критический анализ метода [3, 4], и показано, что на самом деле величина $K_{{\text{a}}}^{{''}}$, определяемая выражением (11), представляет собой кажущуюся константу диссоциации $K_{{\text{a}}}^{'}$ (3), $K_{{\text{a}}}^{{''}}$ ≡ $K_{{\text{a}}}^{'}$. Действительно, подставив в формулу (3) для $K_{{\text{a}}}^{'}$ выражение константы Генри KH (константы равновесия реакции (4)),
(12)
${{K}_{{\text{H}}}} = \frac{{{{m}_{{{{{\text{H}}}^{ + }}}}}{{\gamma }_{{{{{\text{H}}}^{ + }}}}}{{m}_{{{{{\text{A}}}^{ - }}}}}{{\gamma }_{{{{{\text{A}}}^{ - }}}}}}}{{{{p}_{{{\text{HA}}}}}}},$Несмотря на то, что с помощью подхода [3, 4] невозможно определить истинные константы диссоциации, его широко использовали для оценки соответствующих величин для галогенводородных кислот. В табл. 1 представлены имеющиеся в литературе значения десятичных логарифмов констант диссоциации HCl, HBr, и HI, в том числе, оценки $K_{{\text{a}}}^{{''}}$, полученные в оригинальных работах [2–5, 7–9] и монографии [10], а также приводящиеся в химических справочниках и популярных учебниках [11–19].
Таблица 1.
Десятичные логарифмы констант диссоциации HCl, HBr, HI в водном растворе при 298.15 К
| Кислота | lg Ka | Ссылка | Кислота | lg Ka | Ссылка |
|---|---|---|---|---|---|
| HCl | 0.51 | (Д) [27] | HBr | 2.15–4.65 | (Д) [28] |
| HCl | 0.90 | (Е) [29] | HBr | 4.7 | (Г) [30] |
| HCl | 1.05–2.6 | (Д) [28] | HBr | 5.8 | (Г) [20] |
| HCl | 1.25 | (Д) [31] | HBr | 8 | (А) [10] |
| HCl | 2.2 | (Г) [30] | HBr | 8 | (Б) [19] |
| HCl | 2.3 | (Д) [32] | HBr | 8.34 | (А) [9] |
| HCl | 2.4–2.5 | (Е) [33] | HBr | 8.60 ± 0.03 | (А) [7] |
| HCl | 3.9 | (В) [20] | HBr | 8.69 | (Г) [34] |
| HCl | 3.9 | (Г) [20] | HBr | 8.7 | (Г) [35] |
| HCl | 5–13 | (В) [36] | HBr | 8.72 | (Б) [18] |
| HCl | 5.9 ± 0.4 | (В) [22] | HBr | 8.8 ± 0.8 | (В) [22] |
| HCl | 6 | (А) [10] | HBr | 9 | (А) [10] |
| HCl | 6.09 | (А) [8] | HBr | 9 | (Б) [11–13, 15–17] |
| HCl | 6.07 ± 0.03 | (А) [7] | HBr | 9.0 | (Г) [37] |
| HCl | 6.1 | (Б) [19] | HBr | 9 | (Г) [38] |
| HCl | 6.11 | (А) [3] | HBr | ~9 | (Г) [39] |
| HCl | 6.19 | (А) [4] | HBr | 9.5 | (Б) [14] |
| HCl | 6.2 | (Б) [18] | HBr | 10 | (Г) [40] |
| HCl | 6.24 | (А) [5] | HBr | 15 | (В) [23] |
| HCl | 6.29 | (Г) [34] | HI | 5.2 | (Г) [30] |
| HCl | 6.3 | (Г) [35] | HI | 8.56 | (Б) [18] |
| HCl | 6.8 | (Г) [37] | HI | 8.56 ± 0.07 | (А) [7] |
| HCl | 7 | (А) [10] | HI | 9 | (А) [10] |
| HCl | 7 | (Б) [11–17] | HI | 9 | (Б) [19] |
| HCl | 7 | (Г) [38] | HI | 9.3 | (Г) [35] |
| HCl | 7 | (Г) [39] | HI | 9.3 | (Г) [37] |
| HCl | 7 | (Д) [41] | HI | 9.3 | (Г) [34] |
| HCl | 7.08–7.45 | (В) [26] | HI | ~9.4 | (Г) [39] |
| HCl | 7.3 | (В) [26] | HI | 9.5 | (Б) [11] |
| HCl | 7.40(0ºС) | (А) [2] | HI | 9.5 | (Г) [38] |
| HCl | 7.8 | (Д) [42, 43] | HI | 9.5 ± 1.0 | (В) [22] |
| HCl | 8 | (Г) [40] | HI | 10 | (А) [10] |
| HCl | 14 | (В) [23] | HI | 10 | (Б) [12–14] |
| HI | 10.4 | (Г) [20] | |||
| HI | 11 | (Б) [15–17] | |||
| HI | 12 | (Г) [40] |
(А) – значения кажущейся константы $K_{{\text{a}}}^{{''}}$, найденные из давлений пара галогенводородов над водными растворами кислот; (Б) – значения констант диссоциации, приводящиеся в учебниках и справочниках; (В) – получены на основе квантово-химических расчетов процесса диссоциации; (Г) – вычислены на основе теоретических оценок энергии Гиббса гидратации молекул галогенводородов; (Д) – оценены различными косвенными методами; (Е) – получены на основе данных по электропроводности растворов HCl.
В учебнике [12] дана ссылка на [10]; по-видимому, значения из других изданий [11, 13–17] также основаны на [10] (это же мнение авторов [20]). Таким образом, приведенные в пособиях [11–19] величины представляют собой на самом деле логарифмы кажущихся констант диссоциации $K_{{\text{a}}}^{{''}}$.
Альтернатива эксперименту – расчет констант диссоциации сильных кислот с использованием методов квантовой химии. Обычно при этом используют представление процесса диссоциации (1) с помощью термодинамических циклов. Типичный цикл включает процессы переноса недиссоциированной молекулы кислоты из раствора в газовую фазу, диссоциацию в газовой фазе и гидратацию протона и аниона кислоты. Как правило, растворитель рассматривают как сплошную среду, а энергии сольватации рассчитывают с использованием различных моделей взаимодействия полярных и заряженных частиц с диэлектрическим континуумом. Оценку состояния рассматриваемой области исследований можно посмотреть в монографии [21]. Полученные в расчетах значения констант диссоциации представлены в табл. 1.
В работе [22] определены энергии Гиббса и константы диссоциации HCl, HBr и HI. Кислотность в газовой фазе вычисляли квантово-химическими методами высокого уровня или брали из эксперимента, а энергии сольватации рассчитывали с использованием модели поляризованного диэлектрического континуума. Авторы [23] вычисляли константы диссоциации в водном растворе по методике COSMO-RS [24] с помощью программного пакета COSMOthermX [25], однако для HCl и HBr получены слишком завышенные оценки этих величин [22, 23]. На высоком теоретическом уровне расчет константы диссоциации HCl в водном растворе выполнен в работе [26]. Энергию переноса недиссоциированной молекулы из газа в раствор вычисляли методом Монте-Карло и различными квантово-химическими методами, энергию диссоциации в водном растворе – с использованием модели сольватации в сплошной среде, при учете экспериментальных данных и результатов расчетов в микрокластерах. Различные методики дали значения lg Ka(HCl) = = 7.08–7.45 при 300 К [26].
Несмотря на значительный прогресс в этой области, в настоящее время расчетные значения Ka характеризуются весьма большой неопределенностью (см. табл. 1). Иногда, даже в рамках одного исследования, результаты расчетов Ка различными методами сильно отличаются друг от друга. Например, в работе [36] найдены величины lg Ka(HCl) в диапазоне 5–13. Разброс значений констант диссоциации при использовании различных расчетных подходов может быть очень большим, что продемонстрировано в работе [44]: получены значения lg Ka(HCl) в диапазоне от –11.5 до +5, что свидетельствует о неприменимости некоторых подходов.
Еще один теоретический подход к определению константы Ka состоит в том, что реакцию диссоциации (1) можно представить как разность процессов растворения с диссоциацией (4) и без диссоциации
Отметим, что равновесие в процессе (13) описывается константой Генри
которая связана с предельным коэффициентом активности соотношением [1](15)
$H = \frac{{{\text{55}}{\text{.51}}}}{{f_{{{\text{HA}}}}^{\infty }{\text{ p}}_{{{\text{HA}}}}^{*}}}.$Также при оценке энергии гидратации применяли допущение о том, что для HCl, HBr и HI она такая же, как для HF [30], принимали равенство энергий гидратации HCl, HBr, HI и соответствующих величин для CH3Cl, CH3Br, CH3I [40], использовали корреляцию на основе электроотрицательности [35], аналогию PH3–H2S–HCl, AsH3–H2Se–HBr, SbH3–H2Te–HI [37]. Кроме того, аналогичные подходы использовали при вычислении константы Генри H недиссоциированных галогенводородов [34, 38, 39]. Полученные таким образом оценки констант диссоциации галогенводородных кислот в водном растворе при 298.15 К приведены в табл. 1.
Константа кислотной диссоциации хлористоводородной кислоты HCl имеет большое значение в атмосферной химии. В современных и тщательно разработанных моделях тропосферной химии, представленных, например, в работах [46–48], константа диссоциации HCl взята из [5]. Но, как показано выше, это значение константы неправильно, так как метод [5] позволяет определить лишь кажущуюся константу. В работе [49] отмечается сложность нахождения значений констант диссоциации сильных кислот, и рекомендуется вообще не использовать их в качестве параметров моделей атмосферной химии. Вместо этого предлагается использование констант Генри KH [50], относящихся к процессу (4) растворения с диссоциацией, определить которые в эксперименте намного легче. Однако такой поход не позволяет рассматривать реакции недиссоциированных молекул HCl и других сильных кислот в водном растворе.
В силу исключительной важности константы кислотной диссоциации HCl(aq), множество работ посвящено ее определению различными косвенными методами. Полученные величины приведены в табл. 1. Значения Ka(HCl) оценивали на основе концентрационной зависимости среднеионных коэффициентов активности в водных растворах хлористоводородной кислоты [31], исходя из данных по активностям в растворах HCl–HClO4(aq), определенных потенциометрическим методом [27], исходя из значений функций кислотности в водных растворах [28]. Исследования [32, 42, 43] посвящены нахождению Ka(HCl) с помощью специальной методики обработки данных по давлению паров HCl и его среднеионным коэффициентам активности в водном растворе. В работе [29] значение Ka(HCl) получено экстраполяцией на чистую воду данных по константам диссоциации HCl в водно-диоксановых смесях, определенных кондуктометрическим методом. Авторы [41] для нахождения Ka(HCl) использовали денситометрический метод. Следует отметить, что результаты большинства упомянутых в этом абзаце работ вызывают сомнения. Представляет интерес подробный критический анализ методов и выводов работ [27–29, 31], представленный в [51].
Константа кислотной диссоциации HCl необходима при исследовании гидротермальных геохимических процессов, протекающих как при обычных, так и при сверхкритических температурах и давлениях. Много работ посвящено исследованию кислотной диссоциации и определению константы диссоциации HCl в этих условиях, причем полученные значения константы диссоциации достаточно противоречивы. Подробный и тщательный анализ исследований в этой области можно посмотреть в [51, 52], а также в [53]. Изучению электропроводности и определению константы диссоциации HCl в воде при высоких температурах посвящены, в частности, работы [33, 54]. Экстраполяция данных [33] к температуре 298.15 К и плотности воды 1 г/см3 дает величину lg Ka(HCl) = 2.4–2.5. Подобные низкие значения константы диссоциации HCl(aq) вряд ли обоснованы. При выводе уравнения для термодинамических свойств HCl(aq) в гидротермальных системах, автор [51] в качестве опорного значения использует величину lg Ka(HCl) = 6.235 (298.15 К, 1 бар), которая приводится в работе [5]. Однако, как показано выше, эта величина является кажущейся константой.
Таким образом, литературные величины констант диссоциации галогенводородных кислот имеют значительную неопределенность, и можно сделать вывод, что их достоверные значения до сих пор неизвестны.
МЕТОДИКА ОЦЕНКИ КОНСТАНТ ДИССОЦИАЦИИ
Для расчета констант диссоциации использовали формулы (2) и (3). Константы Генри KH вычисляли с помощью соотношения (4), исходя из энергий Гиббса образования молекул галогенводородов в газовой фазе и галогенид-ионов в водном растворе, приведенных в справочниках [55, 56]. Все величины определяли для температуры 298.15 К.
Давления чистых HCl и HBr рассчитывали с помощью зависимостей, приведенных в справочнике [57], HI – в [58], причем в формулу (3) подставляли не давления, а летучести (фугитивности). Коэффициенты летучести рассчитывали с помощью уравнения состояния Редлиха–Квонга [59], значения критических постоянных для расчета коэффициентов a и b уравнения взяты из справочника [57].
Предельные коэффициенты активности $f_{{{\text{HA}}}}^{\infty }$ для HCl, HBr, HI, а также для других соединений, рассчитывали по методике COSMO-RS [24, 60], с помощью программы из программного пакета ADF [61, 62]. На основе специально разработанной модели взаимодействия молекулы растворенного вещества со сплошной средой – растворителем [60] программа определяет изменение энергии Гиббса при переходе молекулы из чистой жидкости в бесконечно разбавленный раствор и из найденного значения вычисляет предельный коэффициент активности. Методика расчетов была такой же, как рекомендовано в описании. При отсутствии исследуемых соединений в базе данных COSMO-RS сведения о геометрическом строении молекул брали из онлайн-базы данных [63] и выполняли предварительную оптимизацию геометрической структуры в газовой фазе. Предельные коэффициенты активности вычисляли для бесконечно разбавленного водного раствора при температуре 298.15 К, с использованием четырех рекомендованных наборов параметров (ADF combi2005 [24, 61], ADF combi1998 [61, 64], Klamt [64], MOPAC PM6), имеющихся в программе.
Предельные коэффициенты активности аналогичных соединений вычисляли также на основе доступных справочных данных с помощью формулы (15). Значения констант Генри H брали из справочной работы [65], причем не использовали результаты, полученные с помощью теоретических методов. Константы Генри для SbH3 и H2Te вычислили по формуле (14), исходя из значений растворимости при комнатной температуре: SbH3 – 0.2 объема на один объем воды [66]; H2Te – 0.1 М [67]; коэффициенты активности γSbH3 и γH2Te принимали равными 1. Константу Генри H для HF, H2O2, H2S, HN3, NH3, PH3, HCN, CO, CO2 определяли также по формуле:
где ${{\Delta }_{{\text{f}}}}G_{{{\text{298}}}}^{^\circ }({\text{X}}({\text{aq}}))$ и ${{\Delta }_{{\text{f}}}}G_{{{\text{298}}}}^{^\circ }({\text{X}}({\text{g}}))$ – стандартные энергии Гиббса образования соединений X (недиссоциированных молекул) в водном растворе и в газовой фазе при 298.15 К, взятые из справочников [55, 56].Для HF, HCN, H2S, NH3 и CO2, в формулу (15) подставляли летучести (фугитивности), которые рассчитывали, как описано выше. Для остальных веществ использовали давления, рассчитанные по уравнению Антуана, коэффициенты которого приведены в [68]. Давления вычисляли для температуры 298.15 К, которая в части случаев находилась за пределами рекомендованных температурных интервалов.
В нашей работе [1] представлена формула предельного коэффициента активности
связывающая его с изменением энергии Гиббса при изотермическом переносе молекулы X из чистого вещества в бесконечно разбавленный раствор, где ΔfG*(X(lq)) – стандартная энергия Гиббса образования чистого вещества X в жидком состоянии. Ее использовали для расчета коэффициентов активности H2O2, HCN и HN3, на основе справочных данных [55, 56].ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Значения констант Генри KH и кажущихся констант диссоциации сильных кислот, рассчитанные на основе справочных данных, приведены в табл. 2. В литературе можно найти следующие оценки констант Генри KH, моль2 кг–2 атм–1, при 298.15 К, полученные преимущественно из данных о парциальных давлениях и коэффициентах активности растворов HCl: 2.04 × 106 [49, 69], 2.0 × 106 [70–72]; HBr: 8.32 × 108 [72], 1.3 × 109 [70, 71]; HI: 2.5 × 109 [70, 71]. Они лишь незначительно отклоняются от значений в табл. 2, вычисленных из энергий Гиббса образования HА(g) и А–(aq).
Таблица 2.
Константы Генри, давления чистых жидкостей и кажущиеся константы диссоциации галогенводородных кислот HCl, HBr и HI в водном растворе при 298.15 К
| Кислота | KH, моль2 кг–2 бар–1 | p*, бар | $K_{{\text{a}}}^{'}$, моль/кг | $\lg K_{{\text{a}}}^{'}$ |
|---|---|---|---|---|
| HCl | 2.00 × 106 [55] 1.97 × 106 [56] |
47.2 [57] | 1.71 × 106 1.68 × 106 |
6.23 6.22 |
| HBr | 7.81 × 108 [55] 7.07 × 108 [56] |
24.6 [57] | 3.46 × 108 3.13 × 108 |
8.54 8.50 |
| HI | 2.32 × 109 [55] 2.15 × 109 [56] |
8.19 [57] | 3.42 × 108 3.18 × 108 |
8.53 8.50 |
Кажущиеся константы $K_{{\text{a}}}^{'}$, определенные в настоящей работе, хорошо согласуются с результатами [2–5, 7–10], которые обсуждались выше. Небольшое различие между нашими и литературными величинами обусловлено использованием различных типов исходных данных: в настоящей работе – справочные стандартные энергии Гиббса чистых веществ в конденсированной и газовой фазе, их давления пара, а также энергии Гиббса соответствующих анионов в водном растворе, в работах [2–5, 7, 10] – давления пара и коэффициенты активности реальных растворов для HCl, HBr и HI.
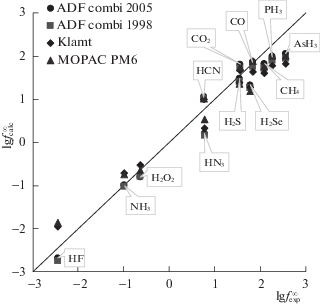
На рис. 1 результаты расчета предельных коэффициентов активности сравниваются с соответствующими величинами, полученными из справочных данных, для гидридов элементов, а также для H2O2, HCN, CO и CO2. Видно, что программа COSMO-RS [62] позволяет с удовлетворительной точностью вычислять предельные коэффициенты простых молекул. Следует отметить, что по сравнению с другими классами соединений, молекулы галогенводородов обладают самой простой осесимметричной структурой, и для них построение полости и теоретический расчет энергии Гиббса гидратации является наиболее легкой задачей.
Рис. 1.
Сравнение десятичных логарифмов предельных коэффициентов активности при 298 К, определенных на основе справочных данных (средние значения), и рассчитанных в программе COSMO-RS с использованием наборов параметров ADF combi2005, ADF combi1998, Klamt, MOPAC PM6.
На рис. 2 показано периодическое изменение справочных и расчетных значений предельных коэффициентов в рядах ЭН3 – ЭН2 – ЭН – инертный газ, и их соотношение с коэффициентом HCN. Расчетные значения предельных коэффициентов активности галогенводородов очень хорошо вписываются в периодическую зависимость логарифмов этих величин от атомного номера элемента, соответствующую периодическому закону Менделеева. На рис. 3 показано изменение коэффициентов активности в гомологических рядах алкилхлоридов, бромидов, и иодидов. Видно хорошее соответствие вычисленных предельных коэффициентов галогенводородов линейным зависимостям lg f∞(н-CnH2n + 1Hal) от числа атомов углерода в гомологических рядах н-алкилгалогенидов (галогенводороды рассматриваются как нулевые члены рядов). При этом различные наборы параметров (ADF combi2005 [24, 61], ADF combi1998 [61, 64], Klamt [64], MOPAC PM6) обеспечивают примерно одинаковое качество расчетов, и выделить какой-либо один оптимальный набор не представляется возможным. По совокупности данных рис. 1–3 мы делаем вывод, что рассчитанные в настоящей работе предельные коэффициенты активности галогенводородов являются достоверной оценкой их действительных величин, т.е. близки к реальным значениям. Максимальные и минимальные расчетные значения коэффициента для какого-либо галогенводорода, вычисленные с использованием различных наборов параметров, мы принимаем в качестве верхней и нижней границ интервала, содержащего истинную величину. Таким образом, имеет место оценка, показанная в табл. 3.
Рис. 2.
Изменение десятичных логарифмов предельных коэффициентов активности гидридов ЭНх (х = 1, 2, 3) и инертных газов в периодах таблицы Д.И. Менделеева в зависимости от атомного номера элемента. $\blacktriangle $ – справочные значения для PH3, AsH3, SbH3, H2S, H2Se, H2Te, Ar, Kr, Xe; $ \bullet $ – значения для HCl, HBr, HI, рассчитанные в программе COSMO-RS; Пунктирные линии – верхняя и нижняя границы значений ${\text{lg}}f_{{{\text{HCN}}}}^{\infty }$, определенные на основе справочных данных.
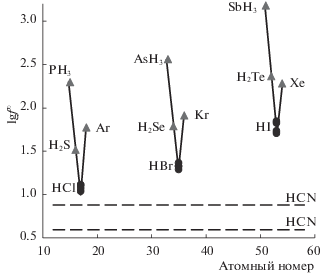
Рис. 3.
Зависимости десятичного логарифма предельного коэффициента активности в гомологических
рядах н-алкилхлоридов (а), н-алкилбромидов (б) и н-алкилиодидов (в) от числа атомов углерода в алкильной группе.
 – справочные значения для алкильных производных; $ \bullet $ – значения для HCl, HBr, HI, рассчитанные в программе COSMO-RS.
– справочные значения для алкильных производных; $ \bullet $ – значения для HCl, HBr, HI, рассчитанные в программе COSMO-RS.
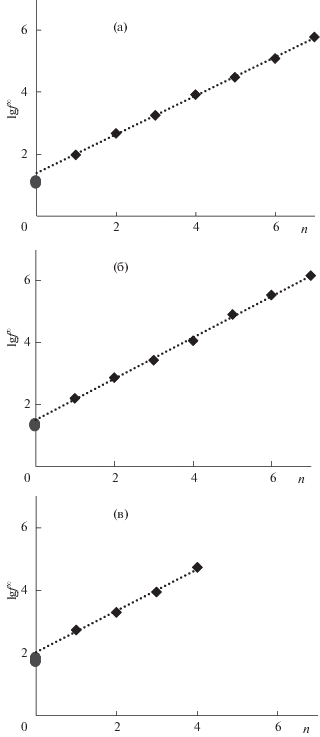
Таблица 3.
Десятичные логарифмы кажущихся констант, предельных коэффициентов активности, и истинных констант диссоциации галогенводородных кислот HCl, HBr и HI в водном растворе при 298.15 К
| Кислота | $\lg K_{{\text{a}}}^{'}$ | $\lg f_{{{\text{HA}}}}^{\infty }$ | lg Ka |
|---|---|---|---|
| HCl | 6.22–6.23 | 1.04–1.11 | 7.26–7.34 |
| HBr | 8.50–8.54 | 1.29–1.36 | 9.78–9.90 |
| HI | 8.50–8.53 | 1.70–1.84 | 10.21–10.37 |
Правильность оценки предельных коэффициентов галогенводородов подтверждается также следующими качественными выводами. Имеется сходство свойств галогенводородов HCl, HBr и HI и гидридов соседних халькогенов H2S, H2Se и H2Te. Действительно, размеры молекул HCl и H2S, HBr и H2Se, HI и H2Te близки, они обладают сопоставимым дипольным моментом, диэлектрические постоянные веществ невелики. Все эти вещества не отличаются сильным межмолекулярным взаимодействием, что подтверждается низкими температурами кипения и их регулярным изменением в группе периодической системы. С водой они могут образовывать только слабые водородные связи, растворимы в воде ограниченно. В то же время молекулы галогенводородов обладают большей полярностью, чем гидриды халькогенов. Поэтому можно заключить, что предельные коэффициенты активности галогеноводородов меньше коэффициентов активности соответствующих гидридов халькогенов, т.е. справедливы неравенства $\lg f_{{{\text{HCl}}}}^{\infty } < \lg f_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}}}^{\infty }$, $\lg f_{{{\text{HBr}}}}^{\infty } < \lg f_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}}}^{\infty }$, $\lg f_{{{\text{HI}}}}^{\infty } < \lg f_{{{{{\text{H}}}_{{\text{2}}}}{\text{Te}}}}^{\infty }$.
По величине коэффициента активности при бесконечном разведении, цианистый водород HCN занимает промежуточное положение между веществами с высоким и низким сродством к воде ($\lg f_{{{\text{HCN}}}}^{\infty }$ = 0.6–0.9) (см. рис. 1). Его молекула может образовывать водородные связи с молекулами воды, но не столь сильные, как HF или кислородсодержащие кислоты. Однако водородные связи HCN намного сильнее HCl, HBr и HI. Это проявляется в значительной способности к ассоциации в жидком HCN, в то время как жидкие HCl, HBr, HI практически не ассоциированы. Поэтому можно ожидать, что предельный коэффициент активности HCN меньше, чем HCl, HBr, HI. Таким образом, предельные коэффициенты галогенводородов должны быть заключены в диапазонах: $\lg f_{{{\text{HCN}}}}^{\infty } < \lg f_{{{\text{HCl}}}}^{\infty } < \lg f_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}}}^{\infty }$, $\lg f_{{{\text{HCN}}}}^{\infty } < $ $ < \lg f_{{{\text{HBr}}}}^{\infty } < \lg f_{{{{{\text{H}}}_{{\text{2}}}}{\text{Se}}}}^{\infty }$, $\lg f_{{{\text{HCN}}}}^{\infty } < \lg f_{{{\text{HI}}}}^{\infty } < \lg f_{{{{{\text{H}}}_{{\text{2}}}}{\text{Te}}}}^{\infty }$. Данные рис. 2 показывают, что соответствующие расчетные и экспериментальные коэффициенты действительно удовлетворяют приведенным неравенствам.
Исходя из найденных значений предельных коэффициентов активности и кажущихся констант, истинные константы диссоциации сильных кислот вычислены по формуле (16). Их значения приведены в табл. 3. Следует отметить очень хорошее совпадение нашей оценки lg Ka(HCl) = 7.26–7.34, и значений lg Ka(HCl) = = 7.08–7.45, полученных на основе тщательных квантово-химических расчетах процесса диссоциации HCl [26], выполненных на высоком теоретическом уровне.
Таким образом, найдены величины констант диссоциации сильных галогенводородных кислот, недоступные экспериментальному определению. Точность оценки достаточно высокая, поскольку различие между верхними и нижними границами десятичных логарифмов констант не превышает 0.16 единиц pKa. Мы считаем, что полученные оценки констант диссоциации HCl, HBr и HI наиболее достоверны. Действительно, при их определении в максимальной степени использованы надежные справочные данные (при вычислении кажущейся константы $K_{{\text{a}}}^{'}$). Правильность расчетных значений предельных коэффициентов активности подтверждается соответствием закономерностям изменения коэффициентов в периодах таблицы Менделеева, в гомологических рядах, а также соотношением с известными коэффициентами сходных по свойствам веществ.
Список литературы
Levanov A.V., Isaikina O.Y., Gurbanova U.D., Lunin V.V. // J. Phys. Chem. B 2018. V. 122. № 23. P. 6277.
Wynne-Jones W.F.K. // J. Chem. Soc. 1930. P. 1064.
Robinson R.A. // Trans. Faraday Soc. 1936. V. 32. P. 743.
Robinson R.A., Bates R.G. // Anal. Chem. 1971. V. 43. № 7. P. 969.
Marsh A.R.W., Mcelroy W.J. // Atmos. Env. 1985. V. 19. № 7. P. 1075.
Леванов А.В., Исайкина О.Я., Лунин В.В. // Журн. физ. химии. 2017. Т. 91. № 7. С. 1147.
Marcus Y. // J. Chem. Soc. Faraday Trans. 1. 1979. V. 75. P. 1715.
O'Brien S.J., Kenny C.L., Zuercher R.A. // J. Am. Chem. Soc. 1939. V. 61. № 9. P. 2504.
O'Brien S.J., Bobalek E.G. // J. Am. Chem. Soc. 1940. V. 62. № 11. P. 3227.
Белл Р. Протон в химии. М.: Мир, 1977.
Huheey J.E., Keiter E.A., Keiter R.A. Inorganic Chemistry: Principles of Structure and Reactivity. New York: Harper Collins College Publishers, 1993.
Smith M.B. March’s Advanced Organic Chemistry, 7th Ed. Hoboken, NJ: John Wiley & Sons, 2013.
Greenwood N.N., Earnshaw A. Chemistry of the Elements, 2nd Ed. Oxford: Butterworth-Heinemann, 1997.
Cotton F.A., Wilkinson G., Murillo C.A., Bochmann M. Advanced Inorganic Chemistry, 6th Ed. New York: John Wiley & Sons, 1999.
Справочник химика. Т. 3. 2 изд. С. 78 / Под ред. Б.П. Никольского. М.-Л.: Химия, 1965.
Atkins P.W., De Paula J. Atkins’ Physical Chemistry, 8th Ed. Oxford: Oxford University Press, 2006.
Atkins P.W., Overton T.L., Rourke J.P., Weller M.T., Armstrong F.A. Shriver and Atkins’ Inorganic Chemistry, 5th Ed. New York: W. H. Freeman and Co, 2010.
Lange’s Handbook of Chemistry. 15th ed. / Ed by J.A. Dean. New York: McGraw-Hill, 1999.
Albert A., Serjeant E.P. The Determination of Ionization Constants: A Laboratory Manual, 3rd Ed. London - New York: Chapman and Hall, 1984.
Schmid R., Miah A.M. // J. Chem. Educ. 2001. V. 78. № 1. P. 116.
Shields G.C., Seybold P.G. Computational Approaches for the Prediction of pKa Values. Boca Raton, FL: CRC Press, 2014.
Trummal A., Lipping L., Kaljurand I., Koppel I.A., Leito I. // J. Phys. Chem. A. 2016. V. 120. № 20. P. 3663.
Raamat E., Kaupmees K., Ovsjannikov G., Trummal A., Kütt A., Saame J., Koppel I., Kaljurand I., Lipping L., Rodima T., Pihl V., Koppel I.A., Leito I. // J. Phys. Org. Chem. 2013. V. 26. № 2. P. 162.
Klamt A. COSMO-RS. From Quantum Chemistry to Fluid Phase Thermodynamics and Drug Design. Amsterdam: Elsevier, 2005.
Eckert F., Leito I., Kaljurand I., Kütt A., Klamt A., Diedenhofen M. // J. Comput. Chem. 2009. V. 30. № 5. P. 799.
McGrath M.J., Kuo I.F.W., Ngouana W B.F., Ghogomu J.N., Mundy C.J., Marenich A.V., Cramer C.J., Truhlar D.G., Siepmann J.I. // Phys. Chem. Chem. Phys. 2013. V. 15. № 32. P. 13578.
Johnson K.S., Pytkowicz R.M. // Am. J. Sci. 1978. V. 278. № 10. P. 1428.
Högfeldt E. // J. Inorg. Nucl. Chem. 1961. V. 17. № 3. P. 302.
Сретенская Н.Г. // Геохимия. 1992. № 3. С. 447.
Myers R.T. // J. Chem. Educ. 1976. V. 53. № 1. P. 17.
Posner A.M. // Nature. 1953. V. 171. № 4351. P. 519.
Полторацкий Г.М. // Ж. общей химии. 2000. V. 70. № 11. С. 1785.
Ho P.C., Palmer D.A., Gruszkiewicz M.S. // J. Phys. Chem. B. 2001. V. 105. № 6. P. 1260.
Ionin M.V. // Trudy Gorkovsk. Polytekh. Inst. 1969. V. 25. P. 35.
Pauling L. // J. Chem. Educ. 1956. V. 33. № 1. P. 16.
Pliego J.R., Riveros J.M. // J. Phys. Chem. A. 2002. V. 106. № 32. P. 7434.
Pauling L. // J. Chem. Educ. 1976. V. 53. № 12. P. 762.
McCoubrey J.C. // Trans. Faraday Soc. 1955. V. 51. P. 743.
Ebert L. // Naturwissenschaften. 1925. V. 13. № 18. P. 393.
Pearson R.G. // J. Am. Chem. Soc. 1986. V. 108. № 20. P. 6109.
Лысова С.С., Зевацкий Ю.Э., Демидов Е.В., Новоселов Н.П. // Журн. общ. химии. 2015. Т. 85. № 4. С. 529.
Полторацкий Г.М., Семенов С.В. // Журн. общ. химии. 2002. Т. 72. № 10. С. 1599.
Полторацкий Г.М., Андреев С.Б., Осовская И.И., Яковлев В.А. // Журн. общ. химии. 2002. Т. 72. № 9. С. 1426.
Arillo-Flores O.I., Ruiz-López M.F., Bernal-Uruchurtu M.I. // Theor. Chem. Account. 2007. V. 118. № 2. P. 425.
Matyushov D.V., Schmid R. // J. Chem. Phys. 1996. V. 105. № 11. P. 4729.
Bräuer P., Tilgner A., Wolke R., Herrmann H. // J. Atmos. Chem. 2013. V. 70. № 1. P. 19.
Sander R., Baumgaertner A., Gromov S., Harder H., Jöckel P., Kerkweg A., Kubistin D., Regelin E., Riede H., Sandu A., Taraborrelli D., Tost H., Xie Z.Q. // Geosci. Model Dev. 2011. V. 4. № 2. P. 373.
Thomas J.L., Stutz J., Lefer B., Huey L.G., Toyota K., Dibb J.E., Von Glasow R. // Atmos. Chem. Phys. 2011. V. 11. № 10. P. 4899.
Clegg S.L., Brimblecombe P. // Atmos. Env. 1986. V. 20. № 12. P. 2483.
Clegg S.L., Brimblecombe P. // Atmos. Env. 1988. V. 22. № 1. P. 91.
Pokrovskii V.A. // Geochim. Cosmochim. Acta. 1999. V. 63. № 7. P. 1107.
Tagirov B.R., Zotov A.V., Akinfiev N.N. // Geochim. Cosmochim. Acta. 1997. V. 61. № 20. P. 4267.
Реуков В.В., Зотов А.В. // Геол. рудн. месторожд. 2006. Т. 48. № 2. С. 167.
Balashov V.N., Hnedkovsky L., Wood R.H. // J. Mol. Liq. 2017. V. 239. P. 31.
Иориш В.С., Юнгман В.С. / База данных “Термические Константы Веществ”, рабочая версия – 2, http://www.chem.msu.ru/cgi-bin/tkv.pl?show=welcome.html, Accessed 27.06.2017 (Основана на издании “Термические константы веществ. Справочник в 10 выпусках” под ред. В.П. Глушко. М.: ВИНИТИ, 1965–1982).
Wagman D.D., Evans W.H., Parker V.B., Schumm R.H., Halow I., Bailey S.M., Churney K.L., Nutall R.L. The NBS Tables of Chemical Thermodynamic Properties. J. Phys. Chem. Ref. Data, 1982, 11, Supplement № 2. Washington D. C.: National Bureau of Standards, 1982.
Perry’s Chemical Engineers’ Handbook, 7th ed. / Perry R.H., Green D.W., Maloney J.O., eds. New York: McGraw-Hill, 1997.
Antoine Equation Parameters // in NIST Chemistry WebBook, NIST Standard Reference Database Number 69, P.J. Linstrom and W.G. Mallard, Editors. Gaithersburg MD, 20899: National Institute of Standards and Technology. Retrieved May 28, 2017.
Redlich O., Kwong J.N.S. // Chem. Rev. 1949. V. 4. № 1. P. 233.
Klamt A. // J. Phys. Chem. 1995. V. 99. № 7. P. 2224.
Pye C.C., Ziegler T., Van Lenthe E., Louwen J.N. // Can. J. Chem. 2009. V. 87. № 7. P. 790.
Louwen J.N., Pye C.C., Lenthe E.V., Mcgarrity E.S., Xiong R., Sandler S.I., Burnett R.I. ADF2017 COSMO-RS. SCM, Theoretical Chemistry, Vrije Universiteit, Amsterdam, The Netherlands, http://www.scm.com, 2017.
Computational Chemistry Comparison and Benchmark DataBase, Release 16a (NIST Standard Reference Database 101), http://cccbdb.nist.gov/ August 2013.
Klamt A., Jonas V., Bürger T., Lohrenz J.C.W. // J. Phys. Chem. A. 1998. V. 102. № 26. P. 5074.
Sander R. // Atmos. Chem. Phys. 2015. V. 15. № 8. P. 4399.
Stock A., Guttmann O. // Ber. deutsch. chem. Ges. 1904. B. 37. № 1. S. 885.
Федоров П.И. / “Теллур” // В кн. Химическая энциклопедия, Т. 4. М.: Большая Российская энциклопедия, 1995. С. 1018.
Yaws C.L., Satyro M.A. The Yaws Handbook of Vapor Pressure. Antoine coefficients. 2nd Ed.: Gulf Professional Publishing, 2015.
Clegg S.L., Brimblecombe P. // Atmos. Env. 1988. V. 22. № 1. P. 117.
Brimblecombe P., Clegg S.L. // J. Atm. Chem. 1988. V. 7. № 1. P. 1.
Brimblecombe P., Clegg S.L. // J. Atm. Chem. 1989. V. 8. № 1. P. 95.
Carslaw K.S., Clegg S.L., Brimblecombe P. // J. Phys. Chem. 1995. V. 99. № 29. P. 11557.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии