Журнал физической химии, 2019, T. 93, № 1, стр. 82-85
Влияние ультразвука на кинетику растворения кристаллического иода в этанолеВ. В. Клюбин, К. А. Клюбина
В. В. Клюбин a, *, К. А. Клюбина a
a Государственный морской технический университет
Санкт-Петербург, Россия
* E-mail: kljubin@mail.ru
Поступила в редакцию 16.03.2018
Аннотация
Исследовано влияние ультразвука на кинетику растворения кристаллического иода в этаноле по данным УФ-спектров поглощения. Показано, что обработка ультразвуком существенно ускоряет течение химической реакции, связанной с образованием сложных анионов ${\text{I}}_{3}^{ - }$.
Растворение является физико-химическим процессом, протекающим между твердой и жидкой фазами и характеризующимся переходом твердого вещества в раствор. Растворенным веществом считается тот из компонентов, который при обычных условиях находится в агрегатном состоянии, отличном от агрегатного состояния растворителя. Процесс растворения зависит от свойств растворителя, природы растворяемых веществ, температуры процесса. Из литературы известно, что ультразвук сильно влияет на процессы растворения различных веществ и на течение химических реакций [1–3]. Применение ультразвуковых колебаний обеспечивает многократное ускорение всех процессов, протекающих между двумя неоднородными средами. При этом увеличивается выход полезных продуктов, они могут приобретать новые свойства.
Распространение ультразвука в жидкой среде сопровождается процессом кавитации, возникающее при этом знакопеременное звуковое давление способствует проникновению жидкости в трещины и капилляры растворяемого вещества и позволяет проводить высокоэффективное диспергирование твердой фазы. Ускоряя процесс измельчения твердой фазы, ультразвук, кроме того, влияет на течение большинства химических реакций. В кавитационном пузырьке и прилегающем к нему объеме жидкости происходит существенное ускорение различных физико-химических процессов [4].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Чтобы понять, как ультразвук влияет на процесс растворения кристаллического иода в этаноле, мы приготовили два раствора одинаковой концентрации 1000 ppm. В одном из растворов кристаллики иода засыпались в этиловый спирт, где происходило их постепенное растворение без систематического перемешивания, лишь в те моменты, когда из общего раствора отбирались пробы для измерений спектров поглощения, этот раствор перемешивался легким покачиванием колбы. Второй раствор такого же объема и концентрации подвергался систематической обработке ультразвуком перед каждым измерением в течение 10 минут.
Для обработки растворов ультразвуком использовалась ванна типа DSA-100-GL2-4.0L, в которой создавалось ультразвуковое поле с частотой 40 кГц и мощностью 100 вт. Процесс растворения анализировался с помощью электронных спектров поглощения, измеряемых в области 190–1000 нм. Для измерения спектров поглощения в работе использовался спектрофотометр ПЭ-5400УФ (производство ЭКОХИМ, Санкт-Петербург). Измерения проводились в кварцевых кюветах с длиной оптического пути 5 мм. Прибор регистрирует оптическую плотность образцов $A = \lg \left( {{{{{J}_{o}}} \mathord{\left/ {\vphantom {{{{J}_{o}}} J}} \right. \kern-0em} J}} \right)$, где ${{J}_{o}}$ – представляет собой интенсивность света, прошедшего кювету с растворителем, а $J$ – является интенсивностью света, прошедшего кювету с исследуемым раствором. В качестве растворов сравнения использовался этиловый спирт. Измерения проводились при комнатной температуре. В работе использовался 96% этиловый спирт и кристаллический иод марки ЧДА без дополнительной очистки.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Процесс растворения кристаллического иода в этиловом спирте проходит несколько стадий. Попадая в жидкость, кристаллы иода растаскиваются полярными молекулами этанола на отдельные молекулы ${{{\text{I}}}_{2}}$:
На рис. 1 показаны спектры поглощения растворов кристаллического иода в этаноле, измеренные при концентрации иода, равной 1000 ppm, непосредственно после приготовления (кривая 1) и через 5 ч после смешения (кривая 2). Кривая 3 этого рисунка представляет собой спектр раствора, концентрация которого равнялась 100 ppm. Высокую концентрацию иода мы использовали для того, чтобы хорошо зарегистрировать полосы поглощения, возникающие при больших длинах волн, а при низкой концентрации хорошо фиксируется полоса, возникающая при малых длинах волн. Дело в том, что поглощение растворов иода в области длин волн 200–250 нанометров на порядок выше поглощения на более длинных волнах.
Рис. 1.
Спектры поглощения неозвученных растворов кристаллического иода в этаноле: 1 – через 5 минут после смешения, концентрация 1000 ppm, 2 – через 5 часов после смешения, концентрация 1000 ppm, 3 – через 5 часов после смешения, концентрация 100 ppm.
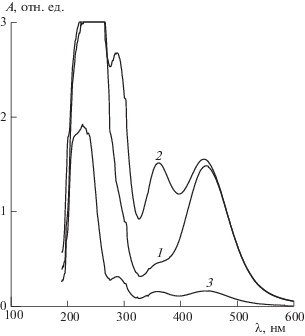
Из рис. 1 следует, что в спектрах растворов иода в этаноле наблюдаются четыре полосы поглощения. Первая самая интенсивная полоса попадает в область ультрафиолетовых волн, максимум ее располагается примерно на длине волны 230 нм. Более слабые по интенсивности полосы имеют максимумы на длинах волн 290, 360, 445 нм. Причем, как видно из рисунка, в свежеприготовленном растворе самыми интенсивными являются полосы 230 и 445 нм. По мере хранения растворов интенсивность полос 290 и 360 возрастает. Чтобы понять с чем это связано, необходимо знать какие соединения иода вызывают поглощение света в этой области спектра. В работах [5–8] показано, что полоса с максимумом на длине волны примерно 230 нм связана с существованием в растворе анионов ${{{\text{I}}}^{ - }}$, полоса 445 нм возникает когда в растворе присутствует молекулярный иод ${{{\text{I}}}_{2}}$, а две полосы с максимумами на длинах волн 290 и 360 нм определяются поглощением сложного аниона ${\text{I}}_{3}^{ - }$.
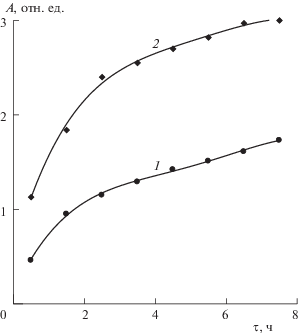
В обоих образцах по мере хранения происходит рост интенсивности поглощения полос с максимумами на длинах волн 290 и 360 нм, причем в озвученных образцах этот рост оказывается более существенным. На рис. 2 показано как изменяется интенсивность полосы 360 нм со временем у того и другого образцов. Из этого рисунка видно, что интенсивность полосы 360 нм в озвученных образцах оказывается примерно в 1.5 раза более высокой. Это говорит о том, что в них концентрация сложных анионов ${\text{I}}_{3}^{ - }$ выше.
Рис. 2.
Зависимости интенсивности полосы поглощения с максимумом на длине волны 360 нм от времени хранения неозвученных (1) и озвученных (2) образцов. Концентрация растворов 1000 ppm.
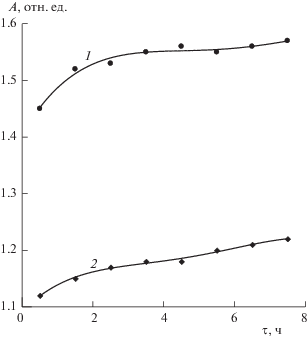
На следующем рис. 3 показано изменение интенсивности полосы с максимумом на длине волны 445 нм со временем у озвученного (2) и неозвученного (1) образцов. Из этого рисунка следует, что полоса 445 нм оказывается более интенсивной у неозвученных образцов. Это свидетельствует о том, что в них содержится больше молекулярного иода ${{{\text{I}}}_{2}}$.
Рис. 3.
Зависимости интенсивности полосы поглощения с максимумом на длине волны 445 нм от времени хранения неозвученных (1) и озвученных (2) образцов. Концентрация растворов 1000 ppm.
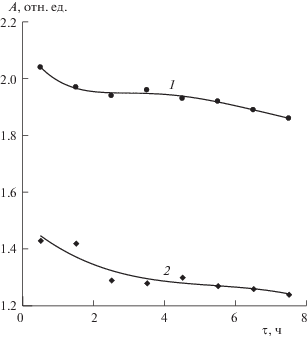
И, наконец, на рис. 4 показано изменение интенсивности полосы поглощения 230 нм. Поглощение на этой длине волны связано с присутствием в растворе анионов ${{{\text{I}}}^{ - }}$. Из этого рисунка видно, что концентрация анионов иода в неозвученном растворе выше, чем в озвученном.
Рис. 4.
Зависимость интенсивности полосы поглощения с максимумом на длине волны 230 нм от времени хранения неозвученных (1) и озвученных (2) образцов. Концентрация растворов 100 ppm.
Опираясь на данные трех последних рисунков, можно сделать вывод о том, как происходит растворение кристаллического иода в этаноле и понять, на какие стадии этого процесса влияет ультразвук. Кристаллики иода, попадая в этиловый спирт, медленно распадаются на отдельные молекулы. В дальнейшем в результате взаимодействия этилового спирта с молекулами иода, согласно реакции
Растворение начинается с того, что в растворе появляются молекулы иода. Одновременно с появлением молекулярного иода в растворе возникают анионы иода ${{{\text{I}}}^{ - }}$, т.е. молекулы иода, попав в раствор, практически сразу же вступают в реакцию с этанолом. Рисунок 2 показывает, что параллельно с процессами создания молекулярного иода и анионов ${{{\text{I}}}^{ - }}$ идет процесс их объединения, процесс формирования сложных анионов ${\text{I}}_{3}^{ - }$. Причем, как следует из рис. 3 и 4, в озвученном образце концентрация молекулярного иода и анионов ${{{\text{I}}}^{ - }}$ оказывается ниже, чем в неозвученном. С чем это связано становится понятным из данных рис. 2. На этом рисунке видно, что концентрация комплексных анионов ${\text{I}}_{3}^{ - }$ выше в озвученном образце. Получается, что действие ультразвука проявляется в том, что он ускоряет процесс течения реакции объединения анионов ${{{\text{I}}}^{ - }}$ с молекулами иода. По мере растворения молекулярного иода, в растворе происходит накопление трииодид-анионионов ${\text{I}}_{3}^{ - }$. Этот процесс должен привоить к уменьшению концентрации как молекул иода, так и анионов ${{{\text{I}}}^{ - }}$ в растворе, но из рис. 3 следует, что концентрация молекулярного иода со временем не уменьшается, а даже несколько увеличивается. Это может говорить о том, что процесс разрушения кристаллического иода идет достаточно медленно, причем как в естественных условиях, так и в образцах подвергнутых ультразвуковой обработке. Как следует из рис. 2 озвучивание способствует лишь ускорению реакции присоединения анионов к молекулам иода, т.е. процессу создания сложных анионов ${\text{I}}_{3}^{ - }$. Более высокая интенсивность полосы 360 нм и более низкая интенсивность полосы 445 нм в озвученных образцах подтверждает этот вывод. В озвученных образцах акустическое давление, возникающее на границах кавитационных пузырьков заставляет анионы ${{{\text{I}}}^{ - }}$ объединяться с молекулами иода, что приводит к возникновению большего количества комплексных анионов ${\text{I}}_{3}^{ - }$.
Таким образом, в результате наших исследований установлено, что кристаллический иод при нормальных условиях в этиловом спирте растворяется очень медленно. В процессе взаимодействия с этанолом в растворе вначале образуются молекулы иода, которые в дальнейшем трансформируются в анионы иода ${{{\text{I}}}^{ - }}$. Присоединяясь к молекулам иода, анионы ${{{\text{I}}}^{ - }}$ создают трииодиды ${\text{I}}_{3}^{ - }$. Накопление комплексных анионов ${\text{I}}_{3}^{ - }$ в растворе хорошо регистрируется по спектрам поглощения, в них интенсивность полос с максимумами 290 и 360 нм со временем растет. Процесс преобразования молекулярного иода ${{{\text{I}}}_{2}}$ в трииодид ${\text{I}}_{3}^{ - }$ в обычных условиях продолжается достаточно долго, но он существенно ускоряется при действии ультразвука. Причем, как показывают наши исследования, комплексные анионы ${\text{I}}_{3}^{ - }$ оказываются очень устойчивыми во времени, они не распадаются на анионы ${{{\text{I}}}^{ - }}$ и молекулярный иод ${{{\text{I}}}_{2}}$, а постепенно накапливаются в растворе. Этот факт подтверждают и другие исследователи [9, 10].
Список литературы
Маргулис М.А. Основы звукохимии. М.: Высш. школа, 1984. 272 с.
Маргулис М.А. Звукохимические реакции и сонолюминесценция. М.: Химия, 1986. 288 с.
Хмелев В.Н., Сливин А.Н., Барсуков Р.В. и др. Применение ультразвука высокой интенсивности в промышленности. Бийск: Изд. АГТУ им. И.И. Ползунова, 2010. 203 с.
Маргулис М.А., Мальцев А.Н. // Журн. физ химии. 1969. Т. 43. С. 1055.
Клюбин В.В., Клюбина К.А., Маковецкая К.Н. // Оптика и спектроскопия. 2016. Т. 120. № 4. С. 46.
Клюбин В.В., Клюбина К.А., Маковецкая К.Н. // Там же. 2018. Т. 124. № 1. С. 56.
Клюбин В.В., Клюбина К.А., Маковецкая К.Н. // Журн. физ. химии. 2017. Т. 91. № 6. С. 973.
Клюбин В.В., Клюбина К.А., Маковецкая К.Н. // Там же. 2018. Т. 92. № 2. С. 277.
Слесарев В.И. Химия. Химия живого. Санкт-Петербург, Химиздат, 2007 г.
Ксензенко В.Н., Стасиневич Д.С. Химия и технология брома, иода и их соединений. М.: Химия, 1995 г.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


