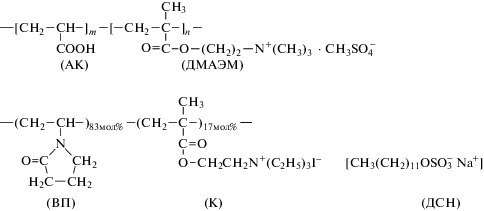Журнал физической химии, 2019, T. 93, № 1, стр. 113-118
Влияние природы биологически активного стабилизатора на спектральные и размерные характеристики гибридных селенсодержащих наносистемС. В. Валуева, Л. Н. Боровикова
С. В. Валуева a, *, Л. Н. Боровикова a
a Российская академия наук, Институт высокомолекулярных соединений
Санкт-Петербург, Россия
* E-mail: svalu67@mail.ru
Поступила в редакцию 05.03.2018
Аннотация
Методами УФ-спектроскопии, статического/динамического светорассеяния и двойного лучепреломления в потоке (ДЛП) при массовом соотношении Se0:полимер, равном ν = 0.1, определены спектральные, молекулярно-конформационные и кинетические характеристики гибридных селенсодержащих наносистем (НС) на основе биосовместимых полимерных стабилизаторов (ПС) различной природы. Показано, что структура (природа) ПС является определяющим фактором в процессе формирования селенсодержащих наноструктур и оптимизации их параметров (константы скорости, размерных параметров, молекулярной массы, плотности и величины свободной энергии, а также спектральных характеристик).
Под наносистемами (НС) понимают обычно множество тел, окруженных газовой или жидкой средой, размер которых остается в пределах от 0.1 до 100 нм. Особенность этих объектов состоит в том, что их размер соизмерим с радиусом действия сил межатомного взаимодействия, т.е. с расстоянием, на которое должны быть удалены атомы тела, чтобы их взаимодействие не влияло на его свойства в заметной степени. Именно в интервале наноразмеров, на молекулярном уровне, природа “программирует” основные характеристики веществ, явлений и процессов. Нанотехнологический подход означает такое же, но целенаправленное регулирование свойств объектов на молекулярном уровне, определяющее фундаментальные параметры. Нанообъекты характеризуются малыми размерами, сложной внутренней организацией, способностью к плотной упаковке, сильными латеральными (боковыми) взаимодействиями, а также высоким отношением площади поверхности к объему. Для стабилизации сложных наноструктур во многих случаях требуются многократные связи, которые являются основой кодировки информации внутри наноструктуры [1]. К таким взаимодействиям относятся стерические, электростатические и гидрофобные, а также водородные и координационные связи. Один из наиболее перспективных способов получения стабильных наночастиц – восстановление их ионных форм в растворах полимеров.
Адсорбция макромолекул на наночастицах сопровождается формированием органической оболочки на неорганическом ядре и приводит к снижению поверхностного натяжения, стабилизации образующихся наночастиц от их агрегации, торможению роста, а также повышению их устойчивости к окружающей среде [2]. Кроме того, в таких процессах часто образуются наночастицы с достаточно узким распределением по размерам, что важно с практической точки зрения для получения хорошо организованных двух- и трехмерных периодических наноструктур. Следует также заметить, что средний размер наночастиц, образующихся в присутствии органических соединений, существенно меньше, чем в их отсутствие. Эти факты свидетельствуют о влиянии адсорбции и природы взаимодействий полимеров с поверхностью наночастиц металлов и неметаллов на процесс формирования наночастиц [3]. Изучение кинетики формирования и последующей самоорганизации наночастиц в присутствии полимерных стабилизаторов (ПС) различной природы с целью расширения спектра межмолекулярных взаимодействий – одна из актуальных проблем нанохимии.
Известно, что биогенный элемент – селен, входящий в состав пищевых продуктов, оказывает антибластическое действие, а между содержанием селена во внешней среде и частотой поражения населения злокачественными опухолями существует обратно пропорциональная зависимость [4]. Известно также, что в условиях дефицита селена наблюдается развитие миокардиодистрофии, атеросклероза, ишемической болезни сердца, инфаркта миокарда и хронического гепатита различной этимологии [5, 6].
Ввиду того, что гибридные наносистемы обладают синергизмом свойств исходных компонентов, в настоящей работе была проведена модификация наночастицами нуль-валентного селена (Se0) биосовместимых полимерных материалов, используемых для получения лекарственных препаратов и БАД [7–9]. Известно, что нуль-валентный селен (Se0) обладает комплексом уникальных биомедицинских свойств, одно из них – высокая противоопухолевая активность. Учитывая тот факт, что, например, полиэлектролитный комплекс (ПЭК) обладает мембранотропными свойствами и резко увеличивает проницаемость липидных бислоев [10], он может повысить уровень активности селена. В связи с этим целесообразна модификация наночастицами Se0 биосовместимых полимерных материалов.
Цель данной работы – методами УФ-спектрофотометрии и динамического/статического светорассеяния провести сравнительное исследование кинетики формирования, спектральных и размерных характеристик гибридных селенсодержащих НС на основе биологически активных полимерных матриц различной природы с использованием редокс-системы селенит–аскорбат. В качестве биологически активных полимерных стабилизаторов (ПС) были взяты: биополиамфолит – бычий сывороточный альбумин (БСА), полиэлектролитный комплекс додецилсульфата натрия (ДСН) с катионным сополимером N-винилпирролидона (ВП) и N,N,N,N-триэтилметакрилоилоксиэтиламмоний йодида (К) при γ = ДСН/К = 0.5, где γ – мольное соотношение заряженных субъединиц (ПЭК), а также синтетический полиамфолит – сополимер (СП) акриловой кислоты и N,N-диметиламиноэтилметакрилата (П(АК-ДМАЭМ)). Структурные формулы и исследуемых соединений приведены ниже:
Молекулярные массы ПС составляют:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали селенистую и аскорбиновую кислоты (“Вектон”, Санкт-Петербург). Вещества растворяли в апирогенной воде для инъекций, дополнительно фильтрованной через стеклянный фильтр. Синтез наночастиц селена осуществляли в результате реакции между селенистой и аскорбиновой кислотами в присутствии ПС:
Спектры поглощения в УФ- и видимой областях измеряли с помощью спектрофотометра “Specord M-40” (Карл Цейс Йена, Германия) в рабочем диапазоне от 220 до 900 нм в кварцевых кюветах с толщиной фотометрического слоя 1 см. Относительная суммарная погрешность при регистрации спектров не превышала 2%. Величины константы скорости k* процесса самоорганизации селенсодержащих НС представлены в табл. 1. Расчет k* проводили по формуле [11]: k* = = ln(Dk/(Dk – Di))/ti, где Dk – оптическая плотность, характеризующая конец процесса (в нашем случае в течение 24 ч), Di – оптическая плотность в данный момент времени ti.
Таблица 1.
Кинетические, молекулярно-конформационные и термодинамические параметры для селенсодержащих НС при ν = 0.1 и pH 3.8
| НС | k* × 103, с–1 | $M_{w}^{*}$ × 10–6 | N* | $R_{g}^{*}$, нм | $R_{h}^{*}$, нм | Φ*, г/см3 | $A_{2}^{*}$ × 104, см3моль/г2 | −ΔG* × 105, Дж/м2 |
|---|---|---|---|---|---|---|---|---|
| БСА/Se0 | 2.5 | 70 | 103 | 50 | 50 | 0.10 | 0.2 | 0.07 |
| ПЭК/Se0 γ = 0.5 | 0.9 | 10 | 85 | 40 | 40 | 0.03 | 0.5 | 0.06 |
| СП/Se0 | 3.3 | 60 | 3 | 100 | 100 | 0.01 | 0.4 | 0.02 |
Для измерения рН среды использовали милливольтметр И-160МИ.
Методом статического светорассеяния (ССР) [12] определяли средневесовые молекулярные массы $М _{w}^{*}$, среднеквадратичные радиусы инерции $R_{g}^{*}$ селенсодержащих наноструктур, а по величинам второго вириального коэффициента $А _{2}^{*}$ – их сродство к растворителю. По соотношению величин молекулярной массы полимерного стабилизатора (ПС) и образуемой им НС вычисляли количество N* адсорбированных макромолекул на поверхности наночастиц Se0. Значения $М _{w}^{*}$, N*, $R_{g}^{*}$ и $А _{2}^{*}$ представлены в табл. 1.
Статическое светорассеяние измеряли на фотогониодиффузометре “Fica” при длине волны падающего вертикально поляризованного света λ = 546.1 нм. Очистку растворов проводили через миллипору (Millex-HV) диаметром 0.45 мкм. Для калибровки прибора использовали коэффициент рассеяния бензола в вертикально поляризованном свете R90° = 22.3 × 106 м–1. Инкременты показателей преломления определяли измерением показателей преломления растворов (n) и растворителя (вода) (ns) на рефрактометре марки ИРФ-23 при нескольких концентрациях, затем проводили линейную экстраполяцию ∆n(с) = n – ns по методу наименьших квадратов. Угол наклона ∆n(с) определял инкремент показателя преломления dn/dc.
Обработку результатов измерений светорассеяния для определения $М _{w}^{*}$, $R_{g}^{*}$ и $А _{2}^{*}$ проводили по методу Дебая с использованием уравнения [12]:
где c – концентрация раствора, K = = 4(πnsdn/dc)2/NAλ4 – оптическая постоянная раствора (NA – число Авогадро), R90° – отношение Релея, измеряемое под углом рассеяния θ = 90°, P(θ) – функция рассеяния, определяемая по асимметрии рассеяния [z] = lim(R45°/R135°) при c → → 0 (R45° и R135° – отношение Релея при углах рассеяния 45° и 135°). Для определения величины P(90°), отвечающей найденному значению [z], использовали расчетные значения, полученные для сферических частиц [12]. Из этих же данных по значениям [z] находили D*/λ, где D* – диаметр частицы.На основании данных по $М _{w}^{*}$ и среднеквадратичным радиусам инерции $R_{g}^{*}$ по формуле:
(здесь Rcф = 1.29$R_{g}^{*}$) определяли величины средней плотности наноструктур Φ* [13]. Значения Φ* приведены в табл. 1.Гидродинамические радиусы наноструктур ($R_{h}^{*}$) определяли методом динамического рассеяния света (ДРС) на корреляционном спектрометре Photo Cor Complex (источник света – гелий-неоновый лазер фирмы Coherent мощности 20 мВт с длиной волны λ = 632.8 нм) с программируемым коррелятором Photocor-FC (число каналов 288, ЗАО “Антекс”, Россия). Обработку корреляционной функции осуществляли с помощью программы DynaLS (“Гелиос”, Россия). Величины гидродинамических радиусов $R_{h}^{*}$ (таблица 1) рассчитывали из значений коэффицентов диффузии (D*) по уравнению Эйнштейна–Стокса: $R_{h}^{*}$ = kT/6πη0D* (η0 – вязкость растворителя, k – константа Больцмана, T – температура) [14]. Корреляционную функцию интенсивности рассеянного света получали с помощью коррелятора PhotoCor-FC с числом каналов 288 (изготовитель – ЗАО “Антекс”, Россия). Анализ корреляционной функции осуществляли с помощью программы обработки данных динамического светорассеяния Dynals (фирма “Гелиос”, Россия). По соотношению экспериментальных величин $R_{g}^{*}$ и $R_{h}^{*}$ находили значение структурно-конформационного параметра ρ* (табл. 1) [15–18].
Методом двойного лучепреломления в потоке (ДЛП) [19] по характеру градиентной зависимости величины ДЛП (Δn) оценивали молекулярную дисперсность растворов образующихся наноструктур. При этом величину Δn определяли в зависимости от градиента скорости вращения ротора g и концентрации ПС (с) при фиксированной концентрации селена. Использовали титановый динамооптиметр с внутренним ротором высотой 4 см и величиной зазора между ротором и статором 0.03 см. Все исследования ДЛП проводили при термостатировании растворов (21°C) во избежание изменений их вязкости и оптических искажений, вызываемых температурным градиентом. Для градуировки установки применяли фенилэтиловый спирт, который обладает значительным ДЛП (Δn/g = 17 × 10–12 (Δn – разность двух главных показателей преломления раствора)), а также систему полистирол–бромоформ. Погрешность определения характеристической величины ДЛП
где η0– вязкость растворителя, не превышала 10%. Измерения проводили при g < gk, где gk – градиент скорости, при котором наступает турбулентность потока.Экспериментальная величина [n] в общем случае dn/dc ≠ 0 складывается из трех эффектов: [n] = = [n]e + [n]fs + [n]f, где [n]e – собственная анизотропия, [n]fs – эффект микроформы, [n]f – эффект макроформы [19]. При этом величина [n]f связана с асимметрией формы частицы p соотношением:
(2)
$\begin{gathered} {{[n]}_{{\text{f}}}}\, = \,{{((n_{s}^{2}\, + \,2){\text{/}}3)}^{2}}({{M}_{w}}{{(dn{\text{/}}dc)}^{2}}f(p)){\text{/}}(30\pi RT{{n}_{s}})\, = \\ = \;{\text{const}} \times {{M}_{w}}{{(dn{\text{/}}dc)}^{2}}f(p), \\ \end{gathered} $ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Все изученные ПС – полиамфолиты и содержат группы, которые при значении pH синтеза, равном 3.8, будут заряжены положительно. Константы скорости k*, рассчитанные для НС БСА/Se0, ПЭК/Se0 при γ = 0.5 и СП/Se0, в условиях полного насыщения адсорбционной емкости наночастиц селена (ν = 0.1) [20–24], составили соответственно 3.3 × 10–3, 2.5 × 10–3 и 0.9 × 10–3 с1 (табл. 1). Такое существенное изменение константы скорости самоорганизации гибридных НС при неизменных значениях параметров среды (pH) указывает на ощутимое влияние структуры (природы) ПС на величину k*.
На рис. 1 (вставка) представлен оптический спектр поглощения для коллоидного красного аморфного α-Se0: максимум поглощения наблюдается при длине волны λ = 256 нм [25]. На рис. 2 приведены оптические спектры поглощения для изученных ПС: максимум поглощения наблюдается только для БСА при λ = 280 нм (кривая 1), а ПЭК и СП в исследуемом диапазоне λ не поглощают (кривые 2 и 3 соответственно). Известно, что если между компонентами НС нет межмолекулярного взаимодействия, то ее оптическая плотность (DНС) должна быть аддитивной величиной оптических плотностей двух отдельных компонентов при фиксированных концентрациях полимера и селена. В нашем случае величина ΔD = DНС – DSe – DПС ≠ 0, что свидетельствует о взаимодействии между наночастицами α-Se0 и ПС (рис. 1). Более того, оптические спектры поглощения для селенсодержащих НС (рис. 1) существенно отличаются как от оптического спектра поглощения для наночастиц α-Se0 (максимума поглощения при λ = 256 нм, характерного для наночастиц α-Se0, не наблюдается), так и от спектров поглощения для ПС.
Рис. 1.
Оптические спектры поглощения (при ν = 0.1) для селенсодержащих НС: 1 – БСА/Se0, 2 – ПЭК/Se0 (γ = 0.5) и 3 – СП/Se0. На вставке зависимость оптической плотности D от длины волны λ для коллоидного селена [25].
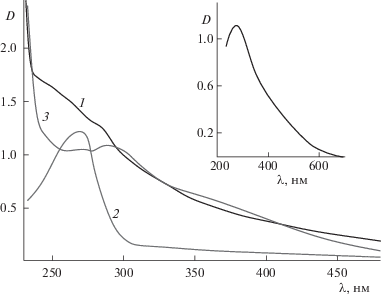
Учитывая гидрофобную природу наночастиц α-Se0, можно предположить, что образование комплексов будет проходить по гидрофобным фрагментам ПС. Однако, исходя из существенных различий в структуре и природе ПС, а, значит, и в степени гидрофобности их макромолекул, можно заключить, что оптические спектры поглощения для селенсодержащих НС, должны значительно различаться между собой. Действительно, как видно из рис. 1, НС Se0/БСА (кривая 1) не имеет выраженного максимума, в то время как для НС ПЭК/Se0 (γ = 0.5) наблюдается ярко выраженный максимум при λ = 283 нм (кривая 2), а для НС СП/Se0 в области λ = 250–280 нм наблюдается плато, переходящее в слабо выраженный максимум при λ = 300 нм (кривая 3). Таким образом, различие в степени выраженности максимумов оптической плотности поглощения для изученных НС обусловлено различиями в структуре и природе молекул ПС.
Оценка гидродинамического радиуса $R_{h}^{*}$ наночастиц селена (при ν = 0.1) методом ДСР показала, что в отсутствие ПС образуются крупные частицы с радиусом ∼180 нм, с узким унимодальным распределением по размерам. По истечении 2 суток визуально наблюдается агрегация наночастиц селена, выпадающих в осадок. При использовании в качестве ПС БСА, ПЭК или СП в водных растворах формируются наноструктуры с размером ≤100 нм (таблица 1), при этом НС характеризуются узким унимодальным распределением по размерам и достаточно высокой стабильностью.
Величина молекулярной массы при переходе от водных растворов полимеров или ПЭК к НС в зависимости от природы ПС возрастала в 85 раз (ПЭК), 1000 раз (БСА) и в 3 раза (СП), т.е. на поверхности НЧ адсорбировано 3–103 молекул полимера (N* = 3–1000) (таблица 1). При этом сохранялось молекулярно-дисперсное состояние растворов наноструктур, о чем свидетельствовал характер градиентных зависимостей Δn = f(g): при g < gк для всех изученных НС они хорошо аппроксимируются прямыми линиями, проходящими через начало координат [19].
Важно также отметить, что для изученных гибридных НС величина среднеквадратичного радиуса инерции $R_{g}^{*}$ совпадает с величиной гидродинамического радиуса $R_{h}^{*}$ (таблица 1) и значение структурно-конформационного параметра ρ* = $R_{g}^{*}$/$R_{h}^{*}$ составляло ρ* = 1.0, что характерно для сплошных сфер [13–18]. Эти значения ρ* существенно меньше величины структурно-конформационного параметра для клубкообразных макромолекул в термодинамически хорошем растворителе (ρклубка = 1.5–1.7) [13–18]. Формирование наноструктур с формой, близкой к сферической, экспериментально обнаружено также в работах [7–9, 20–24].
Оценка величины параметра p* для исследованных наноструктур в приближении [n] ∼ [n]f на основании соотношения (2) показала, что для всех изученных НС характерна сферическая форма наноструктур (p* = 1.0―1.2). Это полностью согласуется с данными по параметру ρ* (ρ* = 1.0).
Расчет средней плотности НС по формуле (1) показал, что в зависимости от природы НЧ формируются НС с плотностью в диапазоне Ф* = = 0.01–0.10 г/см3 (таблица 1), существенно превосходящей плотность полимерного клубка [19]. Важно отметить, что наименее плотные наноструктуры образуются в случае НС СП/Se0, а наиболее плотные – при стабилизации наночастиц селена молекулами БСА. Таким образом, более массивная частица (ПС-БСА) оказывается и более плотной: $М _{w}^{*}$ = 70 × 106 и Φ* = 0.10 г/см3 (таблица 1). Очевидно, что изученные наноструктуры имеют различные упаковку и распределение органических молекул вокруг селенового ядра (ядер). Так, сопоставление величины контурной длины белковой макромолекулы L [19] с величиной $R_{{{\text{с ф }}}}^{*}$ = 1.29$R_{g}^{*}$ = 65 нм показало, что наноструктура БСА/Se0 является полиядерной: $L \ll R_{{{\text{с ф }}}}^{*}$.
Как известно [26], свободная энергия ΔG* взаимодействия макромолекула–наночастица в расчете на единицу площади поверхности частицы может быть определена по соотношению
где с – начальная концентрация полимера, моль/л. Отметим, что соотношение (3) справедливо для сферических наноструктур произвольной морфологии в области образования устойчивых дисперсий. Применение уравнения (3) к изученным наноструктурам показало, что ΔG = –0.07 × × 10–5 Дж/м2 в случае НС БСА/Se0, ΔG = –0.06 × × 10–5 Дж/м2 для НС ПЭК/Se0 с соотношением ДСН/К γ = 0.5 и ΔG* = –0.02 × 10–5 Дж/м2 для Se0/НССП. Таким образом, при использовании в качестве ПС сополимера свободная энергия ΔG* взаимодействия макромолекула–наночастица селена заметно меньше по абсолютной величине, чем для НС БСА/Se0 и ПЭК/Se0.Итак, изученные сферические наноструктуры ощутимо различаются по ММ, размерам и плотности, кроме того, при варьировании природы ПС ощутимо изменяются энергия и характер взаимодействий наночастиц Se0 с ПС, что отражает параметр ΔG*.
Второй вириальный коэффициент А2 для изученных НС стремится к нулю (А2 = (0.2–0.5) × × 10–4 см3моль/г2 (таблица 1)), что характеризует состояние растворов как близкое к идеальному (близком к тета-точке). Следует заметить, что для исследованной в данной работе НС ПЭК/Se0 при γ = 0.5 наличие в растворе селена практически не влияет на его термодинамическое состояние, в то время как при γ = 4.0 [7] переход от системы ПЭК–вода к системе ПЭК/Se0–вода сопровождалось кардинальным изменением термодинамического состояния раствора от хорошего (А2 = 22 × ×10‒4 см3 моль/г2) к плохому (А2= –1.8 × 10–4 см3 моль/г2), по-видимому, вследствие ориентации гидрофобных алкильных цепей ДСН в объемную фазу раствора (система ПЭК/Se0–вода).
Таким образом, структура (природа) ПС является определяющим фактором в процессе формирования селенсодержащих наноструктур и оптимизации их параметров (константы скорости, размерных параметров, молекулярной массы, плотности и величины свободной энергии, а также спектральных характеристик). Полученные результаты составляют физико-химическую основу для целенаправленного синтеза потенциальных лекарственных веществ на основе селена.
Список литературы
Помогайло А.Д., Джардималиева Г.И. Металлополимерные гибридные нанокомпозиты. М.: Наука, 2015. 489 с.
Тальрозе Р.В., Шандрюк Г.А., Мерекалов А.С. и др. // Высокомолек. соед. А. 2009. Т. 51. № 11. С. 1930.
Литманович О.Е. // Там же. С. 2008. Т. 50. № 7. С. 1370.
Yoshizawa K., Willett W.C., Morris S.J. // J. Natl. CancerInst. 1998. V. 90. № 16. P. 1219.
Абдуллаев Г.М., Зейналлы Э.М., Сафаров Ю.И. // Врачебное дело. 1978. № 11. С. 35.
Yu S.Y., Zhu Y.J., Li W.G. // Biol. Trace Element Res. 1997. V. 51. № 1. P. 117.
Валуева С.В., Боровикова Л.Н., Волков А.Я. // Сборник статей по материалам Международной научно-практической конференции “Дни науки”. Прага, Чехия, 2012. С. 24.
Валуева С.В., Суханова Т.Е., Матвеева Н.А. и др. // Сборник статей Второй международной научно-практической конференции “Высокие технологии, фундаментальные и прикладные исследования в физиологии и медицине” (PhysioMedi). Санкт-Петербург, Россия, 2011. С. 130.
Валуева С.В., Азизбекян С.Г., Кучинский М.П. и др. // Нанотехника. 2012. № 4(32). С. 53.
Копейкин В.В. // Биологич. мембраны. 1988. Т. 5. № 7. С. 728.
Березин И.В., Клесов А.А. Практический курс химической и ферментативной кинетики. М.: Изд-во МГУ, 1976. 320 с.
Эскин В.Е. Рассеяние света растворами полимеров и свойства макромолекул. Л.: Наука, 1986. 288 с.
Pogodina N.V., Tsvetkov N.V. // Macromolecules. 1997. V. 30. № 17. P. 4897.
Brown W. Dynamic Light Scattering: the Method and Some Application. Oxford: Clarondon Press, 1993. 305 p.
Meewes M., Ricka J., De Silva M., et al. // Macromolecules. 1991. V. 24. № 21. P. 5811.
Nishio I., Shao Thang Sun, Swislow G., Tanaka T. // Nature. 1979. V. 281. № 5728. P. 208.
Konishi T., Yoshizaki T., Yamakawa H. // Macromolecules. 1991. V. 24. № 20. P. 5614.
Burchard B.W. Static and Dynamic Light Scattering Approaches to Structure Determination of Biopolymers // Laser Light Scattering in Biochemistry / Ed. by S.E. Harding, D.B. Satelle, V.A. Bloomfild. Cambridge: Roy. Soc. Chem., 1992. Information Services. P. 3–21.
Цветков В.Н., Эскин В.Е., Френкель С.Я. Структура макромолекул в растворах. М.: Наука, 1964. 720 с.
Валуева С.В., Боровикова Л.Н., Коренева В.В. и др. // Журн. физ. химии. 2007. Т. 81. № 7. С. 1329.
Валуева С.В., Боровикова Л.Н., Киппер А.И. // Там же. 2008. Т. 82. № 6. С. 1131.
Валуева С.В., Боровикова Л.Н. // Бутлеровские сообщения. 2010. Т. 20. № 5. С. 52.
Валуева С.В., Вылегжанина М.Э., Лаврентьев В.К. и др. // Журн. физ. химии. 2013. Т. 87. № 3. С. 499.
Валуева С.В., Титова А.В., Боровикова Л.Н. // Там же. 2015. Т. 89. № 9. С. 1420.
Бусев А.И. Колориметрические (фотометрические) методы определения неметаллов. М.: Изд-во иностр. лит., 1963. 467 с.
Литманович А.А., Паписов И.М. // Высокомолекуляр. соединения. Б. 1997. Т. 39. № 2. С. 323.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии