Журнал физической химии, 2019, T. 93, № 1, стр. 35-39
Лиганды на основе 2,3,6-O-производных целлюлозы для катализаторов асимметрического гидрированияН. Д. Зубарева, Д. В. Курилов, Е. И. Клабуновский, А. Ю. Стахеев, Л. М. Кустов
Н. Д. Зубарева a, *, Д. В. Курилов a, Е. И. Клабуновский a, А. Ю. Стахеев a, Л. М. Кустов a
a Российская академия наук, Институт органической химии им. Н.Д. Зелинского
Москва, Россия
* E-mail:
Поступила в редакцию 02.03.2018
Аннотация
Разработаны методы синтеза и проведено физико-химическое исследование лигандов на основе 2,3,6-О-производных целлюлозы для катализаторов асимметрического гидрирования.
Целлюлоза – линейный (1→4)-β-глюкан(поли(1→4)-β-D-глюкопиранозил-D-глюко-пираноза) общей формулы [С6Н7О2(ОН)3]n. Этот полисахарид – один из наиболее распространенных биополимеров, входящих в состав клеточных стенок растений и микроорганизмов. Биодоступность целлюлозы, с одной стороны, и наличие в этом природном полимере хиральных центров, с другой, создают привлекательность ее молекулы, например, для использования в области энантиоселективного катализа. Так, оказалось перспективным применение целлюлозы в гомогенном металлокомплексном катализе в качестве хирального нерастворимого лиганда или как носителя гетерогенных катализаторов.
В ранних публикациях, касающихся использования целлюлозы в каталитических процессах, сообщалось о получении катализатора для гидрогенизации со стереоспецифическим действием на основе H2PtCl6 и гидразина в присутствии натриевой соли карбоксиметилцеллюлозы и пероксида водорода [1]. Палладиевые комплексы, полученные из карбоксиметилцеллюлозы, а также аминоэтилцеллюлозы и диэтиламиноэтилцеллюлозы, исследованы как катализаторы в реакциях асимметрической гидрогенизации бензоилмуравьиной и α-ацетамидоакриловой кислот [2]. Однако оптическая чистота соответствующих продуктов восстановления – миндальной кислоты и аланина – оказалась очень низкой (0.10–0.16% ee). Оптически активный метил-N-фталоил-D-аланинат (до 28% ее) получен посредством каталитического асимметрического восстановления метил-α-фталимидоакрилата с использованием в качестве лиганда 2,3-О-бис-дифенилфосфинитного производного целлюлозы при комплексообразовании с катализатором Уилкинсона – [RhCl(Ph3P)3] [3]. В дальнейшем было найдено, что экранирование трифенилметильной группой 6-О-атома в 2,3-О-бис-(дифенилфосфино)целлюлозе позволяет увеличить ее эффективность при асимметрической индукции [4]. Так, в Rh-катализируемой (при комплексообразовании с [Rh(1,5-гексадиен)Cl]2) асимметрической гидрогенизациии 2-фенил-1-бутена в 2-фенил-1-бутан с участием 2,3-О-бис-(дифенилфосфино)-6-О-трифенилметилцеллюлозы в среде бензола был достигнут сравнительно высокий оптический выход продукта (до 49% ее) с конверсией до 100%. При этом установлено, что оптический выход продукта зависит от соотношения P/Rh в каталитической системе [5]. Следует отметить, что в последние годы возобновился интерес к углеводам для получения лигандов, используемых в асимметрическом катализе [6–8].
Цель настоящего исследования – разработка новых стратегий модификации целлюлозы и получение лигандов на ее основе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные соединения и оборудование
Ацетат целлюлозы, 30000. 32.8% Ас. DS 2.45, “Aldrich”.
Салициловая кислота, т.пл. 160°С, “Lancaster”.
4-Гидроксибензойная кислота, 214°С, “Lancaster”.
4-Гидроксифенилуксусная кислота, 148°С, “Lancaster”.
1,1'-(2,2-Дигидрокси-3-карбоксилат)бинафтил, 258–260°С.
1,1'-Карбонилдиимидазол (CDI), 119°С, “Lancaster”.
1,8-Диазабицикло[5.4.0]ундец-7-ен (DBU), “Aldrich”.
Спектры ЯМР 1Н регистрировали на приборе “Bruker 300 AM”. ИК-спектроскопические исследования выполняли на приборе “Specord M-80”, прессовка KBr.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
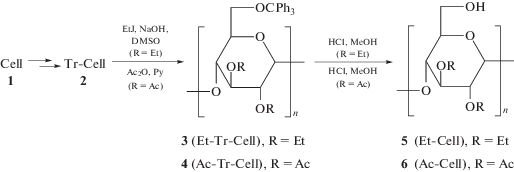
В отличие от упомянутых выше работ был выбран подход, который позволяет модифицировать целлюлозу (как лиганд для металлокомплексного катализа) таким образом, чтобы ввести в молекулу этого полисахарида в 6-О-положение группу, способствующую эффективной координации. Например, такую модификацию можно осуществить посредством получения сложных эфиров арилзамещенных карбоновых кислот с целлюлозой при предварительном экранировании этильными или ацетильными группами 2- и 3-О-положений в β-D-глюкопиранозильных звеньях полисахарида. Для этого исходную частично ацетилированную (32.8%) целлюлозу (Cell’), обрабатывали 15%-ным водным раствором аммиака и получали деацетилированную целлюлозу (Cell, 1), которую использовали для дальнейших реакций. Затем синтезировали 6-О-метилтрифенилцеллюлозу (Tr-Cell, 2) путем тритилирования целлюлозы 1 трифенилметилхлоридом при нагревании в пиридине (Cхема 1). Далее синтезировали 2,3-ди-О-этил-6-О-метилтрифенилцеллюлозу (Et-Tr-Cell, 3) путем алкилирования соединения 2 при нагревании с этилиодидом в присутствии NaOH в среде ДМСО. При обработке Tr-Cell уксусным ангидридом в пиридине получали 2,3-ди-О-ацетил-6-О-метилтрифенилцеллюлозу (Ac-Tr-Cell, 4) (Схема 1). После удаления защитной тритильной группы при 6-О-атоме в соединениях 3 и 4 синтезировали соответственно 2,3-ди-О-этилцеллюлозу (Et-Cell, 5) и 2,3-ди-О-ацетилцеллюлозу (Ac-Cell, 6) (Схема 1).
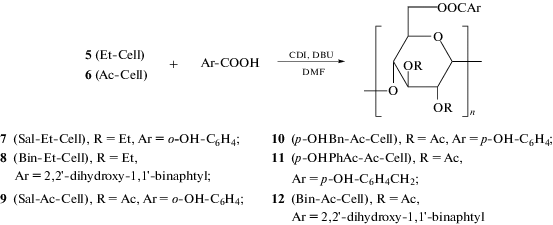
На следующем этапе осуществляли модификацию гидроксильной группы при С6-атоме в соединениях 5 и 6 посредством получения сложных эфиров 7–12 с арилзамещенными карбоновыми кислотами, имеющими гидроксильные группы в ароматическом положении (Схема 2).
Конденсацию соединений Et-Cell 5 и Ac-Cell 6 с кислотами проводили в присутствии конденсирующего реагента N,N'-карбонилдиимидазола (CDI) и основания 1,8-диазабицикло-[5.4.0]ундец-7-ена (DBU) в среде ДМФА (Схема 2). Для соединения 5 (Et-Cell) (получены сложные эфиры с кислотами: салициловой (7) и 2,2'-дигидрокси-1,1'-бинафтил-3-карбоновой (8). Для соединения 6 (Ac-Cell) получены сложные эфиры с кислотами: салициловой (9), 4-гидроксибензойной (p-OH-Bn-Ac-Cell, 10), 4-гидроксифенилуксусной (p-OH-PhAc-Ac-Cell, 11) и 2,2'-дигидрокси-1,1'-бинафтил-3-карбоновой (12). Значения выходов сложных эфиров составили от 40 до 95%. Полученные соединения охарактеризованы ИК-, ЯМР 1Н-спектрами и элементным анализом.
Получение производных целлюлозы
Промежуточные производные целлюлозы: Cell (1), 2, 3 и 4 (Схемы 1 и 2) синтезировали по известным методикам [9, 10] с небольшими изменениями. Спектры ЯМР 1Н записывали в различных растворителях: CDCl3, пиридине и CD2Cl2.
“Регенерированную” целлюлозу (Cell, 1) получали деацетилированием ацетилцеллюлозы (Cell-исх, марки “Aldrich, 30 000”) обработкой 15%-ным водным раствором аммиака. Полноту протекания реакции контролировали по ИК-спектру до исчезновения полосы поглощения связи С=О ацетильной группы при 1760 см–1.
6-О-метилтрифенилцеллюлоза (6-О-тритилцеллюлоза, Tr-Cell, 2). “Регенерированную” целлюлозу (Cell, 1) (1.3 г) нагревали в течение 1 ч с 280 мл 50%-ного пиридина при 95°С, отфильтровывали, обрабатывали 3 раза сухим пиридином (по 280 мл, 1 ч) и нагревали при 95°С со 140 г (0.5 моль) тритилхлорида в течение 3.5 ч [9, 10]. Продукт медленно выливали в 1.5 л метанола, промывали метанолом и сушили в вакууме при 100°С.
Выход 2 – 80%. Степень замещения (DS) определяли гравиметрически [9, 12]: детритилирование осуществляли действием концентрированной HCl в сухом метаноле или действием H2SO4. Элементный анализ: С23.67H23.02O5. Вычислено, %: С 73.37, Н 5.99. Найдено, %: С 73.35, Н 6.04, С6Н7О2 + 0.93 (ОС19Н15) + 2.07 (ОН). Получили 2 с DS = 0.85–1.12. Дальнейшие превращения проводили с образцом 2 с DS 0.93.
2,3-ди-О-этил-6-О-метилтрифенилцеллюлоза (Et-Tr-Cell, 3). В атмосфере аргона к раствору 27.8 г Tr-Cell (2) с DS = 0.93 в 350 мл ДМСО добавляли 69 г NaOH и в течение 2 ч по каплям прибавляли 92 мл иодистого этила (EtI). Реакционную смесь перемешивали 1 ч и грели 3 ч при 60°С. Затем в течение 2 ч добавляли вторую порцию EtI (28 мл), и смесь грели при 50°С еще 19 ч. После этого добавляли третью порцию EtI (20 мл), и реакционную смесь перемешивали еще 3 ч при 50°С, после чего охлаждали до комнатной температуры и выливали в 1.5 л метанола. Выпавший в осадок продукт отфильтровывали, промывали водой, а затем перекристаллизовывали из смеси метанола и пентана. Продукт высушивали при 100°С при пониженном давлении. Выход 80%. Реакция протекала с осложнениями: иногда выделялся иод, и конечный продукт требовал дополнительной очистки. Поэтому образцы 3 получались с различными значениями DS. Наиболее чистый образец получен c DS = 1.75 (Et). Спектры 1H NMR снимали в CD2Cl2 и пиридине; в спектрах обнаружили сигналы метильных групп в области 0.4–1.5 ppm, широкие сигналы остова целлюлозы и метиленовой группы в области 2.5–4.8 ррm и ароматических протонов тритильной группы в области 6.8–7.9 ppm. Спектры, записанные в CD2Cl2 и пиридине, позволили нам рассчитывать величину DS этильных групп, которые оказались близки к результатам, полученным из аналитических данных и также согласуются с данными ИК-спектров. Полоса поглощения гидроксилов при 3500 cм–1 качественно подтверждает оценку DS. Мы сравнивали ИК-спектры полученных эфиров со спектрами исходных кислот и этил- и ацетилцеллюлозы. Полосы С=О-группы при 1684 и 1770 cм–1 указывают на присутствие эфирной группы.
Элементный анализ: С27.17H30.02O5. Вычислено, %: С 74.74, H 6.93. Найдено, %: C 74.74, H 6.87. DS = 0.93 (Trityl), DS = 1.75 (Et) (в расчете на звено глюкозы по С2- и С3-центрам).
2,3-ди-О-ацетил-6-О-метилтрифенилцеллюлоза (Ac-Tr-Cell, 4). К раствору 5 г Tr-Cell (2) (с DS = 1.06 по 6-О-атому) в 25 мл сухого пиридина приливали 10 мл уксусного ангидрида. Раствор перемешивали в течение 10 суток при 30°С. Затем добавляли ацетон, и продукт выделяли при обработке метанолом, удаляли следы уксусного ангидрида и уксусной кислоты и высушивали в вакууме. Элементный анализ. С29.36Н28.16О6.79. Вычислено, %: С 71.99, Н 5.80. Найдено, %: С 72.17, Н 5.84. С6Н7О2 + 1.04 (ОС19Н15) + 1.8(С2Н3О2) + 0.16 (ОН). Получено: 4, DS = 1.04 (Trit-C6) и DS = 1.8 (Ac по С2-, С3-центрам).
2,3-ди-О-этилцеллюлоза (Et-Cell, 5). Реакции осуществляли с различными образцами 3. Детритилирование проводили при действии HCl в растворе MeOH [13, 14]. Получали образцы с различными степенями замещения DS (Et). Для дальнейших реакций использовали образцы с высокой степенью замещения (DS = 1.75 (Et). Однако даже при такой высокой степени замещения детритилирование было неполным, и продукт 5 содержал следы тритильных групп: DS = 0.013 (Tr). Элементный анализ: [С6Н7О2 + 0.013 (ОС19Н15) + 1.75 (ОС2Н5) + 1.237 (ОН)]. С9.74Н17.18О5. Вычислено, %: C 54.58, H 8.06; Найдено,%: C 54.53, H 7.37. DS = 1.75 (Et) и DS = 0.013 (Tr).
2,3-ди-О-ацетилцеллюлоза (Ac-Cell, 6). Для детритилирования 4 использовали HBr: 10 г 4 растворяли при 0°С и перемешивании в уксусной кислоте (перегнанной над CrO3). Образовавшийся гель разрушали встряхиванием в течение 10 мин. Затем к раствору 4 добавляли раствор сухой уксусной кислоты, насыщенной сухим HBr. Через 10 мин реакционную смесь выливали в 2 л метанола. Выделившийся осадок отфильтровывали, промывали большим количеством воды и высушивали при пониженном давлении при 60°С. Элементный анализ: C6H7O2 + 1.8 (C2H3O2) + + 1.2 (OH)C9.6H13.6O6.8. Вычислено, %: C 48.5, H 5.76. Найдено, %: C 48.0, H 5,79. DS = 1.8 (заместители Аc по С2, С3).
Получение сложных эфиров из 2,3-ди-О-этилцеллюлозы
2,3-Ди-О-этил-6-О-(2'-гидроксибензоат)целлюлоза, Sal-Et-Cell (7). К салициловой кислоте (2.24 г, 16.22 ммоль) в 20 мл ДМФА при перемешивании в течение 30 мин добавляли CDI (2.62 г, 16.6 ммоль). Реакционную смесь перемешивали 1 ч при 20°С, при этом изменялся цвет и выделялся СО2 (раствор 1). К 5 Et-Cell (1.76 г, 8.22 ммоль; DS = 1.75 (Et)) в 30 мл ДМФА добавляли DBU (2.46 г, 16.16 ммоль) (раствор 2). Затем раствор 1 добавляли к вязкому раствору 2 при перемешивании при 20°С. Полученную реакционную смесь перемешивали при этой температуре еще 16 ч. Затем добавляли 50 мл диэтилового эфира и 50 мл 10%-ной HCl и образовавшийся вязкий раствор встряхивали в делительной воронке. Непрореагировавшую салициловую кислоту, перешедшую в эфирный слой, удаляли, и образовавшийся осадок в солянокислом растворе отфильтровывали, промывали разбавленной HCl, водой, насыщенным раствором NaHCO3 и затем снова водой. Далее осадок промывали метанолом и эфиром, высушивали при пониженном давлении при 60°С. Выход 40%. Аналитический образец охарактеризован ИК- (в KBr), 1H ЯМР-спектрами и элементным анализом: C14.51H19.9O6.36. C6H7O2 + 0.013 (OC19H15) + 1.75 (OC2H5) + 0.557 (OH) + 0.68 (C7H5O3). Вычислено, %: C 58.85, H 6.78. Найдено, %: C 58.80, H 5.68. DS = 1.75 (Et по С2-, С3-центрам); DS = 0.013 (Trit по С6-центру); DS = 0.68 (салициловая кислота присоединена по С6-центру). При уменьшении степени замещения С2-, С3-групп в Et-Cell с DS = 1.75 (Et) до DS = 1.2 (Et) и изменением соотношений реагентов Et-Cell : Sal : CDI : DBU с 1.75 : 2.24 : 2.62 : 2.46 (г) на 1.50 : 10.58 : 11.66 : 12.42 (г) степень замещения DS (Sal) выросла до DS = 1.40 (Sal).
2,3-Ди-О-этил-6-О-(1,1'-(2,2'-дигидроксибинафтил)-3-карбоксилат)целлюлоза, Bin-Et-Cell (8). Реакцию конденсации проводили в условиях, сходных с условиями получения эфира 7 (с салициловой кислотой). В отличие от реакции с салициловой кислотой продукт 8 образуется в виде вязкой массы в HCl-растворе. Продукт отфильтровывали, промывали метанолом до образования кристаллической массы, затем промывали раствором HCl, водой, насыщенным раствором NaHCO3 и снова водой. Затем осадок промывали метанолом, эфиром и высушивали при пониженном давлении при 60°С. Выход продукта 8 около 30%. Степень замещения DS = 0.35 карбоксинафтолом (в расчете на звено глюкозы по С6-центру). а) Бинафтолкарбоновая кислота (BiN), б) BiN-Et-Cell. Спектр 1H ЯМР − BiN. C17,1H21,4O6,05: Вычислено, %: С 63.44, H 6.66. Найдено, %: C 63.24, H 5.52.
Получение сложных эфиров из 2,3-ди-О-ацетилцеллюлозы
2,3-Ди-О-ацетил-6-О-(2'-гидроксибензоат)целлюлоза, Sal-Ac-Cell (9). Реакцию конденсации 2,3-ди-О-ацетилцеллюлозы 6 проводили в условиях, сходных с условиями получения эфира 7 с салициловой кислотой. Выход продукта 9 – 60%. Элементный анализ C6H7O2 + 1.8 (C2H3O2) + 0.75 (C7H5O3) + 0.75 (OH). C14.85H16.59O8.3. Вычислено, %: C 54.39, H 5.10. Найдено, %: C 54.33, H 5.16. DS = 1.8 (Ac); DS = 0.75 (Sal); DS = 0.45 (OH). В случае этерификации Et-Cell салициловой кислотой для продукта найдено DS = 0.68 (Sal), что показывает преимущество этерификации в случае ацетильных 2,3-замещенных производных целлюлозы по сравнению с 2,3-диэтильными производными целлюлозы.
2,3-Ди-О-ацетил-6-О-(4'-гидроксибензоат)целлюлоза, р-ОHB-Ac-Cell (10). Реакцию конденсации проводили в условиях, сходных с условиями получения эфира с салициловой кислотой (7). Элементный анализ: C17.2H17.9O8.96. Вычислено, %: C 56.08, H 44.91. Найдено, %: C 56.13, H 5.42. Степень замещения целлюлозы 4-гидроксибензойной кислотой DS = 1.08 по С6-центру. Для оставшихся незамещенных ОН-групп в целлюлозе DS = 0.12.
2,3-Ди-О-ацетил-6-О-(4'-гидроксифенилацетат)целлюлоза, р-ОHРhАc-Ac-Cell (11).
Реакцию проводили аналогично этерификации с салициловой кислотой. Элементный анализ: C17.84H19.76O4.63. Вычислено, %: C 56.99, H 5.30. Найдено, %: C 56.80, H 5.14. DS = 1.8 (Ac), DS = 1.03 (4-гидроксифенилуксусная кислота) по С-центру. Для оставшихся незамещенных ОН-групп в целлюлозе DS = 0.17.
2,3-Ди-О-ацетил-6-О-(1,1'-(2,2'-дигидроксибинафтил)-3-карбоксилат)целлюлоза, Bin-Ac-Cell (12). Реакцию этерификации проводили в условиях, сходных с условиями получения эфира с салициловой кислотой (7). В отличие от реакции с салициловой кислотой при получении эфира 12 образовывался вязкий продукт. Непрореагировавший Binapht-COOH удаляли с эфирным слоем. Остаток фильтровали и выливали в метанол, при этом образовался кристаллический продукт, который промывали водой, насыщенным раствором NaHCO3 и снова водой, далее осадок промывали метанолом, эфиром и сушили при 60°С. Выход эфира 12 – 30%. Спектр 1H NMR не мог быть записан вследствие нерастворимости продукта в CDCl3, CD2Cl2, ДМСО, пиридине. Элементный анализ: C25.35H22.6O10.46.1H2O. Вычислено, %: C 62.13, H 5.06. Найдено, %: C 62.20, H 6.36. C6H7O2 + 1.8 (C2H3O2) + 0.75 (C21H13O4) + 0.45 (OH) + 1H2O. DS = 1.8 (Ac), DS = 0.75 (Binapht). Для оставшихся незамещенных ОН-групп в ацетилцеллюлозе DS = 0.45.
Дальнейшее продолжение исследований связано с использованием полученных лигандов в реакциях асимметрического гидрирования и гидросилилирования сложных органических субстратов [15, 16].
Данная работа выполнена при финансовой поддержке Российского научного фонда (проект № 14-50-00126). Авторы выражают благодарность Е.Н. Расадкиной за предоставленный образец 1,1' -(2,2'-дигидрокси-3-карбоксилат)бинафтила.
Список литературы
Zvacek J. // Czech. Pat. 107120 (1964), Chem. Abstr. 1963. V. 59. 14632h.
Harada K., Yoshida T. // Naturwissenschaften. 1970. V. 57(4). P. 131.
Pracejus H., Bursian M. // Ger. Pat. 92031 (1972), Chem. Abstr. 1973. V. 78. 72591b.
Kawabata Y., Tanaka M., Ogata I. // Chem. Lett. 1976. P. 1213.
Kaneda K., Yamamoto H., Imanaka T., Teranishi Sh. // J. Molec. Catal. 1985. V. 29. P. 99.
Minuth T., Boysen Mike M.K. // Org. Lett. 2009. V. 11(18). P. 4212–4215.
Grugel H., Minuth T., Boysen Mike M.K. // Synthesis. 2010. V. 19. P. 3248.
Tian P., Dong H.-Q., Lin G.-Q. // ACS Catal. 2012. V. 2. P. 95.
Harkness B.R., Gray D.G. // Macromolecules. 1990. V. 23. P. 1452.
Honeyman J. // J. Chem. Soc. 1947. P. 168.
Ho F.F.L., Klosiewicz D.W. // Anal. Chem. 1980. V. 52. P. 913.
Methods in Carbohydrate Chemistry / Ed. by R. Whistler. V. III. Cellulose. N.Y.: Academic Press, 1963. P. 4, 27, 327.
Chassaing C., Thienpont A., Felix G. // J. Chromatogr. A. 1996. V. 738. P. 157.
Kaida Y., Okamoto Y. // Bull. Chem. Soc. Jpn. 1993. V. 66. P. 2225.
Ananikov V.P., Gordeev E.G., Egorov M.P. et al. // Mend.Commun. 2016. V. 26. P. 365.
Ananikov V.P., Kustov L.M., Tarasov A.L. et al. // Ibid. 2017. V. 27. № 5. P. 425.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии