Журнал физической химии, 2019, T. 93, № 10, стр. 1522-1528
Роль температурной зависимости энтальпии ионного обмена в прогнозировании поведения ионообменной системы
В. А. Иванов a, *, Е. А. Карпюк a, О. Т. Гавлина a, С. И. Каргов a
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: ivanov@phys.chem.msu.ru
Поступила в редакцию 15.03.2019
После доработки 15.03.2019
Принята к публикации 09.04.2019
Аннотация
Изучено влияние температуры на обмен двух- и однозарядных ионов на полиметакриловых и полиакриловых катионитах в интервале от 298 до 413 K. Показано, что при повышении температуры одновременно со значительным увеличением коэффициента равновесия увеличивается дифференциальная энтальпия. Установлено, что зависимости энтальпии от температуры носят линейный характер; влияние температуры на энтальпию ионного обмена на изученных ионообменниках значительно сильнее, чем в описанных в литературе системах с сульфокислотными катионитами и высокоосновными анионитами. Обсуждена проблема учета зависимости энтальпии от температуры при прогнозировании поведения ионообменных систем.
В работах по сорбционным и ионообменным системам обычно привлекают аппарат химической термодинамики, даже если термодинамические аспекты не являются главным предметом работы. В то же время ни для кого не секрет, что во многих случаях аппарат термодинамики используется достаточно формально, без учета специфичных для ионного обмена моментов. Эти особенности термодинамики ионного обмена неоднократно обсуждались во многих изданиях [1–9]. Основные “подводные камни” в области термодинамики ионного обмена были также рассмотрены нами в [10].
Энтальпию ионного обмена обычно определяют, подставляя экспериментальные значения константы равновесия или, что делается намного чаще, коэффициента равновесия в уравнение изобары Вант-Гоффа. Проблема, которой далее уделим внимание, связана с тем, что при обсуждении влияния температуры на ионообменную селективность в большинстве случаев оперируют средней величиной изменения энтальпии для некоторого температурного интервала. В некоторых работах это обосновывается тем, что зависимость логарифма константы ионного обмена или коэффициента равновесия от обратной температуры оказывается линейной, что подтверждает постоянство изменения энтальпии [11–16]. В то же время в очень многих случаях авторы даже не задумываются о характере такой зависимости, а просто рассчитывают средние значения.
Иной способ определения энтальпии ионного обмена – калориметрическое измерение теплоты реакции ионного обмена. И хотя в некоторых случаях измерения проводят в некотором интервале температур [17], гораздо чаще ограничиваются измерениями лишь при “комнатной” температуре [18]. И даже в упомянутой работе [17] интервал температур, в котором проводились калориметрические измерения, был очень узким (288–308 K) вблизи комнатной температуры. При этом возникает вопрос, насколько адекватно можно прогнозировать поведение ионообменной системы, используя лишь такие данные и не учитывая возможную зависимость энтальпии от температуры.
Работ, в которых анализируют зависимости энтальпии ионного обмена от температуры, сравнительно немного. Можно упомянуть классические работы [19–23], в которых были продемонстрированы температурные зависимости обмена ионов на сульфокислотных катионитах и сильноосновном анионите в определенных ионных системах. При этом, однако, авторы отмечали, что влияние температуры на энтальпию ионного обмена в большинстве случаев небольшое. В работах [24, 25] отметили нелинейность зависимости логарифма коэффициента распределения неорганических ионов на сильнокислотном катионите и сильноосновном анионите от обратной температуры, что должно указывать на непостоянство энтальпии ионного обмена. Однако нелинейность этих зависимостей также была слабовыраженной.
Ранее мы обнаружили, что на некоторых промышленных полиметакриловых и полиакриловых катионитах наблюдается не только необычно сильный рост селективности с температурой, но и энтальпии для реакции обмена ионов Ca2+ и Na+ [26, 27]. В настоящей работе представим некоторые новые данные по влиянию температуры на энтальпию реакции ионного обмена ионов и проанализируем, насколько значительна может быть роль этого влияния в изменении коэффициентов равновесия и селективности ионитов, причем в рассмотрение включим и область “перегретых” растворов с температурой выше 373 K. Предварительно приведем необходимые сведения в области термодинамики ионного обмена.
ТЕРМОДИНАМИКА ИОННОГО ОБМЕНА
Для реакции обмена ионов A и B с зарядами ${{z}_{{\text{A}}}}$ и ${{z}_{{\text{B}}}}$ на ионите, записанной в виде [8, 9]:
(1)
$\frac{1}{{{{z}_{{\text{A}}}}}}{{{\bar {A}}}^{{{{z}_{{\text{A}}}}}}} + \frac{1}{{{{z}_{{\text{B}}}}}}{{{\text{B}}}^{{{{z}_{{\text{B}}}}}}} = \frac{1}{{{{z}_{A}}}}{{{\text{A}}}^{{{{z}_{{\text{A}}}}}}} + \frac{1}{{{{z}_{{\text{B}}}}}}{{{\bar {B}}}^{{{{z}_{{\text{B}}}}}}}$(2)
$K = \frac{{\bar {a}_{{\text{B}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{B}}}}}}} \right. \kern-0em} {{{z}_{{\text{B}}}}}}}}}}{{\bar {a}_{{\text{A}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{A}}}}}}} \right. \kern-0em} {{{z}_{{\text{A}}}}}}}}}}\frac{{a_{{\text{A}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{A}}}}}}} \right. \kern-0em} {{{z}_{{\text{A}}}}}}}}}}{{a_{{\text{B}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{B}}}}}}} \right. \kern-0em} {{{z}_{{\text{B}}}}}}}}}}$(3)
$\begin{gathered} RT\ln K = - \frac{1}{{{{z}_{{\text{B}}}}}}\bar {\mu }_{{\text{B}}}^{{\text{o}}} - \frac{1}{{{{z}_{{\text{A}}}}}}\bar {\mu }_{{\text{A}}}^{{\text{o}}} + \\ + \;\frac{1}{{{{z}_{{\text{A}}}}}}\mu _{{\text{A}}}^{{\text{o}}} - \frac{1}{{{{z}_{{\text{B}}}}}}\mu _{{\text{B}}}^{{\text{o}}} = - \Delta {{G}^{{\text{o}}}}, \\ \end{gathered} $(4)
${{\left( {\frac{{\partial \ln K}}{{\partial T}}} \right)}_{p}} = \frac{{\Delta {{H}^{{\text{o}}}}}}{{R{{T}^{2}}}}.$Как показано в работах [28, 29], исправленный коэффициент равновесия ионного обмена
(5)
$\tilde {K} = \frac{{\bar {c}_{{\text{B}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{B}}}}}}} \right. \kern-0em} {{{z}_{{\text{B}}}}}}}}}}{{\bar {c}_{{\text{A}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{A}}}}}}} \right. \kern-0em} {{{z}_{{\text{A}}}}}}}}}}\frac{{a_{{\text{A}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{A}}}}}}} \right. \kern-0em} {{{z}_{{\text{A}}}}}}}}}}{{a_{{\text{B}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{B}}}}}}} \right. \kern-0em} {{{z}_{{\text{B}}}}}}}}}}$(6)
$\tilde {k} = \frac{{y_{{\text{B}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{B}}}}}}} \right. \kern-0em} {{{z}_{{\text{B}}}}}}}}}}{{y_{{\text{A}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{A}}}}}}} \right. \kern-0em} {{{z}_{{\text{A}}}}}}}}}}\frac{{a_{{\text{A}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{A}}}}}}} \right. \kern-0em} {{{z}_{{\text{A}}}}}}}}}}{{a_{{\text{B}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{B}}}}}}} \right. \kern-0em} {{{z}_{{\text{B}}}}}}}}}}$(7)
$RT\ln \tilde {K} = - \Delta {{G}_{{\bar {n}}}} + RT\ln \left( {{{\bar {c}_{{\text{B}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{B}}}}}}} \right. \kern-0em} {{{z}_{{\text{B}}}}}}}}} \mathord{\left/ {\vphantom {{\bar {c}_{{\text{B}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{B}}}}}}} \right. \kern-0em} {{{z}_{{\text{B}}}}}}}}} {\bar {c}_{{\text{A}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{A}}}}}}} \right. \kern-0em} {{{z}_{{\text{A}}}}}}}}}}} \right. \kern-0em} {\bar {c}_{{\text{A}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{A}}}}}}} \right. \kern-0em} {{{z}_{{\text{A}}}}}}}}}}} \right),$(8)
$RT\ln \tilde {k} = - \Delta {{G}_{{\bar {n}}}} + RT\ln \left( {{{y_{{\text{B}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{B}}}}}}} \right. \kern-0em} {{{z}_{{\text{B}}}}}}}}} \mathord{\left/ {\vphantom {{y_{{\text{B}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{B}}}}}}} \right. \kern-0em} {{{z}_{{\text{B}}}}}}}}} {y_{{\text{A}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{A}}}}}}} \right. \kern-0em} {{{z}_{{\text{A}}}}}}}}}}} \right. \kern-0em} {y_{{\text{A}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{{\text{A}}}}}}} \right. \kern-0em} {{{z}_{{\text{A}}}}}}}}}}} \right),$(9)
$\begin{gathered} \Delta {{G}_{{\bar {n}}}} = \frac{1}{{{{z}_{{\text{B}}}}}}{{{\bar {\mu }}}_{B}} - \frac{1}{{{{z}_{{\text{A}}}}}}{{{\bar {\mu }}}_{A}} + \frac{1}{{{{z}_{{\text{A}}}}}}\mu _{{\text{A}}}^{{\text{o}}} - \\ - \;\frac{1}{{{{z}_{B}}}}\mu _{{\text{B}}}^{{\text{o}}} = RT\ln \left( {{{a_{{\text{B}}}^{{{{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} {{{{\text{z}}}_{{\text{B}}}}}}} \right. \kern-0em} {{{{\text{z}}}_{{\text{B}}}}}}}}} \mathord{\left/ {\vphantom {{a_{{\text{B}}}^{{{{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} {{{{\text{z}}}_{{\text{B}}}}}}} \right. \kern-0em} {{{{\text{z}}}_{{\text{B}}}}}}}}} {a_{{\text{A}}}^{{{{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} {{{{\text{z}}}_{{\text{A}}}}}}} \right. \kern-0em} {{{{\text{z}}}_{{\text{A}}}}}}}}}}} \right. \kern-0em} {a_{{\text{A}}}^{{{{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} {{{{\text{z}}}_{{\text{A}}}}}}} \right. \kern-0em} {{{{\text{z}}}_{{\text{A}}}}}}}}}}} \right), \\ \end{gathered} $Дифференцированием (7) и (8) по температуре при постоянных давлении и составе ионита получают соотношения, аналогичные уравнению (4) [28, 29]:
(10)
${{\left( {\frac{{\partial \ln \tilde {K}}}{{\partial T}}} \right)}_{{p,\bar {n}}}} = \left( {\frac{{\partial \ln \tilde {k}}}{{\partial T}}} \right) = \frac{{\Delta {{H}_{{\bar {n}}}}}}{{R{{T}^{2}}}},$(11)
$\Delta {{H}_{{\bar {n}}}} = \frac{{R{{T}_{1}}{{T}_{2}}}}{{{{T}_{2}} - {{T}_{1}}}}\ln {{\left( {\frac{{{{{\tilde {K}}}_{{{{T}_{2}}}}}}}{{{{{\tilde {K}}}_{{{{T}_{1}}}}}}}} \right)}_{{\bar {n}}}} = \frac{{R{{T}_{1}}{{T}_{2}}}}{{{{T}_{2}} - {{T}_{1}}}}\ln {{\left( {\frac{{{{{\tilde {k}}}_{{{{T}_{2}}}}}}}{{{{{\tilde {k}}}_{{{{T}_{1}}}}}}}} \right)}_{{\bar {n}}}}.$Термодинамические функции $\Delta {{G}_{{\bar {n}}}}$ и $\Delta {{H}_{{\bar {n}}}}$ более информативны, чем стандартные величины, на что неоднократно указывалось ранее [6, 30], так как они характеризуют обмен ионов на ионите с определенной степенью обмена. Они показывают изменения энергии Гиббса и энтальпии при замещении эквивалента ионов B из раствора на эквивалент иона A из бесконечно большого количества ионита определенного состава, когда ионы A и B в растворе находятся в стандартных состояниях.
Определение $\Delta {{H}_{{\bar {n}}}}$ по уравнению (11), так же как и определение $\Delta {{H}^{{\text{o}}}}$ по изобаре Вант-Гоффа (4), осложнено высокой относительной погрешностью [29, 31–33], которая может достигать десятков и даже сотен процентов при погрешностях величин $\tilde {k}$ порядка 10–15% и T2 – T1 ≈ 20 K. В случае ионного обмена на ионите с очень высокой селективностью изучать дифференциальную энтальпию ионного обмена возможно много точнее [29, 33]. При нагревании суспензии селективного ионита и равновесного с ним раствора смеси электролитов, в котором прочнее сорбируемый ион является микрокомпонентом, в основном изменяется соотношение обменивающихся ионов в растворе, а ионный состав ионита изменяется очень слабо. Такое изменение состава ионита обычно меньше погрешности прямого аналитического определения состава ионита. Это означает, что на селективном ионите $\Delta {{H}_{{\bar {n}}}}$ можно определить значительно точнее только по изменению состава раствора при изменении температуры от T1 до T2
(12)
$\Delta {{H}_{{\bar {n}}}} = \frac{{R{{T}_{1}}{{T}_{2}}}}{{{{T}_{2}} - {{T}_{1}}}}\ln \frac{{{{{\left( {{{a_{{\text{А}}}^{{1/{{z}_{{\text{А}}}}}}} \mathord{\left/ {\vphantom {{a_{{\text{А}}}^{{1/{{z}_{{\text{А}}}}}}} {a_{{\text{В}}}^{{1/{{z}_{{\text{В}}}}}}}}} \right. \kern-0em} {a_{{\text{В}}}^{{1/{{z}_{{\text{В}}}}}}}}} \right)}}_{{{{T}_{2}},\bar {n}}}}}}{{{{{\left( {{{a_{{\text{А}}}^{{1/{{z}_{{\text{А}}}}}}} \mathord{\left/ {\vphantom {{a_{{\text{А}}}^{{1/{{z}_{{\text{А}}}}}}} {a_{{\text{В}}}^{{1/{{z}_{{\text{В}}}}}}}}} \right. \kern-0em} {a_{{\text{В}}}^{{1/{{z}_{{\text{В}}}}}}}}} \right)}}_{{{{T}_{1}},\bar {n}}}}}}.$ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. Подготовка ионитов
Исследовали гелевые карбоксильные полиметакриловые катиониты КБ-4П2 и КБ-4 с 2.5 и 6% сшивающего агента дивинилбензола (ДВБ), гелевый полиакриловый катионит КБ-2э4, сшитый 4% диметакрилатом триэтиленгликоля, макропористые полиакриловые катиониты Пьюролайт C104 и Леватит CNP-80, для которого производители не сообщают содержание сшивающего агента ДВБ.
Ионит в смешанных Са,Na-, Mg,Na- и Ni,Na-формах с заданной долей двухвалентного иона M2+ (Mg2+ или Ni2+) готовили следующим образом. Суспензию ионита в Na-форме делили на две порции с определенными объемами, соотношение которых соответствует требующемуся эквивалентному соотношению M2+ и Na+ в смешанной форме ионита. Первую из этих порций помещали в колонку и переводили в M-форму, пропуская избыток 0.5 н. раствора MСl2, и промывали небольшим количеством воды. После этого две порции ионита в М- и Na-формах вновь соединяли (используя для этого небольшое количество 2.5 н. раствора NaCl) и перемешивали в течение суток для установления одинакового ионного состава отдельных зерен.
Определение энтальпии ионного обмена
Указанный выше подход для определения дифференциальной энтальпии ионного обмена на селективных ионитах можно реализовать в рамках статического и динамического методов, которые описаны в [29, 33]. Определение основано на том, что суспензию ионита в смешанной M, Na-форме заданного состава уравновешивали со смешанным 2.3–2.8 н. раствором NaСl и MСl2 при температуре Т1, а затем температуру последовательно повышали на 10–25 K, каждый раз приводя систему в равновесие и анализируя состав раствора. В некоторых из опытов температура была выше 373 K. В этих случаях проводили статический эксперимент при повышенном равновесном давлении паров воды в герметично закрывающейся толстостенной стеклянной колбе с тефлоновым перекрывающимся капилляром, обеспечивающим отбор проб для анализа.
Также проводили обратные эксперименты с последовательным понижением температуры от достигнутых в конце прямых экспериментов значений до начальных значений через те же самые стадии. Во всех экспериментах при изменении температуры состав ионита изменялся лишь на 0.5–2%, в то время как состав раствора изменялся значительно.
При расчетах коэффициента равновесия, дифференциальной энтальпии и изменения теплоемкости реакции ионного обмена использовали соотношения:
(13)
$\tilde {\tilde {k}} = \frac{{y_{{\text{M}}}^{{1/2}}}}{{y_{{{\text{Na}}}}^{{}}}}\frac{{c_{{{\text{Na}}}}^{{}}}}{{c_{{\text{M}}}^{{1/2}}}},$(14)
$\Delta {{H}_{{\bar {n}}}} = \frac{{R{{T}_{1}}{{T}_{2}}}}{{{{T}_{2}} - {{T}_{1}}}}{{\left[ {\ln \frac{{{{{\left( {{{c_{{{\text{Na}}}}^{{}}} \mathord{\left/ {\vphantom {{c_{{{\text{Na}}}}^{{}}} {c_{{\text{M}}}^{{1/2}}}}} \right. \kern-0em} {c_{{\text{M}}}^{{1/2}}}}} \right)}}_{{{{T}_{2}}}}}}}{{{{{\left( {{{c_{{{\text{Na}}}}^{{}}} \mathord{\left/ {\vphantom {{c_{{{\text{Na}}}}^{{}}} {c_{{\text{M}}}^{{1/2}}}}} \right. \kern-0em} {c_{{\text{M}}}^{{1/2}}}}} \right)}}_{{{{T}_{1}}}}}}}} \right]}_{{\bar {n}}}},$(15)
$\Delta {{С}_{{p,}}}_{{\bar {n}}} = \left( {\frac{{\partial \Delta {{H}_{{\bar {n}}}}}}{{\partial T}}} \right)_{p}^{{}}.$Использование молярных концентраций компонентов в растворе связано с тем, что в выражении для химического потенциала иона, использованного при выводе этих соотношений, в качестве стандартного состояния выбран идеальный раствор с концентрацией 1 моль/дм3 [28, 29]. Но рассчитываемая величина $\Delta {{H}_{{\bar {n}}}}$ имеет размерность Дж/г-экв (или кДж/г-экв) в соответствии с записью реакции ионного обмена, которой соответствуют эти соотношения. Также учитывали, что вклад температурной зависимости отношения коэффициентов активности компонентов в растворе в величину $\Delta {{H}_{{\bar {n}}}}$ очень мал, что было показано в работах [28, 29].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 1 представлены зависимости коэффициентов равновесия обмена ионов Ni2+−Na+ и Mg2+−Na+ от температуры. Достаточно большой разброс значений коэффициента равновесия при одной и той же температуре, превышающий погрешность, составляющую ~15%, связан с тем, что измерения для разных составов ионита проводились в разные годы на разных партиях ионита. Тем не менее, эти данные однозначно демонстрируют такой же значительный рост селективности катионитов полиакрилового и полиметакрилового типов с температурой, о котором сообщалось ранее в наших работах [26, 27] для ионов Ca2+–Na+. Особенно значительное увеличение селективности ионита происходит при температурах выше 373 К. Максимальный рост коэффициента равновесия с температурой наблюдается при обмене ионов Ni2+−Na+, для системы Ca2+−Na+ − менее значительный [27], и наименьший эффект из рассмотренных систем наблюдается при обмене ионов Mg2+−Na+.
Рис. 1.
Зависимости коэффициентов равновесия обмена ионов Ni2+ и Na+ (а), Mg2+ и Na+ (б) от температуры на катионите КБ-4П2. Эквивалентные доли двухзарядного иона в ионите приведены на графиках.

Hа рис. 2 представлены экспериментальные зависимости дифференциальной энтальпии от температуры для обмена ионов Ni2+–Na+ и Mg2+–Na+. Из приведенных данных следует, что на полиметакриловом катионите с повышением температуры дифференциальная энтальпия обмена ионов Ni2+–Na+ линейно возрастает более значительно, чем ионов Сa2+–Na+ [26, 27]. Так, при обмене ионов кальция и натрия в интервале от 273 до 400 K дифференциальная энтальпия возрастала от 4–6 до 22–28 кДж/г-экв, а при обмене ионов Ni2+–Na+ в том же температурном интервале – от 4–6 до 28–34 кДж/г-экв. Дифференциальная энтальпия слабее зависит от ионного состава, чем коэффициент равновесия. В случае обмена ионов Mg2+–Na+ значения дифференциальной энтальпии оказались ниже, но и в этом случае $\Delta {{H}_{{\bar {n}}}}$ достаточно резко возрастала с температурой.
Рис. 2.
Зависимости $\Delta {{H}_{{\bar {n}}}}$ от температуры при обмене ионов Ni2+ и Na+ (а), Mg2+ и Na+ (б) на катионите КБ-4П2. Эквивалентные доли двухзарядного иона в ионите приведены на графиках.

Причины резкого возрастания с температурой селективности карбоксильных ионообменников при обмене однозарядных ионов на двухзарядные с температурой подробно рассматривались нами ранее [34] и были объяснены преобладающей ролью изменения гидратации обменивающихся ионов при переходе из одной фазы в другую.
Зависимости $\Delta {{H}_{{\bar {n}}}}$ от температуры адекватно интерполируются линейными зависимостями, которые свидетельствуют о постоянстве величины $\Delta {{C}_{p}}$ (изменение теплоемкости реакции обмена разнозарядных ионов). Полученные значения $\Delta {{C}_{p}}$ представлены в табл. 1. Все значения $\Delta {{C}_{p}}$ положительные, что способствует более значительному росту коэффициента равновесия с температурой, чем это следовало бы из зависимости (10) при постоянной энтальпии обмена. В работах [19–23] авторы также оценивали значения ${{\Delta }_{r}}{{C}_{p}}$, они также были положительны. Однако, как следует из данных табл. 1, на полиметакриловых и полиакриловых катионитах при обмене разнозарядных ионов значения $\Delta {{C}_{p}}$ значительно выше, чем на сульфокатионите (Дауэкс 50 × 12).
Таблица 1.
Значения $\Delta {{C}_{p}}$ для реакций ионного обмена (С – концентрация раствора, yМ – доля М2+ или М+ ионите)
| Ионит | Обмен | С, М | yМ | ${{\Delta }_{r}}{{C}_{p}}$, Дж/(г-экв K) |
|---|---|---|---|---|
| КБ4-П2* | Са2+–Na+ | 2.4–2.7 | 0.20–0.38 | 190 |
| 0.40–0.54 | 210 | |||
| 0.75–0.82 | 190 | |||
| КБ4* | 0.23–0.26 | 77 | ||
| 0.30–0.37 | 93 | |||
| 0.50–0.56 | 130 | |||
| КБ–2э4* | 0.54–0.58 | 150 | ||
| CNP–80* | 0.68–0.70 | 110 | ||
| C104–FL* | 0.62–0.70 | 130 | ||
| КБ4–П2 | Ni2+–Na+ | 0.18 | 200 | |
| 0.44 | 290 | |||
| 0.51–52 | 260 | |||
| 0.58–0.61 | 180 | |||
| Дауэкс 5012** | K+–Na+ | 0.005 | следовые количества | 4.6 |
| Rb+–Na+ | 1.7 | |||
| Cs+–Na+ | 3.8 | |||
| Bа2+–Н+ | 0.224 | 72 | ||
| Со2+–Н+ | 0.072 | 38 | ||
| Zn2+–Н+ | 0.090 | 42 | ||
| Bа2+–Na+ | 0.256 | 45 |
Теперь оценим роль возрастания дифференциальной энтальпии ионного обмена с температурой в прогнозировании температурной зависимости коэффициента равновесия. Представим зависимость энтальпии ионного обмена от температуры по соотношению Кирхгоффа с постоянным значением ${{\Delta }_{r}}{{C}_{p}}$:
(16)
$\Delta {{H}_{{\bar {n},T}}} = \Delta {{H}_{{\bar {n},{{T}_{1}}}}} + \Delta {{C}_{p}}(T - {{T}_{1}}).$Подставим в (10)
(17)
${{\left( {\frac{{\partial \ln \tilde {\tilde {k}}}}{{\partial T}}} \right)}_{{p,\bar {n}}}} = \frac{{\Delta {{H}_{{\bar {n},{{T}_{1}}}}}}}{{R{{T}^{2}}}} + \frac{{\Delta {{C}_{p}}}}{{R{{T}^{2}}}}(T - {{T}_{1}})$(18)
$\ln \frac{{{{{\tilde {\tilde {k}}}}_{{{{T}_{2}}}}}}}{{{{{\tilde {\tilde {k}}}}_{{{{T}_{1}}}}}}} = \frac{{{{T}_{2}} - {{T}_{1}}}}{{R{{T}_{1}}{{T}_{2}}}} \cdot \Delta {{H}_{{\bar {n},{{T}_{1}}}}} + \frac{{\Delta {{C}_{p}}}}{R}\left( {\ln \frac{{{{T}_{2}}}}{{{{T}_{1}}}} + \frac{{\left( {{{T}_{1}} - {{T}_{2}}} \right)}}{{{{T}_{2}}}}} \right).$Последнее соотношение позволяет оценить влияние температуры ${{T}_{2}}$ на отношение коэффициента равновесия при верхнем и нижнем значениях температурного интервала с учетом зависимости дифференциальной энтальпии ионного обмена от температуры.
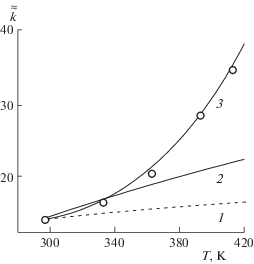
На рис. 3–5 показаны результаты расчетов зависимости коэффициента равновесия от температуры для обмена ионов Ni2+–Na+, Са2+–Na+ и Mg+2–Na+ на катионите КБ-4П2. Расчеты проводили от наименьших экспериментальных значений ${{\tilde {\tilde {k}}}_{{{{T}_{1}}}}}$ при температуре 293–298 К. На этих рисунках зависимости 3 рассчитаны по соотношению (18) с учетом величин $\Delta {{C}_{p}}$, приведенных в табл. 1. Также приведены аналогичные зависимости, рассчитанные при постоянных значениях $\Delta {{H}_{{\bar {n}}}}$, (в соотношении (18) пренебрегли величиной $\Delta {{C}_{p}}$): зависимости 1 рассчитаны при значениях $\Delta {{H}_{{\bar {n}}}}$, соответствующих температуре 293–298 K и зависимости 2 рассчитаны при постоянных значениях $\Delta {{H}_{{\bar {n}}}}$, отвечающих средним величинам для интервала температур 293–333 K. Рассчитывая последние две зависимости, имели в виду, что в ионном обмене при оценке влияния температуры на поведение системы достаточно часто пользуются калориметрическими величинами энтальпии ионного обмена, измеряемыми при температуре ∼293–298 K или средними величинами энтальпии ионного обмена, рассчитываемыми по изобаре Вант-Гоффа из экспериментальных равновесных данных при двух значениях температуры.
Рис. 3.
Зависимости коэффициента равновесия от температуры для реакции обмена ионов Ni2+–Na+ на катионите КБ-4П2 при уNi ∼ 0.45, рассчитанные при постоянных значениях $\Delta {{H}_{{\bar {n}}}}$ = 3.0 (1), и 9.2 кДж/г-экв (2), c учетом зависимости $\Delta {{H}_{{\bar {n}}}}$ от температуры при $\Delta {{C}_{p}}$ = 258 Дж/(г-экв K) (3) и экспериментальные значения (маркеры).

Рис. 4.
Зависимости коэффициента равновесия от температуры для реакции обмена ионов Са2+–Na+ на катионите КБ-4П2 при уCa ∼ 0.5, рассчитанные при постоянных значениях $\Delta {{H}_{{\bar {n}}}}$ = 4.0 (1) и 9.5 кДж/г-экв (2), c учетом зависимости $\Delta {{H}_{{\bar {n}}}}$ от температуры при $\Delta {{C}_{p}}$ = 207 Дж/(г-экв K) (3) и экспериментальные значения (маркеры).

Рис. 5.
Зависимости коэффициента равновесия от температуры для реакции обмена ионов Mg2+–Na+ на катионите КБ-4П2 при уMg ∼ 0.5, рассчитанные при постоянных значениях $\Delta {{H}_{{\bar {n}}}}$ = 1.2 (1) и 3.5 кДж/г-экв (2), c учетом зависимости $\Delta {{H}_{{\bar {n}}}}$ от температуры при $\Delta {{C}_{p}}$ = 115 Дж/(г-экв K) (3) и экспериментальные значения (маркеры).
Видно, что увеличение эндотермичности реакции обмена разнозарядных ионов с температурой на полиметакриловом катионите оказывает очень существенный вклад в возрастание коэффициента равновесия. Зависимости, полученные по соотношению (18) с учетом $\Delta {{C}_{p}}$, хорошо согласуются с экспериментальными данными (представленными на этих же графиках). Полученные результаты показывают, что учитывать температурную зависимость энтальпии ионного обмена в изученных системах наиболее важно в области выше 373 K. Если не учитывать ее (зависимости 1 и 2), то в области “перегретых” растворов прогнозы дают многократно заниженные значения коэффициентов равновесия. Это обстоятельство важно понимать в связи с тем, например, что в хроматографии активно развивается использование перегретых растворов в качестве элюентов [24, 25, 35]. Изученные в настоящей работе ионообменники относятся к группе промышленно производимых и используемых материалов. Их основное назначение – очистка растворов от примесей металлов. Поэтому представленные результаты важны и в этой области.
Список литературы
Толмачев А.М., Горшков В.И. // Журн. физ. химии. 1966. Т. 40. № 8. С. 1924.
Кокотов Ю.А., Пасечник В.А. Равновесие и кинетика ионного обмена. Л.: Химия, 1970. 336 с.
Ионный обмен в химической технологии / Под. Ред. Б.П. Никольского и П.Г. Романкова. Л.: Химия, 1982. 416 с.
Кокотов Ю.А., Золотарев П.П., Елькин Г.Э. Теоретические основы ионного обмена. Л.: Химия, 1986. 270 с.
Солдатов В.С., Бычкова В.А. Ионообменные равновесия в многокомонентных системах. Минск: Наука и техника, 1988. 359 с.
Soldatov V.S. Theory of Ion Exchange. Thermodynamics // In: Ion Exchangers. (Konrad Dorfner, Ed.). Berlin, New York: De Gruyter, 1992. P. 1243–1275.
Grant S.A., Fletcher P. Thermodynamics of Cation Exchange. In: Ion Exchange and Solvent Extraction. A Series of Advances / Ed. by J.A. Marinsky and Y. Marcus. V. 11. New York: Marcel Dekker, 1993. P. 1–108.
Harjula R., Lehto J. // React. Func. Polymers. 1995. V. 27. P. 147.
Харьюла Р., Лето Ю. // Журн. физ. химии. 1996. Т. 70. № 9. С. 1723.
Иванов В.А., Карпюк Е.А. // Сорбционные и хроматографические процессы. 2015. Т. 15. № 1. С. 19.
Lokhande R.S., Singare P.U. // Asian J. Chem. 1998. V. 10. № 6. P. 1026.
Son W.K., Kim S.H., Park S.G. // Bull. Korean Chem. Soc. 2001. V. 22. № 1. P. 53.
Lee I.H., Kuan Y.C., Chern J.M. // J. Chin. Inst. Chem. Eng. 2007. V. 38. № 1. P. 71.
Ibezim-Ezeani M.U., Okoye F.A., Akaranta O. // J. Amer. Chem. Sci. 2012. V. 2. № 1. P. 25.
Singare P.U., Patange A.N. // Int. Lett. Chem., Phys. Astr. 2014. V. 11. № 1. P. 44.
Singare P.U., Patange A.N. // International Letters of Chemistry, Physics and Astronomy. 2014. V. 25. P. 1.
Boyd G.E., Larson Q.V., Lindenbaum S. // J. Phys. Chem. 1968. V. 72. № 7. P. 2651.
Бондарева Л.П., Перегудов Ю.С., Овсянникова Д.В., Астапов А.В. // Сорбционные и хроматографические процессы. 2004. Т. 4. № 5. С. 550.
Bonner O.D., Smith L.L. // J. Phys. Chem. 1957. V. 61. № 12. P. 1614.
Bonner O.D., Pruett R.R. // Ibid. 1959. V. 63. № 9. P. 1417.
Bonner O.D., Pruett R.R. // Ibid. 1959. V. 63. № 9. P. 1420.
Kraus K.A., Raridon R.J. // Ibid. 1959. V. 63. № 11. P. 1901.
Kraus K.A., Raridon R.J., Holcomb D.L. // Chromatogr. 1960. V. 3. № 1. P. 178.
Shibukawa M., Shimasaki T., Saito S., Yarita T. // Anal. Chem. 2009. V. 81. № 19. P. 8025.
Shibukawa M., Taguchi A., Suzuki Y. et al. // Analyst. 2012. V. 137. P. 3154.
Ivanov V., Timofeevskaya V., Gorshkov V., Drozdova N. // J. Radioanalytical and Nuclear Chemistry. 1996. V. 208. № 1. P. 23.
Иванов В.А., Гавлина О.Т., Илюхина Е.А., Горшков В.И. // Журн. физ. химии. 2007. Т. 81. № 11. С. 1927.
Иванов В.А., Тимофеевская В.Д., Горшков В.И. // Там же. 2000. Т. 74. № 4. С. 730.
Иванов В.А., Горшков В.И., Гавлина О.Т., Илюхина Е.А. // Там же. 2007. Т. 81. № 10. С. 1582–1585.
Солдатов В.С. Простые ионообменные равновесия. Минск: Наука и техника, 1972.
Гаммет Л. Основы физической органической химии. М.: Мир, 1972. С. 269.
Васильев В.П. Термодинамические свойства растворов электролитов. М.: Высш. школа, 1982. С. 45.
Иванов В.А., Тимофеевская В.Д., Горшков В.И. и др. // Сорбционные и хроматографические процессы. 2004. Т. 4. № 5. С. 550.
Ivanov V.A., Gorshkov V.I., Timofeevskaya V.D., Drozdova N.V. // Reactive and Functional Polymers. 1998. V. 38. № 2–3. P. 205.
Coym J.W., Dorsey J.G. // Analytical Letters. 2004. V. 37. № 5. P. 1013.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


