Журнал физической химии, 2019, T. 93, № 10, стр. 1517-1521
Обобщенная модель локального состава, ее возможности и ограничения
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: kovalenko@td.chem.msu.ru
Поступила в редакцию 15.03.2019
После доработки 15.03.2019
Принята к публикации 09.04.2019
Аннотация
Рассмотрена возможность применения четырехпараметрической обобщенной модели локального состава (GLCM) для систем разного типа. На основании результатов описания моделью GLCM водно-спиртовых растворов, расслаивающихся водно-органических систем с низкой взаимной растворимостью и растворов макромолекул сделан вывод о возможности модели описывать свойства растворов с явно выраженными отклонениями от идеальности. Показано, что относительно высокая гибкость модели позволяет совместно описывать такие типы данных как парожидкостные и жидкофазные равновесия, равновесия жидкость–кристаллическая фаза, активности компонентов, теплоты смешения и др.
Развитие расчетных методов химической термодинамики последних нескольких десятилетий привело к появлению большого количества термодинамических моделей, которые используются для описания термодинамических свойств фаз и соответственно фазовых равновесий в системах различной природы. Если рассматривать системы, основными компонентами которых являются вода и/или органические растворители, то применительно к ним можно выделить несколько классов термодинамических моделей: полиномиальные модели (модели Маргулеса [1] и Редлиха–Кистера [2]), модели локального состава (модель Вильсона [3], NRTL [4], UNIQUAC [5]), модели групповых вкладов (UNIFAC [6]). Для описания фазовых равновесий с участием жидкой фазы также могут быть использованы уравнения состояния. По-видимому, наиболее часто в последнее время среди них используют PC SAFT [7], а также CPA [8].
К термодинамическим моделям обычно предъявляется ряд требований, в том числе, следующие: 1) возможность описания различных типов экспериментальных данных, 2) предсказательная способность, 3) способность описывать термодинамически согласованные экспериментальные данные с ошибкой, не превышающей ошибку эксперимента, 4) использование наименьшего количества варьируемых параметров, 5) простота математических выражений и др. Зачастую модели удовлетворяют лишь некоторым из перечисленных требований. Это объясняется тем, что даже приведенный выше неполный перечень требований содержит противоречивые позиции. Так, например, высокая предсказательная способность моделей может быть вызвана относительно строгим теоретическим выводом всех необходимых уравнений модели с использованием аппарата статистической термодинамики. С другой стороны, такого рода примеры моделей обычно не обладают “гибкостью”, что приводит к невысокой точности описания данных. Другой пример – высокая точность описания экспериментальных данных, как правило, предполагает наличие в модели относительно большого количества варьируемых параметров, что противоречит пункту 4.
Указанные противоречия обычно приводят к тому, что для разных целей используют разные модели. Например, для прикладных задачах, решение которых должно позволить рассчитать технологическую схему того или иного процесса, первостепенным является точность описания экспериментальных данных. Зачастую это приводит к тому, что авторы определяют различные наборы параметров одной и той же термодинамической модели для описания различных типов экспериментальных данных. Такой подход реализован, например, в программном комплексе ASPEN [9], где для расчета различных фазовых равновесий приводятся разные наборы параметров моделей. В итоге, в зависимости от поставленной цели – расчета условий экстракции, дистилляции или теплового баланса – приходится использовать разные термодинамические модели одного и того же объекта. Основной недостаток такого подхода – отсутствие возможности использования аппарата химической термодинамики, который позволяет связать между собой различные термодинамические функции и разного рода экспериментальные данные.
В результате стало актуальным предложить относительно простую термодинамическую модель, которая могла бы корректно описывать термодинамически согласованные экспериментальные данные разного рода. Возможное решение проблемы – обобщенная модель локального состава, подробно описанная ниже.
ОБОБЩЕННАЯ МОДЕЛЬ ЛОКАЛЬНОГО СОСТАВА
Анализ большинства моделей локального состава позволяет сделать выводы о преимуществах и недостатках каждой из них. Известно [10], что модель Вильсона [3] хорошо себя зарекомендовала для описания парожидкостных равновесий, но не позволяет описывать жидкофазные равновесия. Модель UNIQUAC [5] за счет введения структурных параметров для компонентов позволяет успешно описывать системы с различными размерами частиц, но в случае сильно неидеальных растворов точности модели может быть недостаточно для воспроизведения экспериментальных данных. Одна из наиболее гибких моделей локального состава – модель NRTL [4], но даже она в случае существенных отклонений от идеальности не позволяет совместно описывать данные о фазовых равновесиях и термохимические свойства (например, теплоты смешения). При выводе модели Цубоки–Катаямы [11] авторы применяли концепцию локального состава в выражении для энтальпии смешения раствора, т.е. предполагали, что модель позволит совместно описывать разного рода экспериментальные данные, в том числе и термохимические свойства. Однако, как показала практика, модель Цубоки–Катаямы недостаточно гибкая для сильно неидеальных растворов, а также не всегда хорошо себя проявляет в случае систем, в которых размеры частиц заметно отличаются.
Альтернативой перечисленным моделям может быть обобщенная модель локального состава GLCM (Generalized Local Composition Model) [12]. Избыточная мольная энергия Гиббса для n-компонентного раствора с помощью обобщенной модели локального состава может быть записана следующим образом:
(1)
$\begin{gathered} \frac{{{{G}^{{ex}}}}}{{RT}} = \sum\limits_{i = 1}^n {{{x}_{i}}\ln \frac{{{{\Phi }_{i}}}}{{{{x}_{i}}}} + \frac{z}{2}\sum\limits_{i = 1}^n {{{q}_{i}}{{x}_{i}}\ln \frac{{{{\theta }_{i}}}}{{{{\Phi }_{i}}}}} } + \\ + \;\sum\limits_{i = 1}^n {{{x}_{i}}\ln \left( {\sum\limits_{j = 1}^n {{{x}_{j}}{{\rho }_{{ji}}}} } \right)} - \sum\limits_{i = 1}^n {{{q}_{i}}{{x}_{i}}\ln \left( {\sum\limits_{j = 1}^n {{{\theta }_{j}}{{\tau }_{{ji}}}} } \right)} , \\ \end{gathered} $(2)
$\begin{gathered} {{\theta }_{i}} = \frac{{{{q}_{i}}{{x}_{i}}}}{{\sum\limits_j {{{q}_{j}}{{x}_{j}}} }},\quad {{\Phi }_{i}} = \frac{{{{r}_{i}}{{x}_{i}}}}{{\sum\limits_j {{{r}_{j}}{{x}_{j}}} }}, \\ {{\tau }_{{ij}}} = {{\rho }_{{ij}}}\exp ({{A}_{{ij}}}), \\ \end{gathered} $Выражение (1) сводится к стандартным моделям локального состава UNIQUAC (при ρij= 1), Вильсона (при qi = 1, ri = 1, ρij = 1) и Цубоки–Катаямы (при qi = 1, ri = 1). Обращает на себя внимание большее количество варьируемых параметров в модели GLCM по сравнению с известными моделями локального состава. Если рассматривать бинарную систему, то при заданной температуре количество варьируемых параметров в обобщенной модели локального состава может достигать четырех: A12, A21, ρ12 и ρ21. Для аналогичного случая модели UNIQUAC, Вильсона и Цубоки–Катаямы имеют по два варьируемых параметра, а модель NRTL – три параметра. С одной стороны, избыточное количество параметров в выражении GLCM можно считать недостатком, но с другой – большее количество параметров приводит к тому, что обобщенная модель локального состава по сравнению с большинством стандартных моделей более гибкая. И в случае сильно неидеальных растворов модель GLCM позволяет с более высокой точностью описывать совместно разного рода экспериментальные данные (фазовые равновесия, термодинамические и термохимические свойства раствора).
Однако следует заметить, что для многих систем нет необходимости в использовании всех четырех варьируемых параметров обобщенной модели локального состава. Как известно, один из признаков использования избыточного количества параметров – большие значения рассчитанных ошибок параметров, что свидетельствует о статистической незначимости последних. Если в результате расчета ошибок параметров выясняется, что количество параметров избыточно, в первую очередь рекомендуется редуцировать параметры ρij. Эти параметры могут быть приняты равными единице, либо отношению мольных объемов чистых компонентов i и j, как изначально предлагали авторы модели Цубоки–Катаямы. Оба предложенных варианта приводят к тому, что параметры ρij перестают быть варьируемыми.
Возможны случаи, когда набор из четырех варьируемых параметров модели для бинарной системы избыточный, а из двух – недостаточный. В таких ситуациях рекомендуется использовать параметры ρij, но принять ρij = ρji, т.е. в этом случае выражение для избыточной энергии Гиббса, согласно обобщенной модели локального состава, сводится к трехпараметрическому виду.
Перед тем, как перейти к рассмотрению нескольких примеров использования обобщенной модели локального состава, по-видимому, следует вернуться к вопросу о расчете ошибок параметров. Несмотря на то, что расчет ошибок параметров и служит удобным инструментом для выявления статистически незначимых параметров, можно привести примеры, когда при определении оптимального количества параметров модели можно обойтись без анализа ошибок параметров. Если модель применяется для описания экспериментальных данных при фиксированной температуре, то все варьируемые параметры не зависят от температуры и в этом случае общее количество параметров для бинарной системы не больше четырех. Тогда может быть использован последовательный перебор вариантов модели с различным количеством параметров. Оптимальным в этом случае считается решение, при котором используется минимально возможное количество варьируемых параметров, а точность описания экспериментальных данных не уступает или незначительно уступает решениям с большим количеством параметров. Ситуация значительно меняется, если необходимо описать экспериментальные данные в широком температурном диапазоне. Как показывает практика, в этом случае температурная зависимость каждого из четырех параметров A12, A21, ρ12 и ρ21 может в свою очередь содержать до 4–5 температурных параметров. В такого рода случаях, когда общее количество параметров системы может превышать 10 или 15, выявление статистически незначимых параметров без расчета ошибок параметров становится невозможным.
ПРИМЕРЫ
Система вода–1-бутанол. Водно-спиртовые растворы относятся к группе систем, для которых характерно значительное отклонение от идеального раствора. Если также учесть, что для подавляющего большинства систем H2O–CnH2n + 1OH при n ≥ 4 наблюдается расслаивание раствора, система вода–1-бутанол отлично подходит в качестве тестового объекта для определения возможностей модели. Для системы вода–1-бутанол в литературе представлено достаточно большое количество экспериментальных данных. В настоящей работе параметры обобщенной модели локального состава были определены при обработке экспериментальных данных о парожидкостных и жидкофазных равновесиях, а также энтальпии смешения. Для описания указанного набора экспериментальных данных в достаточно широком температурном диапазоне (273–390 K) единым набором параметров модели GLCM потребовалось использование всех четырех варьируемых параметров модели: A12, A21, ρ12 и ρ21. С учетом зависимости каждого из указанных бинарных параметров от температуры общее количество параметров GLCM для системы вода–1-бутанол составило 14.
В результате можно сделать вывод о том, что в случае достаточно непростой для моделирования системы вода–1-бутанол модель GLCM, в отличие от большинства других моделей, позволяет совместно описывать не только данные о жидкофазных и парожидкостных равновесиях, но и термохимические свойства раствора. О качестве описания можно судить по данным рис. 1. Более детально результаты применения модели GLCM для водно-спиртовых систем представлены в работе [13].
Рис. 1.
Система вода–1-бутанол: а – LLE- и TXY-равновесия (P = 101.325 кПа), линии – расчет (GLCM), символы – экспериментальные данные ($\bigcirc $ – [14], $ \bullet $ – [15]); б – энтальпия смешения при 303.15 K, сплошная линия – расчет (GLCM), пунктирные линии – границы взаимной растворимости компонентов, символы – экспериментальные данные ($ \bullet $ – [16], $\bigcirc $ – [17]).

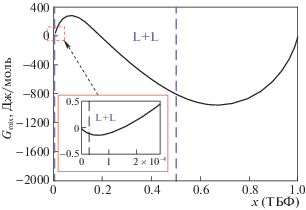
Система вода–трибутилфосфат. В качестве еще одного примера может быть выбрана система вода–трибутилфосфат (ТБФ), которая служит базовой для многих систем, представляющих интерес с точки зрения экстракционных процессов. Для системы вода–ТБФ по сравнению с предыдущим примером в литературе представлено значительно меньше информации о парожидкостных равновесиях, активности компонентов и энтальпии смешения (практически все измерения проводились при 298 K). Однако, жидкофазные равновесия изучены достаточно полно, что должно быть связано с основной сферой применения трибутилфосфата, который обычно используется в качестве экстрагента для экстракционного разделения. Несмотря на достаточно большое внимание, которое исследователи проявляют к системе вода–ТБФ, в литературе не удалось найти ни одной работы (за исключением [12]), где была бы представлена строгая термодинамическая модель, которая бы описывала для исследуемой системы все упомянутые ранее типы экспериментальных данных. В работе [12] была продемонстрирована возможность применения модели GLCM для описания системы вода–ТБФ. Согласно [12], такие распространенные модели растворов, как NRTL, UNIQUAC, Редлиха–Кистера не способны адекватно описать весь необходимый набор экспериментальных данных. Одной из причин неудачного описания может быть крайне низкая растворимость ТБФ в воде (при 320 K содержание ТБФ составляет ∼2 × 10–5 мол. доли). За счет достаточно большой гибкости, которая характерна для GLCM, эта модель позволяет адекватно описать исследуемую систему. На рис. 2 приведена рассчитанная по GLCM зависимость энергии Гиббса смешения от состава для системы вода–ТБФ. Обращает на себя внимание нетривиальное поведение Gmix вблизи чистой воды, именно такая зависимость от состава энергии Гиббса смешения и приводит к достаточно точному описанию низкой растворимости ТБФ в воде.
Рис. 2.
Зависимость энергии Гиббса смешения от состава системы вода–ТБФ, линия – расчет (модель GLCM), T = 298.15 K, пунктир – границы взаимной растворимости компонентов.
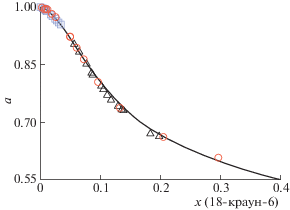
Система вода–18-краун-6. Далеко не каждая термодинамическая модель способна описать термодинамические свойства водных растворов макромолекул. В связи с этим система вода–18-краун-6 может представлять интерес для тестирования обобщенной модели локального состава. Согласно [18], попытки описания концентрационной зависимости воды в водном растворе 18-краун-6 с помощью таких моделей, как NRTL и Редлиха–Кистера, не привели к успеху. Адекватные результаты были лишь получены с помощью модели UNIQUAC. Если учесть, что модель UNIQUAC – частный случай модели GLCM (при ρij = = 1 выражение GLCM становится эквивалентным UNIQUAC), то можно считать, что обобщенная модель локального состава позволяет описывать свойства растворов с различными размерами молекул компонентов. Результат сопоставления расчета по UNIQUAC/GLCM с экспериментальными данными для системы вода–18-краун-6 приведен на рис. 3. Более подробная информация (в том числе и о возможности описания равновесия жидкость–кристаллическая фаза) приведена в работе [18].
Многокомпонентные системы. Как и все модели локального состава, модель GLCM может применяться для описания свойств многокомпонентных растворов. В этом случае обычно используется традиционная методология. Параметры, полученные для систем с меньшим числом компонентов, фиксируются, а для описания экспериментальных данных в системах с большим числом компонентов при необходимости, могут быть использованы дополнительные параметры. Так, в случае трехкомпонентной системы выражение GLCM для избыточной энергии Гиббса c учетом дополнительных тройных параметров τijk записывается следующим образом:
(3)
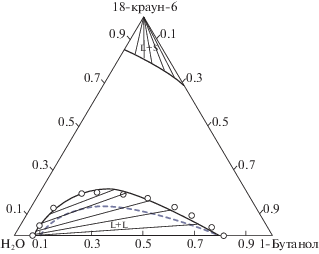
$ - \;q_{1}^{{}}{{x}_{1}}\ln \left( {\sum\limits_{i = 1}^3 {{{\theta }_{i}}{{\tau }_{{i1}}}} + {{\theta }_{2}}{{\theta }_{3}}{{\tau }_{{231}}}} \right) - $В качестве примера тройной системы для тестирования обобщенной модели локального состава может быть выбрана система вода–1-бутанол–18-краун-6. Ранее было показано, что достаточно универсальная модель GLCM позволяет описывать свойства как водно-спиртовых растворов, так и растворов макромолекул. А система вода–1-бутанол–18-краун-6 является как раз комбинацией этих двух типов систем. Результаты описания этой тройной системы обобщенной моделью локального состава приведены на рис. 4. Из данных рис. 4. можно сделать вывод о том, что модель GLCM только лишь на основе полученных для бинарных подсистем параметров неудовлетворительно описывает равновесия жидкость–жидкость в исследуемой тройной системе. В связи с этим потребовалось использование двух (из трех) дополнительных параметров тройного взаимодействия. В результате было получено адекватное описание экспериментальных данных в тройной системе. Более подробная информация о моделировании системы вода–1-бутанол–18-краун-6 приведена в работе [13].
Рис. 4.
Изотермическое (298.15 K) сечение фазовой диаграммы системы вода–1-бутанол–18-краун-6. Сплошная линия – результат расчета (модель GLCM) с использованием параметров тройного взаимодействия, прерывистая линия – расчет (модель GLCM) без учета параметров тройного взаимодействия, символы $\bigcirc $ – экспериментальные данные [21].
Таким образом, достаточно гибкая модель GLCM позволяет единым набором параметров описывать разного рода экспериментальные данные (жидкофазные и парожидкостные равновесия, равновесия жидкость–кристаллическая фаза, активности компонентов, теплоты смешения и др.) в таких достаточно непростых системах, как водно-спиртовые растворы, расслаивающиеся водно-органические системы с крайне низкой взаимной растворимостью, растворы макромолекул.
Работа выполнена в рамках темы “Химическая термодинамика” (АААА-А16-116061750195-2).
Список литературы
Carlson H.C., Colburn A.P. // Ind. Eng. Chem. 1942. V. 34. № 5. P. 581.
Redlich O., Kister A.T. // Ibid. 1948. V. 40. P. 345.
Wilson G.M. // J. Am. Chem. Soc. 1964. V. 86. № 2. P. 127.
Renon H., Prausnitz J.M. // AIChE J. 1968. V. 14. № 1. P. 135.
Abrams D.S., Prausnitz J.M. // Ibid. 1975. V. 21. № 1. P. 116.
Fredenslund A., Jones R.L., Prausnitz J.M. // Ibid. 1975. V. 21. P. 1086.
Gross J., Sadowski G. // Ind. Eng. Chem. 2001. V. 40. № 4. P. 1244.
Kontogeorgis G.M., Voutsas E.C., Yakoumis I.V., Tassios D.P. //. Ibid. 1996. V. 35 № 11. P. 4310.
ASPEN Physical Property System. Physical Property Methods and Model. User Guide, 2006.
Морачевский А.Г., Смирнова Н.А., Пиотровская Е.М. Термодинамика равновесия жидкость–пар. Л.: Химия, 1989.
Tsuboka T., Katayama T. // J. Chem. Eng. Jpn. 1975. V. 8. № 3. P. 181.
Maksimov A.I., Kovalenko N.A. // J. Chem. Eng. Data. 2016. V. 61. № 12. P. 4222.
Коваленко Н.А. Термодинамические свойства и фазовые равновесия в системах, образованных 18-краун-6, водой, пропанолами и бутанолами: Дис. … канд. хим. наук. М.: МГУ, 2013. 126 с.
Maczynski A., Shaw D.G., Goral M., Wisniewska-Goclowska B. // J. Phys. Chem. Ref. Data. 2007. V. 36. № 1. P. 59.
Ellis S.R.M., Garbett R.D. // Ind. Eng. Chem. 1960. V. 52. № 5. P. 385.
Goodwin S.R., Newsham D.M.T. // J. Chem. Thermodyn. 1971. V. 3. № 3. P. 325.
Белоусов В.П., Поннер В. // Вестн. ЛГУ. 1970. № 10. С. 111.
Kovalenko N.A., Pustovgar E.A., Uspenskaya I.A. // J. Chem. Eng. Data. 2013. V. 58. № 1. P. 159.
Gottlieb M., Herskowitz M. // Fluid Phase Equilib. 1984. V. 17. № 1. P. 135.
Patil K., Pawar R., Dagade D. // J. Phys. Chem. A. 2002. V. 106. № 41. P. 9606.
Коваленко Н.А., Головина Н.Б., Богачев А.Г., Успенская И.А. // Журн. физ. химии. 2011. Т. 85. № 9. С. 1688.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии