Журнал физической химии, 2019, T. 93, № 10, стр. 1529-1537
Адсорбционные равновесия в нанопорах кремнеземов с привитыми бромпропильными группами
Т. М. Рощина a, *, Н. К. Шония a, **
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: 2474747@mail.ru
** E-mail: natalyashonija@gmail.com
Поступила в редакцию 15.03.2019
После доработки 15.03.2019
Принята к публикации 09.04.2019
Аннотация
Методом газовой хроматографии исследована зависимость термодинамических характеристик и адсорбции разных классов органических соединений от химической природы поверхности кремнеземов, модифицированных 3-бромпропилтрихлорсиланом с образованием монослойного покрытия (образец Br-2), привитого слоя полимерного типа (образец Br-5), а также дополнительно силанизированного (образец Br-5*). Показано, что дисперсионные взаимодействия на бромокремнеземах проявляются сильнее, чем на исходном носителе или образце NH2 с привитым аминопропильным слоем полимерного типа. Роль специфических взаимодействий, как правило, снижается в ряду: Br-2 > Br-5 > Br-5* > NH2. Анализ полученных данных указывает на то, что механизм удерживания на кремнеземах с бромпропильными группами определяется проникновением адсорбированных молекул в привитой слой. В противоположность этому, полимерный аминопропильный слой обладает более жесткой структурой с ограниченной конформационной подвижностью привитых аминопропильных групп, и в этом случае, доминирует адсорбционный механизм удерживания.
Химическое модифицирование поверхности различных оксидов, включая нанопористые кремнеземы, относится к незаменимым методам создания новых материалов, применяемых в различных вариантах современной хроматографии, сорбции, катализе и в других областях [1, 2]. В случае необходимости синтеза на поверхности привитых соединений сложного строения с помощью проведения ряда последовательных химических превращений в поверхностном слое (методом поверхностной сборки) в качестве предшественников используют ограниченное число силанов, содержащих реакционноспособную концевую функциональную группу, при этом к наиболее распространенным относятся аминоалкил- и бромалкилсиланы [2, 3].
Считают [2, 3], что методом поверхностной сборки можно привить практически любое соединение. Однако, несмотря на большие синтетические возможности метода поверхностной сборки, протекание последовательных химических реакций со 100% селективностью является скорее исключением, чем правилом. Поэтому целенаправленный синтез сложных конечных продуктов химического модифицирования требует систематического изучения свойств поверхности не только исходного носителя, но и полученного на его основе химически модифицированного кремнезема-прекурсора для дальнейшего модифицирования.
Исследованию физико-химических характеристик поверхности аминокремнеземов с помощью разнообразных методов, включая ИК-спектроскопию и ЯМР, посвящены многочисленные работы [2, 4]. Отмечено [2, 4], что в случае сорбентов с привитыми аминосоединениями имеет место организация так называемой арочной структуры привитого слоя за счет взаимодействия NH2-групп с силанолами поверхности кремнезема, что влияет на их протолитические и комплексообразующие характеристики, уменьшает доступность и реакционную способность привитых групп, изменяет однородность и полярность поверхности. Проведенное в [5, 6] систематическое исследование кремнеземов с химически привитым аминопропильным покрытием полимерного типа методом газовой хроматографии показало, что независимо от характеристик исходного носителя могут быть получены аминокремнеземы с близкими адсорбционными свойствами и достаточно однородной поверхностью в случае формирования плотного модифицирующего слоя с концентрацией привитых групп более 4 нм–2. Приведен целый ряд примеров применения аминокремнеземов для исследования взаимосвязей между строением адсорбированных молекул и характеристиками их удерживания, а также для разделения высокополярных и реакционноспособных соединений, в том числе органических оснований.
На основе бромалкилкремнеземов были получены сорбенты для лигандообменной хроматографии, разделения энантиомеров, выделения и очистки ферментов, а также энантиоселективные и металлокомплексные катализаторы [2, 7–12]. Применение 3‑бромпропилтрихлорсилана обеспечило надежное связывание со стенками кварцевого капилляра сверхсшитого полимера на основе винилпиридина, предложенного в [13] в качестве стационарной фазы для капиллярной электрохроматографии.
Использование бромалкилкремнеземов позволяет проводить синтез в более мягких условиях по сравнению с хлоралкилкремнеземами и нередко с лучшим выходом [2, 4]. К положительным моментам применения 3-бромпропилтрихлорсилана относятся высокая плотность прививки модификатора и возможность проведения дополнительной силанизации с помощью простых агентов, в частности, триметилхлорсилана, что может благоприятно сказываться на свойствах полученных на основе бромокремнеземов материалов с привитыми соединениями сложного строения и облегчает предсказание их адсорбционной и каталитической активности.
Несмотря на широкий спектр практического применения, сведения о поверхностных свойствах привитых бромалкилсиланов до сих пор относятся к малоизученной области. Краткая аннотация наших работ [14, 15], посвященных изучению кремнеземов с бромпропильными покрытиями, приведена в [2, с. 397].
В работе представлены результаты исследования свойств поверхности нанопористых кремнеземов, модифицированных 3‑бромпропилтрихлорсиланом с образованием монослойного покрытия и привитого слоя полимерного типа, а также обобщение закономерностей, связывающих природу привитых функциональных групп, в основном бром- и аминопропильных, и термодинамические характеристики адсорбции (ТХА).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования
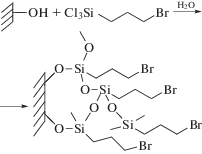
Носитель – кремнезем SiO2 с эффективным радиусом пор 20 нм и удельной поверхностью sуд 97 м2/г [16], относящийся к мезопористым адсорбентам. Химически модифицированные кремнеземы (ХМК) синтезированы в ЗАО “БиоХимМак СТ” с использованием трифункционального модификатора 3-бромпропилтрихлорсилан, что обычно обеспечивает существование в составе привитого покрытия дополнительных гидроксилов у якорного атома кремния, принадлежащего модификатору.
Синтез образца Br-2 с монослойным покрытием (концентрация привитых групп N ≈ 2 нм–2) проводили в безводных условиях (на первой стадии) по следующей схеме:
Образец Br-5 (концентрация привитых групп N ≈ 4.9 нм–2) получали в присутствии воды:
В этом случае молекулы модификатора взаимодействуют как с поверхностью кремнезема, так и между собой с образованием привитого слоя полимерного типа.
Образец Br-5* представляет собой Br-5, дополнительно обработанный триметилхлорсиланом (ТМС).
С целью анализа влияния природы функциональной группы на ТХА использованы известные [5, 6] и новые данные для образца аминокремнезема NH2 с привитым слоем полимерного типа (N ≈ 4.7 нм–2), полученного модифицированием SiO2 3-аминопропилтриэтоксисиланом.
Методы
Величины удельной поверхности sуд образцов рассчитаны методом БЭТ из изотерм адсорбции азота (площадка молекулы 0.162 нм2), измеренных на сорбтометре ASAP-2020 Micromeritics при 77 К. Кроме этого для оценки значений $s_{{{\text{уд}}}}^{*}$ ХМК использовано уравнение, подобное приведенному в [2]:
где $s_{{{\text{уд}}}}^{0}$ – удельная поверхность исходного носителя, m – массовая доля привитого слоя в ХМК.Газохроматографические исследования выполнены на хроматографе “Хром-5” с пламенно-ионизационным детектором и со стеклянными колонками (длина 0.6–0.8 м и внутренний диаметр 2.5 мм); в качестве газа-носителя использовали гелий (расход газа 15–35 мл/мин). Перед измерениями образцы прогревали в токе гелия при температуре 453 К в течение 30 ч.
В качестве тестовых молекул использовали н‑алканы, адамантан, транс-декалин, ароматические углеводороды, кислород- и азотсодержащие соединения (“х.ч.”). Пробы веществ вводили 3–6 раз в виде паро-воздушных смесей в количестве 0.1–0.2 мл. “Мертвое” время определяли по метану [17].
Константы Генри адсорбционного равновесия КГ и индексы удерживания Ковача I рассчитывали из газохроматографических (ГХ) параметров по формулам, приведенным в [1, 17].
При определении термодинамических характеристик адсорбции использовали следующие стандартные состояния вещества: 1 мкмоль/см3 в газовой фазе и 1 мкмоль/м2 в адсорбированном состоянии [1, 17].
Начальные дифференциальные мольные теплоты адсорбции q и стандартные энтропии адсорбции ΔS° (в области Генри) определены из температурной зависимости KГ в интервале от 372 до 423 К с шагом 4–5 К по уравнению [1, 17]:
Для всех тестовых соединений погрешность экспериментального определения термодинамических характеристик адсорбции не превышала 5%.
Вклад СН2-групп в величины ln KГ ($\ln {{K}_{{\text{Г}}}}({\text{C}}{{{\text{H}}}_{2}})$) и в q (${{q}_{{{\text{С}}{{{\text{Н}}}_{2}}}}}$) для н‑алканов рассчитывали по уравнениям [1, 18]:
где n – число атомов углерода в молекуле н‑алкана, а и a' – величины, отвечающие вкладу двух атомов Н в lnKГ и q соответственно.Вклады специфического взаимодействия оценивали согласно уравнению [1, 19]:
где ΔG° – энергия Гиббса адсорбции и ΔGd – энергия дисперсионных сил исследуемого соединения, равная значению ΔGd реального или гипотетического н-алкана с той же поляризуемостью.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Согласно данным по адсорбции азота модифицирование 3-бромпропилтрихлорсиланом почти не влияет на величины sуд (м2/г) образцов, рассчитанные по БЭТ: для Br-2 sуд = 106, для Br-5 sуд = 95. Рассчитанные по уравнению (1) значения $s_{{{\text{уд}}}}^{*}$ на 10% ниже. В случае аминопропилкремнезема NH2sуд = 71, а $s_{{{\text{уд}}}}^{*}$ = 89. Известную сложность представляет собой выбор значения площадки молекулы для химически модифицированных поверхностей [20, 21]. Однако различия в значениях sуд (использовали в расчетах) и $s_{{{\text{уд}}}}^{*}$ не оказали влияния на интерпретацию результатов нашей работы. Модифицирование сопровождается обычным снижением константы С уравнения БЭТ: 100 на исходном носителе SiO2, а на образцах Br-2, Br-5 и NH2: 59, 55 и 44 соответственно.
ТХА линейных алканов, взаимодействие которых с поверхностью определяется преимущественно дисперсионными силами, представлены на рис. 1–3. Показано, что образование на поверхности бромпропильного слоя приводит к существенному увеличению констант Генри КГ и теплот адсорбции q по сравнению с исходным носителем. При этом КГн-алканов почти не изменяются при переходе от образца с монослойным покрытием Br-2 к бромокремнезему Br-5 с привитым слоем полимерного типа, толщина которого примерно равна двум “монослоям”. Дополнительная силанизация триметилхлорсиланом приводит к небольшому снижению (на ≈ 20%) КГн‑алканов на образце Br-5*, но эти величины остаются много выше, чем на исходном носителе и тем более, на низкоэнергетическом кремнеземе [22], модифицированном ТМС (рис. 1). КГ всех тестовых соединений на образце, содержащем на поверхности только триметилсилильные группы, почти на порядок ниже, чем на бромокремнеземах [22]. Следовательно, сильные дисперсионные взаимодействия с привитыми бромпропильными радикалами компенсируют эффект уменьшения количества доступных для адсорбции силанольных групп после дополнительной силанизации. Теплоты адсорбции н-алканов (рис. 2), как и вклады в теплоту адсорбции СН2-групп, на образцах с привитым бромпропильным слоем полимерного типа близки (${{q}_{{{\text{С}}{{{\text{Н}}}_{2}}}}}$ = 6 кДж/моль) и, как и КГ, выше, чем на исходном носителе (${{q}_{{{\text{С}}{{{\text{Н}}}_{2}}}}}$ = = 4.3 кДж/моль [16]). Сопоставление стандартных энтропий адсорбции показывает, что ΔS° снижаются после модифицирования 3‑бромпропилтрихлорсиланом, что для Br-5* выражено сильнее (рис. 3).
Рис. 1.
Зависимости ln KГ от числа атомов углерода n в молекулах н‑алканов при 403 К на исходном и модифицированных кремнеземах.

Рис. 3.
Зависимости стандартных энтропий адсорбции ΔS° от числа атомов углерода n в молекулах н‑алканов.

Полученные результаты позволяют предположить, что определенное значение в механизме удерживания на бромсодержащих ХМК играет проницаемость привитого слоя для адсорбирующихся молекул. Это обеспечивает, во-первых, рост значений теплоты адсорбции после модифицирования за счет дополнительных боковых взаимодействий с привитыми группами и, во-вторых, снижение энтропии адсорбции вследствие уменьшения подвижности молекул, “растворяющихся” в слое модификатора.
Формирование на поверхности аминопропильного слоя полимерного типа практически не влияет на ТХА молекул, способных только к дисперсионным взаимодействиям: КГ, q и ΔS° н-алканов почти не изменяются при переходе от SiO2 к аминокремнезему (рис. 1–3). На первый взгляд сохранение величин КГ и q после модифицирования аминосиланом можно объяснить, если учесть, что дополнительные гидроксилы у атома кремния, образующиеся при модифицировании кремнезема трифункциональным силаном, способны принимать весьма активное участие в дисперсионном взаимодействии. Похожие результаты наблюдались и на привитых слоях, полученных с помощью трифункциональных октил- и перфторгексилсиланов [22, 23]. Однако необходимо принять во внимание, что привитые аминосоединения могут формировать арочную структуру привитого слоя за счет взаимодействия NH2-групп с остаточными и/или вновь образованными силанолами поверхности, что уменьшает участие в адсорбционном процессе обоих типов групп.
Особенности адсорбционных равновесий на бромпропилкремнеземах можно объяснить, если учесть, что поляризуемость атома брома почти в два раза выше, чем амино- и, тем более, ОН группы (например, 6 × 10–3, 4 × 10–3 , 4.4 × 10–3 и 3.3 × × 10–3 нм3 для CH3Br, CH3NH2, CH3CH3 и СН3ОН соответственно [24]).
На основании наших данных можно, в первом приближении, объяснить сильное нековалентное связывание белков поверхностью аффинных сорбентов, полученных при использовании в качестве предшественников бромокремнеземов [12]. Главная причина этого, на наш взгляд, заключается в высоком дисперсионном потенциале поверхности с привитыми бромпропильными группами, что способствует усилению гидрофобных взаимодействий.
Для обсуждения возможного механизма удерживания в системах с участием модифицированных кремнеземов и насыщенных углеводородов исследовали адсорбционные равновесия в системах с участием молекул с одинаковым числом атомов углерода, но с различным пространственным строением: адамантан (AД), транс‑декалин (Д) и декан (С10). Данные по индексам Ковача, теплотам и энтропиям адсорбции для АД и Д приведены в табл. 1. Как и в случае н‑алканов, q циклических соединений уменьшаются в следующем порядке: Br-5* > Br-5 > SiO2 ≈ NH2, а ΔS° увеличиваются в противоположном направлении: Br-5* < < Br-5 < SiO2 ≈ NH2.
Таблица 1.
Индексы удерживания Ковача (I) при 403 К, теплоты (q, кДж/моль) и энтропии адсорбции (ΔS°, Дж/(моль К))
| Параметр | SiO2 | NH2 | Br-5 | Br-5* |
|---|---|---|---|---|
| Адамантан | ||||
| I | 969 | 980 | 1013 | 1052 |
| q | 42.3 | 41.5 | 51.9 | 55.1 |
| –ΔS° | 126 | 123 | 136 | 144 |
| транс-Декалин | ||||
| I | 975 | 995 | 1012 | 1039 |
| q | 42.1 | 42.8 | 52.8 | 55.2 |
| –ΔS° | 125 | 124 | 139 | 145 |
Известно, что отдельные звенья циклических молекул AД и Д удалены от поверхности раздела газ–твердое тело. Поэтому на плоской поверхности, например, на графитированной термической саже ГТС [16], AД и Д удерживаются намного слабее, чем С10, молекула которого в наиболее выгодной для взаимодействия конформации может контактировать с поверхностью всеми звеньями. Адамантан выходит из колонки с ГТС почти вместе с гептаном – I(АД) = 690, а транс-декалин раньше нонана I(Д) = 870. На SiO2 С10 также адсорбируется сильнее, чем циклические соединения, однако различия в индексах Ковача AД и Д малозаметны (табл. 1). Сказанное иллюстрирует рис. 4, где результаты представлены в наглядном и компактном виде как температурные зависимости отношений констант Генри циклических углеводородов и декана. Вероятно, это связано с особенностями молекулярной топографии (шероховатостью, кривизной) поверхности аморфных кремнеземов, образованной беспорядочно расположенными кремний-кислородными тетраэдрами. На бромокремнеземах порядок выхода иной: циклические углеводороды выходят позже декана. Подобная картина наблюдается и при растворении в жидких фазах, например, на метилсилоксане OV-1 I(АД) = 1103, а I(Д) = 1056 [16]. Определяющим фактором в удерживании на жидких фазах является уменьшение давления насыщенных паров АД и Д (~9 кПа и 16.8 кПа при 403 К соответственно) по сравнению с деканом (28.3 кПа при 403 К), а форма и размер молекулы оказывают лишь второстепенное влияние. Вероятно, на бромокремнеземах предпочтителен абсорбционный механизм удерживания. Можно предположить, что увеличение относительных параметров циклических соединений (табл. 1, рис. 4), при переходе от образца Br-5 к Br-5* связано с уменьшением влияния адсорбционного поля поверхности кремнезема, к которому приводит дополнительное силанизирование, и, вероятно, привитой слой становится менее структурированным.
Рис. 4.
Зависимости $\ln K_{{\text{Г}}}^{{{\text{отн}}}}$ от обратной температуры; АД – $K_{{\text{Г}}}^{{{\text{отн}}}}$ = КГ (адамантан)/КГ (декан) – пунктирные линии со стрелками; Д – $K_{{\text{Г}}}^{{{\text{отн}}}}$ = КГ (транс-декалин)/КГ (декан) – сплошные линии.
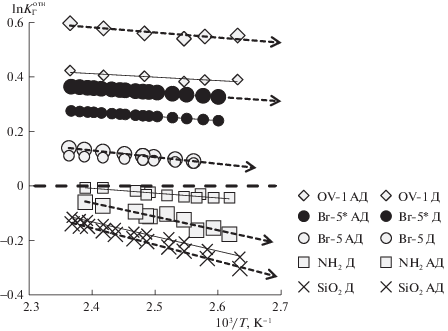
К особенностям аминокремнезема в сравнении с ранее исследованными ХМК [16] относится то, что циклические соединения удерживаются на этом образце во всей области исследованных температур слабее декана, что напоминает закономерности адсорбции AД и Д на твердой поверхности исходного носителя (табл. 1, рис. 4). Возможно, вследствие того, что аминопропильные радикалы могут взаимодействовать с остаточными силанольными группами поверхности с образованием так называемых арочных структур, снижается подвижность привитых групп и модифицирующий слой становится более “жестким”.
Следует учесть, что линейные зависимости ln КГ для н-алканов от числа атомов углерода в молекуле в ряду семи гомологов c коэффициентом корреляции R > 0.999 (рис. 1.) и, следовательно, аддитивность вклада метиленового звена, дают возможность вполне обоснованно утверждать, что н-алканы, в том числе декан, взаимодействуют с поверхностью кремнезема или с привитыми слоями всеми звеньями.
Таким образом, анализ полученных результатов указывает на то, что в механизме удерживания на кремнеземах с бромпропильными группами существенное значение имеет проникновение адсорбированных молекул в привитой слой. В противоположность этому, полимерный аминопропильный слой обладает более жесткой структурой с ограниченной конформационной подвижностью привитых аминопропильных групп, и в этом случае, по видимому, доминирует адсорбционный механизм удерживания.
Существует достаточно большой набор подходов, позволяющих оценить с помощью метода газовой хроматографии “полярность” поверхности материалов, т.е. вкладов электростатических и донорно-акцепторных взаимодействий, образования водородной связи в сорбцию и, следовательно, их селективность к разным классам органических соединений. В табл. 2 для некоторых из исследованных тестовых соединений представлены вклады специфического взаимодействия ΔGsp в стандартную энергию Гиббса адсорбции на исходном носителе, бромо- и аминокремнеземах. Там же для сравнения приведены данные на еще двух признанных неполярных адсорбентах – кремнеземах, модифицированных октилтрихлорсиланом [22], с близкой для функциональных ХМК плотностью прививки октильных групп – образце С8 (N ≈ 4.4 нм–2) и образце с дополнительной силанизацией С8*.
Таблица 2.
Вклады специфического взаимодействия в энергию Гиббса адсорбции –ΔGsp (кДж/моль) при 403 К
| Соединение | SiO2 | Br‑2 | Br‑5 | Br‑5* | NH2 | С8 | С8* |
|---|---|---|---|---|---|---|---|
| Бензол | 5.1 | 3.6 | 3.3 | 3.0 | 3.2 | 3.3 | 1.5 |
| Толуол | 5.7 | 3.9 | 3.6 | 3.3 | 3.2 | 3.6 | 1.5 |
| Этилбензол | 5.7 | 3.9 | 3.6 | 3.2 | 3.1 | 3.5 | 1.4 |
| Диэтиловый эфир | 14.5 | 11.1 | 9.2 | 5.6 | 2.2 | 7.4 | 2.8 |
| Этилацетат | 17.7 | 13.8 | 12.2 | 10.8 | 5.5 | 10.1 | 4.6 |
| 2-Метилпропан-2-ол | 13.5 | 11.9 | 9.9 | 8.0 | 10.4 | 3.9 | |
| Ацетонитрил | 18.1 | 14.3 | 13.3 | 13.5 | 10.2 | 13.5 | 11.9 |
| Нитрометан | 9.8 | 8.6 | 8.05 | 8.23 | 7.76 | ||
| Тетрагидрофуран | 14.0 | 12.9 | 5.7 | ||||
| Диоксан | 18.7 | 16.5 | 15.0 | 7.35 | |||
| Метилэтилкетон | 18.2 | 14.7 | 13.3 | 12.3 | 11.4 | 6.9 |
В целом значения –ΔGsp уменьшаются при модифицировании SiO2, что связано с замещением и экранированием силанольных групп поверхности кремнезема. В группе бромокремнеземов самые низкие значения –ΔGsp, как правило, наблюдаются на Br-5*. Полярность поверхности Br-5* выше, чем аминокремнезема, что отвечает изменению дипольных моментов μ молекул аналогичных производных алканов: μ (1-Br-пропана) = 1.9 D, μ (1-аминопропана) = 1.3 D [25]. При этом бромпропильные группы, в отличие от аминогрупп (нуклеофилов), обладают достаточно сильными электрофильными свойствами. Этот фактор способен влиять на величины –ΔGsp молекул с выраженной донорной способностью. Например, при переходе от аминокремнезема к образцу Br-5* –ΔGsp диэтилового эфира, диоксана и тетрагидрофурана растут более чем в 2 раза, в то время как для спиртов различаются всего в 1.2 раза. Аналогичным образом изменяются индексы Ковача I, самой популярной оценке характеристик неподвижных фаз для ГХ (табл. 3): на Br-5* они выше, чем на NH2 на 120–300 ед. для простых эфиров, а для спиртов всего на ≈30 ед.
Таблица 3.
Индексы удерживания Ковача (I) при 403 К
| Соединение | Br-2 | Br-5 | Br-5* | NH2 |
|---|---|---|---|---|
| Бензол | 673 | 664 | 652 | 683 |
| Толуол | 794 | 783 | 772 | 795 |
| Этилбензол | 893 | 883 | 872 | 892 |
| Диэтиловый эфир | 921 | 842 | 689 | 568 |
| Этилацетат | 1038 | 968 | 922 | 703 |
| 2-Метилпропан-2-ол | 1021 | 952 | 876 | 841 |
| Пропан-2-ол | 960 | 877 | 845 | 814 |
| Ацетонитрил | 812 | 776 | 798 | 718 |
| Нитрометан | 726 | 705 | 722 | 753 |
| Тетрагидрофуран | 997 | 966 | 672 | |
| Диоксан | 1151 | 1098 | 799 |
К неожиданным характеристикам аминокремнезема относится понижение –ΔGsp по сравнению с октилкремнеземом С8, т.е. с образцом с неполярными привитыми группами. Единственной причиной этого явления может быть активное взаимодействие NH2-групп с силанолами исходного носителя и/или дополнительными SiOH-группами, что снижает степень участия в адсорбционном процессе обоих типов групп и приводит к созданию более плотного покрытия. Как и для октилкремнеземов, дополнительная силанизация бромокремнезема как правило сопровождается уменьшением –ΔGsp: на Br-5 > Br-5*.
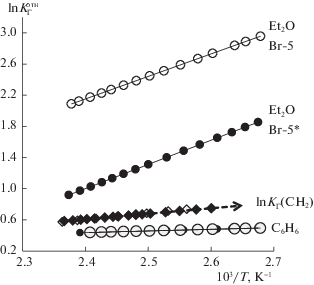
Дополнительная силанизация давно считается приемом, способствующим улучшению качества сорбентов, в частности химической однородности их поверхности. Так, октилкремнезем С8* с дополнительной силанизацией в отношении многих исследованных соединений обладает наиболее неполярной поверхностью. Однако только в немногочисленных работах приводятся количественные адсорбционные данные, подтверждающие эффективность этого процесса [2, 22, 26–28]. В связи с этим подробнее остановимся на сравнении констант Генри ряда соединений, измеренных в широком интервале температур, на образцах Br-5 и Br-5*.
Сопоставление температурных зависимостей относительных констант Генри $\ln K_{{\text{Г}}}^{{{\text{отн}}}}$ для молекул со сравнительно близкими размерами и поляризуемостями, включая такие традиционные пары, как бензол-гексан или диэтиловый эфир-пентан [1, 20, 28], дало возможность охарактеризовать роль π-связей или водородных связей в межмолекулярных взаимодействиях (рис. 5). Показано, что дополнительная силанизация существенно снижает $\ln K_{{\text{Г}}}^{{{\text{отн}}}}$ для пары диэтиловый эфир–пентан на Br-5* по сравнению с Br-5, что обусловлено замещением и экранированием силанольных групп как исходного носителя, так и дополнительных SiOH-групп, образовавшихся в результате гидролиза непрореагировавших атомов Cl при модифицировании 3-бромпропилтрихлорсиланом. При этом дополнительная силанизация почти не оказывает влияние на величины $\ln K_{{\text{Г}}}^{{{\text{отн}}}}$ для пары бензол-гексан. Интересно, что вклады метиленовых звеньев в адсорбцию ln КГ (CH2), согласно которым принято оценивать энергию дисперсионных сил, близки на этих образцах, но выше, чем ${\text{ln}}K_{{\text{Г}}}^{{{\text{отн}}}}$ для пары бензол–гексан.
Рис. 5.
Зависимости вкладов метиленовых звеньев в адсорбцию ln КГ (CH2) и $\ln K_{{\text{Г}}}^{{{\text{отн}}}}$ от обратной температуры на Br-5 и Br-5*; Et2O – $K_{{\text{Г}}}^{{{\text{отн}}}}$ = КГ (диэтиловый эфир)/КГ (пентан); С6Н6 – $K_{{\text{Г}}}^{{{\text{отн}}}}$ = КГ (бензол)/КГ (гексан).
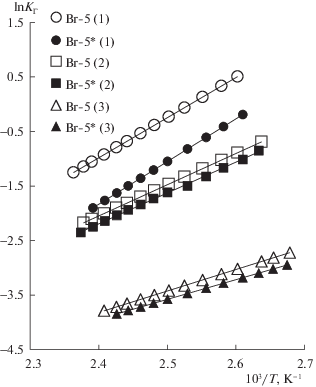
Величины КГ для 2-метилпропан-2-ола (рис. 6), как и для диэтилового эфира, заметно падают после дополнительной силанизации, поскольку для этих молекул преобладающую роль играет сильное взаимодействие по типу образования водородных связей с остаточными силанольными группами поверхности (число которых снижается после дополнительной силанизации ТМС). Иная картина наблюдается при изучении адсорбции ацетонитрила (рис. 6). Дополнительная силанизация приводит только к едва заметному снижению (на ≈5%) КГ ацетонитрила, что напоминает данные для алканов, например, пентана (рис. 6), и к изменению порядка выхода диэтилового эфира и ацетонитрила на образце Br-5* по сравнению с Br-5. Как видно из табл. 3, на Br-5* ацетонитрил адсорбируется сильнее диэтилового эфира. Это можно объяснить, если учесть, что ацетонитрил способен к более сильным электростатическим взаимодействиям (дипольный момент μ(CH3CN) = = 3.9D), чем диэтиловый эфир (μ = 1.1D), с полярными бромпропильными группами. Следовательно, адсорбция ацетонитрила на бромокремнеземах преимущественно происходит на бромпропильных звеньях, а не на SiOH-группах. Аналогичные результаты наблюдаются при сравнении I нитрометана (μ = 3.5D), которые, в отличие, например, от спиртов, растут после обработки бромокремнезема ТМС (табл. 3).
Рис. 6.
Зависимости lnКГ от обратной температуры для 2-метилпропан-2-ола (1), ацетонитрила (2) и пентана (3).
Таким образом, модифицирование бромпропилсиланом, увеличение плотности привитого слоя и дополнительная силанизация в большинстве случаев снижает вклад специфических взаимодействий в ряду SiO2 > Br-2 > Br-5 > Br-5*. Однако эта закономерность нарушается для молекул с большим дипольным моментом, что показано на примере ацетонитрила и нитрометана. Значения –ΔGsp и I подрастают на Br-5* в сопоставлении с Br-5 (табл. 2, 3).
Остановимся на некоторых моментах, связанных с применением кремнеземов с привитым бромпропильным покрытием в аналитической хроматографии. К важным свойствам бромокремнеземов Br-5 и Br-5* с пленкой модификатора полимерного типа относится то, что на них наблюдаются симметричные хроматографические пики практически всех исследованных полярных соединений. Следовательно, на практике вполне допустимо использование более дешевого (без дополнительного силанизирования) адсорбента с привитыми бромпропильными группами. Br-5 обладает достаточно высокой селективностью разделения веществ с близкими физико-химическими свойствами [14]. Термостойкость бромокремнеземов не менее 473 К, нелетучесть, стабильность при хранении не менее 5 лет предполагают возможность применения 3-бромпропилтрихлорсилана для приготовления насадочных и капиллярных колонн для ГХ со сравнительно высокой полярностью.
Таким образом, обобщение полученных результатов указывает на существенные различия в свойствах поверхности бромо- и аминокремнеземов, что представляет интерес с точки зрения предсказания адсорбционной и каталитической активности материалов, полученных на основе таких ХМК. В целом, к преимуществам кремнеземов с привитым слоем полимерного типа по сравнению с монослойным покрытием относится, во-первых, существенное снижение доступности остаточных силанольных групп и, во-вторых, возможность реализации более высокого выхода в процессах синтеза привитых соединений сложного строения за счет увеличения концентрации реакционноспособных центров на поверхности предшественника, что способствует решению задач синтеза сорбентов и катализаторов с заданными свойствами.
Список литературы
Киселев А.В. Межмолекулярные взаимодействия в адсорбции и хроматографии. М.: Высш. школа, 1986. 360 с.
Химия привитых поверхностных соединений / Под ред. Лисичкина Г.В. М.: Физматлит, 2003. 592 с.
Лисичкин Г.В. Химическое модифицирование твердых поверхностей // Современное естествознание. Энциклопедия. М.: Наука, Флинта, 1999. Т. 1. С. 206.
Тертых В.А., Белякова Л.А. Химические реакции с участием поверхности кремнезема. Киев: Наукова думка, 1991. 264 с.
Roshchina T.M., Davydov V.Y., Khrustaleva N.M. et al. // Adsorpt. Sci. Technol. 1997. V. 15. № 3. C. 147.
Давыдов В.Я., Рощина Т.М., Хрусталева Н.М., Мандругин А.А. // Журн. физ. химии. 1993. Т. 67. № 12. С. 2428.
Даванков В.А., Навратил Дж., Уолтон Х. Лигандообменная хроматография. М.: Мир, 1989. 294 с.
Кудрявцев Г.В., Бернадюк С.З., Лисичкин Г.В. // Успехи химии. 1989. Т. 58. № 4. С. 684.
Кротов В.В., Староверов С.М., Нестеренко П.Н., Лисичкин Г.В. // Журн. общ. химии. 1986. Т. 56. № 11. С. 2460.
Кротов В.В., Староверов С.М., Нестеренко П.Н., Лисичкин Г.В. // Там же. 1987. Т. 57. № 5. С. 1187.
Мингалев П.Г. Взаимосвязь структуры и аффинных свойств кремнеземных сорбентов с привитыми олигопептидами: Автореф. дис. канд. хим. наук. М.: МГУ, 1993. 20 с.
Mingalev P.G., Fadeev A.Y. // J. Chromatogr. A. 1996. V. 719. P. 291.
Маерле К.В. Сверхсшитый полимер на основе винилпиридина в качестве стационарной фазы в капиллярной электрохроматографии. Автор. дис. канд. хим. наук: М.: Ин-т элементоорганических соединений им. А.Н. Несмеянова РАН, 2009. 25 с.
Рощина Т.М., Давыдов В.Я., Тимошик М.С. и др. // Вестн. МГУ. Сер. 2. Химия. 1998. Т. 39. № 4. С. 236.
Рощина Т.М., Коханов О.В., Власенко Е.В., Фадеев А.Ю. // Труды IX Международной конф. по теоретическим вопросам адсорбции и адсорбционной хроматографии “Современное состояние и перспективы развития теории адсорбции” (к 100-летию со дня рождения академика М.М. Дубинина). М.: ГНЦ РФ “Ниопик”, 2001. С. 250.
Roshchina T.M., Gurevich K.B., Fadeev A.Y. et al. // J. Chromatogr. A. 1999. V. 844. P. 225.
Экспериментальные методы в адсорбции и молекулярной хроматографии / Под ред. Никитина Ю.С. и Петровой Р.С. М.: МГУ, 1990. 318 с.
Papirer E., Balard H., Vergelati C. // Adsorption on silica surfaces. Surfactant science series. Marcel: Dekker. Inc., 2000. V. 90. P. 205.
Voelkel A., Strzemiecka B., Adamska K., Milczewska K. // J. Chromatogr. A. 2009. V. 1216. P. 1551.
Грег С., Синг К. Адсорбция, удельная поверхность, пористость. М.: Мир, 1984. 306 с.
Карнаухов А.П. Адсорбция. Текстура дисперсных и пористых материалов. Новосибирск: Наука, 1999. 470 с.
Рощина Т.М., Шония Н.К., Таякина О.Я., Фадеев А.Ю. // Журн. физ. химии. 2011. Т. 85. № 2. С. 352.
Рощина Т.М., Шония Н.К., Лагутова М.С., Фадеев А.Ю. // Там же. 2008. Т. 82. № 3. С. 470.
Miller T.M. / in CRC Handbook of Chemistry and Physics / ed. by D. R. Lide. CRC Press. Boca Raton. Fl, 2002. 83d edition. 202 p.
Осипов О.А., Минкин В.И. Справочник по дипольным моментам. М.: Высш. школа, 1971. 414 с.
Киселев А.В., Лисичкин Г.В., Никитин Ю.С. и др. // Журн. физ. химии. 1983. Т. 57. № 7. С. 1829.
Шония Н.К., Староверов С.М., Никитин Ю.С., Лисичкин Г.В. // Журн. физ. химии. 1984. Т. 58. № 3. С. 702.
Сердан А.А., Никитин Ю.С., Староверов С.М., Лисичкин Г.В. // Там же. 1986. Т. 60. № 1. С. 147.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии