Журнал физической химии, 2019, T. 93, № 10, стр. 1569-1574
Низкотемпературный синтез гибридных наноформ на основе антибактериального препарата диоксидина и наночастиц биологически активных металлов (серебро, медь), включенных в биополимерные криогели
Т. И. Шабатина a, *, О. И. Верная a, А. В. Нуждина a, В. П. Шабатин a, А. М. Семенов b, М. Я. Мельников a
a Московский государственный университет имени М.В. Ломоносова,
Химический факультет
Москва, Россия
b Биологический факультет
Москва, Россия
* E-mail: tatyanashabatina@yandex.ru
Поступила в редакцию 15.03.2019
После доработки 15.03.2019
Принята к публикации 09.04.2019
Аннотация
Криохимические нанотехнологии использованы для получения гибридных систем на основе антибактериального препарата диоксидина, наночастиц металлов (Ag, Cu) и биополимерных матриц (криогелей) на основе желатина, альгината кальция и хитозана. Согласно данным методов ИК-, УФ-, ЯМР-спектроскопии, ПЭМ, СЭМ, полученные системы представляют собой широкопористые матрицы с диаметром пор от 10 до 200 мкм, в которые включены антибактериальный препарат и наночастицы серебра размером 2–30 нм или меди размером 1–5 нм. Показано, что полученные системы способны обеспечить постепенное высвобождение диоксидина от 40 мин до 3 суток (в зависимости от природы матрицы). Установлена большая активность к подавлению роста E. coli 52 и S. aureus 144 гибридных композитов на основе металлов и диоксидина, включенных в биополимерные криоструктураты, по сравнению с составляющими их компонентами, включенными в те же матрицы, по отдельности.
Перед выходом на фармацевтический рынок лекарственные препараты проходят длительный и дорогостоящий путь – от синтеза молекулы до проведения клинических испытаний и урегулирования окончательных юридических формальностей. Поэтому в настоящее время актуальны пути оптимизации существующих лекарственных препаратов, создание новых лекарственных форм на их основе. Оптимальная лекарственная форма должна обеспечивать наличие лекарственного вещества только в органе мишени в приемлемой концентрации (выше минимально эффективной концентрации и ниже минимальной токсической концентрации) в течение необходимого времени.
В последние десятилетия нанотехнологии нашли активное применение в различных областях науки, в том числе в медицине, например, для получения наночастиц лекарственных веществ [1, 2]. Одно из наиболее важных направлений исследований – создание систем направленной доставки лекарственных веществ на основе гибридных наночастиц и нанокомпозитов. Известны примеры использования ряда неорганических наночастиц в комплексных системах с целью повышения эффективности лекарственного препарата [3–8]. Так, одновременное использование систем на основе антибактериальных препаратов и наночастиц золота, серебра или меди позволяет расширить диапазон их применения и активность по сравнению с индивидуальными компонентами [3–6].
Включение магнитных наночастиц в противоопухолевые препараты позволяет совместить гипертермию и химиотерапию и повысить эффективность противоопухолевого лечения [7–9]. Кроме того, при введении лекарственных систем не напрямую в пораженный орган, а перорально или внутривенно необходимо, чтобы они попадали только в паталогические ткани и не повреждали здоровые органы. В данном случае идеальная система доставки лекарств должна не превышать размер в 200 нм (для проникновения через биологические барьеры), содержать активные компоненты, носитель, который обеспечит их высвобождение в пораженном органе, а также поверхностные специфические нацеливающие лиганды – вектора, направляющие полученную систему в орган-мишень. Для направленной доставки в опухолевые клетки используют различные векторы: белки α-фетопротеин и трансферрин, обладающие сродством к поверхности раковых клеток; пептидный гормон гонадолиберин, способный направить лекарственный препарат к опухолевым клеткам молочной железы, яичников и простаты; моноклональные антитела – к различным рецепторам на поверхности раковых клеток. Также возможно нацеливание систем направленной доставки магнитным полем при использовании в качестве векторов магнитных наночастиц. В качестве носителей для лекарственных форм используют липосомы, мицеллы, мезопористые кремнеземы, наночастицы золота и полимеры.
Кроме того, эффективность лекарственных препаратов повышают, контролируя их концентрацию и высвобождение в целевом органе. Формы контролируемого высвобождения позволяют снизить колебания плазменной концентрации лекарственных препаратов, частоту и интенсивность нежелательных лекарственных реакций, и эти формы более удобны для пациентов, так как требуют меньшей частоты введения. В системе с контролируемым высвобождением биологически активный агент включен в носитель, обычно полимерный материал, который обеспечивает длительное и постоянное выделение лекарственной формы. Скорость высвобождения вещества определяется свойствами самого полимера и слабо зависит от факторов окружающей среды (таких, например, как рН жидкостей организма). Системы с контролируемым высвобождением способны доставлять вещества непрерывно в течение длительного времени от часов до месяцев.
Цель настоящей работы – синтез гибридных нанокомпозитов на основе антибактериального препарата диоксидина и наночастиц металлов (серебра и меди), включение полученных нанокомпозитов в альгинатные, хитозановые и желатиновые криогели, способные обеспечить их пролонгированное выделение, а также определение антибактериальной активности полученных гибридных лекарственных наноформ в отношении бактериальных клеток E. coli 52 и S. aureus 144.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Субстанцию диоксидина, соответствующую фармакопейной статье 42-2308-97, коллоидное серебро марки КНД-С-К (ТУ 9154-024-74107096-2008), хлорид меди II, гидразина гидрат квалификации “ч.д.а.” использовали без дополнительной очистки. Наночастицы меди получали восстановлением водного раствора хлорида меди гидразин-гидратом [10]. Низкотемпературный синтез желатиновых, хитозановых и Са-альгинатных криоструктуратов проводили согласно [11–13].
Высокодисперсный порошок диоксидина и гибридные нанокомпозиты диоксидина с наночастицами серебра (Ag/диоксидин) или меди (Сu/диоксидин) получали распылением водного раствора, содержащего диоксидин и наночастицы металла (1 мас. % диоксидина, 0.005 мас. % Ag или 0.02 мас. % Cu), через пневматическую форсунку в жидкий азот, затем замороженные растворы подвергали криосублимационной сушке в течение 24 ч [14–16]. Образцы криоструктурированных биополимерных матриц на основе альгината кальция, желатина и хитозана были любезно предоставлены проф. В.И. Лозинским (Институт элементоорганических соединений им. А.Н. Несмеянова РАН) [11–13]. Диоксидин, а также нанокомпозиты Ag/диоксидин, Сu/диоксидин, включали в диски криогелей следующим образом: губчатые диски погружали на 30 мин в водные растворы диоксидина и наночастиц металла (1 мас. % диоксидина, 0.02 мас. % Ag или 0.02 мас. % Cu), затем диски извлекали из раствора, замораживали жидким азотом и подвергали криосублимационной сушке в течение 24 ч. Полученные образцы на основе альгината кальция (Ag/диоксидин/альгинат, Сu/диоксидин/альгинат) содержали 14 мас. % диоксидина и 0.56 мас. % металла, на основе желатина (Ag/диоксидин/желатин, Сu/диоксидин/желатин) содержали 11.5 мас. % диоксидина, 0.46 мас. % металла, на основе хитозана (Ag/диоксидин/хитозан, Сu/диоксидин/хитозан) содержали 4.8 мас. % диоксидина, 1.5 мас. % металла, согласно результатам атомной абсорбционной спектрометрии, полученным на спектрометре Thermo iCE 3000 spectrometer (Thermo Fisher Scientific Inc., USA).
Рентгенофазовый анализ (РФА) образцов проводили на дифрактометре Rigaku D/MAX-2500 (Rigaku, Япония) на CuKα-излучении (λ = = 1.54056 Å). Спектры ядерного магнитного резонанса (ЯМР 1H) регистрировали в насыщенном растворе в дейтерированной воде (D2O) на ЯМР-спектрометре высокого разрешения VXR-400 фирмы “Varian” (США). ИК-спектры образцов получали в интервале 4000–400 см–1 на спектрометре Bruker Tensor II (Германия) с приставкой ATR platinum. Регистрацию ИК-спектров образцов осуществляли по методике диффузного отражения. УФ-спектры водных растворов и экстрактов образцов снимали на спектрофотометре Jasco V-770 (Jasco, Япония) в интервале 200–700 нм. Кинетику высвобождения диоксидина из криоструктуратов отслеживали спектрофотометрически на спектрофотометре Jasco V-770 (Jasco, Япония) при λ = 375 нм.
Микроструктуру образцов изучали методом просвечивающей электронной микроскопии (ПЭМ) на электронном микроскопе LEO 912 AB Omega (ZEISS, Germany) при увеличениях ×80–×500 000 и методом сканирующей электронной микроскопии (СЭМ) на растровом электронном микроскопе Phenom (FEI Company, Германия) при увеличениях ×20–×4000. Определение удельной поверхности (Sуд) образцов проводили методом низкотемпературной адсорбции – тепловой десорбции аргона на лабораторной установке на базе хроматографа Хром 5. Предварительно адсорбированные газы удаляли с поверхности образцов на вакуумной установке. Средний размер частиц (a) диоксидина рассчитывали по формуле: a = 6/ρSуд, где ρ – плотность диоксидина.
Определение антибактериальной активности различных форм диоксидина и гибридных нанокомпозитов Ag/диоксидин и Сu/диоксидин в сравнении с исходным диоксидином и растворами коллоидного серебра и меди осуществляли диско-диффузионным методом [17], с использованием дисков фильтровальной бумаги марки “красная лента” (диаметром 5 мм) и дисков альгинатных, хитозановых и желатиновых криоструктуратов (диаметром 4 и высотой 2 мм). В качестве тест-культур использовали бактериальные клетки, полученные из коллекции бактериальных культур кафедры микробиологии биологического факультета МГУ имени М.В. Ломоносова: E. coli 52, S. aureus 144. Эксперименты проводили в чашках Петри, содержащих 20 мл агаризованной питательной среды, подсушенной в течение суток (толщина слоя среды 4 мм). Измерение зон подавления роста (ЗПР) тест-культур проводили через 24 ч инкубации. Статистически достоверные результаты получали девятикратным повторением измерений ЗПР для каждой серии образцов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Гибридные нанокомпозиты диоксидина с наночастицами серебра и меди
На начальном этапе была проведена модификация диоксидина, которая заключалась в микронизации его частиц и включении в них наночастиц серебра и меди. ИК-спектры полученных систем соответствовали ИК-спектрам высокодисперсного диоксидина, полученного методом сублимационной сушки [16] (полоса колебания хиноксалинового кольца находится при 1510 см–1, полосы колебаний С–Н бензольного кольца проявляются при 975, 113, 1160 см–1, а полоса колебаний C–O–H – при 1288 см–1). Рентгеновские дифрактограммы, а также набор межплоскостных расстояний (d, Å) и интенсивностей (Iотн, %) соответствовали той же высокодисперсной форме диоксидина [19] (d, Å – Iотн, %: 8.740–100.0%; 8.026–94.2%; 6.899–57.8%; 6.288–50.9%; 5.978–43.4%; 3.358–99.3%; 3.304–67.6%). Отсутствие на рентгеновской дифрактограмме пиков серебра и меди связано с их низким содержанием в образце и малым размером их частиц.
Спектры ЯМР-1Н полученных гибридных систем (D2O) δ: 4.94–5.22 (m, 4H, 2*CH2), 7.85–8.05 (m, 2H, H Ar), 8.37–8.52 (m, 2H, H Ar) соответствовали диоксидину. УФ-спектры водных растворов композитов Ag/диоксидин и Сu/диоксидин соответствуют диоксидину, в них присутствует интенсивная полоса поглощения при 250 нм, относящаяся к π → π*-переходу электронов атомов углерода ароматической системы, и полоса низкой интенсивности при 375 нм, относящаяся к n → π*-переходу. Отсутствие в УФ-спектре водных растворов композитов полос, соответствующих плазмонному поглощению наночастиц серебра и меди, связано как с невысокой интенсивностью поглощений по сравнению с диоксидином, так и малым содержанием наночастиц серебра и меди в образце.
Согласно данным просвечивающей электронной микроскопии (ПЭМ), нанокомпозиты Ag/диоксидин и Cu/диоксидин состоят из органических частиц (размером 50–350 нм), внутрь которых включены наноразмерные частицы серебра (размером 2–30 нм) или Cu (размером 1–5 нм). Удельная поверхность для композитов Ag/диоксидин составила 31 м2/г (средний размер частиц 130 нм), для композитов Cu/диоксидин 24 м2/г (средний размер частиц 166 нм), что согласуется с микрофотографиями, полученными методом ПЭМ.
Системы на основе гибридных композитов диоксидина с наночастицами металлов и биополимерных матриц
В качестве носителей для лекарственных препаратов используют системы на основе полисахаридов (крахмала, целлюлозы, хитозана, гиалуроновой кислоты, альгината кальция) и белков (протеинов, полипептидов, таких как альбумин, желатин, трансферрин, лактоферрин, шелк, коллаген, β-казеин) [18]. Для оптимизации размера, биоразлагаемости и способности к высвобождению включенных в матрицу соединений биополимеры перед нанесением на них лекарственного препарата подвергают предварительной модификации, которая определяет их размер и внутреннюю пространственную сетку. Для систем контролируемого высвобождения лекарственных веществ биополимеры используются в виде наночастиц и микрочастиц (для перорального и внутривенного введения в организм) и массивных матриц (гидрогелей или если формирование матрицы протекало при низких температурах – криогелей) для местного применения [19, 20].
Затем гибридные композиты Ag/диоксидин и Cu/диоксидин включали в биополимерные криогели на основе желатина, хитозана и альгината кальция. Включение диоксидина в биополимерные матрицы подтверждают ИК-спектры полученных систем, которые представляют суперпозицию ИК-спектров гибридных нанокомпозитов и используемой матрицы. Широкие полосы хитозана при 580 см–1, желатина при 534 см–1 и альгината при 550 см–1 накладываются на несколько более узких полос диоксидина. Спектры ЯМР 1Н экстрактов гибридных систем в D2O идентичны спектрам ЯМР 1Н диоксидина. УФ-спектры водных экстрактов систем Ag/диоксидин/желатин, Ag/диоксидин/хитозан, Ag/диоксидин/альгинат, Cu/диоксидин/желатин, Cu/диоксидин/хитозан, Cu/диоксидин/альгинат были идентичны УФ-спектрам диоксидина. Также спектрофотометрически получены кинетические кривые высвобождения диоксидина из биополимерных матриц, которые представлены на рис. 1. Высвобождение диоксидина из матриц в зависимости от их природы протекает за время от 40 мин до 3 суток.
Рис. 1.
Кинетические кривые высвобождения диоксидина из альгинатной (а), желатиновой (б) и хитозановой (в) матриц.
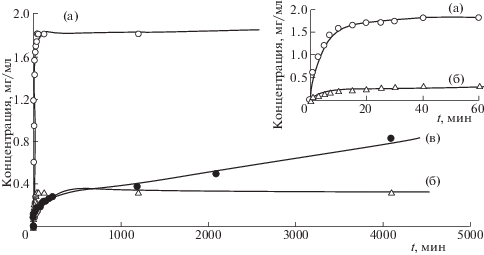
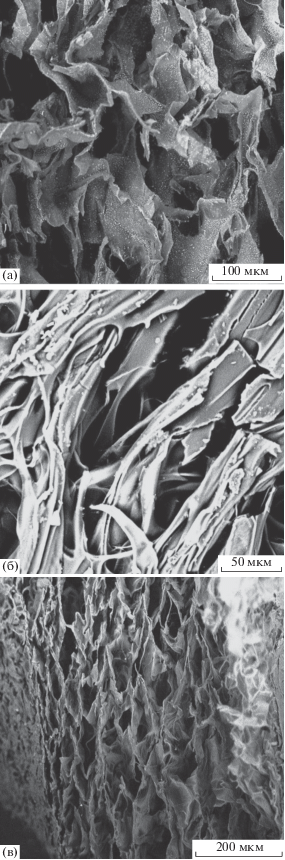
Микрофотографии СЭМ (рис. 2) до и после включения гибридных нанкомпозитов в матрицу были идентичны. Размер пор как гибридных систем Ag/диоксидин/желатин, Ag/диоксидин/хитозан, Ag/диоксидин/альгинат, Cu/диоксидин/желатин, Cu/диоксидин/хитозан, Cu/диоксидин/альгинат, так и исходных биополимерных матриц составляет 10–200 мкм. Это наряду с ИК-спектрами свидетельствует в пользу того, что включенный в биополимерные криоструктураты диоксидин находится на поверхности матрицы в высокодисперсном состоянии, а также объясняет сравнительно высокую скорость высвобождения лекарственного вещества из альгинатной и желатиновой матриц (40–60 мин). Изменение структуры этих матриц за счет варьирования условий их синтеза может позволить в дальнейшем снизить скорость высвобождения диоксидина и получить более длительный эффект постепенного высвобождения лекарственного препарата. Высвобождение диоксидина из хитозановой матрицы протекает за значительно больший период времени, вероятно, за счет более сильного взаимодействия лекарственного препарата с матрицей, что делает хитозановые криогели оптимальными носителями в системах контролируемого высвобождения диоксидина.
Рис. 2.
Микрофотография СЭМ систем Ag/диоксидин/альгинат (а), Ag/диоксидин/желатин (б), Ag/диоксидин/хитозан (в).
Согласно микрофотографиям ПЭМ (рис. 3) и электронным дифрактограммам полученных гибридных систем контролируемого высвобождения, внутри органических матриц находятся наночастицы серебра с размером от 2 до 30 нм или меди с размером от 1 до 5 нм.
Антибактериальная активность гибридных систем
Антибактериальная активность полученных различных форм диоксидина и гибридных наносистем на его основе была определена в отношении микробных клеток E. coli 52 и S. aureus 144. Полученные данные обобщены в табл. 1, 2. Антибактериальная активность гибридных композитов наночастиц металлов с диоксидином оказалась выше, чем индивидуальных наночастиц металлов и диоксидина, как в случае тестирования их стандартным диско-диффузионным методом, так и в случае использования для тестирования дисков альгинатных и желатиновых криогелей. Исключением была лишь биополимерная матрица на основе хитозана, нанесение гибридных нанокомпозитов на которую приводит к их более низкой антибактериальной активности по сравнению с диоксидином. Вероятно, хитозановый криогель отличается не только сильным взаимодействием диоксидин–носитель, но и более сильным взаимодействием металл–диоксидин–носитель, которое замедляет выделение не только диоксидина, но и ионов металлов с его поверхности и, таким образом снижает активность систем наночастицы металла–диоксидин–хитозан.
Таблица 1.
Диаметры ЗПР (d, мм) E. coli 52 и S. aureus 144, вокруг дисков фильтровальной бумаги, пропитанных растворами диоксидина и наночастиц Ag и Cu и их гибридными нанокомпозитами
| Бактериальный штамм | Ag | Cu | Диоксидин | Ag/диоксидин | Cu/диоксидин |
|---|---|---|---|---|---|
| E. coli 52 | 0 | 0 | 26.2 ± 1.2 | 36.7 ± 0.6 | 32.1 ± 1.2 |
| S. aureus 144 | 0 | 0 | 30.3 ± 0.6 | 37.1 ± 0.6 | 33.3 ± 1.2 |
Таблица 2.
Диаметр ЗПР (d, мм) бактериальных штаммов вокруг дисков криогелей, пропитанных диоксидином, наночастицами металлов и их гибридными нанокомпозитами
| Криогель на основе | Компоненты криогеля | E. coli 52 | S. aureus 144 |
|---|---|---|---|
| Альгината | Ag | 10.0 ± 0.6 | 0 |
| Cu | 0 | 0 | |
| диоксидин | 20.0 ± 0.6 | 17 ± 0.6 | |
| диоксидин/Ag | 23.0 ± 0.8 | 32 ± 0.8 | |
| диоксидин/Cu | 22.1 ± 1.2 | 23 ± 0.6 | |
| Желатина | Ag | 4 ± 1.2 | 0 |
| Cu | 0 | 0 | |
| диоксидин | 35 ± 0.6 | 10 ± 0.6 | |
| диоксидин/Ag | 38 ± 1.2 | 15 ± 0.6 | |
| диоксидин/Cu | 37 ± 1.2 | 14 ± 0.6 | |
| Хитозана | Ag | 7 ± 1.0 | 6.6 ± 0.5 |
| Cu | 0 | 0 | |
| диоксидин | 33.2 ± 1.6 | 11.5 ± 2.5 | |
| диоксидин/Ag | 23.4 ± 1.2 | 7.5 ± 0.6 | |
| диоксидин/Cu | 22.0 ± 1.2 | 6.5 ± 0.5 |
Таким образом, методом криохимического синтеза получены новые системы контролируемого высвобождения на основе гибридных нанокомпозитов диоксидина с наночастицами серебра (размером 2–30 нм) и меди (размером 1–5 нм), и биополимерных криогелей, которые обеспечивают постепенное высвобождение диоксидина за период времени от 40 мин до 3 суток. Полученные системы на основе желатиновых и альгинатных матриц показали большую антибактериальную активность в отношении E. coli 52 и S. aureus 144, чем в случае, когда в эти матрицы были включены только наночастицы металлов или диоксидин. В случае хитозанового криогеля наблюдается иная закономерность, которая, вероятно, связана с сильным взаимодействием в системе носитель–наночастицы металлов–диоксидин.
Работа выполнена при поддержке РНФ (грант № 16-13-10365).
Список литературы
Thomas B.G. // Rec. Pat. on Nanomed. 2012. V. 2. P. 52.
Rizvi S., Saleh A.M. // Saudi Pharm. J. 2017. V. 26. № 1. P. 64.
Yang P., Pageni P., Rahman Md A. et al. // Adv. Healthcare Mater. 2018. 1800854. 8p.
Верная О.И., Шабатин В.П., Семенов А.М. и др. // Вестн. Моск. ун-та. Сер. 2. Химия. 2016. 57. № 6. С. 388.
Верная О.И., Шабатин В.П., Нуждина А.В. и др. // Изв. АН. Сер. хим. 2017. № 11. С. 2152.
Шабатина Т.И., Верная О.И., Карлова Д.Л. и др. // Рос. нанотех. 2018. Т. 13. № 9–10. С. 92.
Revia R.A., Zhang M. // Mater. Today. 2016. V. 19. № 3. P. 157.
Ito A., Fujioka M., Yoshida T. et al. // Cancer. Sci. 2007. V. 98. № 3. P. 424.
Sharma A.K.// Biopolymers in Drug Delivery. Biopolymers Res. 1. 2017. e101.
Сайкова С.В., Воробьев С.А, Николаева Р.Б. и др. // Журн. общ. химии. 2010. Т. 80. № 6. С. 952.
Lozinsky V.I., Kulakova V.K., Ivanov R.V. et al. // E‑Polymers. 2018. V. 18. № 2. P. 172.
Сажнев Н.А., Дроздова М.Г. // Прикладная биохимия и микробиология. 2018. Т. 54. № 5. С. 455.
Lozinsky V.I. // Gels. 2018. V. 4. № 3. P. 77.
Верная О.И., Шабатин В.П., Семенов А.М. и др. // Вестн. МГУ Сер. 2. Химия. 2016. Т. 57. № 5. С. 315.
Верная О.И., Шабатин В.П., Хватов Д.И. и др. // Журн. физ. химии. 2017. Т. 91. № 2. С. 230.
Shabatina T.I., Vernaya O.I., Sabatin V.P. et al. // Crystals. 2018. V. 8. № 7. P. 298.
Определение чувствительности микроорганизмов к антибактериальным препаратам. Методические указания / Под ред. Г.Г. Онищенко.М., 2004. 40 с.
Nitta S.K. and Numata K. // Engineering Int. J. Mol. Sci. 2013. V. 14. P. 1629.
Gopi S., Amalraj A., Thomas S. // Drug Des. 2016. V. 5. P. 129.
Lozinsky V.I., Galaev I., Plieva M. et al. // Trends in biotechnol. V. 21. P. 445.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



