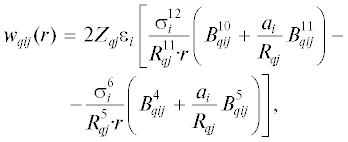Журнал физической химии, 2019, T. 93, № 11, стр. 1737-1745
Расчет коэффициента распределения ксенона при разделении метансодержащих газовых смесей методом газогидратной кристаллизации
М. С. Сергеева a, *, А. Н. Петухов a, Д. Н. Шаблыкин a, В. М. Малышев a, В. М. Воротынцев a
a Нижегородский государственный технический университет им. Р.Е. Алексеева
Нижний Новгород, Россия
* E-mail: sergeeva.m.s@rambler.ru
Поступила в редакцию 21.12.2018
После доработки 12.02.2019
Принята к публикации 19.02.2019
Аннотация
Рассмотрен процесс извлечения ксенона методом газогидратной кристаллизации из газовых смесей на основе метана (CH4) с примесными компонентами – сероводород (H2S), диоксид углерода (CO2), ксенон (Xe). Показано, что при нормированном увеличении концентрации Xe в газовой смеси коэффициент газогидратного распределения Xe незначительно уменьшается, так как увеличивается индивидуальное давление гидратообразования Xe и его концентрация в газовой фазе. Установлено, что коэффициент газогидратного распределения Xe существенно зависит от состава газовой смеси и слабо зависит от изменения его концентрации. Для газовой смеси CH4 = 94.85 об. %, H2S = 2.50 об. %, CO2 = 2.50 об. %, Xe = 0.15 об. %, приближенной к составу природного газа, процесс гидратообразования был смоделирован в температурном диапазоне 273.15–283.15 K. Показано, что при увеличении температуры процесса гидратообразования на 10 K коэффициент газогидратного распределения Xe уменьшился на 5.42%.
Ксенон (Xe) используется во многих отраслях промышленности. Например, Xe используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света [1–3], он используется как общий анестетик в медицинской промышленности [4], а также как газообразный пропеллент в электростатических ионных двигателях [5]. Жидкий Xe применяется в калориметрах [6] и в качестве рабочей среды лазеров [7]. Радиоактивные изотопы Xe (127Xe, 131Xe, 133Xe, 135Xe, 137Xe и др.) применяют в качестве источников излучения в радиографии и для диагностики в медицине [8]. Фториды Xe являются мощными окислителями [9, 10].
Концентрация Xe в воздухе составляет 8.70 × × 10–4 об. % [11]. В настоящее время производство Xe из воздуха методом низкотемпературной ректификации является высокоэнергозатратным, крупногабаритным и дорогостоящим [12].
Концентрация Xe в некоторых месторождениях природного газа составляет 0.15 об. % [12], в связи с этим, извлечение Xe из природного газа является актуальным. Природный газ содержит 60–95 об. % углеводородов, а также другие газы [13].
В настоящее время разделение компонентов природного газа осуществляется с использованием сорбционных [14, 15], мембранных [16–18] и гибридных [19, 20] методов. Также в последнее время проводятся экспериментальные исследования по разделению компонентов природного газа методом газогидратной кристаллизации [21–23]. Одним из основных параметров, характеризующих эффективность данного разделения является разница в давлениях диссоциации компонентов природного газа (Pдис(CH4) > Pдис(CO2) > > Pдис(C2H6) > Pдис(C3H8) > … > Pдис(Xe) ≈ ≈ Pдис(H2S)…) [24]. Давление диссоциации газового гидрата Xe наименьшее, следовательно, его отделение от основного компонента природного газа (метан (CH4)) будет эффективным.
Для эффективного извлечения Xe из природного газа предложен метод газогидратной кристаллизации, который широко используется для извлечения диоксида углерода (CO2) из газового потока [25–27], для разделения газовых смесей CH4 + CO2 [28], CO2 + N2 [29], CH4 + N2 [30], CH4 + He [31], CH4 + C7H14 [32], для извлечения гексафторида серы (SF6) [33]. Преимуществами метода газогидратной кристаллизации являются простота экспериментальной установки, возможность эффективного разделения газов при температурах выше 273.15 K, высокая эффективность газового разделения из-за различия в давлениях диссоциации газовых гидратов, безопасность транспортировки газов в газогидратном состоянии, высокая вместимость газов из-за клатратной структуры газовых гидратов [34].
Основным параметром, характеризующим эффективность разделения газовых смесей методом газогидратной кристаллизации, является коэффициент газогидратного распределения. В связи с этим, целью нашей статьи является определение влияния концентрации Xe, температуры и давления газовой смеси на коэффициент газогидратного распределения Xe из различных метансодержащих газовых смесей: CH4 + H2S + Xe, CH4 + + CO2 + Xe, CH4 + H2S + CO2 + Xe.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Газовые гидраты – это кристаллические молекулярные комплексы, образованные из смеси молекул воды и газа [35]. Образование газовых гидратов делится на две стадии. Первая стадия – это образование ядер кристаллизации из насыщенной газом воды [36]. Вторая стадия – это объемно-диффузионное образование газового гидрата [37].
Для образования газовых гидратов необходимы следующие условия:
1) гидратообразующий газ не должен химически взаимодействовать с водой;
2) диаметр газовой молекулы должен быть меньше диаметра газогидратной полости;
3) давление газа в системе должно быть больше, чем давление диссоциации газовых гидратов. Давление диссоциации газовых гидратов (Pдис) – это минимальное давление, при котором возможен процесс гидратообразования.
Основные структуры газовых гидратов – кубическая структура-I (КС-I), 2D · 6T · 46H2O; кубическая структура-II (КС-II), 16D · 8H · 136H2O; гексагональная структура-III (ГС-III), 3D · 2D' · E · · 34H2O, где D, D' – малые газогидратные полости, T, H, E – большие газогидратные полости [38]. Газы CH4, H2S, CO2, Xe образуют газовый гидрат КС-I [22]. Если имеется смесь газов, то образуется смешанный газовый гидрат.
Газогидратные полости являются полиэдрами [39]. Из-за периодической структуры газовых гидратов их свойства могут быть представлены статистической термодинамикой. Для определения свойств газовых гидратов используется модель идеального твердого клатрата, разработанная Ван-дер-Ваальсом [40].
Адсорбция газовых молекул в малых и больших газогидратных полостях описывается идеально сглаженной ячеечной моделью Ленгмюра [41]. Уравнение, связывающее константу Ленгмюра (Cij) со сферически сглаженной потенциальной функцией ячейки ${{w}_{{qij}}}(r)$ на радиальном расстоянии r от центра газогидратной полости до газовой молекулы и с учетом отклонения газовых молекул от сферической формы:
(1)
$\begin{gathered} {{C}_{{ij}}} = \left[ {\frac{{4\pi }}{{kT}}\mathop \smallint \limits_0^{{{R}_{{qj}}}} {\text{ex}}{{{\text{p}}}^{{ - \frac{{{{w}_{{qij}}}(r)}}{{kT}}}}}{{r}^{2}}dr} \right] \times \\ \times \;\left[ {{\text{exp}}\left( { - {{A}_{j}}{{{\left( {{{U}_{i}}\left( {\frac{{{{\sigma }_{i}}}}{{{{R}_{{qj}}} - {{a}_{i}}}}} \right)\frac{{{{\varepsilon }_{i}}}}{{kT}}} \right)}}^{{{{l}_{j}}}}}} \right)} \right], \\ \end{gathered} $Таблица 1.
Характеристики газогидратной ячейки КС-I [42]
| Тип полости | Первый слой | Второй слой | Третий слой | ${{A}_{j}}$ | ${{l}_{j}}$ |
|---|---|---|---|---|---|
| Малая | R11 = 3.875 Å Z11 = 20 |
R21 = 6.593 Å Z21 = 20 |
R31 = 8.056 Å Z31 = 50 |
35.345 | 0.973 |
| Большая | R12 = 4.152 Å Z12 = 21 |
R22 = 7.078 Å Z22 = 24 |
R32 = 8.285 Å Z32 = 50 |
14.116 | 0.826 |
Газовые молекулы в основном расположены около центра газогидратной полости и никогда не находятся дальше чем 0.5–1.0 Å от этого центра [42].
Параметры потенциала Кихара используются для определения сферически сглаженной потенциальной функции ячейки ${{w}_{{qij}}}(r)$ [43]:
где ${{Z}_{{qj}}}$ – координационный номер газогидратной полости.(3)
$B_{{qij}}^{n} = \frac{1}{n}\left[ {{{{\left( {1 - \frac{r}{{{{R}_{{qj}}}}} - \frac{{{{a}_{i}}}}{{{{R}_{{qj}}}}}} \right)}}^{{ - n}}} - {{{\left( {1 + \frac{r}{{{{R}_{{qj}}}}} - \frac{{{{a}_{i}}}}{{{{R}_{{qj}}}}}} \right)}}^{{ - n}}}} \right],$Второй и третий слой молекул воды влияет на стабильность газового гидрата [42], следовательно, общий потенциал ячейки определяется тремя слоями молекул воды:
где ${{w}_{{1ij}}}(r)$, ${{w}_{{2ij}}}(r)$, ${{w}_{{3ij}}}(r)$ – вклад в потенциал ячейки первого, второго и третьего слоя молекул воды, соответственно.Для расчета по уравнению (1) используется радиус трех слоев молекул воды (табл. 1), так как более удаленные слои молекул воды не влияют на общий потенциал газогидратной ячейки [44].
Согласно правилу Лоренца–Бертло [45], параметры взаимодействия газ–вода в газогидратной фазе:
(5)
$\frac{{{{\varepsilon }_{i}}}}{k} = \sqrt {\frac{{{{\varepsilon }_{{{{{\text{H}}}_{2}}{\text{O}}}}}}}{k}\frac{{{{\varepsilon }_{{{\text{газ}}}}}}}{k}} ,$(6)
${{\sigma }_{i}} = \frac{{{{\sigma }_{{{{{\text{H}}}_{2}}{\text{O}}}}} + {{\sigma }_{{{\text{газ}}}}}}}{2},$Образование газогидратной фазы становится термодинамически возможным в случае, когда $P_{{\text{w}}}^{{0(I)}} \leqslant P_{{\text{w}}}^{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}$ [47], где $P_{{\text{w}}}^{{0(I)}}$ – равновесное давление паров воды над пустой газогидратной решеткой КС-I, Па; $P_{{\text{w}}}^{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}$ – равновесное давление паров воды над поверхностью воды, Па [48].
Равновесное давление паров воды над пустой газогидратной решеткой КС-I ($P_{{\text{w}}}^{{0(I)}}$) описывается уравнением [49]:
Критическое условие для образования газогидратной фазы [47]:
(9)
$\begin{gathered} {\text{ln}}\left( {\frac{{P_{{\text{w}}}^{{0(I)}}}}{{P_{{\text{w}}}^{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}} \right) = \frac{h}{{(1 + h)m}}{\text{ln}}\left( {1 + \mathop \sum \limits_i \,{{C}_{{1i}}}{{P}_{i}}} \right) + \\ + \;\frac{1}{{(1 + h)m}}{\text{ln}}\left( {1 + \mathop \sum \limits_i \,{{C}_{{2i}}}{{P}_{i}}} \right), \\ \end{gathered} $Доля заполненных газами полостей (Qij) [40]:
Средняя доля заполненных газами полостей (Qi):
где Nj – доля газогидратных полостей j-типа.Распределение молекул основного и примесного газов в газогидратных полостях описывается коэффициентом газогидратного распределения (Ki):
где xi – мольная доля i-газа в газогидратной фазе; yi – мольная доля i-газа в газовой фазе.После подстановки xi и yi из уравнения (12) уравнение для определения коэффициента газогидратного распределения примет вид:
Коэффициент газогидратного распределения характеризует распределение газовых молекул в газогидратных полостях.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для расчета доли заполненных газами полостей (уравнение (10)) и коэффициента газогидратного распределения (13) необходимо определить параметры потенциала Кихара (5)–(7). Отклонения значений экспериментально определенных параметров потенциала Кихара εi/k для газов CH4, CO2, H2S, Xe составляют 6.24–16.63% [42, 50–53]. Для согласованности экспериментальных и рассчитанных давлений диссоциации используются полученные численным методом значения параметров потенциала Кихара (табл. 2), которые находятся в пределах ошибки (0.22–12.64%) их определения.
Таблица 2.
Параметры потенциала Кихара
| Параметры | CH4 | CO2 | H2S | Xe |
|---|---|---|---|---|
| ${{\varepsilon }_{{{\text{газ}}}}}{\text{/}}k$, K | 210 | 500 | 480 | 360 |
| ${{\sigma }_{{{\text{газ}}}}}$, Å | 2.87 | 2.12 | 2.55 | 2.79 |
| ${{a}_{{{\text{газ}}}}}$, Å | 0.26 | 0.68 | 0.49 | 0.25 |
Параметры потенциала Кихара влияют на значения констант Ленгмюра, которые позволяют по уравнению (9) рассчитать давление диссоциации гидратообразования. В табл. 3 представлены рассчитанные с использованием параметров потенциала Кихара (табл. 2) константы Ленгмюра для малых и больших газогидратных полостей, а также рассчитанные и экспериментальные индивидуальные давления диссоциации газовых гидратов.
Таблица 3.
Константы Ленгмюра для малых (С1) и больших (С2) газогидратных полостей и индивидуальные давления диссоциации газовых гидратов при T = 273.15 K
| Адсорби-рованная молекула | С1, 1/кПа | С2, 1/кПа | Pдис, кПа | ||
|---|---|---|---|---|---|
| Рассчитанное в нашей работе | Среднее давление (экспериментальные давления) | δ, % | |||
| CH4 | 7.86 × 10–3 | 6.29 × 10–3 | 2625 | 2626 (2716 [54], 2680 [55], 2482 [56]) | 0.06 |
| CO2 | 1.78 × 10–2 | 1.03 × 10–2 | 1268 | 1270 (1218 [57], 1338 [58], 1310 [59], 1214 [60]) | 0.19 |
| Xe | 1.60 × 10–1 | 6.70 × 10–2 | 154 | 154 (154 [61], 155 [62], 153 [24]) | 0.19 |
| H2S | 2.53 × 10–1 | 1.07 × 10–1 | 96 | 96 (93 [63], 100 [64], 95 [65]) | 0.26 |
Относительные погрешности (δ) рассчитанных давлений диссоциации газовых гидратов составляют 0.06–0.26% от средних экспериментально определенных (табл. 3), следовательно, полученные параметры потенциала Кихара могут быть использованы для теоретического расчета коэффициентов газогидратного распределения.
Из уравнений (10), (11), (13) для метансодержащих газовых смесей при нормированном увеличении концентрации Xe и уменьшении концентраций остальных газов получены значения доли заполненных газами малых и больших газогидратных полостей, средняя доля заполненных газами полостей и коэффициент газогидратного распределения (табл. 4–6). Расчет параметров газогидратного равновесия проводился при постоянном давлении, равном давлению диссоциации газовой смеси при максимальной концентрации газа с наибольшим давлением диссоциации газового гидрата CH4 = 94.85 об. %. Давление Xe было увеличено на 1 кПа, а давления газов CH4, H2S, CO2 были нормированы на постоянное давление газовой смеси.
Таблица 4.
Доля заполненных газами малых (Q1) и больших (Q2) газогидратных полостей, средняя доля заполненных газами полостей (Qi) и коэффициент газогидратного распределения (Ki) для газовой смеси CH4 + H2S + + Xe при различных концентрациях (Ci) извлекаемого газа – Xe при Т = 273.15 K и Pсмеси = 1113.94 кПа
| Газ | Ci, % | Q1, % | Q2, % | Qi, % | Ki | Ci, % | Q1, % | Q2, % | Qi, % | Ki |
|---|---|---|---|---|---|---|---|---|---|---|
| CH4 | 94.85 | 35.07 | 48.44 | 45.10 | 0.51 | 94.76 | 34.83 | 48.21 | 44.86 | 0.51 |
| H2S | 5.00 | 59.58 | 43.45 | 47.48 | 10.16 | 5.00 | 59.18 | 43.23 | 47.22 | 10.11 |
| Xe | 0.15 | 1.13 | 0.82 | 0.89 | 6.37 | 0.24 | 1.79 | 1.30 | 1.42 | 6.34 |
| ∑ | 93.48 | 93.51 | ||||||||
| CH4 | 94.68 | 34.60 | 47.97 | 44.63 | 0.50 | 94.59 | 34.37 | 47.73 | 44.39 | 0.50 |
| H2S | 4.99 | 58.78 | 43.02 | 46.96 | 10.06 | 4.99 | 58.39 | 42.81 | 46.71 | 10.01 |
| Xe | 0.33 | 2.45 | 1.78 | 1.95 | 6.31 | 0.42 | 3.09 | 2.25 | 2.46 | 6.28 |
| ∑ | 93.53 | 93.56 | ||||||||
| CH4 | 94.51 | 34.14 | 47.50 | 44.16 | 0.50 | 94.42 | 33.91 | 47.27 | 43.93 | 0.50 |
| H2S | 4.98 | 58.00 | 42.60 | 46.45 | 9.96 | 4.98 | 57.61 | 42.39 | 46.20 | 9.91 |
| Xe | 0.51 | 3.74 | 2.73 | 2.98 | 6.25 | 0.60 | 4.37 | 3.19 | 3.49 | 6.22 |
| ∑ | 93.59 | 93.62 |
Таблица 5.
Доля заполненных газами малых (Q1) и больших (Q2) газогидратных полостей, средняя доля заполненных газами полостей (Qi) и коэффициент газогидратного распределения (Ki) для газовой смеси CH4 + CO2 + + Xe при различных концентрациях (Ci) извлекаемого газа – Xe при Т = 273.15 K и Pсмеси = 2444.32 кПа
| Газ | Ci, % | Q1, % | Q2, % | Qi, % | Ki | Ci, % | Q1, % | Q2, % | Qi, % | Ki |
|---|---|---|---|---|---|---|---|---|---|---|
| CH4 | 94.85 | 82.98 | 85.53 | 84.89 | 0.95 | 94.81 | 82.39 | 85.20 | 84.49 | 0.94 |
| CO2 | 5.00 | 9.84 | 7.26 | 7.91 | 1.67 | 5.00 | 9.77 | 7.23 | 7.87 | 1.67 |
| Xe | 0.15 | 2.62 | 1.40 | 1.70 | 12.02 | 0.19 | 3.32 | 1.77 | 2.16 | 11.96 |
| ∑ | 94.50 | 94.52 | ||||||||
| CH4 | 94.77 | 81.80 | 84.87 | 84.10 | 0.94 | 94.73 | 81.22 | 84.55 | 83.72 | 0.93 |
| CO2 | 5.00 | 9.70 | 7.21 | 7.83 | 1.66 | 4.99 | 9.63 | 7.18 | 7.79 | 1.65 |
| Xe | 0.23 | 4.01 | 2.15 | 2.61 | 11.90 | 0.27 | 4.69 | 2.52 | 3.06 | 11.84 |
| ∑ | 94.54 | 94.56 | ||||||||
| CH4 | 94.69 | 80.65 | 84.23 | 83.33 | 0.93 | 94.65 | 80.09 | 83.91 | 82.95 | 0.93 |
| CO2 | 4.99 | 9.56 | 7.15 | 7.75 | 1.64 | 4.99 | 9.49 | 7.12 | 7.72 | 1.63 |
| Xe | 0.31 | 5.36 | 2.89 | 3.50 | 11.78 | 0.36 | 6.02 | 3.25 | 3.94 | 11.73 |
| ∑ | 94.58 | 94.60 |
Таблица 6.
Доля заполненных газами малых (Q1) и больших (Q2) газогидратных полостей, средняя доля заполненных газами полостей (Qi) и коэффициент газогидратного распределения (Ki) для газовой смеси CH4 + H2S + + CO2 +Xe при различных концентрациях (Ci) извлекаемого газа – Xe при Т = 273.15 K и Pсмеси = 1522.36 кПа
| Газ | Ci, % | Q1, % | Q2, % | Qi, % | Ki | Ci, % | Q1, % | Q2, % | Qi, % | Ki |
|---|---|---|---|---|---|---|---|---|---|---|
| CH4 | 94.85 | 49.27 | 61.78 | 58.65 | 0.66 | 94.79 | 48.93 | 61.50 | 58.35 | 0.66 |
| H2S | 2.50 | 41.85 | 27.70 | 31.24 | 13.32 | 2.50 | 41.56 | 27.58 | 31.07 | 13.25 |
| CO2 | 2.50 | 2.95 | 2.67 | 2.74 | 1.17 | 2.50 | 2.93 | 2.66 | 2.73 | 1.16 |
| Xe | 0.15 | 1.58 | 1.04 | 1.18 | 8.36 | 0.22 | 2.26 | 1.49 | 1.68 | 8.32 |
| ∑ | 93.81 | 93.84 | ||||||||
| CH4 | 94.73 | 48.60 | 61.21 | 58.06 | 0.65 | 94.66 | 48.26 | 60.93 | 57.77 | 0.65 |
| H2S | 2.50 | 41.28 | 27.45 | 30.91 | 13.19 | 2.50 | 40.99 | 27.33 | 30.74 | 13.12 |
| CO2 | 2.50 | 2.91 | 2.65 | 2.71 | 1.16 | 2.50 | 2.89 | 2.64 | 2.70 | 1.15 |
| Xe | 0.28 | 2.93 | 1.94 | 2.19 | 8.27 | 0.35 | 3.59 | 2.38 | 2.68 | 8.23 |
| ∑ | 93.87 | 93.89 | ||||||||
| CH4 | 94.60 | 47.93 | 60.66 | 57.48 | 0.65 | 94.54 | 47.61 | 60.38 | 57.19 | 0.64 |
| H2S | 2.49 | 40.72 | 27.20 | 30.58 | 13.06 | 2.49 | 40.44 | 27.08 | 30.42 | 12.99 |
| CO2 | 2.49 | 2.87 | 2.63 | 2.69 | 1.15 | 2.49 | 2.85 | 2.61 | 2.67 | 1.14 |
| Xe | 0.41 | 4.25 | 2.82 | 3.18 | 8.19 | 0.48 | 4.89 | 3.26 | 3.66 | 8.15 |
| ∑ | 93.92 | 93.95 |
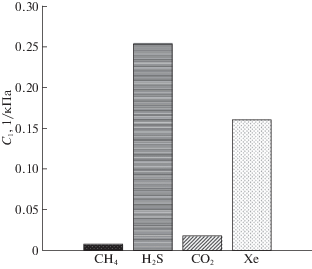
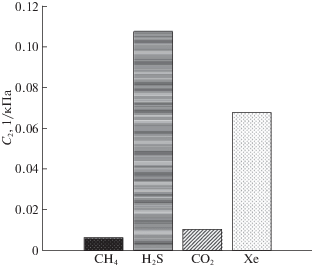
Таблицы 4–6 показывают, что при нормированном увеличении концентрации Xe и уменьшении концентраций CH4, H2S, CO2, суммарная начальная концентрация (давление) всех газов остается постоянным, однако суммарная концентрация газов в газогидратной фазе увеличивается, так как увеличивается концентрация Xe в газогидратной фазе. Из уравнения (13) следует, что чем больше суммарная доля заполненных газами газогидратных полостей, тем меньше коэффициент газогидратного распределения. Долю заполненных газами малых и больших газогидратных полостей характеризуют значения констант Ленгмюра (рис. 1, 2).
Из рис. 1 и 2 видно, что в рассматриваемых газовых смесях малые и большие газогидратные полости в основном заполнены молекулами H2S и Xe, т.e. эти молекулы являются лучшими гидратообразователями (имеют низкое давление диссоциации газового гидрата) по сравнению с молекулами CH4 и CO2. Давления диссоциации газовых гидратов (9) определяются константами Ленгмюра (1). Адсорбция газов газогидратными полостями в большей степени определяется радиусом взаимодействия ядер молекул (ai): чем меньше значение ai, тем больше адсорбция газовых молекул газогидратными полостями. Так как для сферических газовых молекул a(CH4) > a(Xe), следовательно, Xe будет адсорбироваться в большей степени газогидратными полостями. В случае несферических газовых молекул a(CO2) > a(H2S), следовательно, H2S будет адсорбироваться в большей степени газогидратными полостями.
На рис. 3 показана зависимость коэффициента газогидратного распределения Xe от концентрации Xe в различных газовых смесях при постоянных давлениях газовых смесей, соответствующих давлению диссоциации газовой смеси при максимальной концентрации CH4.
Рис. 3.
Зависимости коэффициента газогидратного распределения Xe в различных газовых смесях от концентрации Xe при Т = 273.15 K; 1 – CH4 + CO2 + Xe (Pсмеси = 2444.32 кПа), 2 – CH4 + H2S + CO2 + Xe (Pсмеси = 1522.36 кПа), 3 – CH4 + H2S + Xe (Pсмеси = = 1113.94 кПа).
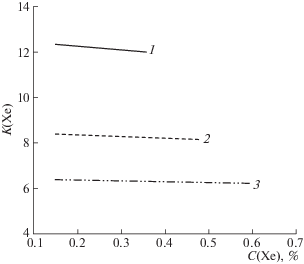
Из рис. 3 видно, что коэффициент газогидратного распределения Xe существенно зависит от состава газовой смеси и слабо зависит от изменения концентрации Xe. В первой газовой смеси лучшим гидратообразователем является Xe, так как это газ с наименьшим давлением диссоциации газового гидрата (Pдис(Xe) < Pдис(CO2) < < Pдис(CH4)). Лучшим гидратообразователем во второй и третьей газовых смесях является H2S, так как это газ с наименьшим давлением диссоциации газового гидрата (Pдис(H2S) < Pдис(Xe) < < Pдис(CO2) < Pдис(CH4)). Следовательно, наиболее эффективно извлечение Xe из газовой смеси CH4 = 94.85 об. %, CO2 = 5.00 об. %, Xe = 0.15 об. %.
Таким образом, для эффективного извлечения Xe из природного газа методом газогидратной кристаллизации необходим состав газовой смеси без примесей с близким к Xe давлением диссоциации газового гидрата. Когда в газовой смеси присутствует H2S с достаточно высокой эффективностью выделяется как Xe, так и H2S. В связи с этим для выделения преимущественно Xe природный газ должен быть очищен от H2S или необходимо применять дополнительные методы разделения. Например, возможно использование мембранного газоразделения [18, 66], так как проницаемость благородных газов через промышленные полимерные мембраны типа полидиметилсилоксан (ПДМС) или триацетат целлюлозы (ТАЦ) на два порядка ниже, чем проницаемость H2S [67]. Также для отделения Xe от следовых примесей могут быть использованы гибридные и комбинированные методы, такие как мембранная колонна [68, 69], газогидратно-мембранное разделение [70] и т.д.
В результате теоретических расчетов установлено, что газогидратные полости заполнены газом не полностью. Средние доли заполненных газами малых и больших газогидратных полостей для рассматриваемых газовых смесей составляют 95.70 и 93.42 об. % соответственно. Для дальнейшего моделирования газогидратной кристаллизации рассмотрим зависимость средней доли заполненных газами полостей от давления газовой смеси CH4 = 94.85 об. %, H2S = 2.50 об. %, CO2 = = 2.50 об. %, Xe = 0.15 об. %, наиболее приближенной к составу природного газа (табл. 7). Давление газовой смеси увеличивается от давления диссоциации газовой смеси при T = 273.15 K до давления диссоциации газового гидрата CH4 при T = 273.15 K.
Таблица 7.
Средняя доля заполненных газами полостей газовой смеси CH4 + H2S + CO2 + Xe от давления газовой смеси при T = 273.15 K
| Pсмеси, кПа | CH4 | H2S | CO2 | Xe | $\sum {{{Q}_{i}}} $, % | ||||
|---|---|---|---|---|---|---|---|---|---|
| Q1, % | Q2, % | Q1, % | Q2, % | Q1, % | Q2, % | Q1, % | Q2, % | ||
| 1522 | 49.27 | 61.78 | 41.85 | 27.70 | 2.95 | 2.67 | 1.58 | 1.04 | 93.81 |
| 1802 | 49.61 | 62.44 | 42.14 | 28.00 | 2.97 | 2.70 | 1.59 | 1.05 | 94.72 |
| 2081 | 49.86 | 62.93 | 42.35 | 28.22 | 2.98 | 2.72 | 1.60 | 1.06 | 95.40 |
| 2361 | 50.05 | 63.31 | 42.51 | 28.39 | 2.99 | 2.74 | 1.61 | 1.07 | 95.92 |
| 2640 | 50.20 | 63.61 | 42.64 | 28.53 | 3.00 | 2.75 | 1.61 | 1.07 | 96.33 |
Из табл. 7 следует, что при увеличении давления газовой смеси CH4+H2S+CO2+Xe от 1522 до 2640 кПа средняя доля заполненных газами полостей увеличивается на 2.69%.
Так как изменение температуры и давления влияет на процесс гидратообразования, рассмотрим зависимость коэффициента газогидратного распределения Xe от температуры и давления газовой смеси CH4 = 94.85 об. %, H2S = 2.50 об. %, CO2 = 2.50 об. %, Xe = 0.15 об. % (рис. 4). Давление газовой смеси увеличивается от давления диссоциации газового гидрата до давления диссоциации газового гидрата CH4 при данной температуре.
Рис. 4.
Зависимость коэффициента газогидратного распределения Xe от температуры и давления газовой смеси CH4 + H2S + CO2 + Xe.
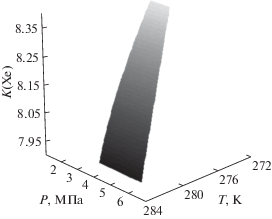
При увеличении температуры и давления газовой смеси CH4 + H2S + CO2 + Xe уменьшается коэффициент газогидратного распределения Xe (рис. 4). В температурном диапазоне 273.15–283.15 K максимальный коэффициент газогидратного распределения Xe равен 8.36 при Pсмеси = = 1522 кПа и T = 273.15 K, минимальный коэффициент газогидратного распределения Xe равен 7.93 при Pсмеси = 6199 кПа и T = 283.15 K. Таким образом, при увеличении температуры процесса гидратообразования на 10 K коэффициент газогидратного распределения Xe уменьшился на 5.42%. Это связано с тем, что при увеличении температуры и давления газовой смеси создаются условия для перехода в газогидратное состояние газов с высоким давлением диссоциации газовых гидратов, например, CH4 и CO2, газовые молекулы перераспределяются в газогидратных полостях.
ВЫВОДЫ
Для определения эффективных условий извлечения Xe из природного газа смоделировано извлечение Xe из метансодержащих газовых смесей. Установлено, что коэффициент газогидратного распределения Xe существенно зависит от состава газовой смеси и слабо зависит от изменения концентрации извлекаемого газа. Установлено, что в газовой смеси CH4 = 94.85 об. %, H2S = = 2.50 об. %, CO2 = 2.50 об. %, Xe = 0.15 об. %, приближенной к составу природного газа, при увеличении давления газовой смеси увеличивается средняя доля заполненных газами полостей. Показано, что для повышения эффективности извлечения Xe необходимо понижать как температуру процесса гидратообразования, так и давление процесса гидратообразования до давления диссоциации Xe, а также содержание H2S должно быть понижено до следового уровня (≈3 × 10–4 об. %).
Работа выполнена при финансовой поддержке Российского научного фонда (код проекта № 17-79-20286).
Список литературы
Zundu L., Aidong J., Yichuan H., Minwang Q. // Chinese Phys. Lett. 1989. V. 6. № 10. P. 440.https://doi.org/10.1088/0256-307X/6/10/003
Matsuda O., Yaguchi T. Filling Composition for Incandescent Lamp, and Incandescent Lamp Containing the Same and Its Use. Patent US5432408A, 1995.
Neiger M., Hoppstock R., Kleiner B. Xenon Short Arc Discharge Lamp. Patent US4937496A, 1990.
Sanders R.D., Ma D., Maze M. // Br. Med. Bull. 2005. V. 71. № 1. P. 115.https://doi.org/10.1093/bmb/ldh034
Challoner A.D., Poeschel R.L. Spacecraft with Modulated Thrust Electrostatic Ion Thruster and Associated Method. Patent US4825646A, 1955.
Gallucci G. // J. Phys. Conf. Ser. 2009. V. 160. № 1. P. 12011.https://doi.org/10.1088/1742-6596/160/1/012011
Басов Н.Г., Данилычев В.А., Попов Ю.М., Ходкевич Д.Д. // Письма в ЖЭТФ. 1970. Т. 12. № 10. С. 473.
Fontaine J.-P., Pointurier F., Blanchard X., Taffary T. // J. Environ. Radioact. 2004. V. 72. № 1–2. P. 129.https://doi.org/10.1016/S0265-931X03.00194-2
Holloway J.H., Schrobilgen G.J. // J. Chem. Soc., Chem. Commun. 1975. V. 76. № 15. P. 623.https://doi.org/10.1039/C39750000623
Winters H.F., Coburn J.W. // Appl. Phys. Lett. 1979. V. 34. № 1. P. 70.https://doi.org/10.1063/1.90562
Godish T., Davis W.T., Fu J.S. Air Quality. Boca Raton: CRC Press, 2014. 542 p.
Сметанников В.П., Орлов А.Н., Малинин Н.Н., Семенова О.П. Способ получения ксенонового концентрата из природного горючего газа, продуктов его переработки, включая техногенные отходящие газы, и устройство для его реализации. Патент RU2466086C2, 2010.
Guo B., Ghalambor A. Natural Gas Engineering Handbook. Houston: Gulf Publishing, 2014. 472 p.
Callaway M. Material and Method for the Sorption of Hydrogen Sulfide. Patent US8404031B1, 2013.
Belmabkhout Y., De Weireld G., Sayari A. // Langmuir.2009. V. 25. № 23. P. 13275.https://doi.org/10.1021/la903238y
Kohl A.L., Nielsen R.B. Gas Purification. Houston: Gulf Publishing, 1997. 1395 p.
Akhmetshina A.I., Gumerova O.R., Atlaskin A.A., Petukhov A.N. et al. // Sep. Purif. Technol. 2017. V. 176. P. 92.https://doi.org/10.1016/J.SEPPUR.2016.11.074
Vorotyntsev V.M. // Pet. Chem. 2015. V. 55. № 4. P. 259.https://doi.org/10.1134/S0965544115040106
Atlaskin A.A., Petukhov A.N., Yanbikov N.R. et al. // Chem. Process Eng. 2018. V. 39. № 3. P. 323.https://doi.org/10.24425/122953
Sergeeva M.S., Petukhov A.N., Trubyanov M.M. et al. // J. Phys.: Conf. Ser. 2018. V. 1134. P. 012078.https://doi.org/10.1088/1742-6596/1134/1/012078
Golombok M., Schoonebeek R. // Energy Technol. 2013. V. 1. № 8. P. 457.https://doi.org/10.1002/ente.201300066
Sloan E.D., Koh C.A. Clathrate Hydrates of Natural Gases. Boca Raton: CRC Press, 2008. 752 p.
Sergeeva M., Petukhov A., Vorotyntsev I. et al. // Pet. Sci. Technol. 2019. V. 37. № 1. P. 86.https://doi.org/10.1080/10916466.2018.1506806
Истомин В.А., Якушев В.С. Газовые гидраты в природных условиях. М.: Недра, 1992. 236 с.
Duc N.H., Chauvy F., Herri J.M. // Energy Convers. Manag. 2007. V. 48. № 4. P. 1313. .https://doi.org/10.1016/j.enconman.2006.09.024
Surovtseva D., Amin R., Barifcani A. // Chem. Eng. Res. Des. 2011. V. 89. № 9. P. 1752.https://doi.org/10.1016/j.cherd.2010.08.016
Tajima H., Yamasaki A., Kiyono F. // Energy. 2004. V. 29. P. 1713. .https://doi.org/10.1016/j.energy.2004.03.003
Zhong D.-L., Li Z., Lu Y.-Y., Wang J.-L. et al. // Appl. Energy. 2015. V. 158. P. 133.https://doi.org/10.1016/j.apenergy.2015.08.058
Seo Y.-T., Kang S.-P., Lee H., Lee C.-S. et al. // Korean J. Chem. Eng. 2000. V. 17. № 6. P. 659.https://doi.org/10.1007/BF02699114
Zhong D.-L., Daraboina N., Englezos P. // Fuel. 2013. V. 106. P. 425.https://doi.org/10.1016/J.FUEL.2013.01.029
Ildyakov A.V., Manakov A.Y., Zavjalov A.P., Bardakhanov S.P. // Chem. Eng. Technol. 2011. V. 34. № 10. P. 1733.https://doi.org/10.1002/ceat.201000513
He S., Liang D., Li D., Ma L. // Chem. Eng. Technol. 2011. V. 34. № 8. P. 1228.https://doi.org/10.1002/ceat.201000548
Lee E.K., Lee J.D., Lee H.J., Lee B.R. et al. // Environ. Sci. Technol. 2009. V. 43. № 20. P. 7723.https://doi.org/10.1021/es901350v
Gholipour Zanjani N., Zarringhalam Moghaddam A., Nazari K., Mohammad-Taheri M. // Chem. Eng. Technol. 2012. V. 35. № 11. P. 1973.https://doi.org/10.1002/ceat.201200089
Davidson D.W. // Water: a comprehensive treatise. 1973. V. 2. P. 115.
Yuhara D., Barnes B.C., Suh D., Knott B.C. et al. // Faraday Discuss. 2015. V. 179. P. 463.https://doi.org/10.1039/C4FD00219A
Jung J.-W., Santamarina J.C. // J. Cryst. Growth. 2012. V. 345. № 1. P. 61.https://doi.org/10.1016/J.JCRYSGRO.2012.01.056
Kirchner M.T., Boese R., Billups W.E., Norman L.R. // J. Am. Chem. Soc. 2004. V. 126. № 30. P. 9407.https://doi.org/10.1021/JA049247C
Jeffrey G.A., McMullan R.K. // Prog. Inorg. Chem. 1967. V. 8. P. 43.https://doi.org/10.1002/9780470166093.ch2
van der Waals J.H., Platteeuw J.C. // Adv. Chem. Phys. 1959. V. 2. P. 3.https://doi.org/10.1002/9780470143483.ch1
Platteeuw J.C., van der Waals J.H. // Mol. Phys. 1958. V. 1. № 1. P. 91.https://doi.org/10.1080/00268975800100111
Holder G.D., John V.T. // Fluid Phase Equilib. 1983. V. 14. P. 353. https://doi.org/10.1016/0378-381283.80141-1
John V.T., Holder G.D. // J. Phys. Chem. 1981. V. 85. № 13. P. 1811. https://doi.org/10.1021/j150613a010
John V.T., Holder G.D. // J. Phys. Chem. 1982. V. 86. № 4. P. 455. https://doi.org/10.1021/j100393a008
Holder G.D., Hand J.H. // AIChE J. 1982. V. 28. № 3. P. 440. https://doi.org/10.1002/aic.690280312
McKoy V., Sinanoglu O. // J. Chem. Phys. 1963. V. 38. № 12. P. 2946. https://doi.org/10.1063/1.1733625
Barrer R.M., Stuart W.I. // Proc. R. Soc. A: Math. Phys. Eng. Sci. 1957. V. 243. № 1233. P. 172. https://doi.org/10.1098/rspa.1957.0213.
Dean J.A. Lange’s Handbook of Chemistry. Oxford: McGraw-Hill, 1999. 1424 p.
Sloan E.D. Clathrate Hydrates of Natural Gases. New York: Marcel Dekker, 1998. 757 p.
Avlonitis D. // Chem. Eng. Sci. 1994. V. 49. № 8. P. 1161. https://doi.org/10.1016/0009-250994.85087-9
Martín A., Peters C.J. // J. Phys. Chem. C. 2009. V. 113. № 1. P. 422. https://doi.org/10.1021/jp8074546
Tee L.S., Gotoh S., Stewart W.E. // Ind. Eng. Chem. Fundam.1966. V. 5. № 3. P. 363. https://doi.org/10.1021/i160019a012
John V.T., Papadopoulos K.D., Holder G.D. // AIChE J. 1985. V. 31. № 2. P. 252. https://doi.org/10.1002/aic.690310212
Nixdorf J., Oellrich L.R. // Fluid Phase Equilib. 1997. V. 139. № 1–2. P. 325. https://doi.org/10.1016/S0378-381297.00141-6
Adisasmito S., Frank R.J., Sloan E.D. // J. Chem. Eng. Data. 1991. V. 36. № 1. P. 68. https://doi.org/10.1021/je00001a020
Smelik E.A., King H.E. // Am. Mineral. 1997. V. 82. № 1–2. P. 88. https://doi.org/10.2138/am-1997-1-211
Vlahakis J.G., Chen H.-S., Suwandi M.S., Barduhn A.J. // Syracuse Univ. Res. Dev. Rep. 1972. V. 14. P. 180.
Ohgaki K., Makihara Y., Takano K. // J. Chem. Eng. Japan. 1993. V. 26. № 5. P. 558.https://doi.org/10.1252/jcej.26.558
Fan S.-S., Guo T.-M. // J. Chem. Eng. Data. 1999. V. 44. № 4. P. 829.https://doi.org/10.1021/JE990011B
Goel N. // J. Pet. Sci. Eng. 2006. V. 51. № 3–4. P. 169.https://doi.org/10.1016/J.PETROL.2006.01.005
Ewing G.J., Ionescu L.G. // J. Chem. Eng. Data. 1974. V. 19. № 4. P. 367.https://doi.org/10.1021/je60063a006
Makogon T.Y., Mehta A.P., Sloan E.D. // J. Chem. Eng. Data. 1996. V. 41. № 2. P. 315.https://doi.org/10.1021/je950126p
Selleck F.T., Carmichael L.T., Sage B.H. // Ind. Eng. Chem. 1952. V. 44. № 9. P. 2219. https://doi.org/10.1021/ie50513a064
Carroll J. Natural Gas Hydrates: A Guide for Engineers. Waltham: Gulf Professional Publishing, 2014. 340 p.
Lundgaard L., Mollerup J.M. // Fluid Phase Equilib. 1991. V. 70. № 2–3. P. 199.https://doi.org/10.1016/0378-381291.85034-R
Baker R.W. Membrane Technology and Applications. Chichester: John Wiley & Sons, Inc., 2004. 538 p.
Mark J.E. Polymer Data Handbook. Oxford: Oxford University Press, Inc., 1999. 1040 p.
Атласкин А.А., Трубянов М.М., Янбиков Н.Р., Буковский М.В. и др. // Мембраны и мембранные технологии. 2018. Т. 8. № 3. С. 196. https://doi.org/10.1134/S2218117218030021
Hwang S.-T., Yuen K.H., Thorman J.M. // Sep. Sci. Technol. 1980. V. 15. № 4. P. 1069. https://doi.org/10.1080/01496398008076288
Воротынцев В.М., Малышев В.М., Воротынцев И.В., Батталов С.В. // Теоретические основы химической технологии. 2016. Т. 50. № 4. С. 463. https://doi.org/10.7868/S0040357116040163
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии