Журнал физической химии, 2019, T. 93, № 11, стр. 1638-1643
Системы вода–метансульфонат цинка (меди): термодинамические свойства фаз и фазовые равновесия
Е. В. Белова a, *, Д. И. Финкельштейн a, А. И. Максимов a, И. А. Успенская a, **
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: catrine2@mail.ru
** E-mail: ira386@gmail.com
Поступила в редакцию 08.04.2019
После доработки 08.04.2019
Принята к публикации 14.05.2019
Аннотация
Статическим методом при 298.15 K определено давление насыщенного пара воды и рассчитана активность растворителя в системах Zn(CH3SO3)2–H2O и Cu(CH3SO3)2–H2O. На основании данных о равновесиях жидкость–пар и жидкость–твердое определены параметры модели Питцера–Симонсона–Клегга для описания избыточной энергии Гиббса жидкой фазы. Оценены значения параметров стабильности гидратов Zn(CH3SO3)2 · 12H2O, Zn(CH3SO3)2 · 4H2O и Cu(CH3SO3)2 · 4H2O. Рассчитаны фрагменты фазовых диаграмм.
Метансульфоновая кислота и ее соли являются частью природного круговорота серы, эти соединения разлагаются под действием определенных бактерий [1, 2], поэтому метансульфонаты и их смеси не опасны для окружающей среды и могут быть востребованы в химической промышленности как реактивы “зеленой химии”. Растворы метансульфонатов цинка и меди уже находят применение в гальванопластике [3], четырехводные кристаллогидраты этих солей используются в качестве катализаторов в ряде органических реакций [4–6]. Растворы метансульфонатов могут выступать в качестве электролита в цинк-цериевых химических источниках тока [7]. В этой связи актуальной задачей является прогноз функциональных свойств промышленных многокомпонентных растворов, включающих метансульфонаты цинка и меди, и оптимизация условия выделения цинка и меди из таких смесей.
Целью настоящей работы было определение давления насыщенного пара воды в системах Zn(CH3SO3)2–H2O и Cu(CH3SO3)2–H2O с последующим построением на их основе термодинамических моделей жидкой фазы в этих системах. Рассчитанные параметры бинарных взаимодействий могут быть использованы в дальнейшем при моделировании свойств многокомпонентных смесей, содержащих, в числе прочего, метансульфонаты меди и цинка.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. Для синтеза Zn(CH3SO3)2 · 4H2O и Cu(CH3SO3)2 · 4H2O использовали реактивы, перечисленные в табл. 1. Все опыты проводили с дистиллированной водой, электропроводность которой при 25°С составляла 4.5 мкСм/см.
Таблица 1.
Используемые реактивы
| Название | Номер CAS | Производитель | Чистота | Очистка/Количество примесей |
|---|---|---|---|---|
| ZnO | 1314-13-2 | Компонент-Реактив | х. ч. | По паспорту реактива |
| Ba(OH)2 · 8H2O | 12230-71-6 | Лабтех | ч. д. а. | По паспорту реактива |
| CuSO4 · 5H2O | 7758-99-8 | Компонент-Реактив | х. ч. | По паспорту реактива |
| HSO3CH3 | 75-75-2 | Alfa Aesar | 98.0% | По паспорту реактива |
| Zn(CH3SO3)2 · 4H2O | Синтез, см. [8] | 99.94% 99.95% |
Перекристаллизация/РФлА, определение чистоты по пику плавления на ДСК | |
| Cu(CH3SO3)2 · 4H2O | Синтез, см. [8] | 99.9% | Перекристаллизация/РФлА |
Методика синтеза тетрагидратов Zn(CH3SO3)2 · 4H2O и Cu(CH3SO3)2 · 4H2O описана в работе [8]. Для идентификации синтезированных образцов и оценке степени их чистоты использовали рентгенофазовый (РФА) и рентгено-флюоресцентный (РФлА) анализ, дифференциальную сканирующую калориметрию, термогравиметрию и комплексонометрическое титрование.
В высушенных образцах Cu(CH3SO3)2 · 4H2O среднее количество воды составило 4.03 молекулы на 1 молекулу безводной соли; в Zn(CH3SO3)2 · 4H2O, который сушили при 40°C, 3.99 молекулы. По результатам комплексонометрического титрования содержание металла в соли составило 19.42 ± 0.06 мас. % (расчетное значение 19.49 мас. %) и 19.90 ± 0.08 мас. % (расчетное значение 19.96 мас. %) для Cu(CH3SO3)2 · 4H2O и Zn(CH3SO3)2 · 4H2O соответственно.
Измерение давления пара осуществляли статическим методом при температуре 25°С/298.15 K на установке, подробно описанной в [9]. Образцы для опытов готовили растворением навески четырехводных кристаллогидратов. Концентрации растворов определяли до и после дегазации системы, чтобы учесть потерю растворителя при дегазации системы.
Для описания термодинамических свойств жидкой фазы выбрана модель Питцера–Симонсона–Клегга [10]. Параметризация термодинамической модели жидкой фазы проводилась в среде MATLAB. Для этого минимизировалась целевая функция вида:
(1)
$\begin{gathered} F({{X}_{1}}, \ldots ,{{X}_{n}},{{\theta }_{1}}, \ldots ,{{\theta }_{k}}) = \\ = \mathop \sum \limits_x \mathop \sum \limits_{i = 1 \ldots n} {{w}_{x}}{{(X_{i}^{{{\text{exp}}}} - X_{i}^{{{\text{calc}}}}({{\theta }_{1}}, \ldots ,{{\theta }_{k}}))}^{2}}, \\ \end{gathered} $В настоящей работе для каждой из систем оптимизированы параметры ${{\alpha }_{0}}$, ${{\alpha }_{1}}$, $B_{{MX}}^{0}$, $B_{{MX}}^{1}$, ${{W}_{{s,MX}}}$, ${{U}_{{s,MX}}}$, ${{V}_{{s,MX}}}$ а также параметры стабильности всех гидратов, для которых имелись экспериментальные данные о растворимости при разных температурах [8]. Для всех параметров рассчитаны их доверительные интервалы для 95% вероятности с помощью встроенной функции nlparci.
Результаты измерения давления насыщенного пара в системе Zn(CH3SO3)2–H2O при 25°С (298.15 K) приведены в табл. 2. Результаты измерения давления насыщенного пара в системе Cu(CH3SO3)2–H2O при 25°С (298.15 K) приведены в табл. 3.
Таблица 2.
Давление насыщенного пара и активность воды в системе Zn(CH3SO3)2–H2O при Т = 298.15 K
| № | w, мас. % | u(w), мас. % | P, кПа | u(P), кПа | aэксп | u(aэксп) | Pрасч, кПа |
|---|---|---|---|---|---|---|---|
| 1 | 45.01 | 0.12 | 2.310 | 0.01 | 0.729 | 0.004 | 2.313 |
| 2 | 39.78 | 0.11 | 2.564 | 0.01 | 0.809 | 0.004 | 2.558 |
| 3 | 25.12 | 0.10 | 2.908 | 0.02 | 0.917 | 0.005 | 2.916 |
| 4 | 21.47 | 0.09 | 2.948 | 0.01 | 0.931 | 0.004 | 2.962 |
| 5 | 17.08 | 0.09 | 3.026 | 0.02 | 0.955 | 0.005 | 3.007 |
| 6 | 9.44 | 0.08 | 3.080 | 0.02 | 0.972 | 0.005 | 3.079 |
Таблица 3.
Давление насыщенного пара и активность воды в системе Cu(CH3SO3)2–H2O при 298.15 K
| № | w, мас. % | u(w), мас. % | P, кПа | u(P), кПа | aэксп | u(aэксп) | Pрасч, кПа |
|---|---|---|---|---|---|---|---|
| 1 | 41.53 | 0.12 | 2.474 | 0.01 | 0.780 | 0.004 | 2.468 |
| 2 | 34.37 | 0.11 | 2.689 | 0.01 | 0.849 | 0.004 | 2.688 |
| 3 | 29.61 | 0.10 | 2.797 | 0.01 | 0.883 | 0.004 | 2.809 |
| 4 | 22.03 | 0.09 | 2.978 | 0.02 | 0.940 | 0.005 | 2.963 |
| 5 | 15.95 | 0.08 | 3.072 | 0.02 | 0.970 | 0.005 | 3.052 |
| 6 | 12.91 | 0.07 | 3.091 | 0.02 | 0.975 | 0.005 | 3.086 |
Результаты расчета параметров модели Питцера–Симонсона–Клегга. Расчет параметров модели Питцера–Симонсона–Клегга проводился в два этапа. Сначала определяли значения $B_{{MX}}^{0}$, $B_{{MX}}^{1}$, ${{W}_{{s,MX}}}$, ${{U}_{{s,MX}}}$, ${{V}_{{s,MX}}}$, (${{\alpha }_{0}}$, ${{\alpha }_{1}}$ были фиксированы) с использованием экспериментальных данных по равновесию жидкость–пар при 298.15 K (наст. работа), затем уточняли температурную зависимость параметров $B_{{MX}}^{0}$, $B_{{MX}}^{1}$, ${{W}_{{s,MX}}}$, ${{U}_{{s,MX}}}$, ${{V}_{{s,MX}}}$, используя экспериментальные данные по равновесию лед–жидкость [8]. Рекомендуемые значения параметров приведены в табл. 4. О качестве описания экспериментальных данных можно судить по расчетным значениям давления паров воды над растворами систем Zn(CH3SO3)2–H2O и Cu(CH3SO3)2–H2O (последние столбцы табл. 2 и 3, соответственно), полученным с помощью уравнения
(2)
$p_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{{\text{расч}}}} = p_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{{\text{(s)}}}}{{x}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}{{\gamma }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}.$(3)
${{\Delta }_{{\text{m}}}}{{G}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}(T) + RT\ln ({{x}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}{{\gamma }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}(x,T)) = 0.$Таблица 4.
Параметры модели Питцера–Симонсона–Клегга для жидкой фазы и параметры стабильности кристаллогидратов в системах Zn(CH3SO3)2–H2O и Cu(CH3SO3)2–H2O
| Параметр | Zn(CH3SO3)2–H2O | Cu(CH3SO3)2–H2O |
|---|---|---|
| Жидкая фаза | ||
| ${{\alpha }_{0}}$ | 13 | |
| ${{\alpha }_{1}}$ | 2 | |
| $B_{{MX}}^{0}$ | (1179.7 ± 80) – (17.892363 ± 3) (T – 298.15) | (–402.91 ± 290) |
| $B_{{MX}}^{1}$ | –289.32663 ± 17 | (92.25472 ± 9) – (1.0866188 ± 0.2) (T – 298.15) |
| ${{W}_{{s,MX}}}$ | –37.700239 ± 2 | 0 |
| Соединение | а | b | с |
|---|---|---|---|
| Твердые фазы | |||
| Zn(CH3SO3)2 · 12H2O | 144193.321 ± 10000 | 3854.7703 ± 600 | – |
| Zn(CH3SO3)2 · 4H2O | −1941.5932 ± 1600 | 312.764378 ± 80 | 0 |
| Cu(CH3SO3)2 · 8H2O | 17494.56 ± 100 | 0 | 0 |
| Cu(CH3SO3)2 · 4H2O | 24810.43 ± 160 | 246.026 ± 4 | 0.810983 ± 0.2 |
Параметры стабильности (${{\Delta }_{{\text{m}}}}G$) четырех кристаллогидратов оценены при минимизации целевой функции (1), включающей в себя данные по равновесию жидкость–твердое из работы [8]. Расчетные значения термодинамических функций получены решением следующих нелинейных уравнений относительно температуры:
(4)
$\begin{gathered} {{\Delta }_{{\text{m}}}}G\left( T \right) + RT\left( {12\ln \frac{{{{x}_{{{{{\text{H}}}_{2}}{\text{O}}}}}{{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}}}}(x,T)}}{{x_{{{{{\text{H}}}_{2}}{\text{O}}}}^{{{\text{hydr}}}}\gamma _{{{{{\text{H}}}_{2}}{\text{O}}}}^{{{\text{hydr}}}}({{x}^{{{\text{hydr}}}}},T)}}\mathop + \limits_{_{{_{{_{{_{{_{{_{{_{{_{{_{{}}}}}}}}}}}}}}}}}}}^{} } \right. \\ + \,\left. {\ln \frac{{{{x}_{{{\text{Z}}{{{\text{n}}}^{{2 + }}}}}}{{\gamma }_{{{\text{Z}}{{{\text{n}}}^{{2 + }}}}}}(x,T){{{({{x}_{{{\text{C}}{{{\text{H}}}_{3}}{\text{SO}}_{3}^{ - }}}}{{\gamma }_{{{\text{C}}{{{\text{H}}}_{3}}{\text{SO}}{{{_{3}^{ - }}}^{ - }}}}}\left( {x,T} \right))}}^{2}}}}{{x_{{{\text{Z}}{{{\text{n}}}^{{2 + }}}}}^{{{\text{hydr}}}}\gamma _{{{\text{Z}}{{{\text{n}}}^{{2 + }}}}}^{{{\text{hydr}}}}({{x}^{{{\text{hydr}}}}},T){{{(x_{{{\text{C}}{{{\text{H}}}_{3}}{\text{SO}}_{3}^{ - }}}^{{{\text{hydr}}}}\gamma _{{{\text{C}}{{{\text{H}}}_{3}}{\text{SO}}_{3}^{ - }}}^{{{\text{hydr}}}}({{x}^{{{\text{hydr}}}}},T))}}^{2}}}}} \right)\, = \\ = \;0 \\ \end{gathered} $(5)
$\begin{gathered} {{\Delta }_{{\text{m}}}}G(T) + RT(n\ln ({{x}_{{{{{\text{H}}}_{2}}{\text{O}}}}}{{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}}}}(x,T)) + \\ + \;\ln ({{x}_{{{\text{M}}{{{\text{e}}}^{{2 + }}}}}}{{\gamma }_{{{\text{M}}{{{\text{e}}}^{{2 + }}}}}}(x,T){{({{x}_{{{\text{C}}{{{\text{H}}}_{3}}{\text{SO}}_{3}^{ - }}}}{{\gamma }_{{{\text{C}}{{{\text{H}}}_{3}}{\text{SO}}_{3}^{ - }}}}(x,T))}^{2}})) = 0 \\ \end{gathered} $В представленных выше формулах Me = = Cu, Zn; n – количество воды в гидрате Me(CH3SO3)2 · nH2O; xi – мольная доля i-го составляющего, рассчитанная с учетом полной диссоциации электролита; $x_{i}^{{{\text{hydr}}}}$ – мольная доля i-го составляющего в растворе, полученном при конгруэнтном плавлении гидрата Me(CH3SO3)2 · nH2O.
Для описания температурной зависимости параметров стабильности использованы функции вида
(6)
$\begin{gathered} {{\Delta }_{{\text{m}}}}G = a(1 - T{\text{/}}299.3) + b(T - 299.3) - \\ - \;bT\ln \left( {\frac{T}{{299.3}}} \right), \\ \end{gathered} $Все параметры приведены с избыточным числом значащих цифр, чтобы при проведении арифметических операций с округленными цифрами не потерять в точности описания свойств системы.
Данные по зависимости активности воды при 25°С (298.15 K) от состава для бинарных растворов метансульфонатов цинка и меди представлены символами на рис. 1а, 1б. Для сравнения на графики нанесены кривые a(H2O) = f(m1/2) для систем ZnCl2–H2O [11], Zn(NO3)2–H2O [12]. CuCl2–H2O [13] и Cu(NO3)2–H2O [14].
Рис. 1.
Активность воды при 25°С/298.15 K в зависимости от состава (m1/2) бинарных растворов систем H2O–Zn(CH3SO3)2 (а) и Cu(CH3SO3)2 (б). Размеры символов превышают погрешность определения активности.
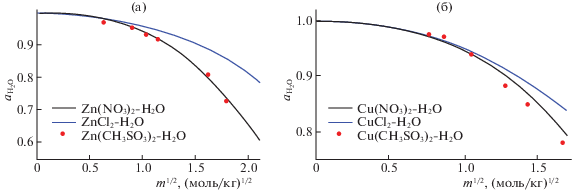
Как видно из рис. 1а, активности растворителя в системах Zn(NO3)2–H2O и Zn(CH3SO3)2–H2O близки по значению при одинаковых моляльностях растворов. Известно, что в растворах Zn(NO3)2 преимущественно образуются ионы [Zn(H2O)6]2+ и NO$_{3}^{ - }$, в отличие от ZnCl2, в растворах которого некоторая часть анионов связывается в комплексы или образуют сетчатые структуры. Исходя из строения Zn(CH3SO3)2 · 12H2O, кристаллизующегося при температуре ниже комнатной [8], и большинства кристаллогидратов Zn(NO3)2, также содержащих структурные фрагменты {Zn(H2O)6}, можно предположить, что в растворах Zn(CH3SO3)2 преобладают ионы [Zn(H2O)6]2+ и несвязанные в комплекс анионы – CH3SO$_{3}^{ - }$. Зависимость активности от состава растворов также свидетельствует в пользу этой гипотезы.
В отличие от солей цинка, для растворов систем Cu(NO3)2–H2O и Cu(CH3SO3)2–H2O наблюдаются более явно выраженные отличия в значениях активности растворителя при одинаковых моляльностях смесей (рис. 1б). При этом можно видеть, что активность растворителя в хлоридной системе при прочих равных условиях выше, чем в растворах нитрата и метансульфоната меди, что, по всей видимости, также связано с преобладанием аквакатионов в растворах этих систем и наличием хлоридных комплексов – в растворах хлорида меди.
Активности воды, рассчитанные по модели Питцера–Симонсона–Клегга с параметрами, указанными в табл. 4, хорошо согласуются с экспериментальными данными (рис. 2). Как видно из рис. 3, эти параметры позволяют также получить адекватное описание линии кристаллизации льда.
Рис. 2.
Давление пара H2O при 25°С/298.15 K в зависимости от состава бинарных систем H2O–Zn(CH3SO3)2 (а) и Cu(CH3SO3)2 (б) (w); точками показаны экспериментальные данные (наст. работа; размер символов сопоставим с экспериментальной погрешностью), линией – расчет (наст. работа).

Рис. 3.
Линия ликвидуса льда при P = 1 бар в бинарных системах H2O–Zn(CH3SO3)2 (а) и Cu(CH3SO3)2 (б); точками показаны экспериментальные данные [8] ($ \bullet $ – из кривых ДСК, размер символа сопоставим с экспериментальной погрешностью); линией – расчет (наст. работа).

Оптимизированные параметры жидкой фазы использовали далее для оценки термодинамических свойств кристаллогидратов Zn(CH3SO3)2 · 12H2O, Zn(CH3SO3)2 · 4H2O Cu(CH3SO3)2 · 8H2O и Cu(CH3SO3)2 · 4H2O на основе данных о растворимости этих фаз [8]. Для трех указанных соединений удалось получить статистически значимые оценки параметров стабильности (нижняя часть табл. 4). О качестве описания кривой кристаллизации Zn(CH3SO3)2 · 12H2O можно судить по рис. 4; отклонение расчетных и измеренных величин связано с заметным разбросом имеющихся экспериментальных данных. В случае гидрата Cu(CH3SO3)2 · 8H2O удалось оценить только один параметр “а” в уравнении (6), так как данные по растворимости этого соединения отсутствуют, в работе [8] методом ДСК получены температура перитектического распада и координаты эвтектики со стороны льда.
В целом, судя по рис. 5 и 6, результаты расчета фазовых диаграмм систем Zn(CH3SO3)2–H2O и Cu(CH3SO3)2–H2O удовлетворительно согласуются с экспериментальными данными, представленными в работе [8].
Рис. 5.
Фазовая диаграмма системы Zn(CH3SO3)2–H2O: A = Zn(CH3SO3)2 · 12H2O, B = Zn(CH3SO3)2 · 4H2O, I = лед, символы – экспериментальные данные [8] ($\blacktriangledown $ – по растворимости, $ \bullet $ – из кривых ДСК), линии – результаты расчета (наст. работа).

Рис. 6.
Фазовая диаграмма системы Cu(CH3SO3)2–H2O, A = Cu(CH3SO3)2 · 8H2O, B = Cu(CH3SO3)2 · 4H2O, I = лед, символы – экспериментальные данные [8] ($\blacktriangledown $ – по растворимости, $ \bullet $ – из кривых ДСК), линии – результаты расчета (наст. работа).

Таким образом, в результате проделанной работы получены новые экспериментальные данные о парожидкостных равновесиях в системах вода–метансульфонат цинка и вода–метансульфонат меди; построены термодинамические модели твердых фаз и растворов, с помощью которых рассчитаны фазовые диаграммы бинарных систем. Анализ имеющихся данных позволяет сделать следующие выводы.
1. Значения активности растворителя в системах метансульфонат цинка–вода и нитрат цинка–вода близки при одинаковых концентрациях солей, что, по-видимому, связано с присутствием в растворе гексааквакатионов и сравнимыми вкладами короткодействующих взаимодействий вплоть до концентраций 4–5 моль/кг (насыщенных растворов).
2. Значения активности растворителя в системах метансульфонат меди–вода и нитрат меди–вода различаются при одинаковых концентрациях солей выше 1 моль/кг: по-видимому, в этом концентрационном диапазоне вклад короткодействующих взаимодействий между гексааквакатионом и анионами проявляется в большей степени, чем в случае цинка.
3. Параметры стабильности гидратов Zn(CH3SO3)2 · 12H2O, Zn(CH3SO3)2 · 4H2O и Cu(CH3SO3)2 · 4H2O, полученные в настоящей работе, можно использовать в системах большей компонентности. Параметры стабильности Cu(CH3SO3)2 · 8H2O требуют уточнения и могут быть использованы только для предварительного прогноза растворимости в многокомпонентных системах, содержащих метансульфонаты меди.
Работа выполнена в рамках темы “Химическая термодинамика” (АААА-А16-116061750195-2) и частично при финансовой поддержке молодежного проекта Российского фонда фундаментальных исследований (код проекта № 16-33-00958). Особую благодарность авторы выражают Воскову Алексею Леонидовичу за предоставленный скрипт, рассчитывающий коэффициенты активности и избыточную часть энергии Гиббса по модели Питцера–Симонсона–Клегга в среде MATLAB.
Список литературы
Gernon M.D., Wu M., Buszta T., Janney P. // Green Chemistry. 1999. V. 1. P. 127.
Bentley R., Chasteen T.G. // Chemosphere. 2004. V. 55. P. 291.
Hasan M., Rohan J.F. // J. Electrochem. Soc. 2010 V. 157. P. 278.
Jiang H. // React. Kinet. Catal. L. 2005. V. 84. P. 223.
Wang M., Wang Z.-C., Sun Z.-L., Jiang H. // Transit. Metal Chem. 2005. V. 30. P. 792.
Wang M., Gong H., Jiang H., Wang Z. // Synth. Commun. 2006. V. 36. P. 1953.
Leung P.K., Ponce-de-Leon C., Low C.T.J. et al. // J. Power Sources. 2011. V. 196. P. 5174.
Belova E.V., Krasnov V.S., Ilyukhin A.B., Uspenskaya I.A. // Thermochim. Acta. 2018. V. 668. P. 46.
Kovalenko N.A., Pustovgar E.A., Uspenskaya I.A. // J. Chem. Eng. Data. 2012. V. 58. P. 159.
Clegg S.L., Pitzer K.S., Brimblecombe P. // J. Phys. Chem. 1992. V. 96. P. 9470.
Goldberg R.N. // J. Phys. Chem. Ref. Data. 1981. V. 10. P. 1.
Stokes R.H., Levien B.J. // J. Am. Chem. Soc. 1946. V. 68. P. 333.
Goldberg R.N. // J. Phys. Chem. Ref. Data. 1979. V. 8. P. 1005.
Albright J.G., Rizzo P., Rard J.A. // J. Chem. Thermodyn. 1998. V. 30. P. 327.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



