Журнал физической химии, 2019, T. 93, № 11, стр. 1644-1651
Термическая стабильность 4-трет-бутилдифенилоксида
В. А. Шакун a, *, Т. Н. Нестерова a, С. В. Таразанов b, С. А. Спиридонов a
a Самарский государственный технический университет
Самара, Россия
b Всероссийский научно-исследовательский институт по переработке нефти
111116 Москва, Россия
* E-mail: ShakyH@mail.ru
Поступила в редакцию 11.02.2019
После доработки 11.02.2019
Принята к публикации 14.05.2019
Аннотация
В диапазоне температур 703–763 K изучена термическая стабильность 4-трет-бутилдифенилоксида (4-ТБДФО), произведена идентификация компонентов реакционной массы термолиза, предложена кинетическая модель процесса, рассчитаны константы скорости и параметры уравнения Аррениуса для всех рассматриваемых реакций. Установлена преобладающая роль изомеризационных превращений 4-ТБДФО. Предложен механизм радикальной изомеризации трет-бутильного заместителя.
Дифенилоксид (ДФО) и его алкилпроизводные представляют научный интерес и имеют большое практическое значение в развитии современной промышленности.
Общеизвестно, что ДФО в смеси с бифенилом используется в качестве высокотемпературного теплоносителя [1, 2]. На основе производных ДФО создаются полимеры, обладающие уникальными механическими и оптическими свойствами [3], некоторые из алкилДФО, в том числе содержащие С4-заместитель, проявляют свойства жидких кристаллов [4].
Однако, информация о термической стабильности дифенилоксида и его производных ограничена. Наиболее обширные исследования [5, 6] посвящены определению начальных температур и минимальных энергий декомпозиции алкилароматических эфиров с целью определения перспективных гидравлических жидкостей и лубрикантов.
В последнее время возрос интерес к исследованию термической стабильности алкилбензолов в области производства перспективных топлив. Большое внимание уделяется, в том числе, бутилбензолам [7–10], как модельным структурам. Эти работы объединяет то, что в реакторах различного типа (золотые, стальные, стеклянные) в диапазоне температур 500–800 K распад н-бутилбензола (НББ) и трет-бутилбензола (ТББ) по радикальному механизму сопровождался образованием втор-бутилбензола (ВББ) и изобутилбензола (ИББ), соответственно.
В данной работе в качестве объекта исследования избран 4-трет-бутилдифенилоксид (4-ТБДФО) как соединение, которое объединяет в себе свойства алкиларенов и простых ароматических эфиров. Нами произведен анализ взаимных превращений продуктов термолиза, и показано, что изомеризация 4-ТБДФО играет определяющую роль в процессе распада.
Эта информация приобретает высокую значимость при исследовании и разработке термо- и теплостойких полимеров. Известно [11], что простые ароматические полиэфиры обладают высокой тепло- и термостойкостью, а присутствие алкильного заместителя в ядре сообщает полимеру дополнительные свойства, например, повышает температуру стеклования. Полифениленоксиды и их алкилпроизводные используются при температурах вплоть до 623 K, поэтому полученные результаты актуальны для развития представления об их свойствах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные вещества
4-ТБДФО синтезирован, выделен и очищен нами [12], концентрация основного вещества составила 99.93 мас. % по данным ГЖХ.
Методика изучения термолиза 4-ТБДФО
Исследование термолиза проводили в газовой фазе в стеклянных капиллярах (l = 23–25 мм; dn = = 0.95–1.05 мм) из “Пирекса”, в которые помещалось исследуемое вещество, капилляр продувался гелием (чистота 99.999%) и запаивался. Степень заполнения составляла 25–27% объема, что соответствовало массе вещества в 0.8–1.0 мг. Взвешивания проводили на аналитических весах Shimadzu AUW 120D с точностью 10–4 г. Термостатирование капилляра с веществом осуществлялось в лабораторной печи пиролиза, обеспечивающей точность поддержания температуры в изотермической зоне ±1 K, устройство которой представлено в работе [13]. Время достижения изотермического режима после помещения капилляра в печь не превышало 60 с. Процесс пиролиза завершался процедурой закалки в охлажденной до –15°С пробирке. Термическая стабильность 4-ТБДФО исследована в интервале температур 703–763 K с шагом в 5 K. Конверсия 4-ТБДФО не превышала 25%, число моль в процессе росло не более чем на 5%.
Анализ и идентификация компонентов реакционной смеси термолиза
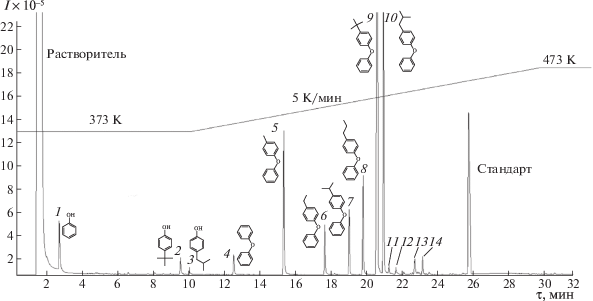
В качестве основного метода анализа реакционных смесей использовали ГЖХ. Анализ выполнялся на хроматографе “Кристалл 2000 М”, с кварцевой капиллярной колонкой SE-30 (60 м × × 250 мкм × 0.25 мкм). Температурный профиль анализа приведен на хроматограмме (рис. 1). Температура испарителя – 250°С, детектора – 280°С.
Рис. 1.
Хроматограмма смеси продуктов термического распада 4-ТБДФО (Т = 728 K, tконт = 40 мин): (1) фенол, (2) 4‑трет-бутилфенол (4-ТБФ), (3) 4-изобутилдфенол (4-ИБФ), (4) дифенилоксид (ДФО), (5) 4-метилдифенилоксид (4-МеДФО), (6) 4-этилдифенилоксид (4-ЭДФО), (7) 4-изипропилдифенилоксид (4-ИПДФО), (8) 4-н-пропилдифенилоксид (4-НПДФО), (9) 4-трет-бутилдифенилоксид (4-ТБДФО), (10) 4-изобутилдифенилоксид (4-ИБДФО), (11‒14) – не определенные компоненты X1–X4.
Количественный анализ состава реакционной массы выполнен методом внутреннего стандарта, в качестве которого использовали н-С20Н42 (98.0 мас. % по ГЖХ), величина калибровочного коэффициента по отношению к 4-ТБДФО составила 0.9625 ± 0.067.
Идентификация компонентов смесей включала направленный химический синтез и хромато-масс-спектрометрический анализ (70 эВ), выполненный на газовом хроматографе Agilent 6850, оснащенном капиллярной колонкой HP-5MS Agilent 19091S-433E (30 м × 250 мкм × 0.25 мкм), и масс-селективным детектором Agilent 5975C VL MSD. Идентификацию продуктов реакции проводили с использованием правил и подходов, описанных Лебедевым [14], Претчем, Бюльманом и Аффольтером [15], а также данных библиотеки NIST 2017 [16].
Структура 4-ИБДФО (10) установлена в результате направленного синтеза. 4-ИБДФО получен по реакции Вюрца–Фиттига в результате взаимодействия смеси 4-бромДФО и изобутила бромистого на натриевой стружке в среде н-гексана при комнатной температуре. 4-БромДФО был получен в результате бромирования ДФО жидким бромом при комнатной температуре, соотношение ДФО/Br2 составило 20/1 моль/моль. Время выхода синтезированного 4-ИБДФО соответствовало компоненту (10) на рис. 1. Наложение хроматограмм не приводится, так как снижает информативность.
АлкилДФО не имели позиционных изомеров и были идентифицированы в соответствии с правилами определения алкилароматических структур [14, 15]. 4-ТБФ идентифицирован посредством сравнения времени выхода со стандартным образцом. 4-ИБФ идентифицирован путем сравнения времен выхода и масс-спектров компонента (3) и 4-н-бутилфенола (>98 мас. % по ГЖХ), который был добавлен к анализируемой смеси.
В реакционной массе, в условиях глубокой конверсии, также наблюдались следовые количества (>0.1 мол. %) изопропилбензола и трет-бутилбензола. Концентрация не идентифицированных компонентов X1–X4 не превышала 0.5 мол. % в самых жестких условиях эксперимента. При построении кинетической модели распада ИПБ, ТББ и компоненты X1–X4 не были включены в обработку.
Характеристики масс-спектров компонентов приведены в табл. 1.
Таблица 1.
Характеристика масс-спектров реакционной массы термолиза 4-ТБДФО
| Соединение | Масс-спектр 70 эВ (m/z, интенсивность отн. %) |
|---|---|
| Фенол | 94 (M+, 100), 66 (46), 39 (43) |
| 4-ТБФ | 150 (M+, 23), 135 (100), 107 (42), 91 (10), 77 (10) |
| 4-ИБФ | 150 (M+, 14), 107 (100), 91 (1), 77 (12) |
| ДФО | 170 (M+, 45), 141 (72), 115 (26), 94 (4), 77 (60) |
| 4-МеДФО | 184 (M+, 100), 169 (4), 141 (15), 91 (100), 77 (50) |
| 4-ЭДФО | 198 (M+, 58), 183 (100), 169 (5), 153 (10), 105 (16), 91 (15), 77 (57) |
| 4-ИПДФО | 212(M+, 37), 197 (100), 178 (4), 169 (2), 119 (6), 104 (14), 91 (36), 77 (38) |
| 4-НПДФО | 212(M+, 32), 183 (100), 165 (1), 153 (8), 107 (8), 91 (6), 77 (35) |
| 4-ТБДФО | 226 (M+, 31), 211 (100), 183 (6), 171 (1), 165 (2), 91 (8), 77 (12) |
| 4-ИБДФО | 226 (M+, 20), 183 (100), 165 (1), 115 (5), 107 (8), 91 (4), 77 (22) |
| Х1 | 224 (M+, 100), 209 (22), 194 (4), 181 (7), 169 (3), 153 (10), 147 (5), 131 (92), 116 (72), 115 (58), 107 (14), 91 (48), 77 (84), 65 (13), 51 (52) |
| Х2 | 210 (M+, 100), 195 (3), 184 (2), 181 (4), 165 (10), 152 (6), 141 (4), 133 (8), 117 (100), 115 (80), 103 (16), 91 (24), 77 (68), 65 (16), 51 (48) |
| Х3 | 224 (M+, 100), 209 (7), 194 (4), 183 (5), 181 (6), 165 (5), 153 (4), 147 (6), 131 (50), 116 (68), 115 (64), 107 (5), 91 (50), 77 (72), 65 (20), 51 (44) |
| Х4 | 224 (M+, 26), 209 (100), 194 (2), 181 (40), 169 (20), 152 (6), 139 (14), 126 (1), 115 (5), 104 (2), 98 (3), 90 (18), 76 (6), 63 (5), 51 (2) |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Предположение о механизме радикальной изомеризации 4-ТБДФО
В табл. 2 представлено изменение концентраций компонентов реакционной смеси при Т = 728 K в зависимости от времени.
Таблица 2.
Изменение концентраций компонентов реакционной массы термолиза 4-ТБДФО при 728 K
| Время, мин | Молярные концентрации компонентов, мол. % | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Фенол | 4-ТБФ | 4-ИБФ | ДФО | 4-MeДФО | 4-ЭДФО | 4-ИПДФО | 4-НПДФО | 4-ТБДФО | 4-ИБДФО | |
| 0.0 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 100.00 | 0.00 |
| 2.0 | 0.04 | 0.03 | 0.00 | 0.05 | 0.04 | 0.00 | 0.03 | 0.00 | 99.16 | 0.65 |
| 5.0 | 0.09 | 0.06 | 0.01 | 0.10 | 0.10 | 0.00 | 0.09 | 0.01 | 97.93 | 1.61 |
| 7.0 | 0.19 | 0.13 | 0.02 | 0.18 | 0.30 | 0.03 | 0.28 | 0.05 | 95.44 | 3.38 |
| 10.0 | 0.10 | 0.10 | 0.01 | 0.16 | 0.27 | 0.02 | 0.25 | 0.04 | 95.60 | 3.45 |
| 15.0 | 0.30 | 0.19 | 0.02 | 0.24 | 0.43 | 0.07 | 0.49 | 0.10 | 92.34 | 5.82 |
| 20.0 | 0.53 | 0.25 | 0.03 | 0.28 | 0.77 | 0.09 | 0.63 | 0.24 | 91.12 | 6.06 |
| 25.0 | 0.75 | 0.31 | 0.03 | 0.35 | 1.13 | 0.16 | 0.93 | 0.50 | 87.87 | 7.97 |
| 30.0 | 1.11 | 0.37 | 0.05 | 0.42 | 1.74 | 0.36 | 1.08 | 0.75 | 85.48 | 8.64 |
| 32.5 | 1.30 | 0.41 | 0.07 | 0.45 | 1.88 | 0.46 | 1.26 | 0.97 | 84.28 | 8.92 |
| 35.0 | 1.39 | 0.45 | 0.07 | 0.51 | 2.16 | 0.53 | 1.31 | 1.09 | 83.35 | 9.14 |
| 40.0 | 1.60 | 0.54 | 0.11 | 0.58 | 2.94 | 0.76 | 1.41 | 1.44 | 81.00 | 9.62 |
| 45.0 | 1.89 | 0.56 | 0.11 | 0.63 | 3.47 | 1.04 | 1.68 | 1.73 | 78.84 | 10.05 |
| 50.0 | 2.52 | 0.66 | 0.12 | 0.76 | 4.25 | 1.51 | 1.74 | 2.27 | 75.52 | 10.65 |
Анализ приведенных экспериментальных данных показал, что при термолизе 4-ТБДФО наиболее активно протекает изомеризация трет-бутильного заместителя с образованием 4-ИБДФО. Например, при 728 K и времени контакта 10 мин концентрация 4-ИБДФО составляет 3.45 мол. % при степени превращения 4-ТБДФО 4.40 мол. %, т.е. селективность образования 4-ИБДФО составила 78%. В целом, в условиях эксперимента, при конверсии 4-ТБДФО 0–10% селективность образования 4-ИБДФО составляет 70–80%. Деструкция 4-ТБДФО проявляется в существенно меньшей степени и способствует образованию 4-ТБФ, фенола и ДФО в результате разрыва связей СAr‒Счетв. и Сar–O. При этом распад практически не затрагивает алкильный заместитель, так как концентрация 4-МеДФО и 4-ИПДФО, например, имеет адекватную взаимосвязь только с 4‑ИБДФО.
Такое направление распада выглядит довольно неожиданно. Особенно интересным оказывается то, что в продуктах термолиза 4-ТБДФО независимо от температуры или времени контакта (в пределах условий исследования) не было обнаружено следов 4-н-бутилДФО и 4-втор-бутил ДФО. Очевидно, что причина заключается в механизме превращения трет-бутильного заместителя. Предположительно, изомеризация, способствующая превращению трет-бутильного заместителя исключительно в изобутильный, может происходить через образование трехчленного цикла между Спервтрет-бутильного заместителя и СAr ароматического ядра (рис. 2).
Приведенный механизм адекватно объясняет, почему в продуктах термолиза 4-ТБДФО отсутствуют вторичные и нормальные бутиларены.
Аналогичный результат был получен нами при термолизе 4-ТБФ [13]. Полученные для 4-ТБДФО и 4-ТБФ данные позволяют предположить об общем характере радикальной изомеризации трет-бутильного заместителя, связанного с различными замещенными аренами.
Формирование кинетической модели термолиза 4-ТБДФО
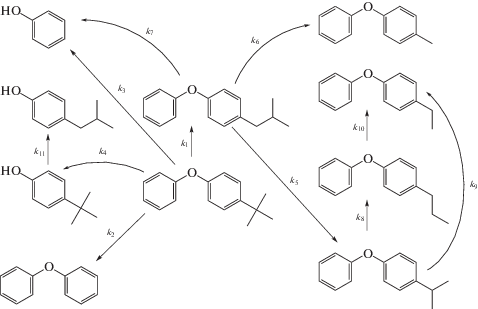
При разработке кинетической модели термолиза 4-ТБДФО из всех теоретически возможных превращений в исследуемой системе был выделен ряд превращений, обладающих наибольшей значимостью (рис. 3).
Очевидно, что в процессе термолиза представленные на схеме (рис. 3) реакции протекают в несколько стадий. Известно также, что в радикально-цепных процессах присутствие свободных радикалов не препятствует осуществлению мономолекулярных реакций [17]. Поэтому нами было принято допущение о том, что все реакции, избранные для кинетического анализа, мономолекулярные. Соответственно, константы скорости указанных на схеме реакций являются комбинацией констант скоростей всех стадий реакции. Значения констант скорости индивидуальных превращений были вычислены в соответствии со следующим алгоритмом:
1. Для всех продуктов реакции вычислены фактические скорости изменения концентрации (ri, эксп), т. е. дифференциал от Сi, эксп = f(τ).
2. Вычислены расчетные скорости (ri, расч) накопления продуктов с учетом 38 наиболее вероятных реакций, уравнение:
3. Путем совместной обработки полученных в пункте 1 и 2 зависимостей с критерием оптимизации
(где n – количество измерений)исключены незначимые реакции и вычислены константы скорости kj (табл. 3). Погрешность определения значений констант скорости составила <10%.
Таблица 3.
Значения констант скорости (ki × 105, c–1) для превращений, сопровождающих термолиз 4-ТБДФО в диапазоне 703–763 K
| T, K | k1 | k2 | k3 | k4 | k5 | k6 | k7 | k8 | k9 | k10 | k11 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 703 | 2.16 | 0.07 | 0.04 | 0.06 | 8.54 | 6.12 | 2.32 | 27.37 | 4.85 | 8.01 | 3.82 |
| 708 | 3.26 | 0.11 | 0.06 | 0.10 | 10.44 | 8.02 | 3.51 | 37.59 | 7.36 | 10.44 | 5.29 |
| 713 | 3.92 | 0.15 | 0.09 | 0.13 | 13.90 | 11.08 | 5.02 | 43.98 | 8.57 | 11.68 | 6.82 |
| 718 | 5.21 | 0.21 | 0.11 | 0.18 | 19.56 | 14.68 | 6.59 | 62.38 | 13.67 | 18.65 | 8.99 |
| 723 | 5.52 | 0.21 | 0.12 | 0.20 | 20.90 | 16.02 | 7.82 | 72.56 | 17.68 | 20.19 | 9.92 |
| 728 | 8.19 | 0.28 | 0.16 | 0.28 | 25.20 | 19.76 | 9.66 | 104.18 | 24.88 | 30.73 | 13.18 |
| 733 | 13.63 | 0.56 | 0.30 | 0.46 | 48.55 | 35.27 | 16.39 | 129.98 | 33.48 | 43.24 | 19.42 |
| 738 | 17.02 | 0.77 | 0.42 | 0.63 | 65.20 | 46.86 | 22.02 | 164.91 | 44.76 | 56.79 | 24.92 |
| 743 | 19.83 | 0.89 | 0.47 | 0.67 | 75.85 | 52.11 | 25.35 | 179.88 | 55.18 | 76.26 | 27.18 |
| 748 | 29.84 | 1.44 | 0.78 | 1.15 | 116.20 | 81.80 | 39.30 | 278.71 | 84.85 | 103.73 | 40.65 |
| 753 | 32.25 | 1.81 | 0.95 | 1.35 | 167.55 | 101.32 | 48.39 | 291.40 | 89.68 | 108.56 | 42.18 |
| 758 | 49.47 | 2.64 | 1.43 | 2.06 | 203.96 | 140.71 | 69.07 | 437.01 | 146.91 | 173.64 | 70.70 |
| 763 | 62.39 | 3.25 | 1.97 | 2.80 | 277.93 | 205.26 | 93.66 | 537.93 | 175.68 | 208.72 | 93.18 |
4. С использованием констант скорости, приведенных в табл. 3, методом Рунге–Кутты получены расчетные значения концентраций продуктов термолиза 4-ТБДФО.
5. Во всем диапазоне температур исследования адекватность предложенной модели тестирована методами математической статистики с применением критерия Пирсона, величина которого превышала 0.99, и критерия Фишера, расчетное значение которого при уровне значимости 0.05 многократно превышало табличную величину.
Из табл. 3 видно, что константа скорости изомеризации “4-ТБДФО → 4-ИБДФО” k1 на порядок выше констант скорости деструктивных процессов (k2–k4), затрагивающих трет-бутильный заместитель и связи Car–O и Car–Cчетв. Так, при 728 K суммарная величина констант скорости k2–k4 составляет 7.20 × 10–6 c–1, что в 11.4 раза меньше k1 = 8.19 × 10–5 c–1.
Также, необходимо отметить, что константа скорости превращения “4-ТБДФО → 4-ИПДФО” во всех вариантах расчета стремилась к нулю. Согласно полученной нами модели источником 4-ИПДФО, а также 4-МеДФО является 4‑ИБДФО, претерпевающий активный распад алкильного заместителя (при 728 K, k5 = 2.52 × × 10–4 и k6 = 1.98 × 10–4 c–1).
Результаты модельного описания состава реакционной массы термолиза 4-ТБДФО при 728 K представлены на рис. 4.
Рис. 4.
Сопоставление экспериментальных (маркеры) и расчетных (линии) концентраций продуктов термических превращений 4-ТБДФО при 728 K: а) ($\blacksquare $) – 4-ТБДФО, ($\blacktriangle $) – 4-ИБДФО, ($ \bullet $) – 4-ИПДФО, ($\bigcirc $) – 4-НПДФО, ($\square $) – 4-ЭДФО, ($\diamondsuit $) – 4-МеДФО; б) (+) – Фенол, ($\vartriangle $) – ДФО, (×) – 4-ТБФ, ($\diamondsuit $) – 4-ИБФ.

Расчет параметров уравнения Аррениуса
Кинетический анализ экспериментальных данных в диапазоне 703–763 K был выполнен для реакции “4-ТБДФО → продукты” по уравнениям расчета константы скорости первого порядка. Путем линеаризации уравнения Аррениуса в координатах “ln ki– 1000/T” установлено, что k0 = = 1014.3 ± 0.5, Ea = 255.2 ± 6.8 кДж/моль. Значения констант скорости распада 4-ТБДФО приведены в табл. 4.
Таблица 4.
Значения констант скорости для реакции “4-ТБДФО → продукты”, протекающей при термолизе 4-ТБДФО в диапазоне 703–763 K
| T, K | 1000/Т | ki, с–1 | –ln(ki) |
|---|---|---|---|
| 703 | 1.42 | 2.33 × 10–5 | 10.665 |
| 708 | 1.41 | 3.56 × 10–5 | 10.243 |
| 713 | 1.40 | 4.55 × 10–5 | 9.998 |
| 718 | 1.39 | 5.53 × 10–5 | 9.803 |
| 723 | 1.38 | 6.59 × 10–5 | 9.627 |
| 728 | 1.37 | 9.03 × 10–5 | 9.312 |
| 733 | 1.36 | 1.55 × 10–4 | 8.770 |
| 738 | 1.36 | 2.05 × 10–4 | 8.493 |
| 743 | 1.35 | 2.24 × 10–4 | 8.402 |
| 748 | 1.34 | 3.48 × 10–4 | 7.962 |
| 753 | 1.33 | 3.88 × 10–4 | 7.855 |
| 758 | 1.32 | 5.84 × 10–4 | 7.445 |
| 763 | 1.31 | 7.38 × 10-4 | 7.211 |
Для реакций, включенных в кинетическую модель процесса в диапазоне температур 703–763 K были вычислены константы скорости и параметры уравнения Аррениуса. Данные приведены в табл. 5.
Таблица 5.
Значения параметров уравнения Аррениуса для превращений, сопровождающих термолиз 4-ТБДФО в диапазоне 703–763 K
| Реакция | ki | lg(k0) | Ea, кДж/моль | R | |
|---|---|---|---|---|---|
| 4-ТБДФО | 4-ИБДФО | k1 | 13.8 ± 0.5 | 248.6 ± 7.0 | 0.99 |
| 4-ТБДФО | ДФО | k2 | 15.1 ± 0.7 | 286.6 ± 9.5 | 0.98 |
| 4-ТБДФО | Фенол | k3 | 15.1 ± 0.6 | 289.4 ± 8.1 | 0.99 |
| 4-ТБДФО | 4-ТБФ | k4 | 14.3 ± 0.5 | 276.6 ± 7.3 | 0.99 |
| 4-ИБДФО | 4-ИПДФО | k5 | 15.7 ± 0.6 | 267.3 ± 9.0 | 0.98 |
| 4-ИБДФО | 4-МеДФО | k6 | 14.9 ± 0.6 | 257.7 ± 7.7 | 0.99 |
| 4-ИБДФО | Фенол | k7 | 15.3 ± 0.4 | 268.0 ± 5.7 | 0.99 |
| 4-ИПДФО | 4-НПДФО | k8 | 12.6 ± 0.3 | 218.0 ± 4.7 | 0.99 |
| 4-ИПДФО | 4-ЭДФО | k9 | 15.3 ± 0.4 | 264.0 ± 5.5 | 0.99 |
| 4-НПДФО | 4-ЭДФО | k10 | 14.3 ± 0.6 | 247.7 ± 9.1 | 0.99 |
| 4-ТБФ | 4-ИБФ | k11 | 12.5 ± 0.5 | 228.3 ± 6.6 | 0.99 |
Таким образом, установлено, что при термолизе 4-трет-бутилдифенилоксида основным превращением является изомеризация в 4-изобутилдифенилоксид. Предложен механизм данной реакции.
В диапазоне температур 703–763 K для реакции “4-ТБДФО → продукты” вычислены параметры уравнения Аррениуса: предэкспоненциальный множитель k0 =1014.3 ± 0.5, энергия активации Ea = 255.2 ± 6.8 кДж/моль.
Предложена кинетическая модель процесса, согласно которой в диапазоне температур исследования основным источником продуктов распада – 4-МеДФО, фенола, 4-ИПДФО – является 4‑ИБДФО. При этом 4-НПДФО образуется в результате изомеризации 4-ИПДФО, а 4-ЭДФО является продуктом деструкции этих двух компонентов. Деструкция исходного 4-ТБДФО протекает в незначительной степени и выражается в разрыве связей Car–O и Car–Cчетв с образованием ДФО, 4-ТБФ и фенола.
Полученная информация может быть использована при разработке перспективных термо- и теплостойких полимерных композиций, так как позволяет предположить поведение их структуры в условиях повышенных температур. Выявленные закономерности, в целом, могут служить основой для дальнейшего исследования термической стабильности соединений класса алкилдифенилоксидов.
Список литературы
Cabaleiro D., Pastoriza-Gallego M.J., Piñeiro M.M. et al. // J. Chem. Thermodynamics. 2012. V. 50. P. 80.
Cabaleiro D., Segovia J.J., Martín M.C. et al. // J. Chem. Thermodynamics. 2016. V. 93. P. 86.
Che J.C., Wu J.A., Li S.W. et al. // Reactive & Functional Polymers. 2014. V. 78. P. 23.
Hu W.Q., Cui Z.K., Jin J. et al. // Applied Surface Science. 2011. V. 258. P. 507.
Blake E.S., Hammann C.W., Edwards J.W. et al. // J. Chem. Eng. Data. 1961. V. 6. № 1. P. 87.
Jackson Jr. M.T., Walker J.Q. // J. Anal. Chem. 1971. V. 43. № 1. P. 74.
Laatikainen M., Vahteristo K., Saukkonen S. et al. // Ind. Eng. Chem. Res. 1996. V. 35. P. 2103.
Ederer H.J., Kruse A., Mas C. et al. // J. Supercrit. Fluids. 1999. V. 15. P. 191.
Yu J., Eser S. // Ind. Eng. Chem. Res. 1998. V. 37. P. 4591.
Guerra L.N.C., Huerta L.J.C., Lorgeoux C. et al. // J. Anal. Appl. Pyrolysis. 2017. V. 133. P. 234.
Бюллер К.-У. Тепло- и термостойкие полимеры. Пер. с нем. / Под ред. Я.С. Выгодского. М.: Химия, 1984. 1056 с. // Buhler K.-U. Spezialplaste. B.: Akademie-Verlag, 1978. 1019 p.
Druzhinina A.I., Pimenova S.M., Tarazanov S.V. et al. // J. Chem. Thermodynamics. 2015. V. 87. P. 69.
Шакун В.А., Нестерова Т.Н., Таразанов С.В. // Нефтехимия. 2019. Т. 59(1). С. 113–120.
Лебедев А.Т. Масс-спектрометрия в органической химии. М.: Бином, 2003. 493 с.
Pretsch E., Buhlmann P., Affolter C. Structure Determination of Organic Compounds: Tables of Spectral Data. Springer. 2000. 421 p.
Интepнeт-pecypc: http://webbook.nist.gov/
Робинсон П., Холбрук К. Мономолекулярные реакции: Пер. с англ. М.: Мир, 1975. 380 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии