Журнал физической химии, 2019, T. 93, № 11, стр. 1714-1723
Адсорбция аминокислот на поверхности брушита и гидроксилапатита
О. А. Голованова a, *, К. К. Головченко a
a Омский государственный университет им. Ф.М. Достоевского
Омск, Россия
* E-mail: golovanoa2000@mail.ru
Поступила в редакцию 08.01.2018
После доработки 01.04.2019
Принята к публикации 09.04.2019
Аннотация
Изучена адсорбция аминокислот на поверхности брушита и гидроксилапатита (ГА) при варьирование pH раствора и концентрации аминокислот. Осуществлен синтез ГА и брушита, а состав твердых фаз подтвержден методами РФА, ИК-спектроскопии и оптической микроскопии. Методом БЭТ определена удельная поверхность брушита (9.0 м2/г) и ГА (72.0 м2/г). Выявлено влияние pH раствора на максимальное значение адсорбции аминокислот на брушите и ГА. Для установления механизма адсорбции методом капиллярного анализа определен знак заряда поверхности твердой фазы брушита и ГА (положительный). Рассчитаны значения свободной энергии Гиббса. Предположено, что аминокислоты взаимодействуют с поверхностью брушита и ГА по механизму физической адсорбции.
Фосфаты кальция (ФК) – компоненты, входящие в состав физиогенных и патогенных образований организма человека. Образования физиогенного характера выполняют разные функции, они генетически обусловлены, место их расположения строго определено в организме человека. Образования патогенного характера могут возникать в результате нарушения функционирования отдельного органа или всего организма.
Существуют данные о том, что на раннем этапе формирования патогенных агрегатов кристаллизуется аналог природного минерала брушита – двуводный гидрофосфат кальция. В организме человека, а также животных брушит может встречаться совместно с другими фосфатами кальция в составе минерального компонента патогенного характера (зубные, почечные, слюнные и другие камни) [1]. Другой фосфат кальция – гидроксилапатит – является одним из минеральных составляющих костной ткани, дентина, и зубной эмали. Гидроксилапатит играет одну из важнейших ролей в физиологических процессах, протекающих в организме человека [2–4].
Известно, что в системе Са(NO3)2–(NH4)2HPO4–H2O при варьировании значений соотношения концентраций реагентов и рН термодинамически возможна кристаллизация СаНРО4 · 2Н2О и Са10(РO4)6(OН)2. При этом, согласно расчетным данным [5], для брушита и ГА существуют области гомогенной устойчивости, локализованные в слабокислой среде. Значительное различие в устойчивости соединений (оцененной по SI, ∆G и Kосажд) обусловливает высокую вероятность кристаллизации термодинамически наиболее стабильного при ${{C}_{{Ca{{{({\text{N}}{{{\text{O}}}_{{\text{3}}}})}}_{2}}}}}{\text{/}}{{C}_{{{{{({\text{N}}{{{\text{H}}}_{4}})}}_{2}}{\text{HP}}{{{\text{O}}}_{4}}}}}$ = 1.00–2.00, рН > 7.5 соединения – ГА.
В работах [6–12] исследователи описали превосходную биологическую активность материалов на основе брушите и ГА, и показали их использование в восстановлении костей или в виде ортопедических дополнений, в качестве основного неорганического материала состава твердых тканей человека. Другое перспективное направление использования данных соединений – в качестве носителей для доставки лекарственных средств [13], например, ряда аминокислот (АК).
Известно, что взаимодействие минеральной и органической составляющих играет огромное значение в процессах биогенной кристаллизации, при формировании как костного матрикса млекопитающих, так и патогенных образований.
Единой теории, объясняющей природу биокосного взаимодействия, в настоящее время не существует. Однако можно предположить, что специфическая роль белковых соединений в процессах образования органоминеральных образований (ОМА) обусловлена способностью их минеральных составляющих (фосфатов, оксалатов и др. солей кальция) избирательно взаимодействовать с аминокислотами, находящимися в физиологическом растворе, за счет протекания как адсорбционных процессов химической и физической природы. Кроме того, при этом могут образовываться комплексы веществ белковой природы с катионами металлов, присутствующими в биологических жидкостях [14–17].
Анализ разных по природе ОМА показал, что минеральная составляющая представлена в основном солями кальция (фосфатов, оксалатов и др.), при этом ионы кальция – слабые комплексообразователи, к тому же АК – стерически объемные лиганды, и их координирование по ионам кальция при подходе нескольких молекул затруднен [18]. В настоящее время преобладает гипотеза, согласно которой, основным в процессе биогенной кристаллизации является адсорбционное взаимодействие аминокислот, как свободных, так и связанных в молекулы белков с неорганическими компонентами биожидкостей [3, 19, 20], но механизм данного взаимодействия до конца не изучен. Актуальны исследования закономерностей сорбции аминокислот на неорганических составляющих патогенных образований [21–26].
Цель данной работы – установление закономерностей адсорбционных процессов аминокислот на брушите и гидроксилапатите при варьировании рН раствора.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и материалы
Синтез брушита проводили путем осаждения при температуре 22–25°С из водного раствора методом массой кристаллизации по следующей реакции:
Синтез гидроксилапатита проводили путем осаждения при температуре 22–25°С из водного раствора методом массой кристаллизации по следующей реакции:
Осадок получали при смешивании двух разбавленных растворов гидрофосфата аммония (NН4)2HPO4 и нитрата кальция Ca(NO3)2 · 4H2O в соотношении 1.67 : 1, а также водного раствора аммиака NH4ОН. При осуществлении синтеза к 500 мл раствора, который содержал Ca(NO3)2, прибавляли 5 мл концентрированого раствора NH4ОН, быстро добавляли равный объем раствора (NН4)2HPO4 с концентрацией 50 ммоль/л. Общий объем смеси составлял 1000 мл. После смешивания растворов значения рН данной системы корректировали до рН 12.00 ± 0.05, используя растворы NaOH (20%) и/или HNO3 (1 : 1). Все используемые в работе реактивы марки “х. ч.”.
Определение знака заряда частиц золей твердых фаз осуществляли методом капиллярного анализа [27]. Метод прямой потенциометрии использовали для определения значения рН раствора, погрешность измерения ±0.01 ед. рН, а с использованием ионоселективного электрода измеряли концентрации ионов кальция в ходе эксперимента и по градуировочному графику определяли неизвестное значение концентрации ионов кальция. Определение фосфат-ионов проводили по методу молибденовой сини, ГОСТ 18309–72. Погрешность определений находится в пределах 2–4 отн. %.
Методом рентгенофазового анализа (РФА) исследовали фазовый состав синтезированных твердых фаз. Дифрактограммы получали с помощью “метода порошка” на рентгеновском аппарате ДРОН-3. Идентификацию фаз проводили при помощи международной картотеки ASTM и таблиц [28]. Чувствительность метода для проводимых измерений РФА составляет не более 3%.
Метод ИК-спектроскопии использовали для получения дополнительной информации о составе синтезированных образцов. ИК-спектры получали на спектрофотометре ФСМ 2201. Математическую обработку данных проводили при помощи программ Static2 и Statistica 10 из пакета StatSoft. Чувствительность метода для проводимых измерений методом ИК-спектроскопии составляет не более 5%.
Осадки, полученные в ходе синтезов, изучали с помощью метода оптической микроскопии с использованием микроскопа бинокулярного серии XSP-104. Съемку проводили в режиме, оптимальном для получения контрастных четких снимков.
Адсорбционный эксперимент. Навеску твердой фазы массой 0.5 г помещали в колбу и заливали раствором аминокислоты (табл. 1). В опыте варьировали концентрацию аминокислоты (2, 4, 6, 8, 10, 15, 20, 25, 30 ммоль/л) и рН раствора (5.00–8.00 ± 0.05 (кроме 6.50) с шагом 0.50). Встряхивали колбы в течение 30 мин, после чего оставляли на 2 суток. По прохождении указанного промежутка времени содержимое колб фильтровали и определяли содержание аминокислот в фильтрате при помощи метода перевода их в медные растворимые соли с их дальнейшим фотометрическим определением (λ = 670 нм), измеряли рН раствора после адсорбции и на аналитических весах определяли массы осадков.
Таблица 1.
Характеристики аминокислот
| Аминокислота | Обозначение | Брутто-формула | pK | pI | ||
|---|---|---|---|---|---|---|
| α-COOH | α-NH2 | Ионные группы | ||||
| Глицин | Gly | C2H5NO2 | 2.35 | 9.78 | 6.20 | |
| Аланин | Ala | C3H7NO2 | 2.35 | 9.78 | 6.11 | |
| Аспарагиновая кислота | Asp | C4H7NO4 | 1.99 | 9.90 | β-COOH – 3.90 | 2.98 |
| Аргинин | Arg | C6H15N4O2 | 1.82 | 8.99 | ε-NH2 12.48 | 10.76 |
| Глутаминовая кислота | Glu | C5H9NO4 | 2.10 | 9.47 | γ-COOH – 4.07 | 3.09 |
| Пролин | Pro | C5H9NO2 | 1.95 | γ-NH – 10.64 | 6.30 | |
Для определения уравнения, описывающего адсорбцию, проводили обработку экспериментальных данных по теории Ленгмюра и Фрейндлиха [29]:
где Г∞ – значение предельной адсорбции, моль/кг; с – концентрация адсорбата при достижении равновесия, моль/л; b – константа адсорбционного равновесия; где n – показатель степени (n < 1), а – коэффициент пропорциональности.Расчет изменения энергии Гиббса производили по формуле:
где R – универсальная газовая постоянная, R = = 8.314 кДж/(кмоль K); К – константа адсорбционного равновесия.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Синтез кристаллов брушита
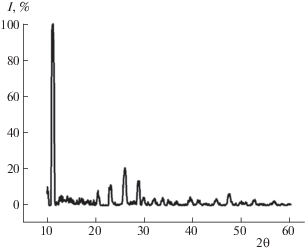
Методами РФА, ИК-спектроскопии и микроскопии установлено, что осадки, полученные после 48 ч кристаллизации, представлены фазой брушита (рис. 1), принадлежащей моноклинной сингонии (2θ = 11.172, 29.411, 35.419). Рассчитанный размер кристаллитов D = 48.06 мкм [23] согласуется с данными [3].
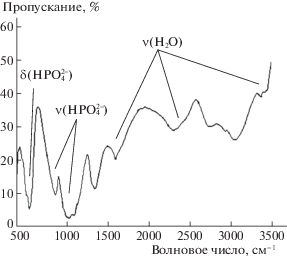
ИК-спектры образцов содержат все полосы, характерные для брушита, (рис. 2) и имеют сложную структуру. Отмечено наличие полос поглощения валентных (1135, 1060, 986 см–1) и деформационных (653, 578, 527 см–1) колебаний группы НРО$_{4}^{{2 - }}$, а также полос, характерных для колебаний воды (3531, 3484, 1646 см–1).
На рис. 3 представлены снимки образцов после синтеза. Результаты микроскопии показали, что образующиеся кристаллы имеют форму тонких удлиненных пластинок. Выдерживание в течение 48 ч приводит к наибольшему росту в направлении одной из осей кристалла, что характерно для брушита.
Анализ надосадочной жидкости и расчет коэффициента Са/Р показал, что для синтезированного брушита он равен 1.00, что соответствует стехиометрическому брушиту [3].
Синтез кристаллов гидроксилапатита
Методами РФА, ИК-спектроскопии и микроскопии установлено, что осадки, полученные после 48 часов кристаллизации, представлены фазой гидроксилапатита (рис. 4), принадлежащей гексагональной сингонии (2θ = 31.8, 32.9, 39.9). Рассчитанный размер кристаллитов D = 13 нм [28] согласуется с данными [3].
ИК-спектр, образцов содержит все полосы, характерные для гидроксилапатита, (рис. 5) и имеет сложную структуру. Отмечено наличие полос поглощения валентных (1113, 1019, 958 см–1) и деформационных (604, 573, 469 см–1) колебаний группы РО$_{4}^{{3 - }}$, а также полос, характерных для валентных колебаний ОН– в молекулах структурно связанной воды (3576, 3400 см–1). Видно, что спектр содержит полосы СО$_{3}^{{2 - }}$ с максимумами при 1460, 1420 и 865 см–1. Присутствующая широкая полоса в области 2700–3700 см–1, а также пик при 3540 см–1 могут быть отнесены к валентным колебаниям Н–О–Н и ОН– соответственно.
На рис. 6 представлены снимки образцов после синтеза. Видно, что получаемые частицы представлены в виде агрегатов, характерных для гидроксилапатита.
Анализ надосадочной жидкости и расчет коэффициента Са/Р показал, что для синтезированного гидроксилапатита он равен 1.67, что соответствует стехиометрическому ГА [3].
Согласно [30], синтезируемые фосфаты кальция имеют низкую растворимость в водном растворе: брушит (0.5 × 10−3 моль/л, рПР = 6.6) и ГА (0.4 × 10−7 моль/л, рПР = 118). При значениях рН эксперимента с учетом растворимости фосфатов кальция в растворе возможно преобладание формы гидрофосфат-иона. Анализ констант комплексобразования между ионами кальция и гидрофосфат-ионами (рK1 = 2.77) позволяет предположить, что их образование маловероятно, особенно для ГА [31].
Адсорбция АК на брушите
На рис. 7 приведены изотермы сорбции аминокислот на брушите. Видно, что сорбция достигает насыщения, благодаря этому существует возможность при Сак = 30 ммоль/л сравнить максимальные значения адсорбции при варьировании рН раствора (табл. 2). Установлено, что для аланина, глицина, глутаминовой и аспарагиновой кислот максимальная адсорбция достигается при рН 7.50 ± 0.05, аргинина – при рН 8.00 ± 0.05, а для пролина при рН 5.00 ± 0.05. Известно, что при данных значениях рН раствора указанные аминокислоты находятся в заряженных ионных формах [32].
Таблица 2.
Значение максимальной адсорбции (Γmax, моль/кг) аминокислот при варьировании рН на брушите от 5.00 до 8.00
| АК | 5.00 | 5.50 | 6.00 | 7.00 | 7.50 | 8.00 |
|---|---|---|---|---|---|---|
| Gly | 0.500 | 0.550 | 0.500 | 0.700 | 0.800 | 0.750 |
| Ala | 0.400 | 0.500 | 0.450 | 0.500 | 0.550 | 0.450 |
| Asp | 0.450 | 0.500 | 0.500 | 0.500 | 0.550 | 0.500 |
| Glu | 0.750 | 0.750 | 0.800 | 0.700 | 0.850 | 0.800 |
| Arg | 0.500 | 0.400 | 0.400 | 0.450 | 0.450 | 0.600 |
| Pro | 0.350 | 0.300 | 0.250 | 0.250 | 0.250 | 0.250 |
После обработки данных адсорбционных экспериментов получены уравнения, описывающие адсорбцию по теории Ленгмюра (1) и Фрейндлиха (2) (табл. 3). Полученные данные адекватны, так как практически все значения адсорбции меньше Г∞. Из табл. 3 видно, что значения адсорбции глицина, глутаминовой и аспарагиновой кислот имеют хорошую корреляцию в линейных координатах модели Фрейндлиха в большей степени, а аланин, аргинин и пролин, напротив, – в линейных координатах модели Ленгмюра.
Таблица 3.
Уравнения Ленгмюра (1) и Фрейндлиха (2) для адсорбции аминокислот на брушите при варьировании рН раствора (Γmax, моль/кг)
| АК | Гmax | pHmax | (1) | (2) | R2 | |||
|---|---|---|---|---|---|---|---|---|
| Г∞ | b | a | n | (1) | (2) | |||
| Gly | 0.800 | 7.50 | 1.128 | 221.1 | 19.42 | 0.704 | 0.655 | 0.899 |
| Ala | 0.550 | 7.50 | 1.133 | 65.10 | 8.580 | 0.681 | 0.983 | 0.980 |
| Asp | 0.550 | 7.50 | 1.348 | 77.00 | 11.81 | 0.738 | 0.880 | 0.973 |
| Glu | 0.850 | 7.50 | 0.952 | 396.6 | 5.830 | 0.576 | 0.863 | 0.936 |
| Arg | 0.550 | 8.00 | 0.946 | 99.50 | 11.12 | 0.67 | 0.826 | 0.800 |
| Pro | 0,350 | 5.00 | 0.455 | 34.97 | 4.067 | 0.587 | 0.971 | 0.888 |
Далее был осуществлен расчет изменения энергии Гиббса по формуле (3) (табл. 4). Расчетные значения свободной энергии Гиббса соответствуют данным максимальной адсорбции АК. Данные табл. 4 свидетельствуют о том, что адсорбция АК на брушите проходит по механизму физической сорбции за счет сил электростатического взаимодействия положительно и отрицательно заряженных центров твердой фазы и АК, и за счет образования водородных связей.
Таблица 4.
Значения свободной энергии Гиббса (–ΔG, кДж/моль) адсорбции аминокислот при варьировании рН на брушите от 5.00 до 8.00
| АК | 5.00 | 5.50 | 6.00 | 7.00 | 7.50 | 8.00 |
|---|---|---|---|---|---|---|
| Gly | 12.4 | 11.8 | 11.9 | 12.7 | 13.4 | 13.1 |
| Ala | 9.08 | 9.92 | 9.68 | 9.86 | 10.35 | 9.35 |
| Asp | 9.62 | 10.2 | 9.86 | 10.2 | 10.8 | 10.2 |
| Glu | 12.6 | 12.8 | 14.8 | 12.4 | 14.8 | 14.4 |
| Arg | 10.3 | 10.4 | 10.3 | 10.6 | 10.6 | 11.4 |
| Pro | 8.81 | 8.70 | 8.56 | 8.56 | 8.56 | 8.56 |
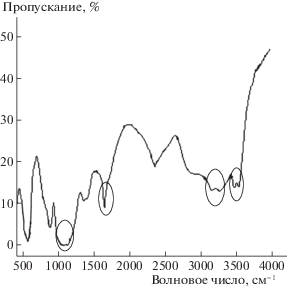
Для подтверждения факта адсорбции приведены результаты ИК-спектроскопии. В спектре образца, после адсорбции (рис. 8) в области 2800–3000 см–1 появляются полосы, соответствующие колебаниям связей С–Н в метиленовых группировках органической составляющей. Полосу колебаний при 1650 см–1 можно рассматривать как суммарную, которая соответствует колебаниям связей С=О, N–H, O–H в молекулах аминокислоты и ОН-ионов в составе брушита. Также отмечено появление специфических полос поглощения, которые связаны с колебаниями связей N–Н и С–N, проявляющихся в областях 1360–1000, 1650–1500, 3500–3300 см–1, что подтверждает сорбцию аминокислот на поверхности брушита.
Адсорбция АК на ГА
Вид кривых сорбции аминокислот на гидроксилапатите (рис. 9) указывает на достижение насыщения сорбции, что позволяет сравнивать значения максимальных адсорбций при варьировании рН раствора (табл. 5). Выяснено, что для глицина характерна максимальная адсорбция при рН 7.50 ± 0.05; аланина и пролина – при рН 6.00 ± 0.05; аргинина – при рН 5.00–6.00 ± 0.05; аспарагиновой кислоты – при рН 8.00 ± 0.05; глутаминовой кислоты – при рН 5.00 ± 0.05. При данных значениях рН раствора указанные аминокислоты находятся в заряженных ионных формах [32].
Таблица 5.
Значения максимальной адсорбции (Γmax, моль/кг) аминокислот при варьировании рН от 5.00 до 8.00
| АК | 5.00 | 5.50 | 6.00 | 7.00 | 7.50 | 8.00 |
|---|---|---|---|---|---|---|
| Gly | 0.400 | 0.350 | 0.400 | 0.400 | 0.450 | 0.400 |
| Ala | 0.150 | 0.150 | 0.200 | 0.150 | 0.150 | 0.150 |
| Asp | 0.150 | 0.150 | 0.200 | 0.200 | 0.250 | 0.300 |
| Glu | 0.300 | 0.250 | 0.250 | 0.200 | 0.200 | 0.200 |
| Arg | 0.200 | 0.200 | 0.200 | 0.150 | 0.150 | 0.150 |
| Pro | 0.250 | 0.300 | 0.350 | 0.250 | 0.200 | 0.250 |
После обработки данных экспериментов получены уравнения, описывающие адсорбцию с позиции теории Ленгмюра (1) и Фрейндлиха (2) (табл. 6). Полученные данные адекватны, так как практически все значения адсорбции меньше Г∞. Видно, что адсорбция всех аминокислот имеет хорошую корреляцию в линейных координатах модели Ленгмюра.
Таблица 6.
Уравнения, описываемые моделями Ленгмюра (1) и Фрейндлиха (2), для адсорбции аминокислот на гидроксилапатите при варьировании рН раствора (Γmax, моль/кг)
| АК | Γmax, | pHmax | Уравнения по модели | R2 | ||||
|---|---|---|---|---|---|---|---|---|
| (1) | (2) | (1) | (2) | |||||
| Γ∞ | b | a | n | |||||
| Gly | 0.450 | 7.50 | 0.749 | 46.49 | 9.158 | 0.722 | 0.960 | 0.957 |
| Ala | 0.200 | 6.00 | 0.239 | 11.40 | 0.938 | 0.401 | 0.957 | 0.898 |
| Asp | 0.300 | 8.00 | 0.368 | 33.47 | 2.965 | 0.534 | 0.969 | 0.830 |
| Glu | 0.300 | 5.00 | 0.368 | 33.15 | 2.966 | 0.534 | 0.969 | 0.830 |
| Arg | 0.200 | 5.00–6.00 | 0.216 | 13.08 | 0.782 | 0.361 | 0.957 | 0.846 |
| Pro | 0.350 | 6.00 | 0.470 | 36.13 | 4.604 | 0.607 | 0.965 | 0.895 |
Далее были рассчитаны изменения энергии Гиббса по формуле (3) (табл. 7). Полученные значения соответствуют данным о максимальной адсорбции. Анализ результатов свидетельствует о том, что адсорбция идет по механизму физический сорбции за счет сил электростатического взаимодействия положительно и отрицательно заряженных центров, и за счет образования водородных связей [33].
Таблица 7.
Значение свободной энергии Гиббса (–ΔG, кДж/моль) адсорбции аминокислот при варьировании рН от 5.00 до 8.00
| АК | 5.00 | 5.50 | 6.00 | 7.00 | 7.50 | 8.00 |
|---|---|---|---|---|---|---|
| Gly | 8.94 | 8.87 | 9.08 | 9.08 | 9.51 | 8.80 |
| Ala | 6.47 | 7.42 | 6.03 | 6.47 | 7.42 | 7.42 |
| Asp | 8.53 | 8.53 | 8.50 | 8.50 | 8.56 | 8.70 |
| Glu | 8.67 | 8.53 | 8.53 | 8.46 | 8.46 | 8.46 |
| Arg | 6.37 | 6.37 | 6.37 | 7.42 | 7.42 | 7.42 |
| Pro | 8.56 | 8.70 | 8.89 | 8.56 | 8.47 | 8.56 |
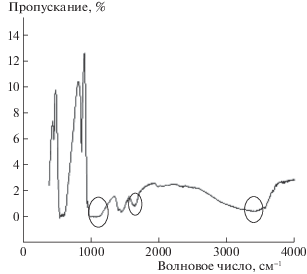
Для подтверждения факта адсорбции приведены результаты ИК-спектроскопии. В спектре образца после адсорбции (рис. 10) отмечается полоса колебаний при 1650 см–1, которую можно рассматривать как суммарную, отвечающую колебаниям связей С=О, N–H, O–H в молекулах аминокислоты и ОН-ионов в составе гидроксилапатита. Также отмечено появление специфических полос поглощения, которые обусловлены колебаниями связей N–Н и С–N, проявляющихся в областях 1360–1000, 1650–1500, 3500–3300 см–1, что подтверждает сорбцию аминокислот на поверхности гидроксилапатита.
Для установления механизма адсорбции было осуществлено определение знака заряда частиц золей твердых фаз методом капиллярного анализа. Анализ заряда твердых фаз при рН 5.00, 6.50, 8.00 ± 0.05 до и после адсорбции аминокислот (Сак = 4 ммоль/л) приведен в табл. 8. Из табл. 8 видно, что при адсорбции глицина, аланина и пролина не происходит изменения знака заряда поверхности, так как при физической адсорбции связываются его положительная и отрицательная группы на концах, и в результате незаряженная боковая группа не влияет на заряд поверхности. При добавлении аргинина происходит также связывание его концевых групп, однако при данных значениях рН он находится в виде положительно заряженного цвиттер-иона, и в результате снаружи поверхности находится его заряженная положительно боковая группа, которая не меняет заряд поверхности.
Таблица 8.
Знак заряда поверхности твердых фаз в присутствии аминокислот
| Твердая фаза | рН | Без АК | Gly | Ala | Asp | Glu | Arg | Pro |
|---|---|---|---|---|---|---|---|---|
| Брушит | 5.00 | + | + | + | – | – | + | + |
| 6.50 | + | + | + | – | – | + | + | |
| 8.00 | + | + | + | – | – | + | + | |
| ГА | 5.00 | + | + | + | – | – | + | + |
| 6.50 | + | + | + | – | – | + | + | |
| 8.00 | + | + | + | – | – | + | + |
Однако при добавлении аспарагиновой и глутаминовой кислот установлено, что происходит перезарядка поверхности, так как эти аминокислоты находятся при данных значениях рН раствора в виде отрицательно заряженных цвитер-ионов. Вследствие этого при адсорбции на поверхности присутствует отрицательно заряженная боковая группа, которая образует мономолекулярный слой, что в результате меняет заряд поверхности гидроксилапатита. Таким образом, для частиц брушита и гидроксилапатита характерны одинаковые изменения знака заряда поверхности при взаимодействии их с аминокислотами.
Результаты исследований позволили нам предположить, что, наиболее вероятно, взаимодействие происходит за счет электростатических сил положительно заряженных Са2+-ионов брушита и гидроксилапатита и отрицательно заряженных карбоксильных групп аминокислот, а также за счет образования водородных связей между гидрофосфатными ионами брушита и фосфатными ионами гидроксилапатита с положительно заряженной аминогруппой аминокислоты.
В [34] нами предложены три группы образующихся комплексов аминокислот с ионами кальция согласно их устойчивости в водном растворе при T = 298 K и рассчитаны основные термодинамические потенциалы изучаемых систем. Показано, что по своей лабильности комплексы Ca2+ с АК располагаются в следующий ряд: δ(Ca2+–Asn) = = δ(Ca2+–Thr) < δ(Ca2+– Lys) < δ(Ca2+–His) < < δ(Ca2++–Ser) < δ(Ca2+–Asp) = δ(Ca2+–Met) < < δ(Ca2+–Ile) = δ(Ca2+–Glu) < δ(Ca2+–Val) < < δ(Ca2+–Ala) = δ(Ca2+–Pro) < δ(Ca2+–Arg) < < δ(Ca2+Gly), т.е. самые лабильные комплексы у ионов кальция с аспарагином и треонином, а самые стабильные – с глицином. Таким образом, исходя из растворимости брушита и концентрации глицина в исходном растворе возможно образование комплекса в соотношении 1:1 (lg K° = 3.11).
Сравнительная характеристика адсорбционных процессов аминокислот на поверхности ГА и брушита
Установлено, что при разном значении рН раствора закономерность адсорбционных процессов для максимальной концентрации аминокислоты на брушите и гидроксилапатите имеет вариативный характер. Так как большинство физиологических растворов имеет значение рН раствора, близкое к 7.5, то сравнение адсорбции было проведено при указанном значении. В результате получены следующие ряды аминокислот по увеличению максимальной адсорбции:
на брушите: пролин < аргинин < аланин = аспарагиновая кислота < глицин < глутаминовая кислота;
на гидроксилапатите: аланин=аргинин < пролин=глутаминовая кислота <аспарагиновая кислота < глицин.
Следует отметить, что для брушита характерна максимальная адсорбция глутаминовой кислоты, а для гидроксилапатита – глицина. По данным [35] можно предположить, что встраивание глицина в структуру гидроксилапатита облегчает процесс его адсорбции, а для брушита характерна более высокая адсорбция глутаминовой кислоты вследствие ее более выгодного расположения при конформационных изменениях в процессе сорбции.
Таким образом, осуществлен синтез брушита и гидроксилапатита, получение которых подтверждено методами РФА и ИК-спектроскопии. Определены знаки зарядов поверхностей брушита и гидроксилапатита которые имеют положительные значения. Исследована адсорбция аминокислот на брушите и гидроксилапатите, получены их максимальные значения адсорбции в интервале значений рН от 5 до 8. Установлено, что на брушите адсорбция глицина, аспарагиновой и глутаминовой кислот описывается моделью Фрейндлиха, а аланина, пролина и аргинина – моделью Ленгмюра, в то время как адсорбция аминокислот на гидроксилапатите описывается моделью Ленгмюра. Рассчитанные значения энергии Гиббса адсорбции согласуются со значениями максимальной адсорбции. Получены ряды значений адсорбции для брушита и ГА. Показано, что при рН 7.50 для брушита характерна максимальная адсорбция глутаминовой кислоты, а для гидроксилапатита – глицина.
Список литературы
Голованова О.А. Патогенные минералы в организме человека. Омск: Изд-во ОмГУ, 2006. 400 с.
Dorozhkin S.V. // Biomaterials. 2010. V. 31. P. 1465.
Солоненко А.П., Голованова О.А. // Журн. неорган. химии. 2014. Т. 59. С. 12.
Hsu Y.H., Turner I.G., Miles A.W. // J. Mater. Sci. Mater. Med. 2007. V. 18. P. 2319.
Солоненко А.П., Голованова О.А. // Бутлеровские чтения. 2011. Т. 24. № 4. С. 106.
Chow L.C., Eanes E.D. // J. Basel. 2001. V. 18. P. 17.
Sepulveda P., Jones J.R., Hench L.L. // J. Biomed. Mater. Res. 2002. V. 59. P. 340.
Silva G.A., Coutinho O.P., Ducheyne P. et al. // J. Regen. Med. 2007. V. 1. P. 97.
Zhang Z., Dalgleish D.G., Goff H.D. // J. Colloids Surf. B Biointerf. 2004. V. 34. P. 113.
Ducheyne P., Qiu Q. // Biomaterials. 1999. V. 20. P. 2287.
Porter A.E., Patel N., Skepper J.N. et al. // Biomaterials. 2003. V. 24. P. 4609.
Langstaff S., Sayer M., Smith T.J. et al. // Biomaterials. 2001. V. 22. P. 135.
Зеленина Т.Г., Федчишин О.В., Трофимов В.В. и др. // Сибирский медицинский журнал. 2009. Т. 90. С. 93.
Голованова О.А., Ачкасова Е.Ю., Пунин Ю.О. и др. // Кристаллография. 2006. Т. 51. № 2. С. 376.
Голованова О.А., Пунин Ю.О., Изатулина А.Р. и др. // Журн. структур. химии. 2014. Т. 55. С. 178.
Голованова О.А., Пятанова П.А., Россеева Е.В. // Докл. АН. 2004. Т. 395. № 5. С. 1.
Голованова О.А., Россеева Е.В., Франк-Каменецкая О.В. // Вестн. СПбГУ. 2006. Сер. 4. № 2. С. 123.
Кожомуратова Ж.С., Миронов Ю.В., Шестопалов М.А. и др. // Координац. химия. 2007. Т. 33. № 1. С. 3.
Dorozhkin S.V. // J. Material Science. 2007. V. 42. P. 1061.
Солоненко А.П., Голованова О.А. // Химия в интересах устойчивого развития. 2013. Т. 21. № 2. С. 227.
Zhu X.D., Fan H.S., Xiao Y.M. et al. // J. Acta Biomater. 2009 V. 5. P. 1311.
Rouahi M., Champion E., Gallet O. et al. // J. Colloids Surf. B Biointerf. 2006. V. 47. P. 10.
Segvich S.J., Smith H.C., Kohn D.H. // J. Biomaterials. 2009. V. 30. P. 1287.
Zhu X.D., Zhang H.J., Fan H.S. et al. // J. Acta Biomater. 2009. V. 6. P. 1536.
Атякшева Л.Ф., Иванова М.В., Тарасевич Б.Н. и др. // Журн. физ. химии. 2018. Т. 92. № 7. С. 1183.
Атякшева Л.Ф., Федосов Д.А., Иванова М.В. и др. // Там же. 2018. Т. 92. № 9. С. 1504.
Скопинская С.Н., Ярков С.П., Злобин В.Н. и др. // Вестник РАМН. 2012. № 3. С. 80.
Егоров-Тисменко Ю.К. Кристаллография и кристаллохимия: учебник. М.: КДУ, 2005. 592 с.
Сафронова Т.В., Путляев В.И. // Наносистемы: физика, химия, математика. 2013. Т. 4. № 1. С. 24.
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1979. 480 с.
Бутман М.Ф., Овчинников Н.Л., Карасев Н.С. и др. // Физикохимия поверхности и защита материалов. 2017. Т. 53. № 4. С. 361.
Голованова О.А., Корольков В.В., Пунин Ю.О. и др. // Химия в интересах устойчивого развития. 2013. Т. 21. № 4. С. 401.
Rimola A., Corno M., Garza J. et al. // Roy. Soc. A. 2012. V. 370. P. 1478.
Голованова О.А., Томашевский И.А. // Журн. физ. химии. 2019. Т. 93. № 1. С. 11.
Голощапов Е.Т., Четвериков А.В., Белозеров Е.С. // Урологические ведомости. 2016. Т. 6. № 4. С. 21.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии