Журнал физической химии, 2019, T. 93, № 11, стр. 1724-1730
Уравнение кинетики сорбции ионов тяжелых металлов на синтетических алюмосиликатах
П. С. Гордиенко a, И. А. Шабалин a, С. Б. Ярусова a, b, *, И. Г. Жевтун a, О. С. Василенко a
a Российская академяи наук, Дальневосточное отделение, Институт химии
Владивосток, Россия
b Владивостокский государственный университет экономики и сервиса
Владивосток, Россия
* E-mail: yarusova_10@mail.ru
Поступила в редакцию 07.08.2018
После доработки 07.08.2018
Принята к публикации 06.03.2019
Аннотация
Получено уравнение кинетики топохимических реакций, которое применено для анализа процессов сорбции ионов тяжелых металлов сорбентами на основе наноструктурированных синтетических алюмосиликатов, ионообменных смол, механизм сорбции которых связан с ионным обменом, а изотермы сорбции описываются уравнением Ленгмюра. Установлено, что во всех рассмотренных случаях экспериментальные результаты по кинетике с минимальными отклонениями отличаются от полученных по предложенному уравнению во всем анализируемом временном интервале.
При исследовании кинетики химических реакций в гетерогенных системах, в том числе и топохимических реакций процессов сорбции и десорбции, одним из основных параметров, характеризующих процесс, являются характерные кинетические постоянные, определяемые из эмпирических уравнений, которыми описывают экспериментальные данные. Временные параметры химических процессов сорбции важны не только для отработки оптимальных параметров промышленных технологий, но и для выбора режимов извлечения сорбентами ионов тяжелых металлов из живых организмов. И в настоящее время при исследовании кинетики топохимических реакций остаются актуальны такие эмпирические зависимости, которые бы имели минимальное число переменных и описывали бы кинетику процесса в заданном временном интервале с наименьшими отклонениями от экспериментальных данных.
В уравнениях формальной кинетики зачастую используют временную зависимость, например, величины степени прохождения реакции $\alpha $ или текущее значение сорбционной емкости Аt, или ее относительной величины, равной Аt/Am, где Am – величина сорбционной емкости сорбента в равновесных условиях, и другие параметры. Применяемые формальные уравнения кинетики должны удовлетворять определенным требованиям, а именно, описывать экспериментальные данные в заданном временном интервале исследуемого процесса. Временные зависимости величин прохождения реакции $\alpha $ или относительной величины сорбционной емкости часто описывают уравнением Колмогорова–Ерофеева в экспоненциальной форме:
где $\alpha $ – относительная величина прохождения исследуемого процесса (изменяется в пределах от 0 до 1); $k$ – относят к обобщенной константе скорости реакции; $t$ – время процесса; $n$ – кинетический параметр.Из уравнения (1), представленного в виде линейной зависимости:
определяется константа скорости исследуемого процесса K: тогда где $K$ имеет размерность (время)–1, а такая размерность константы скорости реакции, если исходить из классического определения типа реакции, соответствует химическим процессам с реакциями, относящимися к первому порядку. Исходя из этого, при использовании уравнения Колмогорова–Ерофеева $n$ рассматривают не только как показатель порядка химической реакции, но и как кинетический показатель исследуемой гетерофазной системы, характеризующий физические процессы, например, диффузию, скорость роста кристаллов и др. Чтобы приписать однозначно физический или химический смысл постоянным в уравнениях кинетики, некоторые авторы рассматривают различные модели топохимических реакций и вводят в предложенные уравнения дополнительно параметры, например, отношение объема продукта реакции и реагента $z$ в уравнении анти-Гистлинга–Браунштейна: и в уравнении анти-Валенси–Картера: или фактор гомогенности реакции $m$, в универсальном уравнении Акулова: и другие безразмерные параметры, которые не всегда легко определить экспериментально.При исследовании процессов сорбции ионов тяжелых металлов из водных растворов в неравновесных условиях сорбентами, представляющими собой природные или синтетические цеолиты, смолы, катиониты, текущие значения сорбционной емкости зависят от времени сорбции. Механизм сорбции для многих таких сорбентов основан на катионном обмене, а изотермы сорбции довольно часто описываются уравнением Ленгмюра, полученным на основе закона действующих масс и примененного для анализа процесса сорбции:
где k (л ммоль–1) – константа Ленгмюра; Ср (ммоль л–1) – равновесная концентрация сорбата.При выводе уравнения (7) И. Ленгмюр рассматривал равновесные условия, при которых приравнивались скорости сорбции и десорбции $\left( {{{V}_{c}} = {{V}_{{\text{д}}}}} \right)$, т.е. временной фактор опосредованно был заложен в механизм сорбции. Причем скорость обратной реакции, десорбции, при выводе уравнения (7) была принята не зависимой от концентрации сорбата в растворе, что противоречит существующим представлениям о равновесных процессах: скорость сорбции ${{V}_{c}}$ равна:
где С – равновесная концентрация сорбата в растворе, ммоль л–1; $\frac{{{{A}_{t}}}}{{{{A}_{m}}}}$ – относительная величина сорбционной емкости; $\left( {1 - \frac{{{{A}_{t}}}}{{{{A}_{m}}}}} \right)$ – относительная величина ионных центров, способных к обмену; $k$1 – постоянная. Скорость десорбции ${{V}_{{\text{д}}}}$ равна: где ${{k}_{2}}$ – постоянная.ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Вывод кинетического уравнения для рассматриваемых процессов получен при учете следующих допущений. Во-первых, предположено, что количество замещенных активных центров ${{A}_{t}}$ в сорбенте зависит не только от концентрации сорбата в растворе C, но и от времени сорбции $t$, что подтверждается экспериментально, тогда
а десорбция сорбата, в отличие от допущений, принятых при выводе уравнения (7), принята зависимой от концентрации сорбата в растворе и относительной величины сорбционной емкости сорбента, т.е.При таких допущениях выполняется равенство значений ${{A}_{t}}$ в уравнениях (10) и (11), из которого и получена временная зависимость текущего значения ${{A}_{t}}$:
где $k$ – константа, имеющая размерность (время)-1; $t$ – время; ${{A}_{m}}$ – максимальная сорбционная емкость сорбента. Из уравнения (12) следует, что константа $k$ может быть определена как из экспериментальных зависимостей значений ${{A}_{t}}$ от $t$ расчетным путем, согласно уравнению:(13)
$k = \sum {\frac{{\frac{{{{A}_{t}}}}{t}\left( {\frac{1}{{{{A}_{m}} - {{A}_{t}}}}} \right)}}{N}} ,$Если исследуемый топохимический процесс соответствует механизму, который описывается уравнением Ленгмюра, то уравнение (12) с постоянной $k$ должно описывать кинетику во всем временном интервале, что подтверждено при анализе данных по кинетике [1–5].
Для любого предлагаемого эмпирического уравнения кинетики необходимо дать обоснование физического смысла входящих в него постоянных величин. В полученном уравнении (12) обратная величина постоянной $k$ соответствует времени сорбции, при котором половина активных центров сорбента прореагировала, т.е. произошла реакция катионного обмена, что легко может быть проверено экспериментально. По этому параметру легко сравнивать кинетические свойства сорбентов. Полученные экспериментальные значения k при различных температурах исследуемого процесса позволяет рассчитать с использованием уравнения Аррениуса энергию активации и изменение термодинамических параметров системы сорбент–сорбат:
Константа Ленгмюра ${{k}_{{\text{л}}}}$ в уравнении (7) и постоянная $k$ в уравнении (12) однозначно характеризуют сорбент, в первом случае – по сорбционной емкости, а во втором – по кинетическим свойствам.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В работе [1] приведены данные (табл. 1) по кинетике сорбции ионов цезия из водных растворов наноструктурированными алюмосиликатами (Т : Ж = 1 : 40, С = 7.67 ммоль л–1), из которых следует, что скорость катионного обмена между сорбентом и раствором очень большая. Через минуту (без учета времени на фильтрацию) сорбционная емкость KAlSiO4 · H2O и KAlSi5O12 · 2.7H2O составляет не менее 95% от ее равновесного значения (табл. 1). Подобная зависимость была получена ранее и для синтетического алюмосиликата калия KAlSi3O8 · 1.5H2O [6].
Таблица 1.
Зависимость величины сорбционной емкости от времени при различных температурах при сорбции ионов Сs+ алюмосиликатами KAlSiO4 · H2O и KAlSi5O12 · 2.7H2O [1]
| T, °C | t, мин | KAlSiO4 · H2O | KAlSi5O12 · 2.7H2O | ||||||
|---|---|---|---|---|---|---|---|---|---|
| $k$, мин–1 | Δ, % | Ас(t)(расч.), ммоль/г | Ас(t)(эксп.), ммоль/г | $k$, мин–1 | Δ, % | Ас(t)(расч.), ммоль/г | Ас(t)(эксп.), ммоль/г | ||
| 20 | 1 | 38 | 0.80 | 0.2605 | 0.2626 | 56 | 2.1 | 0.2790 | 0.2732 |
| 5 | 0.90 | 0.2660 | 0.2634 | 0.10 | 0.2829 | 0.2832 | |||
| 10 | 0.07 | 0.2666 | 0.2668 | 0.07 | 0.2834 | 0.2836 | |||
| 30 | 0.14 | 0.2671 | 0.2667 | 0.03 | 0.2838 | 0.2837 | |||
| 60 | 0.18 | 0.2672 | 0.2667 | 0.07 | 0.2839 | 0.2841 | |||
| 120 | 0.27 | 0.2673 | 0.2666 | 0.10 | 0.2839 | 0.2842 | |||
| 240 | 0.03 | 0.2673 | 0.2674 | 0.07 | 0.2839 | 0.2840 | |||
| 40 | 1 | 18 | 2.90 | 0.2575 | 0.2650 | 83 | 0.98 | 0.2857 | 0.2829 |
| 5 | 0.96 | 0.2689 | 0.2663 | 0.13 | 0.2873 | 0.2869 | |||
| 10 | 1.36 | 0.2703 | 0.2666 | 0.07 | 0.2876 | 0.2878 | |||
| 30 | 1.80 | 0.2713 | 0.2664 | 0.27 | 0.2878 | 0.2886 | |||
| 60 | 3.50 | 0.2716 | 0.2712 | 0.03 | 0.2879 | 0.2878 | |||
| 120 | 0.51 | 0.2717 | 0.2703 | 0.24 | 0.2879 | 0.2872 | |||
| 240 | 0.03 | 0.2718 | 0.2719 | 0.03 | 0.2879 | 0.2880 | |||
| 70 | 1 | 6.2 | 7.53 | 0.2393 | 0.2588 | 25.5 | 1.30 | 0.2781 | 0.2818 |
| 5 | 0.66 | 0.2693 | 0.2711 | 0.06 | 0.2868 | 0.2870 | |||
| 10 | 4.19 | 0.2756 | 0.2645 | 0.50 | 0.2879 | 0.2864 | |||
| 30 | 1.72 | 0.2765 | 0.2718 | 0.13 | 0.2887 | 0.2883 | |||
| 60 | 2.02 | 0.2772 | 0.2717 | 0.13 | 0.2889 | 0.2885 | |||
| 120 | 1.12 | 0.2776 | 0.2745 | 0.03 | 0.2890 | 0.2891 | |||
| 240 | 0.07 | 0.2778 | 0.2780 | 0.70 | 0.2890 | 0.2868 | |||
C учетом максимальных величин сорбционной емкости ${{A}_{m}}$ алюмосиликатов при температурах сорбции 20, 40 и 70°C, которые равны 0.2674, 0.2717 и 0.2780 ммоль г–1 соответственно для KAlSiO4 · H2O, и 0.2840, 0.2880 и 0.2891 ммоль г–1 соответственно для KAlSi5O12 · 2.7H2O, и значений сорбционных емкостей при временах сорбции 1, 5 и 10 мин (табл. 1) по уравнению (13) рассчитаны значения постоянной $k$ (мин–1) кинетического уравнения (12) для KAlSiO4 · H2O и KAlSi5O12 · 2.7H2O. В табл. 1 приведены как расчетные значения сорбционной емкости, так и экспериментальные, а также их различие (Δ, %) и расчетные значения $k$ (мин–1) для каждой температуры. Максимальное различие в величинах сорбционной емкости, определенной экспериментально и рассчитанной по уравнению (12), составляет не более нескольких процентов, причем это относится только к некоторым точкам, что следует отнести к некорректному измерению при проведении эксперимента. Большинство сравниваемых величин отличаются на десятые доли процента, что косвенно подтверждает пригодность уравнения (12) для описания кинетики подобных процессов.
На рис. 1а, 1б приведены данные [1], обработанные согласно уравнениям (14) и (15). Получены линейные уравнения кинетики для KAlSiO4 · H2O для различных температур сорбции (рис. 1а): у = 3.75025 + 0.05457х (20°С); у = 3.71485 + + 0.06689х (40°С); у = 3.66516 + 0.20492х (70°С), и из уравнений определены значения $k$, которые равны 68.7; 55.6; 17.9 мин–1 для соответствующих температур. Для KAlSi5O12 · 2.7H2O получены линейные уравнения (рис. 1б): у = 3.5156 + 0.14167х (20°С); у = 3.4721 + 0.06263х (40°С); у = 3.47142 + + 0.07795х (70°С); значения констант $k$ равны: 24.8; 55.4 и 44.5 мин–1 для 20, 40 и 70°С соответственно.
Рис. 1.
Зависимости обратной величины сорбционной емкости KAlSiO4 · H2O (а) и KAlSi5O12 · 2.7H2O (б) по ионам Cs+ от $1{\text{/}}t$ при различных температурах [1].

Для наноструктурированных алюмосиликатов характерны не только большие сорбционные емкости, но и высокие скорости сорбции. В течение нескольких секунд ($t = 1{\text{/}}k$) сорбционная емкость достигает значения $1{\text{/}}2{{A}_{m}}$. Из значений констант $k$ при различных температурах, согласно уравнению Аррениуса, рассчитано значение энергии активации процесса сорбции, которое не превышает 30 кДж моль–1.
В [2, 3] приведены экспериментальные данные по кинетике извлечения ионов Co2+, Ni2+ и Cd2+ сорбентом, полученным из отходов переработки риса. Для анализа кинетических данных была применена аналитическая зависимость (12), только вместо значений сорбционной емкости ${{A}_{m}}$ и ${{A}_{t}}$ использованы значения степени извлечения $\alpha $. Значения констант $k$ (мин–1) и расчетные значения степени извлечения (Δ, %) приведены в табл. 2. Максимальные значения степени извлечения ${{\alpha }_{m}}$ для каждого элемента при выбранной температуре приняты равными полученным при времени сорбции 180 мин. Расчетное время достижения значения степени извлечения (0.5${{\alpha }_{m}}$) при температурах 20, 40 и 60°C равно для кобальта – 16.6; 9.5 и 3.7 мин; для никеля – 11.4; 7 и 6 мин; для кадмия – 0.2; 0.06 и 0.06 мин соответственно. Можно предположить, что значительное отличие в величинах констант $k$ для никеля, кобальта и кадмия связано с механизмом извлечения ионов, а для ионов кадмия, возможно, это связано с процессами гидролиза.
Таблица 2.
Влияние температуры и времени сорбции на степень извлечения ($\alpha $, %) ионов Co2+, Ni2+ и Cd2+ фитиновым сорбентом [2, 3], (K, мин–1)n, где индекс n = 1, 2 и 3 относится соответственно к Co2+, Ni2+ и Cd2+
| Т, °C (K, мин–1)n |
$t$, мин | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Co2+ | Ni2+ | Cd2+ | ||||||||
| $\alpha $, эксп. | Δ, % | $\alpha $, расч. | $\alpha $, эксп. | Δ, % | $\alpha $, расч. | $\alpha $, эксп. | Δ, % | $\alpha $, расч. | ||
| 20 | 30 | 44.7 | –1.80 | 43.9 | 32.3 | 18.86 | 39.81 | 97.2 | 1.249 | 98.43 |
| (0.06)1 | 60 | 52.6 | 1.68 | 53.5 | 39.8 | 13.7 | 46.16 | 98.9 | –0.14 | 98.76 |
| (0.088)2 | 120 | 60.5 | 0 | 60.05 | 52.4 | –4.8 | 50.15 | 99.1 | –0.17 | 98.93 |
| (4.97)3 | 180 | 68.4 | –0.9 | 67.77 | 54.9 | 0.07 | 54.86 | 99.1 | –0.12 | 98.98 |
| 40 | 30 | 60.5 | –0.01 | 60.49 | 47.4 | –0.08 | 47.36 | 99.2 | 0 | 99.20 |
| (0.105)1 | 60 | 71.1 | –3.37 | 68.78 | 57.4 | 0.09 | 52.30 | 99.3 | 0 | 99.30 |
| (0.143)2 | 120 | 71.6 | 3.02 | 73.83 | 57.4 | –4.0 | 55.18 | 99.4 | –0.06 | 99.34 |
| (16.55)3 | 180 | 79.7 | 5.2 | 75.69 | 58.4 | –3.8 | 56.21 | 99.2 | 0.16 | 99.36 |
| 60 | 30 | 86.8 | –45 | 83.06 | 67.4 | –0.029 | 67.38 | 99.2 | 0 | 99.20 |
| (0.268)1 | 60 | 80.0 | 9.0 | 87.93 | 52.4 | 28.76 | 73.56 | 99.3 | 0 | 99.30 |
| (0.165)2 | 120 | 93.4 | –3.1 | 90.58 | 67.4 | 12.58 | 77.10 | 99.3 | 0.04 | 99.4 |
| (16.55)3 | 180 | 92.1 | 0.6 | 91.50 | 81.0 | –3.37 | 78.36 | 99.4 | –0.04 | 99.36 |
Расчетные и экспериментальные значения степени извлечения ионов тяжелых металлов (табл. 2) отличаются не более, чем на несколько процентов. И для этого типа сорбента предложенное уравнение кинетики описывает процесс сорбции в широком временном интервале.
В работе Р.М. Алосманова [4] представлены данные по кинетике сорбции ионов кобальта и никеля на фосфорсодержащем катионите из водных растворов с концентрацией СМе(II) = = 2 ммоль/дм3 при t = 22 ± 2°C и pH 6, V/ġ = 0.3 л/г. В квазиравновесных условиях через 300 мин сорбции сорбционная емкость исследуемого сорбента по ионам Ni2+ равна 0.448, а по ионам Co2+ – 0.488 ммоль/г, и эти значения приняты за ${{A}_{m}}$. Из представленных данных рассчитана величина постоянной $k$ (для уравнения (12)), которая равна 0.115 мин–1 для процесса сорбции никеля, а для кобальта – 0.09 мин–1. В табл. 3 приведены экспериментальные и расчетные значения сорбционной емкости по уравнению (12) с параметрами: для никеля Am = 0.448 ммоль/г и k = 0.115 мин–1, для кобальта Am = 0.488 ммоль/г и k = 0.09 мин–1. Рассчитанные значения сорбционной емкости во временном интервале 0–300 мин по уравнению (12) отличаются от экспериментальных значений от десятых долей % до 17% (табл. 3).
Таблица 3.
Экспериментальные и расчетные значения сорбционной емкости (ммоль/г) фосфорсодержащего катионита по ионам никеля и кобальта [4]
| № п/п | t, мин | Ni(II) | Co(II) | ||||
|---|---|---|---|---|---|---|---|
| Δ, % | ${{A}_{t}}$(эксп.) | ${{A}_{t}}$(расч.) | Δ, % | ${{A}_{t}}$(эксп.) | ${{A}_{t}}$(расч.) | ||
| 1 | 10 | 0.4 | 0.240 | 0.239 | 3.8 | 0.240 | 0.231 |
| 2 | 20 | 7.6 | 0.336 | 0.312 | 2.7 | 0.4 | 0.313 |
| 3 | 30 | 8.3 | 0.376 | 0.347 | 17.9 | 0.420 | 0.356 |
| 4 | 40 | 10 | 0.408 | 0.368 | 14.3 | 0.440 | 0.382 |
| 5 | 60 | 7.4 | 0.420 | 0.391 | 12.8 | 0.464 | 0.411 |
| 6 | 70 | 7.5 | 0.428 | 0.398 | 12.1 | 0.472 | 0.421 |
| 7 | 90 | 7.8 | 0.440 | 0.408 | 10.5 | 0.480 | 0.434 |
| 8 | 110 | 7.9 | 0.448 | 0.415 | 10.1 | 0.488 | 0.443 |
| 9 | 150 | 5.9 | 0.448 | 0.423 | 7.4 | 0.488 | 0.454 |
| 10 | 200 | 4.4 | 0.448 | 0.429 | 5.6 | 0.488 | 0.462 |
| 11 | 250 | 3.7 | 0.448 | 0.432 | 3.6 | 0.488 | 0.471 |
| 12 | 300 | 3.7 | 0.448 | 0.432 | 3.8 | 0.488 | 0.470 |
На рис. 2 приведены зависимости $1{\text{/}}{{A}_{t}}$ от $1{\text{/}}t$ (данные по кинетике, табл. 3) согласно уравнению (14), которые описываются уравнениями прямых линий. При сорбции никеля: у = 2.06935 + + 19.99202х (коэффициент корреляции R2 = = 0.98058); при сорбции кобальта: y = 1.84865 + + 20.66961х (коэффициент корреляции R2 = = 0.9189).
Рис. 2.
Зависимости обратной величины сорбционной емкости фосфорсодержащего катионита $1{\text{/}}{{A}_{t}}$ по отношению к ионам Ni2+ и Co2+ от $1{\text{/}}t$ [4].
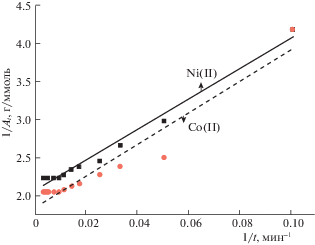
Согласно уравнению (15), рассчитаны величины констант $k$ (мин–1): для никеля – 0.103, для кобальта – 0.089. В пределах ошибки в несколько процентов, такие же значения констант получены при обработке экспериментальных данных согласно уравнению (13). Из полученных результатов следует, что во всем временном интервале механизм сорбции ионов никеля и кобальта на фосфорсодержащем катионите [4], полученном по методикам [7, 8], связан с катионным обменом и описывается уравнением кинетики (12), выведенным на основе анализа топохимической реакции между сорбатом и сорбентом.
Для силиката бария ВаSiO3 · 2.3H2O, синтезированного в многокомпонентной системе ВаCl2 · 2H2O–КОН–SiO2–H2O, получены данные по кинетике извлечения ионов Sr2+ и Ca2+ (табл. 4) из растворов, имитирующих воды озера-накопителя № 11 ПО “Маяк” (состав воды озера-накопителя [9], мг/л: Sr2+ – 10–12; Ca2+ – 100; Mg2+ – 75; Na+ – 132; K+ – 15; Cl– – 82; SO$_{4}^{{2 - }}$ – 650, рН 7.6) при соотношении Т : Ж = 1 : 40 и температуре 20°С. Силикат бария получен при температуре 90°С из водных растворов силиката калия (калиевое жидкое стекло с силикатным модулем, равным 1) и хлорида бария. Образец силиката бария представляет собой порошок, состоящий из нанодисперсных сферообразных частиц практически одного размера, диаметром не более 50 нм, образующих конгломераты, состоящие из наночастиц (рис. 3).
Таблица 4.
Степень извлечения ионов Sr2+ и Ca2+ нанодисперсным силикатом бария ВаSiO3 · 2.3H2O
| t, ч | 0.083 | 0.333 | 0.5 | 0.666 | 1 | 1.5 |
|---|---|---|---|---|---|---|
| ${{\alpha }_{t}}$ | 87.5 | 92.2 | 96.2 | 94.3 | 94.3 | 94.8 |
| ${{\alpha }_{t}}$, % (Sr) | (87.28) | (92.80) | (93.46) | (93.79) | (94.12) | (94.35) |
| Δ, % | 0.24 | –0.6 | 1.3 | –5.0 | 1.72 | 0.47 |
| ${{\alpha }_{t}}$ | 59.7 | 86.7 | 81.4 | 84.0 | 83.3 | 88.9 |
| ${{\alpha }_{t}}$, % (Ca) | (59.98) | (79.36) | (82.31) | (83.86) | (85.48) | (86.59) |
| Δ, % | –0.48 | 8.45 | –1.1 | 0.16 | –2.6 | 2.59 |
Рис. 3.
Морфология микрочастиц образца силиката бария ВаSiO3 · 2.3H2O (исследование выполнено с помощью сканирующего электронного микроскопа высокого разрешения Hitachi S5500 (Япония)).

Из экспериментальных значений величин ${{\alpha }_{t}}$ от времени (табл. 4) при условии, что ${{\alpha }_{m}} = 94.8$ при сорбции ионов Sr2+ и ${{\alpha }_{m}} = 88.9$ при сорбции ионов Ca2+, рассчитаны (по уравнению (13)) значения постоянной $k$, равные 140 ч–1 при сорбции стронция и 25 ч–1 при сорбции ионов кальция. В табл. 4 в скобках приведены расчетные значения (по уравнению (12)) ${{\alpha }_{t}}$ и различие (Δ, %) экспериментальных и расчетных значений ${{\alpha }_{t}}$, не превышающее нескольких процентов. Максимальное отклонение в 5% при сорбции стронция 0.666 ч и 8.45% при времени сорбции кальция 0.333 ч следует рассматривать как экспериментальные ошибки. Данные по кинетике (табл. 4) обработаны согласно уравнениям (14), (15) и представлены на рис. 4. Из уравнения прямой: y = = 0.01045 + 0.0000791х, (коэффициент корреляции R2 = 0.88031) с учетом уравнений (14) и (15) определена максимальная величина степени очистки по ионам Sr2+, равная 96.69%, и величина константы $k = 130.3$ ч–1 (такая же величина получена и по уравнению (13)); по ионам Ca2+: y = = 0.01106 + 0.000457х, (коэффициент корреляции R2 = 0.88031), максимальная степень очистки равна 90.4%, а константа $k = 24.2$ ч–1.
Рис. 4.
Зависимости обратной величины степени очистки раствора от ионов стронция и кальция наноструктурированным силикатом бария.

Для полученного наноструктурированного силиката бария при извлечении ионов Sr2+ из водного раствора со сложным ионным составом (имитатора воды озера-накопителя № 11 ПО “Маяк”, так называемых “теченских вод”) время достижения сорбционной емкости, равной половине максимального значения при (Т : Ж = 1 : 40) или половине значения величины степени очистки, составляет не более 30 с, и такой материал следует рассматривать как перспективный сорбент для очистки жидких радиоактивных отходов в статических условиях сорбции.
Авторы работы [5] определяли статическую сорбционную емкость по ионам Cs+ композиционного сорбента КС-2, имеющего в своем составе 90% алюмосиликата (состав алюмосиликата не указан) и 10% полиакриламида, при сорбции ионов Cs+ из водных растворов с концентрацией ионов Cs+ от 0.1 до 5.0 мэкв/л (Т : Ж = 1 : 50, температура 20°С, время сорбции 24 ч). Было установлено, что максимальная сорбционная емкость составляет 0.065 ± 0.012 мэкв/г, а время достижения равновесного значения концентрации сорбата в растворе составляет ∼80 мин. Экспериментальные данные по кинетике обработаны согласно уравнениям (14) и (15), получено уравнение сорбции: у = 0.00813 + 0.12221х с коэффициентом корреляции R2 = 0.9929, а константа k = 0.066 мин–1, т.е. время достижения 1/2 максимального значения степени сорбции (50%) составляет по предложенному уравнению не более 15–20 мин.
Таким образом, на основе анализа топохимического процесса сорбции с применением закона действующих масс получено уравнение кинетики. Предложенное уравнение применено для описания кинетики известных топохимических реакций. Экспериментально доказано, что оно с высокой точностью описывает данные по кинетике сорбции ионов тяжелых металлов различными синтетическими сорбентами, в том числе на основе алюмосиликатов с различным соотношение кремния и алюминия. Уравнение применено для анализа данных по кинетике сорбции ионов тяжелых металлов сорбентом на основе производного инозитгексафосфорной кислоты, фосфорсодержащим катионитом, композиционным сорбентом, состоящим из алюмосиликата и полиакриламида, из водных растворов различного ионного состава.
Работа выполнена при финансовой поддержке № 18-3-026 комплексной программы фундаментальных научных исследований Дальневосточного отделения РАН “Дальний Восток” на 2018–2020 гг. и проекта 4.5913.2017/8.9 в рамках базовой части государственного задания образовательных организаций высшего образования, находящихся в ведении Министерства науки и высшего образования Российской Федерации.
Список литературы
Гордиенко П.С., Шабалин И.А., Ярусова С.Б. и др. // Хим. технология. 2017. Т. 18. № 1. С. 2.
Ярусова С.Б., Макаренко Н.В., Гордиенко П.С. и др. // Журн. физ. химии. 2018. Т. 92. № 3. С. 451.
Ярусова С.Б., Макаренко Н.В., Гордиенко П.С. и др. // Сборник материалов V Международной конференции по химии и химической технологии, Республика Армения, г. Ереван, 25–29 сентября 2017 г. Ереван: ИОНХ НАН РА, 2017. С. 368.
Алосманов Р.М. // Сорбционные и хроматографические процессы. 2010. Т. 10. Вып. 3. С. 427.
Москальчук Л.Н., Баклай А.А., Леонтьев Т.Г. и др. // Труды БГТУ. Химия и технология неорганических веществ. 2012. № 3. С. 116.
Гордиенко П.С., Ярусова С.Б., Буланова С.Б. и др. // Хим. технология. 2013. Т. 14. № 3. С. 185.
Азизов А.А., Алосманов Р.М., Меликова А.Я. и др. // Изв. вузов. Химия и хим. технология. 2003. Т. 46. Вып. 6. С. 25.
Алосманов Р.М., Мамедов Г.Г., Азизов А.А. и др. // Там же. 2008. Т. 51. № 2. С. 121.
Баранова О.Ю. Защита водных объектов от техногенных радионуклидов сорбентами на основе опалкристобалитовых пород: Автореф. дис. … канд. тех. наук. Екатеринбург, 2006. 19 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


