Журнал физической химии, 2019, T. 93, № 11, стр. 1709-1713
Координация ионов в водных растворах хлорида марганца по данным рентгеновской дифракции
П. Р. Смирнов a, *, О. В. Гречин b
a Российская академия наук, Институт химии растворов им. Г.А. Крестова
Иваново, Россия
b НИИ термодинамики и кинетики химических процессов при ФГБОУ ВО Ивановский
государственный химико-технологический университет
Иваново, Россия
* E-mail: prs@isuct.ru
Поступила в редакцию 21.01.2019
После доработки 21.01.2019
Принята к публикации 12.02.2019
Аннотация
Из полученных методом рентгенодифракционного анализа экспериментальных данных рассчитаны функции радиального распределения водных растворов хлорида марганца в широком диапазоне концентраций при стандартных условиях. Разработаны различные модели структурной организации систем. Путем расчета теоретических функций для каждой модели и сравнения их соответствия с экспериментальными функциями выявлены оптимальные варианты. Установлены количественные характеристики ближнего окружения ионов Mn2+ и Cl–, такие как координационные числа, межчастичные расстояния и разновидности ионных пар. Показано, что структуру насыщенного раствора определяют контактные ионные пары. Сделан вывод, что разбавление ведет к переходу контактных ионных пар к неконтактному типу, а затем к независимой гидратации ионов.
Ряд исследований показал важную роль иона Mn2+ в биологических и геохимических системах. Кроме того, он может использоваться как катализатор при окислении органических молекул в сверхкритической воде. Поэтому установление количественных параметров структуры ближнего окружения этого иона, которые тесно связаны с его химическими реакциями, представляет значительный интерес.
Ион марганца в структурном плане был исследован значительно меньше, чем другие ионы первого ряда переходных металлов. Развитие взглядов на структуру ближнего окружения иона Mn2+ осуществлялось в следующем порядке. В ранних нейтронографических исследованиях определено, что в 2.6 моль/л водном растворе MnSO4 и 4.3 моль/л растворе MnCl2 расстояние Mn2+–О до координированных молекул воды равно 0.209 нм [1]. Авторам не удалось точно установить координационное число (КЧ) катиона, но они определили его примерно равным 5 ± 1. Методом РСА были изучены следующие системы: 4.4 М водный раствор MnNO3 [2], 2 М раствор MnSO4 [3] и Mn(СH3COO)2 [4]. Среднее расстояние от катиона до координированных в первой сфере молекул воды в этих работах было установлено равным 0.219 нм. Для всех исследованных растворов отмечалось образование контактных ионных пар и наличие у иона Mn2+ второй координационной сферы на расстоянии 0.425–0.436 нм. Водные растворы бромида марганца различных концентраций были изучены методом EXAFS спектроскопии [5–7]. Авторы пришли к выводу, что в растворах существует равновесие между гидратными и бромидными комплексами иона марганца, смещающееся в ту или иную сторону в зависимости от концентрации. В более поздней работе, проведенной тем же методом, установлено, что при концентрациях 0.05 и 0.2 моль/кг ион Mn2+ полностью гидратирован шестью молекулами воды, создающими октаэдрическую геометрию первой координационной сферы. Бромид-ион не входит в ближнее окружение катиона. При концентрации же 6 моль/кг количество молекул воды в координационной сфере иона Mn2+ уменьшается до пяти и, в среднем, один ион Br– размещается в ней, формируя контактную ионную пару. Октаэдрическая геометрия ассоциата при этом сохраняется [8].
Расчетными методами структура ближнего окружения иона Mn2+ исследовалась в следующих работах. В работе [9] структура гидратного комплекса обсуждаемого иона определялась тремя различными методами. Расстояние от катиона до молекул воды первой координационной сферы Mn2+–О в зависимости от метода находится в интервале 0.222–0.228 нм. Что касается расстояний Mn2+–H2ОII от катиона до второй координационной сферы, разброс полученных величин увеличивается, попадая в интервал 0.400 (QM/MM) – 0.459 нм (МК). КЧ определены в интервале 6.74–8.90, а количества молекул воды во второй сфере 18.06–22.83. Усовершенствование расчетного метода позволило этой группе авторов в последующей работе уточнить значения расстояний Mn2+–ОI до 0.223–0.225 нм, а КЧ = 6 [10]. Параметры второй сферы описываются следующими значениями: расстояния Mn2+–ОII 0.391–0.445 нм, количество молекул в ней 14–18. Последующее улучшение метода дало следующее описание первой координационной сферы иона Mn2+: расстояние Mn2+–ОI = 0.225 нм, КЧ = 6.0 [11].
Методом спектроскопии КР исследованы водные растворы различных неорганических солей марганца с одновалентными анионами [12]. Установлено, что в растворах перхлората и в разбавленных растворах нитрата марганца вплоть до концентрации 3 М катион присутствует в виде гексагидрата, т.е. без образования внутрисферных комплексов. Авторы отмечают, что в более концентрированных растворах Mn(NO3)2 могут образовываться ионные ассоциаты. В разбавленных растворах MnCl2 катион также находится как гексагидрат вплоть до концентрации 1.5 М, но в более концентрированных системах образуются ионные ассоциаты вида [Mn(OH2)6–nCln](+2–n), где n = 1 или 2. Аналогичная ситуация наблюдается и для раствора MnBr2. В этой же работе методом теории функционала плотности определены расстояния до шести молекул первой и до двенадцати молекул второй координационных сфер, составившие соответственно 0.221 и 0.4355 нм.
Таким образом, можно заключить, что в разбавленных водных растворах его солей ион Mn2+ формирует первую координационную сферу, состоящую из шести молекул воды, находящихся на среднем расстоянии 0.217–0.220 нм, и вторую сферу из двенадцати молекул воды на примерном расстоянии 0.434 нм. Ионные пары с противоионами в разбавленных растворах не образуются. Однако информация о влиянии концентрации на ближнее окружение иона Mn2+ практически отсутствует. Поэтому целью данной работы было методом РСА исследовать зависимость структуры растворов MnCl2 от концентрации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Насыщенный при 25°С раствор дихлорида марганца (мольного соотношения соль: вода 1 : 9.27) готовился весовым методом из кристаллогидрата MnCl2 ⋅ 4H2O квалификации “ч.д.а.” и 0.01 М раствора хлористоводородной кислоты для подавления гидролиза. Более разбавленные растворы соотношений 1 : 20, 1 : 40, 1 : 80 готовились путем последовательного разбавления.
Рентгенодифракционный эксперимент проведен на дифрактометре Bruker D8 Advance (МоKα-излучение, λ = 0.071 нм, циркониевый β-фильтр) в диапазоне углов 4°–130° (2Θ) с шагом 0.1° по рентгенооптической схеме Брегга–Брентано. Проблема отсечения сопутствующего паразитного рассеяния при малых углах регистрации решалась посредством использования глубокой кюветы со свинцовыми краями, не контактирующими с раствором, и устанавливаемого над кюветой свинцового ножа при съемке до 30°. Интенсивность рассеяния от образцов регистрировали позиционно-чувствительным детектором VÅNTEC-1 (Bruker). Отснятые не менее трех раз первичные экспериментальные кривые интенсивности (КИ) усреднялись и сглаживались в программе Origin 7.5 посредством FFT-фильтрации [13].
При расчете экспериментальных и модельных функций использовался математический аппарат, реализованный в алгоритме программного пакета KURVLR [13]. В программу вводились следующие данные: 1) значения экспериментальных интенсивностей рассеяния при каждом шаге углового сканирования, исправленные на фон и поглощение в образце Icoh(s), 2) количество сортов атомов и их концентрации, 3) количество экспериментальных точек, 4) значения волнового вектора s = 4πλ–1sin Θ, 5) стехиометрический объем V, 6) длина волны используемого излучения λ, 7) значения амплитуд атомного рассеяния $f_{i}^{2}(s)$, 8) интенсивности некогерентного рассеяния и 9) доля интенсивности некогерентного рассеяния, зарегистрированная детектором Δ(s). Исправление на некогерентное рассеяние заложено в алгоритм программы.
Структурные функции i(s) определялись по выражению
где Icoh(s) – интенсивность когерентного рассеяния, xi – число атомов сорта i в стехиометрическом объеме V, fi(s) – рассеивающие факторы i-го атома.ФРР рассчитывались путем Фурье-преобразования по формуле (2)
(2)
$D(r) = 4\pi {{r}^{2}}{{\rho }_{0}} + 2r{{\pi }^{{ - 1}}}\int\limits_0^{{{s}_{{\max }}}} {si(s)M(s)\sin rsds} ,$На основании полученной экспериментальной и литературной информации были разработаны модели ближнего окружения ионов в растворе. Расположение атомно-молекулярных частиц задавалось координатами частиц, определяемыми на основе межчастичных расстояний и геометрических представлений о возможной форме такого окружения. Собственная структура воды, неразрушенная ионами и проявляемая по мере разбавления растворов, задавалась в виде фрагментарных тетраэдрических комплексов.
Для расчета теоретических функций вводились количество молекулярных комплексов, их концентрации и радиусы, число и координаты частиц, составляющих молекулярный комплекс, а также их среднеквадратичные отклонения от положения равновесия (температурные коэффициенты). Радиусы молекулярных комплексов определялись на основе сложения ионных радиусов и эффективного радиуса молекулы воды. Расчет теоретических структурных функций для этих моделей проводился по формуле:
(3)
$ \times \exp ( - {{b}_{{ij}}}{{s}^{2}}) - \sum\limits_i {\sum\limits_j {{{x}_{i}}{{x}_{j}}{{f}_{i}}(s){{f}_{j}}(s)4\pi R_{j}^{3}{{V}^{{ - 1}}} \times } } $Первая часть уравнения относится к взаимодействиям на коротких расстояниях, характеризующихся расстоянием rij, температурным фактором bij и количеством парных взаимодействий nij между атомами i и j. Вторая часть уравнения соответствует взаимодействию между сферическим объемом и непрерывной электронной плотностью, находящейся за этим объемом. Rj – радиус сферического объема вокруг j-го атома, а Bj – параметр, описывающий ослабление континуума электронной плотности. Математическим критерием соответствия функций служил фактор рассогласования, рассчитанный по методу наименьших квадратов в каждой точке структурных функций.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Кривые интенсивности (КИ) рассеяния растворов MnCl2 представлены на рис. 1. КИ наиболее концентрированного раствора мольного соотношения 1 : 9.27 отличается от других кривых преобладанием максимума при 11.40 нм–1, предшествующего основному пику, возникающему при 22 нм–1. Это свидетельствует о реализации в данной системе структуры, отличной от усредненных структур более разбавленных растворов. Можно также утверждать, что в данной системе имеет место так называемая среднеудаленная упорядоченность. Переход к более разбавленному раствору (1 : 20) ведет к изменению интенсивностей первого и второго пиков. Начинает формироваться матрица собственной структуры растворителя, хотя межионные взаимодействия на средних расстояниях продолжают играть существенную роль. Дальнейшее перераспределение интенсивности пиков КИ и соответствующий рост основного “водного” максимума по мере разбавления раствора определяется усилением вкладов от собственной структуры растворителя.
Рис. 1.
Экспериментальные кривые интенсивности рентгеновского рассеяния водными растворами хлорида марганца мольных соотношений соль : вода: а – 1 : 9.27, б – 1 : 20, в – 1 : 40, г – 1 : 80, д – 1 : 120.

С использованием программы KURVLR (Швеция) рассчитаны структурные функции si(s) и функции радиального распределения (ФРР) атомно-электронной плотности для исследованных систем (рис. 2). Для наиболее разбавленного раствора (1 : 120) ФРР не рассчитывались, так как сильный маскирующий эффект растворителя может внести значительную неточность в установление количественных характеристик координационных сфер ионов.
Рис. 2.
Экспериментальные функции радиального распределения водных растворов хлорида марганца мольных соотношений соль : вода: а – 1 : 9.27, б – 1 : 20, в – 1 : 40, г – 1 : 80 (точки) и теоретические функции, рассчитанные для оптимальных моделей (сплошные линии).
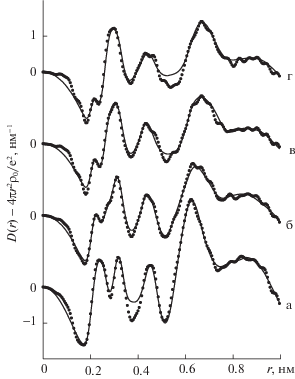
Разработка структурных моделей растворов основывалась на интерпретации максимумов, наблюдаемых на экспериментальных ФРР. Первый пик на всех ФРР при ~0.220 нм отражает вклады от рассеивающих групп катион – первая координационная сфера (Mn2+–OH2) в общую картину рассеяния. У насыщенного раствора он несколько смещен в сторону бóльших расстояний. Вероятно, это вызвано образованием в нем ассоциатов Mn2+–Cl– контактного типа с бóльшими, чем Mn2+–H2OI межчастичными расстояниями. Второй пик при ~0.310 нм сложный и включает в себя как вклады от расстояний между ближайшими молекулами воды, реализуемые при 0.290 нм, так и вклад от гидратации аниона (Cl––H2O) с расстоянием 0.310 нм. Третий пик при ~0.420 нм также составной, в него входят вклады от взаимодействий катиона со второй координационной сферой (Mn2+–H2OII) и вклады от расстояний между молекулами воды по ребру тетраэдра в сетке растворителя у тех растворов, у которых эта сетка формируется (мольные соотношения 1 : 40 и 1 : 80). У насыщенного раствора он также смещен в сторону больших расстояний. Очевидно, что в этом случае возникновение пика определяется другими типами вкладов. В четвертый широкий и интенсивный пик, находящийся в интервале 0.6–0.7 нм, вносят вклады большое количество взаимодействий, поэтому не ставилась задача его расшифровки и количественной обработки. Однако, следует отметить, что в случае насыщенного раствора этот пик столь интенсивен, что можно предполагать наличие в системе пространственной межионной упорядоченности, с расположением ионов на среднем расстоянии 0.62 нм друг от друга.
Модельный подход изначально использовался для насыщенного раствора. Предварительная модель, включавшая шесть молекул воды в ближайшем окружении катиона, не привела к удовлетворительному соответствию экспериментальной и расчетной функций. Интенсивность первого пика, соответствующего взаимодействию иона Mn2+ с его первой координационной сферой на расчетных функциях, была значительно завышена. Поэтому в следующей модели количество молекул воды в ближнем окружении катиона было уменьшено. Но одним лишь типом взаимодействий Mn2+–OH2 не удалось описать широкий первый пик. Это свидетельствовало о вкладе в него дополнительных взаимодействий. Как было отмечено выше, этими взаимодействиями вероятно являются контакты катиона с анионом. В расчеты была включена модель в виде контактной ионной пары. Некоторая ее корректировка в результате оптимизации привела в итоге к оптимальному варианту, в котором один хлорид-ион находится на расстоянии Mn2+–Cl– 0.250 нм от катиона. Кроме того, в ближнее окружение катиона входят четыре молекулы растворителя. Вторая сфера иона Mn2+ в столь концентрированном растворе не сформирована. Наличие некоторого количества взаимодействий между анионом Cl– и молекулами воды определяется его нахождением в первой координационной сфере катиона и соседством с входящими в нее молекулами растворителя. Соответствие расчетной и экспериментальной функций показано на рис. 2, а основные параметры модели сведены в табл. 1.
Таблица 1.
Основные структурные параметры оптимальных моделей водных растворов хлорида марганца
| Тип взаимодей-ствия | Мольное соотношение | |||||||
|---|---|---|---|---|---|---|---|---|
| насыщенный | 1 : 20 | 1 : 40 | 1 : 80 | |||||
| r | n | r | n | r | n | r | n | |
| Mn2+–O | 0.217 | 4.00 | 0.219 | 4.90 | 0.217 | 5.4 | 0.216 | 6.2 |
| Mn2+–OII | – | – | 0.428 | 2.60 | 0.428 | 3.7 | 0.430 | 6.1 |
| Cl––O | 0.315 | 1.65 | 0.315 | 2.22 | 0.315 | 3.3 | 0.315 | 5.1 |
| Mn2+–Cl- | 0.250 | 1.05 | 0.465 | 0.80 | – | – | – | – |
Далее анализировался раствор мольного соотношения 1 : 20. За основу при разработке модели была взята модель, полученная в качестве оптимальной для насыщенного раствора. Расчетные функции показали необходимость корректировки первоначального варианта. В результате оптимизации выявился итоговый вариант, представляющий собой следующее (табл. 1). Ближнее окружение катиона качественно изменилось. Хлорид-ион вышел из первой координационной сферы и встроился во вторую на расстоянии 0.465 нм. Количество молекул воды в первой координационной сфере иона Mn2+ увеличилось. Таким образом определять структуру раствора стали неконтактные ионные пары. Катион начал формировать вторую координационную сферу. По аналогичному алгоритму осуществлялся модельный подход и к раствору соотношения 1 : 40. Итоговая модель свидетельствует о том, что усредненная структура раствора изменилась (табл. 1). Ассоциаты между ионами перестали определять ближний порядок, т.е. ионы Mn2+ и Cl– перешли к так называемой “независимой” гидратации. Несколько увеличилось количество молекул растворителя в первой и второй координационных сферах катиона и гидратной сфере аниона. Модель для раствора мольного соотношения 1 : 80 показала лишь увеличение количества молекул воды, входящих в координационную упорядоченность ионов (табл. 1). Катион стал формировать первую координационную сферу из шести молекул воды. Количество молекул воды во второй координационной сфере катиона и гидратной сфере аниона еще не достигло максимально возможных значений, опубликованных в литературе.
По изученной системе можно сделать следующие выводы. Структура насыщенного раствора хлорида марганца определяется контактными ионными парами, в которых один ион Cl– входит в первую координационную сферу катиона, располагаясь на расстоянии 0.250 нм. Помимо хлорид-иона в первую сферу катиона входят четыре молекулы воды. При переходе к раствору мольного соотношения 1 : 20 количество молекул воды в первой координационной сфере катиона увеличивается до пяти, а хлорид ион из первой координационной сферы переходит во вторую. Определяющими структуру раствора становятся неконтактные ионные пары. Дальнейшее разбавление ведет к полному распаду ионных ассоциатов (раствор 1 : 40). В растворе мольного соотношения 1 : 80 катион достраивает свою первую координационную сферу. Вторая сфера включает шесть молекул растворителя. Анион также выстраивает свое гидратное окружение.
Список литературы
Neilson G.W., Newsome J.R., Sandstrom M. // J. Chem. Soc. Faraday Trans. 1981. V. 77. № 7. P. 1245.
Caminiti R., Cucca P., Pintori T. // Chem. Phys. 1984. V. 88. № 1. P. 155.
Lichery G., Paschina G., Piccaluga G. et al. // J. Chem. Phys. 1984. V. 81. № 12. P. 6059.
Caminiti R., Cucca P., Monduzzi M. et al. // Ibid. 1984. V. 81. № 1. P. 543.
Beagley B., Gahan B., Greaves G.N. et al. // J. Chem. Soc. Chem. Commun. 1983. V. 21. P. 1265.
Beagley B., Gahan B., Greaves G.N. et al. // Ibid. 1985. V. 24. P. 1804.
Beagley B., McAuliffe C.A., Smith S.P.B. et al. // J. Phys.: Condens. Matter. 1991. V. 3. P. 7919.
Chen Y., Fulton J., Partenheimer W. // J. Solut. Chem. 2005. V. 34. № 9. P. 993.
Yagüe J.I., Mohammed A.M., Loeffler H. et al. // J. Phys. Chem. A. 2001. V. 105. № 32. P. 7646.
Loeffler H.H., Yague J.I., Rode B.M. // Ibid. 2002. V. 106. № 41. P. 9529.
Schwenk C.F., Loeffler H.H., Rode B.M. // J. Am. Chem. Soc. 2003. V. 125. № 6. P. 1618.
Rudolph W.W., Irmer G. // Dalton Trans. 2013. V. 42. № 40. P. 14460.
OriginPro 7.5. Copyright 1991–2003. OriginLab Corporation. USA.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


