Журнал физической химии, 2019, T. 93, № 11, стр. 1674-1680
Антиоксидантные свойства аминокислотных производных фуллерена C60
В. А. Волков a, О. В. Ямскова b, *, Н. Э. Шепель b, В. С. Романова b, Д. В. Курилов c, А. В. Трегубов b, О. В. Вышиванная b, М. В. Воронков a, И. А. Ямсков b, В. М. Мисин a, Н. Д. Зубарева c, Л. М. Кустов c
a Российская академия наук, Институт биохимической физики имени Н.М. Эмануэля
Москва, Россия
b Российская академия наук, Институт элементоорганических соединений им. А.Н. Несмеянова
Москва, Россия
c Российская академия наук, Институт органической химии им. Н.Д. Зелинского
Москва, Россия
* E-mail: olga_yamskova@mail.ru
Поступила в редакцию 27.01.2019
После доработки 27.01.2019
Принята к публикации 12.02.2019
Аннотация
Проведено сравнительное исследование относительной антиоксидантной активности (ОАА) фуллерена С60 и его аминокислотных производных методами амперометрии и флуориметрии. Для изучения влияния стерических факторов исследуемых соединений на величину ОАА определены размеры наночастиц в соответствующих коллоидных растворах методом динамического светорассеяния (фотонной корреляционной спектроскопии). На основании результатов, полученных в отношении зависимости ОАА фуллерена С60, а также его аминокислотных производных (в солевых формах) от соответствующих размеров наночастиц в коллоидных водных растворах, проведен статистический корреляционно-регрессионный анализ данных. Выявлена тесная отрицательная (обратная) корреляционная связь между размером наночастиц в растворе и проявляемыми ими антиоксидантными свойствами, причем с проявлением синергетического эффекта, связанного с влиянием как химического строения исследуемых соединений, так и их структурной организацией в коллоидном растворе. Найдено, что строение заместителя в молекуле аминокислотного производного фуллерена С60, в свою очередь, оказывает влияние на размер образующихся наночастиц, и в то же время восстановительные свойства аминокислотных производных фуллерена С60, в основном, определяются электронными эффектами заместителей.
Благодаря наличию π-сопряжения в молекуле фуллерена С60 ее электронная система электронодефицитна. По этой причине фуллерен и его производные способны проявлять свойства акцептора свободных радикалов [1, 2], обладают большой радикалоемкостью и могут выступать в качестве антиоксидантов в различных системах, в том числе биологических [3, 4], а также в качестве соединений, способных влиять на свободно-радикальные процессы и процессы переноса энергии [5]. Наряду с антиоксидантными свойствами фуллерены способны передавать энергию фотовозбуждения и тем самым – переводить кислород из триплетного состояния в синглетное [6]. Таким образом, фуллерен может выступать в качестве антиоксиданта и, кроме того, способствовать протеканию реакций посредством переноса энергии и стабилизации интермедиатов, предположительно, по механизму π-анионного катализа [7, 8].
С точки зрения применения в качестве регуляторов свободнорадикальных процессов, представляет интерес изучение конъюгатов фуллерена с молекулами, участвующими в метаболических процессах, протекающих в биологических системах (в частности, конъюгатов с протеиногенными аминокислотами [1], а также аминокислотами, являющимися нейромедиаторами и/или обладающими иной биологической активностью).
Известно, что фуллерен и его производные в водных средах находятся в виде коллоидных растворов [9, 10], поэтому физико-химические свойства указанных соединений будут определяться как их структурными особенностями, так и размером образуемых ими наночастиц [9, 11–13].
Для сравнительного исследования антиоксидантных свойств аминокислотных производных фуллерена С60 выбраны два метода, один из которых (флуориметрический) позволяет определять способность этих соединений инактивировать свободные радикалы, образующиеся в результате распада азоинициатора – 2,2'-азобис(2-амидинопропан)дихлорида (АБАП). Другой метод (амперометрический) дает возможность оценить восстановительные свойства исследуемых молекул. Известно, что введение заместителей в молекулу фуллерена приводит к изменению соответствующих биологических свойств [11], а также физико-химических характеристик. С целью изучения влияния стерических факторов на величину относительной антирадикальной активности (ОАА) аминокислотных производных фуллерена С60 определяли размеры наночастиц в соответствую-щих коллоидных растворах методом динамического светорассеяния.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Концентрацию фуллерена С60 и его аминокислотных производных в водных растворах определяли методом весового анализа.
Амперометрия
Амперометрическая установка “ЦветЯуза-01-АА” (НПО “Химавтоматика”, Россия) представляет собой электрохимическую ячейку со стеклоуглеродным анодом и катодом из нержавеющей стали, к которым приложена разность потенциалов 1.3 В [14]. Анализируемая проба с помощью дозатора с объемом петли 20 мкл вводится в поток элюента (дистиллированная вода), который прокачивается насосом через электрохимическую ячейку со скоростью 1.2 мл/мин. В процессе прохождения пробы через ячейку регистрируется ток (нА) электрохимического окисления, развертка которого во времени (с) выводится на монитор компьютера, и для исследуемых образцов определяется площадь под амперометрической кривой Sобр (нА с). Предварительно для стандартного образца (образца сравнения), в качестве которого взята галловая кислота, строится градуировочный график зависимости величины площади под амперометрической кривой (Sгк) от концентрации вещества в растворе.
Таким образом, используя значения отношения площадей под кривыми электрохимического окисления исследуемого и стандартного образцов, а также их концентрации в растворах (при помощи градуировочного графика), вычисляют относительный параметр k, равный отношению констант скоростей электрохимического окисления исследуемого (kобр) и стандартного (kгк) образцов [15]:
где Sобр и Sгк – площади под амперометрическими кривыми для исследуемого и стандартного образцов, Собр и Сгк – концентрации (мМ) водных растворов исследуемого и стандартного образцов соответственно.Флуориметрия
Кинетические кривые изменения интенсивности флуоресценции во времени измеряли на спектрофлуориметре “FluoroLog 3.21” (США) при температуре 37 ± 0.2°C (при термостатировании в кюветном отделении). Наблюдаемую флуоресценцию детектировали при длине волны λ = = 515 нм под прямым углом относительно пучка возбуждения в стандартной (1 см) кварцевой кювете при длине волны возбуждающего света λ = = 491 нм. Интенсивности флуоресценции корректировали по отношению к чувствительности измеряющего фотоэлектронного умножителя. Температуру образца поддерживали при помощи термостата “Cole-Parmer 12108-15” (США) (6 л, вода, нагрев/охлаждение, цифровой контроллер). Компоненты образца (за исключением инициатора) предварительно термостатировали в течение 10 мин перед смешиванием. Температуру в кювете уточняли при помощи ртутного термометра с шагом деления шкалы 0.1 К. Величину ОАА определяли по методике, представленной в работе [16].
Растворы флуоресцеина и АБАП готовили в фосфатном буфере (75 мМ, рН 7.4), а затем инкубировали в течение 10 мин при 37°C перед помещением в кювету для определения флуоресценции. Конечные концентрации компонентов смеси в кювете составляли: 9.6 мМ (АБАП), 10–8 М (флуоресцеин), 2.5 × 10–6 М (исследуемый раствор). Фосфатный буфер (75 мМ) использовали для холостого опыта, тролокс (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновую кислоту) в концентрации 1.2 × 10–6 М – в качестве препарата сравнения. Величину, характеризующую ОАА, рассчитывали как соотношение площадей под кривыми тушения флуоресценции для соответствующего исследуемого образца (Sобр) и тушения флуоресценции для тролокса (Sтр) с учетом холостого опыта (“бланка”, без добавления антиоксидантов, Sбл), а также концентраций тролокса (Cтр) и исследуемых образцов (Cобр):
Динамическое светорассеяние
Для определения гидродинамического радиуса частиц аминокислотных производных фуллерена С60, диспергированных в водном растворе, использовали метод лазерного динамического рассеяния света (фотонной корреляционной спектроскопии). Измерения проводили на анализаторе “Photoсor Compact-Z” (Россия), оснащенном термостабилизированным AlGaInP диодным лазером с длиной волны λ = 637.4 нм (мощностью 30 мВт) и многоканальным коррелятором “Photoсor-FС”. Распределения по гидродинамическому радиусу получали из измеренных корреляционных функций интенсивности рассеянного света при помощи программного обеспечения DynaLS фирмы “Alango Ltd” (Израиль) методом кумулянтов [17], а также ALV-5000/E фирмы “ALV-GmbH” (Германия) методом CONTIN [18]. Измерения проводили при величине угла рассеивания 90° и температуре 25°С. Использовали цилиндрические кюветы диаметром 8 мм и объемом 1 мл. Концентрации образцов составляли 10–6 М.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Введение заместителей в молекулу фуллерена С60 приводит к значительному увеличению восстановительной активности полученных производных, вероятно, вследствие изменений в системе π-электронного сопряжения в молекуле фуллерена, имеющего место в результате 1,2-присоединения с образованием ковалентной С–N-связи [19], при этом неподеленная пара электронов на атоме азота также способствует увеличению восстановительных свойств, создавая положительный мезомерный эффект для π-электронной системы фуллерена. Карбоксильная группа, находящаяся в α-положении к асимметрическому атому углерода, несет заряд, проявляя при этом отрицательный индуктивный и положительный мезомерный эффекты. Поскольку во всех исследуемых производных заместители, вводимые в молекулу фуллерена С60, представляют собой α-аминокислоты, то можно полагать, что различия в восстановительных свойствах обусловлены как структурной организацией молекул аминокислотных производных в растворе, так и природой бокового заместителя в аминокислоте. Значения параметра k, отражающие восстановительные свойства исследуемых аминокислотных производных фуллерена С60, представлены в табл. 1.
Таблица 1.
Восстановительные свойства аминокислотных производных фуллерена С60, определенные амперометрическим методом
| № | Соединение | Структурная формула заместителя | k |
|---|---|---|---|
| 1 | Фуллерен C60 | – | 0.011 |
| 2 | N-(Моногидрофуллеренил)-L-аланина калиевая соль, Н – C60 – L-Ala – ОК |  |
0.085 |
| 3 | N-(Моногидрофуллеренил)-D-аланина калиевая соль, Н – C60 – D-Ala – ОК |  |
0.069 |
| 4 | N-(Моногидрофуллеренил)-L-валина калиевая соль, Н – C60 – L-Val – ОК |  |
0.455 |
| 5 | N-(Моногидрофуллеренил)-D-валина калиевая соль, Н – C60 – D-Val – ОК | 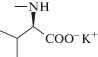 |
0.335 |
| 6 | N-(Моногидрофуллеренил)-L-аспарагиновой кислоты дикалиевая соль, Н – C60 – L-Asp – (ОК)2 |  |
0.170 |
| 7 | N-(Моногидрофуллеренил)-D-аспарагиновой кислоты дикалиевая соль, Н – C60 – D-Asp – (ОК)2 |  |
0.214 |
Наиболее высокие значения восстановительного потенциала выявлены у аминокислотных производных фуллерена С60, включающих D- и L-валин, что, по-видимому, можно объяснить наличием в составе аминокислоты изопропильной группы, проявляющей наибольший электронодонорный эффект.
При исследовании антирадикальной активности фуллерена С60 и его аминокислотных производных для всех анализируемых веществ в реакционной системе в качестве рабочей выбрана концентрация 2.5 × 10–6 М и определен размер наночастиц, присутствующих в водном растворе. При указанной концентрации более слабые антиоксиданты не дают чувствительного отклика в рамках используемой методики, что позволяет выделить наиболее сильные антиоксиданты, избежав при этом заметного эффекта тушения флуоресценции флуоресцеина. Как видно из табл. 2, параметр, характеризующий ОАА фуллерена С60 (№ 1) и его производного с L-аспарагиновой кислотой (№ 6), близок к нулю, однако при использовании концентраций, на порядок более высоких, метод позволил количественно оценить их антиоксидантные свойства.
Таблица 2.
Величины ОАА фуллерена С60, а также аминокислотных производных (солевых форм) фуллерена С60 и соответствующие размеры (d) наночастиц в коллоидных водных растворах
| № | ОАА | d, нм |
|---|---|---|
| 1 | – * | 78 ± 6 |
| 2 | 0.15542 | 94 ± 13 |
| 3 | 0.63235 | 42 ± 6 |
| 4 | 0.27362 | 90 ± 15 |
| 5 | 0.03605 | 107 ± 18 |
| 6 | – * | 108 ± 30 |
| 7 | 0.00513 | 110 ± 20 |
Очевидно, что способность анализируемых веществ защитить флуоресцирующий агент от атак свободными радикалами связана не только с антирадикальной активностью самого вещества, обусловленной его структурой, но и со стерической доступностью молекул исследуемого соединения для свободных радикалов в растворе. На основании результатов, представленных в табл. 2 (№ 2–7), проведен статистический анализ и для полученной зависимости построена однофакторная регрессионная модель линейного типа. Математическая обработка данных осуществлена с использованием программного обеспечения “MS Excel”.
Показатель ковариации ($Cov$) вычисляли по формуле:
В предположении наличия линейной связи между двумя признаками для оценки степени связи между рассматриваемыми явлениями вычисляли линейный коэффициент корреляции Пирсона (rxy):
где $Cov(xy)$ – значение показателя ковариации; σx (23.49764) и σy (0.22271) – рассчитанные значения стандартных отклонений эмпирических значений величин факторного и результативного признаков соответственно. Величина rxy = –0.98846. Полученное значение rxy можно интерпретировать как наличие отрицательной (обратной) сильной (тесной) связи между изучаемыми явлениями, т.е. приблизительно в 98.9% между факторным и результативным признаками присутствует обратная связь.Проведена оценка значимости полученной величины линейного коэффициента корреляции Пирсона с помощью t-критерия Стьюдента (tp) согласно формуле (для совокупности малого объема):
Рассчитан коэффициент детерминации (R2), показывающий долю вариации значений результативного признака (yi), которая объясняется вариацией значений факторного признака (xi). Величину коэффициента детерминации вычисляли путем возведения в квадрат линейного коэффициента корреляции Пирсона:
Коэффициент детерминации R2 = 0.97706. Это означает, что ~97.7% изменчивости значений результативного признака (ОАА) объясняется влиянием изменения значений факторного признака (размеров частиц). Остальная часть (1 – R2) ~ ~ 0.023 или 2.3%) изменчивости значений ОАА объяснима влиянием прочих факторов.
Найдены параметры a0 и a1 уравнения линии регрессии $\hat {y}$ = a + bx, характеризующего связь между факторным и результативным признаками. Параметр a1 (коэффициент регрессии) рассчитан в соответствии со следующими соотношениями:
Тогда уравнение регрессии принимает вид:
где ${{\hat {y}}_{x}}$ – теоретическое значение результативного признака y, предсказанное по уравнению регрессии. Рассчитана средняя относительная ошибка аппроксимации (〈ε〉, %):где i = 1, 2, ..., n (n = 6). Значение величины 〈ε〉 приближенно равно 13.1%, что составляет менее 15%. Это свидетельствует о достаточно адекватном соответствии построенной регрессионной модели исходным эмпирическим данным.
Результирующая диаграмма корреляционной связи между величиной ОАА и размером наночастиц аминокислотных производных фуллерена С60 представлена на рис. 1.
Рис. 1.
Диаграмма корреляционной связи между величиной ОАА и размером (d) наночастиц аминокислотных производных фуллерена С60.

Фуллереновые производные L- и D-аланина отличаются только конфигурацией асимметрического углеродного атома α-аминокислоты, однако, существенные различия в значениях средних размеров образованных ими наночастиц приводят к тому, что по величине ОАА раствор производного D-аланина более чем в 4 раза выше, чем для соответствующего производного L-аланина.
Следует отметить, что метод динамического светорассеяния чувствителен к частицам большого размера, и, в частности, для раствора фуллеренового производного D-аланина зафиксировано образование частиц размеров порядка сотен нанометров, однако, их доля в массовом распределении не превышает 5%. При этом фуллереновое производное D-аланина, образовавшее наночастицы наименьшего среднего размера среди всех исследуемых образцов (табл. 2, № 3), показало среди них и самую высокую антирадикальную активность. Указанный эффект, возможно, обусловлен стерическим фактором – размером наночастиц в растворе: при их увеличении уменьшается величина отношения площади поверхности наночастицы к ее объему на единицу объема коллоидного раствора. Молекулы внутри этого объема оказываются труднодоступными для взаимодействия с радикалами, и соответствующее соединение проявляет меньшую антиоксидантную активность.
Фуллереновые производные L- и D-аспарагиновых кислот, несмотря на достаточно высокие показатели восстановительной активности (табл. 1, № 6 и 7), вследствие более высоких величин средних размеров наночастиц, показывают низкие значения ОАА (табл. 2, № 6 и 7). Кинетические кривые уменьшения интенсивности флуоресценции в ходе взаимодействия флуоресцеина со свободными радикалами в холостом опыте и в присутствии наиболее активных аминокислотных производных фуллерена С60 представлены на рис. 2.
Рис. 2.
Кинетические кривые уменьшения интенсивности флуоресценции флуоресцеина в результате его деградации при взаимодействии с радикалами в холостом опыте (1) и при добавлении в систему растворов калиевых солей 2–4 (соответствуют номерам в табл. 1) с одинаковой концентрацией 2.5 × 10–6 М и раствора тролокса (5) с концентрацией 1.2 × 10–6 М. Начальные концентрации растворов флуоресцеина и АБАП – соответственно 10–8 М и 9.6 мМ.

Следует отметить, что у тролокса (5) – водорастворимого аналога витамина Е, использованного в работе в качестве стандарта сравнения, наблюдается выраженный период индукции с резким выходом из него, что свидетельствует о проявлении свойств сильного антиоксиданта. В то же время аминокислотные производные фуллерена С60 замедляют деградацию флуоресцеина. Однако кинетические кривые для фуллереновых аминокислотных производных не показывают периода индукции, что свидетельствует о неполном ингибировании процесса. Упомянутые экспериментальные факты с учетом выявленной обратной корреляционной связи между размерами их наночастиц и соответствующей способностью тормозить свободнорадикальное окисление (величиной ОАА), могут быть объяснены тем, что антиоксидант, находящийся в наночастицах, перехватывает радикалы только вблизи поверхности частиц, в то время как в остальном объеме реакционной смеси радикалы продолжают повреждать молекулы флуоресцеина.
Фуллерен С60 представляет собой классический пример акцептора электронов в радикальных реакциях и стабилизирующего вещества в процессах образования анион-радикальных интермедиатов. С точки зрения аспекта усиления антиоксидантной и восстановительной способностей фуллерена С60 его модификация посредством введения заместителей различной природы, приводящая к увеличению антиоксидантных и восстановительных свойств, происходит вследствие изменений в системе π-электронного сопряжения. Строение заместителя в молекуле производного, в свою очередь, оказывает влияние на размер образующихся наночастиц. На основании полученных в настоящей работе экспериментальных данных установлена отрицательная корреляционная связь между размером наночастиц в растворе и проявляемыми ими антиоксидантными свойствами, причем с проявлением синергетического эффекта, связанного с влиянием как химического строения исследуемых соединений, так и их структурной организацией в растворе. В то же время восстановительные свойства аминокислотных производных фуллерена, в основном, определяются электронными эффектами заместителей.
Список литературы
Sun T., Xu Z. // Bioorg. Med. Chem. Lett. 2006. V. 16. № 14. P. 3731.
Kato S., Aoshima H., Saitoh Y. et al. // J. Nanosci. Nanotechnol. 2011. V. 11. № 5. P. 3814.
Gudkov S.V., Guryev E.L., Gapeyev A.B. et al. // Nanomedicine. 2018. V. 15. № 1. Epub ahead of print. P. 37–46. https://doi.org/10.1016/j.nano.2018.09.001
Grebowski J., Kazmierska P., Litwinienko G. et al. // Biochim Biophys Acta Biomembr. 2018. V. 1860. № 8. P. 1528. https://doi.org/10.1016/j.bbamem.2018.05.005
Koeppe R., Sariciftci N.S. // Photochem. Photobiol. Sci. 2006. V. 5. № 12. P. 1122.
Yamakoshi Y., Umezawa N., Ryu A. et al. // J. Am. Chem. Soc. 2003. V. 125. № 42. P. 12803.
López-Andarias J., Frontera A., Matile S. // Ibid. 2017. V. 139. № 38. P. 13296.
Gust D., Moore T.A., Moore A.L. // J. Photochem. Photobiol B. 2000. V. 58. № 2–3. P. 63.
Бобылев А.Г., Пеньков Н.В., Трошин П.А., Гудков С.В. // Биофизика. 2015. Т. 60. № 1. С. 38.
Андреев С.М., Пургина Д.Д., Башкатова Е.Н. и др. // Российские нанотехнологии. 2014. Т. 9. № 7–8.
Burgess S., Vishnyakov A., Tsovko C., Neimark A.V. // J. Phys. Chem. Lett. 2018. V. 9. No 17. P. 4872. https://doi.org/10.1021/acs.jpclett.8b01696
Park S., Xie Y., Weaver M.J. // Langmuir. 2002. V. 18. № 15. P. 5792. https://doi.org/10.1021/la0200459
Sun Y., Qian Z., Wei G. // Phys. Chem. Chem. Phys. 2016. V. 18. P. 12582.
Яшин А.Я. // Рос. хим. журн. 2008. Т. 52. № 2. С. 130.
Бирюков В.В. // Химия растительного сырья. 2013. № 3. С. 169.
Ou B., Hampsch-Woodill M., Prior R. L. // J. Agric. Food Chem. 2001. V. 49. № 10. P. 4619. https://doi.org/10.1021/jf010586o
Stepanek P. Dynamic Light Scattering. The Method and Some Applications / Ed. by W. Brown Oxford: Clarendron Press, 1993. 177 p.
Provencher S.W. // Comput. Phys. Commun. 1982. V. 27. № 3. P. 229. https://doi.org/10.1016/0010-4655(82)90174-6
Ямскова О.В., Колягин Ю.Г., Романова В.С. и др. // Журн. физ. химии. 2019. Т. 93. № 2. С. 78.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


