Журнал физической химии, 2019, T. 93, № 12, стр. 1870-1878
Влияние полисахаридов и поливинилпирролидона на фотокаталитическую активность хлорина е6 в реакции окисления триптофана
А. Б. Соловьева a, *, О. В. Хасанова a, Н. А. Аксенова a, b, А. В. Черняк c, В. И. Волков c, В. А. Тимофеева a, П. С. Тимашев a, b
a Российская академия наук, Федеральное государственное бюджетное учреждение науки, Институт химической физики им. Н.Н. Семенова
Москва, Россия
b Институт регенеративной медицины, Первый Московский государственный медицинский университет
им. И.М. Сеченова
Москва, Россия
c Федеральное государственное бюджетное учреждение науки Институт проблем химической физики
Москва, Россия
* E-mail: anna.solovieva@gmail.com
Поступила в редакцию 12.12.2018
После доработки 12.12.2018
Принята к публикации 15.01.2019
Аннотация
Установлено влияние амфифильного полимера – поли-N-винилпирролидона (ПВП) и полисахаридов (ПС) – альгината натрия (АН) и гиалуроновой кислоты (ГК) на фотосенсибилизирующую активность хлорина е6 (Хн_е6) в реакции окисления триптофана, которая рассматривается как модельная при поиске наиболее эффективных лекарственных форм фотосенсибилизатора для антимикробной фотодинамической терапии. Показано, что исходная фотосенсибилизирующая активность Хн_е6, которая характеризуется эффективной константой keff скорости окисления триптофана, возрастает при формировании в водных растворах двойных систем, Хн_е6 – ПВП и Хн_е6 – АН (ГК), и в большей степени для тройных систем, Хн_е6 – ПВП – АН и Хн_е6 – ПВП – АН – ГК. Сделан вывод, что такое повышение активности связано с процессами дезагрегации ассоциатов молекул фотосенсибилизатора (ФС), исходно существующих в водных растворах, вследствие образования комплексных связей между молекулами ФС и фрагментами вводимых в раствор полимеров. Справедливость данного заключения для рассматриваемых в данной работе двойных и тройных систем подтверждена совокупными данными по электронным спектрам поглощения и спектрам флуоресценции хлорина е6 в отсутствии и при введении полимеров (ПВП, АН и ГК) в реакционную систему, а также данными 1Н-ЯМР исследования. С учетом последних данных, согласно которым каждый из полимерных компонентов (ПВП, АН и ГК) влияет на активность ФС, а непосредственное взаимодействие ПВП с ПС в ПМР спектрах практически не проявляется, тройные фотосенсибилизирующие системы в водной среде формируются при образовании взаимопереплетающихся полимерных цепей ПВП-ПС в условиях воздействий локальных гидродинамических потоков и при последующем образовании комплексных связей молекул ФС с фрагментами обоих полимеров.
В связи с наблюдающимся в последние годы ростом резистентности к антибиотикам возникают трудности с использованием целых групп антибактериальных препаратов для лечения инфекций, вызванных антибиотикорезистентными штаммами микроорганизмов, и довольно незначительные инфекции могут вновь стать неизлечимыми, как это было до открытия антибиотиков. Фактически, настоящее время было названо “концом антибиотической эры” [1]. Альтернативой антибиотикотерапии может оказаться антибактериальная фотодинамическая терапия (АФДТ) – фотодинамическая инактивация патогенных микроорганизмов, которая заключается в окислительной деструкции патогенных клеток при воздействии лазерного излучения на такие клетки после предварительной обработки пораженных тканей фотосенсибилизатором (ФС). Наиболее активная и нетоксичная группа ФС – порфириновые фотосенсибилизаторы (ПФС), представляющие собой азотсодержащие макроциклические соединения – порфирины и их частично гидрированные аналоги – хлорины. ФС способны передавать энергию фотовозбуждения растворенному в клетках и тканях молекулярному кислороду, переводя его в синглетное 1О2 состояние [2]. Генерируемый синглетный кислород является активным окислителем, разрушающим патологические (онкологические, инфицированные) участки тканей, воздействуя на клеточную стенку, нуклеиновые кислоты и мембранные белки бактерий [3]. Показано, что различные типы фотосенсибилизаторов, включая порфирины, фталоцианины и хлорины, эффективны in vitro против бактерий (включая резистентные к лекарственным средствам штаммы), дрожжей, вирусов [4]. Эффективность АФДТ продемонстрирована in vivo против локализованных инфекций на животных моделях [5]. Одно из основных преимуществ антимикробной ФДТ перед терапией с использованием антибиотиков заключается в окислительной деструкции микробных клеток-мишеней, что исключает выработку организмом устойчивости к последующим циклам фотодинамических воздействий [6]. В отличие от антибиотиков противомикробное действие ФДТ не убывает со временем. У патогенных микроорганизмов не развивается “устойчивости” к ФДТ, что важно при лечении хронических инфекционных процессов. Бактерицидный эффект метода ФДТ лимитируется зоной лазерного облучения сенсибилизированных тканей, что позволяет избежать при местной ФДТ генерализации побочных эффектов, наблюдаемых при применении антибиотиков [7]. АФДТ эффективен против лекарственно-устойчивых штаммов бактерий, и до сих пор не появилось никакого сообщения о том, что фотодинамическая обработка приводит к резистентности [8, 9].
В последние годы появился ряд работ, посвященных применению антибактериальной фотодинамической терапии (АФДТ) при лечении гнойных заболеваний мягких тканей, в частности трофических язв с использованием фотосенсибилизаторов хлоринового ряда. Хлорины оказывают положительное воздействие на течение раневого процесса, что проявляется выраженным антибактериальным действием, ускорением очищения ран от гнойно-некротического детрита и сокращением сроков заживления раневых дефектов [10, 11].
Для повышения эффективности АФДТ фотосенсибилизаторы используют в составе коньюгатов, то есть при связывании ФС с биологически-активными фрагментами нативных или синтетических систем (антителами, аминокислотами, фрагментами полимеров и биополимеров) [12–17]. Полагается, что в подобных конструкциях полимер уменьшает связывание ФС с нормальными тканями, повышая тем самым биодоступность и эффективность АФДТ [10, 15]. Формируемые полимерные комплексы могут адсорбироваться на липидном бислое и встраиваться в мембраны клеток патологических тканей, облегчая их непосредственное фотоиндуцированное разрушение и последующий транспорт в ткани разрушающих их реагентов. В частности, в [18] описано преодоление резистентности раковых клеток к противоопухолевым препаратам при фотодинамической терапии с использованием солюбилизированного плюроником F-127 хлорина е6 и противоопухолевого антибиотика доксирубицина. Было показано, что в условиях слабого лазерного облучения в раковых клетках усиливалось поглощение доксирубицина через частично деструктированную продуцируемым синглетным кислородом клеточную мембрану.
Ранее нами [19] было показано, что некоторые амфифильные полимеры (АП), в том числе плюроник F-127 и поливинилпирролидон образуют комплексы с ПФС. Такие комплексы оказались активнее исходных ПФС как в модельных процессах фотоокисления, так и в 10–30 раз более эффективные при фотодинамическом и, осложненных ожогов, сосудистых воспалительных заболеваний.
Эффективность антибактериальной фотодинамической терапии труднозаживающих гнойных ран возрастает при одновременном воздействии на рану некоторых биологически активных молекул – протеолитических ферментов, антиоксидантов [20, 21]. Бактерицидные биодеградируемые покрытия на основе полисахаридов (ПС) часто применяются для облегчения состояния больных при лечении длительно незаживающих ран [22]. В работе [23] были представлены наши результаты по ФДТ модельных ран у крыс при использовании в качестве ФС комплексов хлорина е6 с поливинилпирролидоном и хитозаном. Было показано, что при наличии в системе хитозана усиливаются антибактериальные противовоспалительные и прорегенераторные эффекты комплекса “Хн_е6–ПВП”. Такой результат отчасти был неожиданным, поскольку в модельных условиях – при фотоиндуцированном окислении в водном растворе триптофана хитозан уменьшал фотокаталитическую активность комплекса “Хн_е6–ПВП”. Поэтому были инициированы исследования новых композиций “Хн_е6-ПВП-ПС”, в которых молекулы ПС не подавляли бы собственную фотосенсибилизированную активность ФС в модельных процессах окисления триптофана. С этой точки зрения потенциальный интерес для АФДТ могут представлять в качестве ПС компонентов в ФС-АП-ПС композициях и другие, помимо хитозана, природные полисахариды, проявляющие противовоспалительные, иммунотропные, противоопухолевые, противомикробные, противовирусные и другие свойства [24]. Однако необходимой стадией таких разработок является поиск и исследование указанных композиций с растительными ПС, прежде всего, с альгинатом натрия (АН) и гиалуроновой кислотой (ГК), которые широко используются в настоящее время в клинической практике, так как обладают хорошей ранозаживляющей способностью и ускоряют реабилитацию после травм, хирургических операций, останавливают местные кровотечения и стимулируют заживление язвенных поражений слизистой оболочки желудка и кишечника [24–27]. Результаты такого поиска с введением в водную среду при исследовании фотосенсибилизированного окисления триптофана помимо комплекса Хн_е6-ПВП указанных ПС – альгината натрия (АН) и гиалуроновой кислоты (ГК) представлены в данной работе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
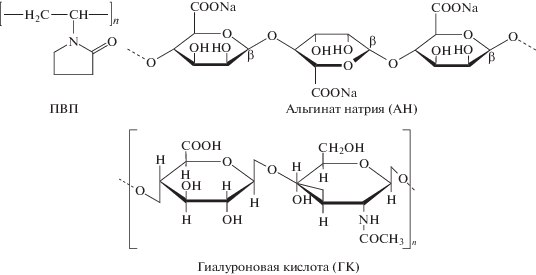
В работе использовались фотосенсибилизатор – хлорин е6, (Frontier Scientific Великобритания) (рис. 1). Водорастворимость хлорина е6 достигалась использованием его в виде тринатриевой соли. Порошок хлорина е6 (0.033 г) растворяли в 5 мл водного раствора гидрокарбоната натрия с концентрацией 2 × 10–2 М. В качестве амфифильного полимера использовали поли-N-винилпирролидон (ПВП) (Мw40000) (Dr. Theodor Schuchardt, Германия) (рис. 2), в качестве полисахаридов использовали альгинат натрия (АН) (Мw80000 до 100000) и гиалуроновую кислоту (ГК) (Мw800000-900000, Sigma-Aldrich, США) (рис. 2). Для исследования фотокаталитической активности ПФС использовали модельную реакцию фотоокисления триптофана (Реахим, Россия).
Фотоокисление триптофана в присутствии порфиринсодержащих систем. Реакцию фотоокисления триптофана (Trp) в водной среде в присутствии хлорина и его комплексов с полимерами осуществляли следующим образом. К раствору триптофана в воде (1 × 10–4 М) добавляли водный раствор Хн_е6 (5 × 10–6 М) и полимеров – ПВП, АН, ГК. Полученную смесь перемешивали (магнитная мешалка “Heidolph”, скорость, 650 об./мин) в течение 10 минут, затем включили освещение реакционной смеси светодиодным аппаратом АФС (производства ООО “Полироник”) с длиной волны λ = 400 нм при мощности 210 мВт и начинали отсчет времени реакции, сохраняя режим перемешивания. Концентрацию альгината натрия и гиалуроновой кислоты в двойных и тройных системах варьировали от 1 × × 10–6 до 5 × 10–5 моль/л, при этом концентрация ПВП изменялась от 3 × 10–5 до 5 × 10–4 моль/л. Следует отметить, что порядок прибавления полимеров не влиял на эффективную константу скорости процесса в тройных системах. За кинетикой процесса следили по изменению концентрации триптофана, которую определяли по уменьшению оптической плотности полосы поглощения (λ = 280 нм) в УФ-спектре триптофана, окисляющегося до эндоперекиси триптофана [28]. УФ- и электронные спектры поглощения (ЭСП) растворов снимали на спектрофотометре Cary50 (Varian, Австрия). Спектры флуоресценции регистрировали на спектрофлуориметре CaryEclipse (Varian, Австрия).
Для сопоставительной оценки активности порфиринсодержащих систем в тестовой реакции фотоокисления триптофана в водной среде вводили эффективную удельную константу скорости keff, определяемую по начальному линейному участку кинетической зависимости Ci = Ci(t):
(1)
${{k}_{{{\text{eff}}}}} = ({\text{1/}}t){\text{ln}}({{C}_{{0i}}}{\text{/}}{{C}_{i}}){\text{/}}{{С}_{{{\text{PS}}}}},$1Н ЯМР-спектры регистрировали с использованием спектрометра Bruker AVANCE III 500 МГц. В стандартные ампулы (с наружным диаметром 5 мм) помещали образцы, растворов Хн_е6, полимеров и систем Хн_e6–ПВП (АН, ГК), Хн_e6–ПВП–АН (ГК) (в соотношении 1 : 1 по массе) в D2O (Aldrich, 99 атом. % D). Спектры 1H-ЯМР были получены при температуре 20.5 ± ± 0.1°С и рабочей частоте прибора 500 МГц. Частоты сдвигов ЯМР калибровали с использованием остаточных сигналов протонов из дейтерированной воды (4.71 м.д.).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Системы ФС-полимер
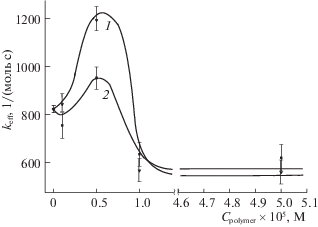
На рис. 3 представлены зависимости эффективной константы скорости реакции фотоокисления keff триптофана, катализируемой хлорином е6 в присутствии ПВП, АН и ГК (рис. 3), от концентрации каждого из этих полимеров. Как следует из рис. 3, наибольшее возрастание keff реализуется для системы Хн_e6-ПВП. В частности, при С0PVP = 5 × 10–5 моль/л величина keff возрастает на 40%, что мы связываем, как указывалось выше с образованием комплексов ПВП-ПФС и, как следствие, дезагрегацией ассоциатов ПФС, исходно существующих в водном растворе [29–31]. Для систем Хн-АН и Хн_е6-ГК было зафиксировано меньшее возрастание keff – на 15 и 13% при С0АН = 5 × 10–5 моль/л и С0ГК = 5 × 10–6 моль/л, соответственно. При этом зависимость keff = = keff(С0ГК) убывает при концентрациях С0ГК более 5 × 10–6 моль/л и выходит на постоянное значение, равное величине keff(С0ГК) при С0ГК = 0.
Рис. 3.
Зависимости эффективной константы скорости фотоокисления триптофана в присутствии систем Хн_е6-ПВП (1), Хн_е6-АН (2), Хн_е6-ГК (3) от концентрации полимеров. ${{C}_{{{\text{Cl\_e6}}}}}$ = 5.0 × 10–6 моль/л, ${{C}_{{0{\text{Tr}}}}}$ = 1.0 × 10–4 моль/л.

Здесь, прежде всего, следует обсудить сам факт увеличения keff при введение в реакционную среду молекул полисахаридов, поскольку, как известно [32], другой полисахарид – хитозан (ХТЗ) приводил к уменьшению фотосенсибилизируемой активности ФС при окислении триптофана в подкисленном водном растворе. В [32] было показано, что снижение активности ФС в присутствии ХТЗ связано с образованием агрегатов молекул ФС, инициируемом взаимодействием протонируемых аминогрупп полисахаридов с ФС. Но в структуре молекул АН и ГК первичные аминогруппы отсутствуют. Следует указать, что они отсутствуют в структуре еще одного полисахарида – в структуре карбоксиметилцеллюлозы (КМЦ), введение которой в реакционную водную среду приводило к повышению эффективной константы фотосенсибилизируемого окисления триптофана [33]. В силу указанных причин, а также приводимых на рис. 3 зависимостей, АН и ГК не только не инициируют образование ассоциатов ФС, но и обусловливают дополнительную (наряду с АП) дезагрегацию таких ассоциатов, исходно существующих в водных растворах. Справедливость этого заключения будет подтверждена ниже совокупными данными по электронным спектрам поглощения (ЭСП) и спектрам флуоресценции хлорина е6 в отсутствии и присутствии полимеров (ПВП, АН и ГК), а также данными ПМР исследования.
В связи с рис. 3, возникают также вопросы о причинах немонотонности зависимости 3. Такой характер зависимости keff = keff(С0ГК) естественно связать с природой ГК как основным полисахаридным компонентом синовиальной жидкости, используемой в организме для смазки подвижных сочленений костей. Известно, что протяженные макромолекулы ГК, прежде всего, из-за наличия в структуре вторичных аминогрупп, посредством которых формируются межмолекулярные и внутримолекулярные связи, приобретают в водных растворах “червеобразные” спиралевидные структуры типа закрученной ленты, рыхлого клубка [26]. В общем, в разбавленных растворах полимеров при наличии гидродинамических потоков свернутые в спираль молекулы “расширяются” при движении. При увеличении концентрации червеобразные молекулы могут начать объединяться в цепи, образуя при этом динамическую нестационарную пространственную сеть, что обусловливает резкое возрастание вязкости таких водных растворов с концентрацией [34].
Необходимо указать, что протяженные макромолекулы АН тоже могут образовывать, как и макромолекулы ГН, но в меньшей степени выраженности, трехмерную структуру типа “молекулярного сита” [35] за счет образования водородных связей между карбоксильными и гидроксильными группами. Поэтому можно полагать, что в присутствии АН и ГК в водной среде молекулы ФС оказываются встроенными в формируемые макромолекулами АН и ГК подвижные структуры. При этом за счет слабых ион-дипольных взаимодействий между боковыми карбоксилсодержащими заместителями в молекуле ФС и подвижными гидрофильными фрагментами макромолекул полисахаридов АН и ГК через структурные перестройки гидратных оболочек могут опосредованно формироваться “на время” координационные связи, которые влияют на дезагрегацию ассоциатов ФС, определяющую некоторое возрастание величин keff. Причем фрагменты макромолекул ГК при концентрациях С0ГК до 2 × 10–6 моль/л оказываются более эффективными при таком опосредствованном связывании с фрагментами Хн_е6 для дезагрегации их ассоциатов, как это следует из рис. 3. Однако при повышении концентрации ГК выше указанной величины начинают в большей мере проявляться (в условиях эксперимента, при максимальной скорости вращения магнитной мешалки) эффекты, инициированные локальными гидродинамическими потоками повышения вязкости ГК. В этих случаях уменьшается вероятность формирования указанного типа координационных связей фрагментов ГК с молекулами ФС, и процессы дезагрегации ассоциатов ФС подавляются. Как следует из рис. 3, уже при С0ГК$ \approx $ 1 × 10–5 моль/л величина keff определяется только передачей синглетного кислорода на молекулу субстрата без участия в процессе ГК. Именно этими обстоятельствами и определяется характер зависимости 3 на рис. 3.
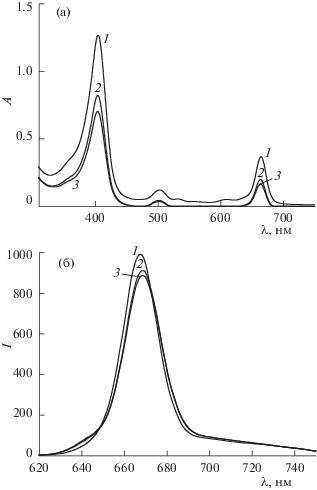
Как указывалось выше, на дезагрегацию ФС, определяющую повышение констант скорости keff окисления триптофана в присутствии полимеров ПВП, АН и ГК, указывают изменения в электронных спектрах поглощения и спектрах флуоресценции хлорина е6 в присутствии ПВП, АН и ГК (рис. 4а,б). Здесь, прежде всего, имеется в виду возрастание интенсивности основной полосы (400 нм) в ЭСП (~ в 2.4 и 1.6 раза для ПВП и ПС, соответственно) и полосы флуоресценции (~ в 1.5, 1.3 и 1.2 раза для ПВП и АН и ГК, соответственно) при введении в водный раствор Хн_е6 указанных полимеров. Приводимые спектры были получены при концентрациях полимеров, при которых наблюдаются максимальные значения эффективной константы фотоокисления триптофана (см. рис. 3). Необходимо также указать, что в спектрах хлорина в присутствии ПВП наблюдается не только рост интенсивности полос, но и длинноволновый сдвиг на 5–10 нм, что свидетельствует об изменении микроокружения молекул ФС [31], т.е. о непосредственном взаимодействии фрагментов хлорина е6 с фрагментами ПВП. Поэтому можно полагать, что взаимодействие между Хн_е6 и фрагментами ПВП приводит к более интенсивной дезагрегации ФС (наибольший рост интенсивности полос в спектрах) по сравнению с системами Хн_е6-АН и Хн_е6-ГК, когда в силу указанных выше причин может реализоваться лишь опосредованное, не прямое воздействие макромолекул АН и ГК на дезагрегацию ассоциатов Хн_е6.
Рис. 4.
Спектральные характеристики систем Хн_е6 (1), Хн_е6-ПВП (2), Хн_е6-АН (3) и Хн_е6-ГК (4): электронные спектры поглощения (а) и спектры флуоресценции (б) при ${{C}_{{{\text{Cl\_e6}}}}}$ = 5.0 × 10–6 моль/л, ${{C}_{{{\text{PVP}}}}}$ = 5 × 10–5 моль/л, ${{C}_{{{\text{AN}}}}}$ = 5 × 10–5 моль/л и ${{C}_{{{\text{GA}}}}}$ = 5 × 10–6 моль/л.

Независимая информация о формирующихся координационных связях в системах Хн_е6-ПВП, Хн_ АН и Хн_е6-ГК была получена на основе данных 1H-ЯМР. Ранее [29] при сравнении ПМР-спектров ПВП в отсутствие и в присутствии хлорина е6 было установлено образование водородных связей и наличие гидрофобных взаимодействий в системе хлорин е6-ПВП (в присутствии хлорина наблюдались хим. сдвиги сигналов протонов метиленовых групп гидрофильных пирролидоновых фрагментов ПВП в слабом поле).
В данной работе было зафиксировано изменение ПМР-спектров хлорина е6 в присутствии ПВП и полисахаридов – АН и ГК. В присутствии полимеров в спектрах 1H ЯМР хлорина наблюдается сдвиг (Δ) сигналов мезо-протонов цикла при 9.21 м.д., 9.04 м.д. и 6.94 м.д. на Δ = 0.4, 0.27 и 1.05 м.д. в присутствии ПВП, на Δ = 0.16, 0.08, 0.3 м.д. для АН, и на Δ = 0.24, 0.46 м.д для ГК в сильное поле. Сдвиг периферийных метильной группы при 1.14 м.д. на Δ = 0.31 м.д. для ПВП, на Δ = 0.13 м.д. в случае АН и на Δ = 0.15 м.д. для ГК в сильное поле, метиновой группы при 6.73 м.д. на Δ = 0.23, 0.56 м.д. в присутствии АН и ГК в зону сильных полей. Сдвиги остатков пропионовой кислоты при 4.46, 2.66 и 2.82 м.д. на Δ = 0.02, 0.08 и 0.04 м.д. для ПВП, на Δ = 0.04, 0.14 и 0.08 м.д. в присутствии АН, на Δ = 0.06, 0.16 и 0.12 м.д в случае с ГК в сильное поле. Это, как показано ранее в [31], свидетельствует об ослаблении взаимного влияния хлориновых циклов, т.е. свидетельствует о дезагрегации ассоциатов Хн_е6. При этом изменений в ПМР спектрах АН и ГК в присутствии хлорина е6 не было зафиксировано, что подтверждают высказанное выше предположение об опосредованном, не прямом воздействии макромолекул АН и ГК с хлорином е6, которое, тем не менее, проявлялось при изменении интенсивности основной полосы ЭСП и полосы спектра флуоресценции хлорина е6 в присутствии ПВП, АН и ГК (рис. 4а,б).
Тройные системы
На рис. 5 представлены зависимости эффективной константы keff фотоокисления триптофана в присутствии тройных систем Хн_е6-ПВП-АН (зависимость 1) и Хн_е6-ПВП-ГК (зависимость 2) от концентрации полисахаридов ${{C}_{{{\text{ps}}}}}$ при фиксированных концентрациях ${{C}_{{{\text{Cl\_e6}}}}}$ = 5.0 × 10–6 моль/л и ${{C}_{{{\text{PVP}}}}}$ = 5 × 10–5 моль/л в реакционной среде. Прежде всего, обращает внимание качественное изменение характера зависимости keff= keff(${{C}_{{{\text{AN}}}}}$) при наличии в реакционной среде ПВП. Если при отсутствии ПВП, т.е. при ${{C}_{{{\text{PVP}}}}}$ = 0, мы имели для keff монотонную зависимость (зависимость 2, рис. 3), то при ${{C}_{{{\text{PVP}}}}}$ = 5 × 10–5 моль/л соответствующая зависимость (зависимость 1, рис. 5) оказывается немонотонной, с выраженным максимумом, подобной зависимости keff= keff(${{C}_{{{\text{GA}}}}}$) как при отсутствии в среде ПВП (зависимость 3, рис. 3), так и при ${{C}_{{{\text{PVP}}}}}$ = 5 × 10–5 моль/л (зависимость 2, рис. 5). При этом максимумы всех указанных немонотонных зависимостей достигаются при ${{C}_{{{\text{ps}}}}}$ $ \approx $ 5.0 × 10–6 моль/л. Как указывалось выше, немонотонный характер зависимости 3 на рис. 3 связан с особенностями червеобразной спиралевидной структуры макромолекул ГК, которые при воздействии локальных гидродинамических потоков могут принимать различные формы и объединяться в цепи. Вследствие нестационарной динамики таких образований резко возрастает вязкость таких водных растворов с увеличением концентрации макромолекул. Именно с последним фактором, реализующемся в условиях наших экспериментов при ${{C}_{{{\text{GA}}}}}$ = 5 × 10–6 моль/л, связано фиксируемое падение величины keff, представленное на рис. 3 (зависимость 3). На основе данных, представленных на рис. 5, естественно полагать, что указанный фактор проявляется и при фотосенсибилизированном окислении триптофана в системе Хн_е6-ПВП-АН (рис. 5, зависимость 1) при концентрациях ${{C}_{{{\text{AN}}}}}$, превышающих ${{C}_{{{\text{AN}}}}}$ = 5 × 10–6 моль/л. По-видимому, при таких концентрациях АН макромолекулы ПВП (${{C}_{{{\text{PVP}}}}}$ = = 5 × 10–5 моль/л) при индуцированном воздействии локальных гидродинамических потоков могут, принимая различные формы, объединяться в цепи с молекулами АН, так что вязкость формирующегося раствора этих полимеров резко возрастает, обусловливая фиксируемое падение величины keff.
Рис. 5.
Зависимость константы скорости фотосенсибилизированного окисления триптофана в присутствии комплекса Хн_е6-ПВП-ПС от концентраций АН (1) и ГК (2) при содержании ПВП (${{C}_{{{\text{PVP}}}}}$ = 5 × 10–5 моль/л) в реакционной среде (${{C}_{{{\text{Cl\_e6}}}}}$ = 5.0 × 10–6 моль/л, ${{C}_{{0Tr}}}$ = = 1.0 × 10–4 моль/л).
Здесь следует указать, что величина фиксируемой для данной системы Хн_е6-ПВП-АН максимальной эффективной константы keff скорости окисления триптофана превышает в 1.5 раза соответственную величину для системы Хн_е6-ПВП при тех же значениях концентраций хлорина е6 и ПВП. Заметим при этом, что концентрация АН, вводимого в тройную систему, на порядок меньше концентрации ПВП как основного полимерного компонента. Максимальная величина константы keff скорости окисления триптофана в другой исследуемой системе – Хн_е6-ПВП-ГК оказалась в 1.1 раза большей, нежели в системе Хн_е6-ПВП (см. рис. 5, зависимость 2), но в 1.5 раза превосходила соответствующую величину для системы Хн_е6-ГК (см. рис. 3, зависимость 3). Наблюдаемое возрастание константы скорости keff в рассматриваемых экспериментах по фотосенсибилизированному окислению триптофана, которое мы связывали с возрастанием степени дезагрегации ассоциатов Хн_е6 при введении в реакционную систему молекул ПС, может возрастать и вследствие не обсуждаемых здесь факторов, в частности, вследствие повышенного химического сродства субстрата (триптофана, в данном случае) к фрагментам вводимых полимеров, около которых координируются молекулы ФС.
На рис. 6 (а, б) представлены ЭСП и спектры флуоресценции двойных систем Хн_е6-ПВП (кривые 1), а также тройных систем Хн_е6-ПВП-АН (кривые 2) и Хн_е6-ПВП-АН-ГК (кривые 3). Помимо проявляемого на рис. 4 некоторого снижения оптической плотности полос в ЭСП и интенсивности флуоресценции, указывающих на происходящие в этих более сложных системах процессы дезагрегации ФС ассоциатов, в полосах поглощения и флуоресценции зафиксированы “батохромные” сдвиги (на 5–10 нм) относительно полос в спектрах чистого хлорина, что свидетельствует о связывании хлорина е6 с ПВП в тройных системах, как это проявлялось и на спектрах, представленных на рис. 4.
Рис. 6.
Спектральные характеристики систем Хн_е6-ПВП (1) и систем Хн_е6-ПВП-АН (2) и Хн_е6-ГК (3): электронные спектры поглощения (а) и спектры флуоресценции (б) при ${{C}_{{{\text{Cl\_e6}}}}}$ = 5.0 × 10–6 моль/л, ${{C}_{{{\text{PVP}}}}}$ = 5 × 10–5 моль/л, ${{C}_{{{\text{AN}}}}}$ = 5 × 10–6 моль/л и ${{C}_{{{\text{GA}}}}}$ = 5 × 10–6 моль/л.
О протекании процесса дальнейшей дезагрегации в тройных системах свидетельствуют данные 1Н ЯМР спектров хлорина в тройных системах. В частности, в присутствии двух полимеров наблюдается дальнейший сдвиг (по сравнению с двойными системами полимер-ФС) сигналов мезо-протонов цикла для системы Хн_е6–ГК–ПВП – 0.2 м.д., наибольший сдвиг наблюдается для системы Хн_е6–АН–ПВП – 0.38 м.д. Интересно, что сигналы протонов периферийных групп в тройных системах также (по сравнению с хлорином) сдвинуты в сильное поле, однако величина сдвига практически во всех случаях не превышает значений для двойных систем. Так, сдвиг Δ для метильных групп макроцикла хлорина в присутствии ПВП составлял 0.31 м.д., в присутствии АН – 0.13 м.д., в присутствии ГК – 0.15 м.д., в присутствии и ПВП и АН – 0.32 м.д. в зону сильных полей, в случае ПВП и ГК – 0.23 м.д. в зону слабых полей. При этом в некоторых случаях величина сдвига становится отрицательной (сдвиг Δ = = ‒0.01 в слабое поле сигналов протонов метинового фрагмента остатков пропионовой кислоты (16) в системе Хн_е6–АН–ПВП). В частности, можно полагать, что в тройных системах протекает дальнейшая дезагрегация, в результате чего периферийные заместители начинают испытывать более сильное экранирующее влияние полимеров.
Таким образом, хотя ПС и ПВП не обладают собственной фотохимической активностью, они способны увеличивать фотокаталитическую активность хлорина е6 в процессах генерации синглетного кислорода, благодаря дезагрегации порфириновых ассоциатов, в виде которых ФС обычно существуют в водных и неводных растворах. Так, АН и ГК повышают фотокаталитическую активность Хн_е6 (~ на 14%), ПВП – на 44%. Суммарный эффект возрастания константы keff скорости фотоокисления триптофана, катализируемого хлорином е6 в присутствии полисахаридов и ПВП при определенном молярном соотношении компонентов, в 2 раза больше суммы эффекта от каждого полимера. При этом системы на основе альгината натрия более эффективны по сравнению с аналогичными комплексами на основе ГК. В частности в тройной системе Хн_е6–ПВП–ГК фотокаталитическая активность повышается на 60–70%, тогда как в тройной системе Хн_е6–АН–ПВП она повышается на 91% (по сравнению с водным раствором Хн_е6 с той же концентрацией ФС).
Работа выполнена в рамках Госзадания, тема V. 46.14, № 0082-2014-0006, АААА-А17-117032750202-6 (получение двойных и тройных порфиринсодержащих комплексов – хлорин е6 с ПВП и полисахаридами-АН (ГК) и тройных хлорин е6-ПВП-АН (ГК) и изучение их спектральных характеристик) и при финансовой поддержке Российского фонда фундаментальных исследований, грант № 17-02-00294 (получение кинетических параметров фотоокисления триптофана в присутствии полученных фотосенсибилизирующих систем).
Список литературы
Huang L., Zhiyentayev T., Xuan Y. et al. // Lasers in Surgery and Medicine. 2011. V. 43. Issue 4. P. 313.
Hamblin M.R., Hasan T. // Photochem Photobiol Sci. 2004. V. 3. P. 436–50.
Shrestha A., Kishen A. // Basic research − technology. 2012. V. 38. P. 1275.
Makowski A., Wardas W. // Curr. Top. Biophys. 2001. V. 25. P. 19.
Wainwright M. // Antimicrob Chemother. 1998. V. 42. № 1. P. 13.
Jori G., Brown S.B. // Photochem Photobiol Sci. 2004. V. 3. Issue 5. P. 403.
Гейниц А.В., Толстых П.И., Дербенев В.А. // Фотодинамическая терапия гнойных и длительно не заживающих ран: пособие для врачей. М.: Медицина, 2004. 15 с.
Alenezi K., Tovmasyanb A., Batinic-Haberle I. et al. // Photodiagnosis Photodyn Ther. 2017. V. 17. P. 154.
Филоненко Е.В., Серова Л.Г. // Biomedical photonics. Т. 5. № 2. P. 26.
Zhiyentayev T.M., Boltaev U.T., Solov’eva A.B. et al. // Photochemistry and Photobiology. 2014. V. 90. P. 171.
Соловьева А.Б., Спокойный А.Л., Руденко Т.Г. и др. // Клиническая практика. 2016. № 2. С. 38.
Толстых П.И., Соловьева А.Б., Тамразова О.Б. и др. // Лазерная медицина. 2011. Т. 15. № 4. С. 55.
Tsvetkov V.B., Solov’eva A.B., Melik-Nubarov N.S. // Physical Chemistry Chemical Physics. 2014. V. 16. P. 10903.
Rudenko T.G., Shekhter A.B., Guller A.E. et al. // Photochem. Photobiol. 2014. V. 90. P. 1413.
Shirmanova M.V., Gavrina A.I., Aksenova N.A. et al. // J. Anal Bioanal Tech. 2014. V. S1. P. 8.
Solov’eva A.B., Kopylov A.S., Savko M.A. et al. // Scientific Reports. 2017. V. 7. № 12640. P. 1.
Савко М.А., Аксенова Н.А., Акишина А.К. и др. // Журн. физ. химии. 2017. Т. 91. № 11. С. 1970.
Park H., Park W., Na K. // Biomaterials. 2014. V. 35. № 27. P. 7963.
Solovieva A.B. et al. // Laser Physics. 2009. V. 19. № 4. P. 1.
Толстых М.П., Клебанов Г.Н., Шехтер А.Б. и др. Антиоксиданты и лазерное излучение в терапии ран и трофических язв. М.: Издательский дом “ЭКО”, 2001. 240 с.
Толстых М.П., Клебанов Г.Н., Климов Ю.В. и др. // Биомедицинская радиоэлектроника. 2001. № 2. С. 15.
Винник Ю.С., Якимов С.В., Тепляков Е.Ю. и др. // Сибирский мед. журн. 2004. № 4. С. 35.
Solovieva A.B., Kardumian V.V., Aksenova N.A. et al. // Scientific Reports. 2018. V. 8. № 8042.
Криштанова Н.А., Сафонова М.Ю., Болотова В.Ц. и др. // Вестн. ВГУ. 2005. № 1. С. 212.
Talegaonkar S., Ahmad F.J., Kohli K. et al. // Pharmaceutics and Biopharmaceutics. 2008. V. 68. P. 513.
Scott J.E. // Chemical and Biological Implications, in Ciba Foundation Symposium 143 – the Biology of Hyaluronan (eds D. Evered and J. Whelan). 2007. P. 6.
Кайшева Н.Ш., Мыкоц Л.П., Василенко Ю.К. // Химико-фармацевтический журн. 2004. Т. 38. № 1. С. 31.
Osburn E.J., Chau L.-K., Chen S.-Y. et al. // Langmuir. 1996. V. 12. P. 4784.
Aksenova N.A., Oles T., Sarna T. et al. // Laserphysics. 2012. V. 22. № 10. P. 1642.
Kardumyan V.V., Aksenova N.A., Chernyak A.A. et al. // Laser physics. 2014. V. 25. № 4. P. 6002.
Горох Ю.А., Аксенова Н.А., Соловьева А.Б. и др. // Журн. физ. химии. 2011. Т. 85. № 5. С. 959.
Глаголев Н.Н., Роговина С.З., Соловьева А.Б. и др. // Russ. J. Physical Chemistry. 2006. Suppl. P. 72.
Aksenova N.A., Zhientaev T.M., Brilkina A.A. et al. // Photon Lasers Med. 2013. V. 2. Iss. 3. P. 189.
Швайчак Э. // Рос. журн. биомеханики. Часть 1. 2003. Т. 7. № 3. С. 87.
Юданова Т.Н., Решетов И.В. // Химико-фармацевтический журн. 2006. Т. 40. № 2. С. 24.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии