Журнал физической химии, 2019, T. 93, № 12, стр. 1879-1885
Фотодиссоциация арилбензопирролоимидазолонов в условиях лазерной десорбции и ионизации
В. С. Гринёв a, b, *, А. Ю. Егорова a
a Саратовский национальный исследовательский государственный университет
имени Н.Г. Чернышевского
Саратов, Россия
b Российская академия наук, Институт биохимии и физиологии растений и микроорганизмов
Саратов, Россия
* E-mail: grinev@ibppm.ru
Поступила в редакцию 25.01.2019
После доработки 25.01.2019
Принята к публикации 12.02.2019
Аннотация
Показан общий характер фотодиссоциации арилзамещенных тетрагидропирролоимидазолонов в условиях лазерной десорбции и ионизации. Отмечена их склонность к образованию сложных димерных ионов и продуктов перегруппировок. Установлено, что такой характер фрагментации связан с наличием в кристаллах изучаемых веществ π–π-стэкинг-взаимодействий между бензольными кольцами заместителей и межмолекулярных водородных связей, которые частично сохраняются при переходе из твердой фазы в газообразную.
Молекулы, включающие бензимидазольный фрагмент, проявляют широкий спектр биологической активности, в связи с чем данные системы активно изучаются, в том числе и с помощью масс-спектрометрии.
Анисимовой с соавт. [1] было проведено масс-спектрометрическое исследование пирроло[1,2-a]бензимидазолов и имидазо[1,2-a]бензимидазолов. Масс-спектры были получены в условиях электронного удара. Отмечена характерная особенность – склонность данных структур к отщеплению боковых радикалов от молекулярного иона с образованием устойчивых катионов, в которых общий для двух циклов атом азота за счет делокализации стабилизирует положительный заряд. Было показано, что далее в условиях электронного удара происходит разрыв связей в пиррольном и имидазольном кольцах, и что данные системы образуют один и тот же бирадикал-катион, который подвергается дальнейшему распаду. Авторы отмечают, что обсуждаемые структуры катионов имеют много общего с фрагментами, образующимися в результате фрагментации тиазоло[3,2-a]бензимидазольных производных.
Исследование масс-спектрометрическими методами впервые полученных производных бензимидазола – 3-ацетил-2-[β-(2-тионил)-β-(фенилгидразино)]-ацетилбензимидазола и 2-[(2-тионил)ацетил)]бензимидазола в условиях ионизации электронным ударом, показало, что в спектре помимо интенсивного пика молекулярного иона имеется также множество пиков, обусловленных сигналами перегруппировочных ионов [2]. Закономерной для данных соединений является схема фрагментации, включающая два основных пути. Бензимидазольный фрагмент в условиях электронного удара не сохраняется и претерпевает дальнейший распад.
Изучены масс-спектры антигельминтных метаболитов, выделяемых Dicrocoelium dendriticum, имеющих в своем составе бензимидазольный фрагмент, в условиях ионизации электрораспылением в режиме детекции положительных и отрицательных ионов [3]. Во всех исследованных соединениях бензимидазольный фрагмент сохраняется и не подвергается дальнейшему распаду.
В последнее десятилетие продолжнают активно изучаться низкомолекулярные соединения различных классов на предмет их использования в качестве матриц для масс-спектрометрии с матрично-активированной лазерной десорбцией и ионизацией (МАЛДИ). Одним из последних исследований является, в частности [4], в котором предлагается 31 матрица на основе производных бензимидазолов, кумаринов и флавонов. Однако характер фрагментации данных соединений авторами не рассматривается, отмечается только, что все они обладают низким уровнем “шума” и минимизируют интерференцию с сигналами аналита в низкомолекулярной области.
Таким образом, в литературе не имеется никаких сведений относительно поведения производных бензимидазола в условиях лазерной десорбции и ионизации (ЛДИ), поэтому целью данного исследования было изучить характер фрагментации арилтетрагидропирролоимидазолонов в условиях ЛДИ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3а-Фенил- и 3a-(4-метилфенил)-2,3,3a,4-тетрагидро-1H-бензо[d]пирроло-[1,2-a]имидазол-1-оны 1a,b были синтезированы по методике [5], их структуры подтверждены данными элементного анализа, ИК-, УФ-, ЯМР 1Н- и 13С-спектроскопии, а также РСА [6]
Приготовленные растворы соответствующих 3a-арил-2,3,3a,4-тетрагидро-1H-бензо[d]пирроло[1,2-a]имидазол-1-онов в ацетонитриле с концентрацией 10 мг/мл наносили по 1 мкл на лунку стального планшета МАЛДИ, и давали высохнуть капле при комнатной температуре. Масс-спектры были записаны в линейном режиме на масс-спектрометре AB Sciex TOF/TOF 5800 (США) с детектированием положительных ионов. Метод ионизации – ЛДИ, твердотельный лазер Nd:YAG, длина волны 355 нм (соответствует энергии фотона ∼3.5 эВ), ускоряющее напряжение 20 кВ. Ионизация проводилась при мощностях лазера 4500 (57% от максимального значения) и 6000 (76%) условных единиц. Каждый масс-спектр представлял собой сумму не менее 10 отдельных спектров. Масс-спектрометрические исследования проводились в Центре коллективного пользования научным оборудованием “Симбиоз” при ИБФРМ РАН.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
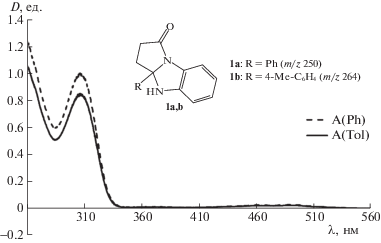
Одним из основных требований, выдвигаемых к подобным молекулам, – способность поглощать УФ-излучение лазеров МАЛДИ масс-спектрометров, максимумы которых приходятся на 337 нм для моделей, оснащенных азотным лазером, или 355 или 266 нм, отвечающим, соответственно, третьей или четвертой гармонике твердотельного лазера – алюмо-иттриевого граната, легированного ионами неодима. Молекулы арилзамещенных бензопирролоимидазолонов 1a,b могут рассматриваться в качестве матриц для метода МАЛДИ для анализа высокомолекулярных природных соединений, поскольку они имеют максимумы поглощения, обусловленные n → π*-переходами, при ∼310 нм. Спектры поглощения в УФ- и видимой области в растворе хлороформа соединений 1a,b показан на рис. 1. Поскольку максимум поглощения 1a,b несколько отличается от максимумов лазеров масс-спектрометров, это позволяет ожидать меньшего выхода фрагментарных ионов самой матрицы, что позволит улучшить качество сигнала в области низких масс.
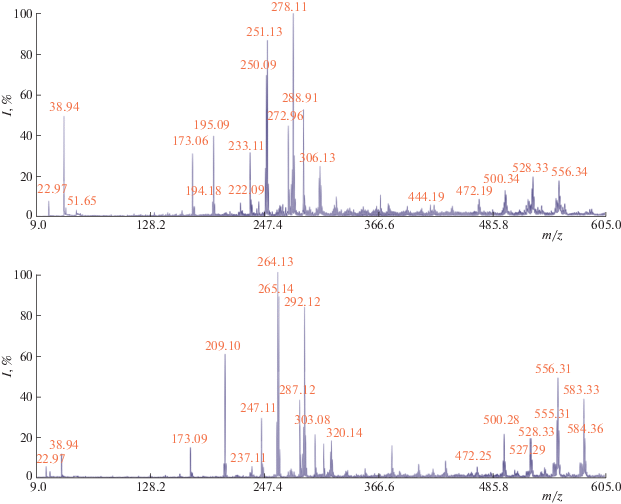
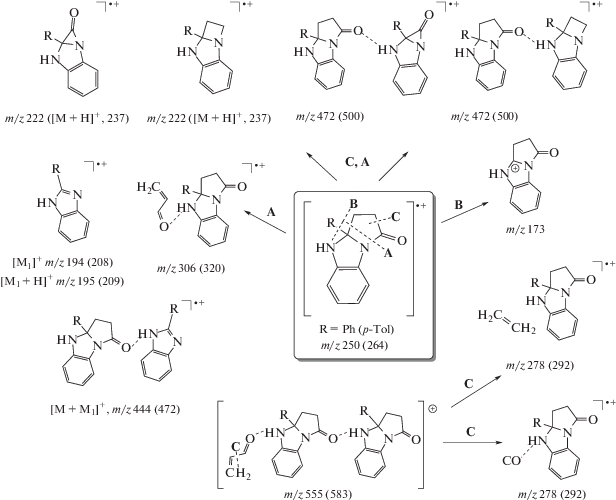
Анализ полученных масс-спектров арилбензопирролоимидазолонов 1a,b (рис. 2) позволяет говорить о существовании нескольких путей фотоиндуцированного распада исходных молекул в условиях ЛДИ (обозначенных на схеме А, B и С соответственно, рис. 3).
При относительно небольших мощностях лазера (4500 у.е.) данные соединения образуют сравнительно небольшое количество фрагментов, масса которых не превышает для 1a 289, для 1b – 303 а.е.м., что позволяет судить о перспективности данного класса соединений в качестве нового типа малошумящих матриц МАЛДИ для анализа биополимеров в области низких масс (от 300 а.е.м.).
При увеличении мощности лазера до 6000 у.е. происходит закономерное увеличение выхода различных ионов, а также, по-видимому, становится возможной ионизация более крупных фрагментов, поскольку в спектрах наблюдается группа сигналов от ионов, отвечающих димерным молекулам и результатам перегруппировок исходных молекул с отколовшимися фрагментами, чего не наблюдается при меньших мощностях лазера (4500 у.е.).
В масс-спектрах 1a,b наблюдаются сигналы, которые условно можно разделить на две группы: пики фрагментов, полученных в результате распада и перегруппировок мономерных молекул бензопирролоимидазолона (с массами до 306 для 1a и 320 а.е.м. для 1b), и пики фрагментов, репрезентирующих распад их димеров (с массами 500–555 а.е.м.). Последние могут рассматриваться и как результат перегруппировок образующихся осколков с исходными молекулами соответствующего арилзамещенного бензопирролоимидазолона. В целом, можно отметить общий характер фрагментации соединений 1a,b (табл. 1).
Таблица 1.
Ионы, наблюдаемые в масс-спектрах ЛДИ соединений 1a,b
| Ион | 1a | 1b | ||
|---|---|---|---|---|
| Точная масса | Эксперим. масса | Точная масса | Эксперим. масса | |
| Na+ | 22.9892 | 22.97 | 22.9892 | 22.97 |
| K+ | 38.9632 | 38.94 | 38.9632 | 38.94 |
| C3H3+ | 39.0229 | 38.74 | ‒ | ‒ |
| C4H3+ | 51.0229 | 51.65 | ‒ | ‒ |
| [M – Ar]+ | 173.0709 | 173.06 | 173.0709 | 173.09 |
| [M – C3H4O]+ | 194.0844 | 194.18 | 208.1000 | |
| [M – C3H4O + H]+ | 195.0917 | 195.09 | 209.1073 | 209.10 |
| [M – C2H4] + | 222.0973 | 222.09 | 237.1022 | 237.11 |
| [M – CO] + | 222.1157 | 222.09 | 237.1386 | 237.11 |
| [M – OH]+ | 233.1073 | 233.11 | 247.1230 | 247.11 |
| [M]•+ | 250.1106 | 250.09 | 264.1263 | 264.13 |
| [M + H]+ | 251.1179 | 251.13 | 265.1335 | 265.14 |
| [M + Na]+ | 273.0998 | 272.96 | 287.1155 | 287.12 |
| [M + CO]•+ | 278.1055 | 278.11 | 292.1212 | 292.12 |
| [M + C2H4]•+ | 278.1419 | 278.11 | 292.1576 | 292.12 |
| [M + K]+ | 289.0738 | 288.91 | 303.0894 | 303.08 |
| [M + C3H4O]•+ | 306.1368 | 306.13 | 320.1525 | 320.14 |
| [2M – C3H4O]+ | 444.1950 | 444.19 | 472.2263 | 472.25 |
| [2M – C2H4]+ | 472.1899 | 472.19 | 500.2212 | 500.28 |
| [2M – CO]+ | 472.2263 | 472.19 | 500.2576 | 500.28 |
| [2M – H]+ | 499.2129 | 499.34 | 527.2442 | 527.29 528.33 |
| [2M + CO]+ | 528.2161 | 528.33 | 555.2391 | 555.31 556.31 |
| [2M + C2H4]+ | 528.2525 | 528.33 | 555.2755 | |
| [2M + C3H4O ‒ H]+ | 555.2391 | 555.34 | 583.2704 | 583.33 |
| [2M + C3H4O]+ | 556.2474 | 556.34 | 584.2787 | 584.36 |
В спектрах наблюдаются интенсивные пики молекулярного иона [M]•+ с m/z 250 и протонированной молекулы [M + H]+ с m/z 251 для 1а (m/z 264 и m/z 265, соответственно, для 1b). Появление данных частиц может быть объяснено следующими уравнениями [7]:
(2)
${\text{M}} + h\nu \to {{{\text{H}}}^{ + }} + {\bar {e}} + {{[{\text{M}}--{\text{H}}]}^{ \bullet }},$Отметим, что энергия кванта УФ-излучения твердотельного лазера составляет приблизительно 3.5 эВ, чего недостаточно для отрыва электрона от нейтральных молекул 1a,b, поскольку энергии ионизации бензимидазольных производных лежат в пределах 5.4–7.3 эВ [8]. Так как считается, что двухфотонная ионизация маловероятна [9], наиболее точным описание механизма ионизации представляется аналогично предлагаемому для фуллеротетрагидропиридинов, энергии ионизации которых оказываются относительно близкими производным бензимидазола, суть которого состоит в передаче энергии одной возбужденной квантом света молекулы другой, находящейся рядом [10] и образованием соответствующих частиц по уравнениям (1)–(3).
Поскольку детектирование осуществляется в режиме положительных ионов, электронейтральные нечетноэлектронные и отрицательно заряженные частицы в спектрах не обнаруживаются, однако могут вступать в дальнейшие превращения.
Пики димеров [2M]•+ с m/z 500 (1a) и m/z 528 (1b) также наблюдается в спектре. Наибольшее количество фрагментов получается в результате распада по пути А, включающего синхронную фотодиссоциацию связей N–C1 и С3а–С3. В результате отщепления бирадикального фрагмента ·C3H2–C2H2–Ċ=O образуются катион-радикалы 2-арил-1H-бензо[d]имидазола ${{[{{{\text{M}}}_{1}}]}^{{ \bullet + }}}$ с m/z 194 (1а) и m/z 208 (1b), катионы 2-арил-1H-бензо[d]имидазол-3-ия [M1 + H]+ с m/z 195 (1a) и с m/z 265 (1b), а также катион-радикалы типа ${{[{\text{M}} + {{{\text{M}}}_{1}}]}^{{ \bullet + }}}$ с m/z 444 (1a) и m/z 472 (1b). В результате [1, 2]-миграции водорода бирадикал состава С3Н4О может превращаться в более стабильную молекулу – акролеин, в которой имеется сопряжение кратных связей. В то же время, бирадикал, по-видимому, способен подвергаться гетеролитическому распаду по двум путям, давая катион-радикалы составов C2H4 и CO, и соответствующие анион-радикалы (уравнения (4), (5). Существование последних обусловлено, в том числе, невысокими значениями сродства к электрону этих молекул (этилена –1.55 ± 0.1 эВ и монооксида углерода –1.8 ± 0.1 эВ) [11, 12]
(4)
$ \cdot {\kern 1pt} {\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} --{\kern 1pt} {\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} --{\kern 1pt} {\dot {C}}{\kern 1pt} = {\kern 1pt} {\text{O}} \to {{{\text{C}}}_{2}}{\text{H}}_{4}^{{ \bullet + }} + {\text{C}}{{{\text{O}}}^{{ \bullet --}}},$(5)
$ \cdot {\kern 1pt} {\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} --{\kern 1pt} {\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} --{\kern 1pt} {\dot {C}}{\kern 1pt} = {\kern 1pt} {\text{O}} \to {\text{C}}{{{\text{O}}}^{{ \bullet + }}} + {{{\text{C}}}_{2}}{\text{H}}_{4}^{{ \bullet - }}.$Частица состава С3Н4О дает с исходными молекулами ионы типа [M + С3Н4О]•+ с m/z 306 (1а) и с m/z 320 (1b), согласно уравнению (5), и с димером исходной молекулы комплексные ионы [2M + С3Н4О]+ с m/z 555 (1a) и m/z 583 (1b). Последний может также подвергаться дальнейшему распаду акролеина по пути С, давая изобарные (с точностью до одной десятой m/z) ионы с m/z 278 (1a) и m/z 292 (1b).
Серия сигналов в диапазоне m/z 444-555 с шагом примерно в 28 а.е.м. может рассматриваться как результат последовательного отрыва фрагментов C2H4 и CO, массы которых с точностью до одной десятой а.е.м. совпадают. Подтверждением этого является наличие группы сигналов, отличающихся сотыми долями а.е.м., что говорит о том, что каждый кластер таких сигналов отвечает разным фрагментам. Наблюдаемое некоторое уширение данных сигналов, вероятно, связано с метастабильностью образуемых ионов.
В спектре наблюдаются пик, отвечающий осколку [M – R]+ с m/z 173, образующийся по пути распада В исходной молекулы – отщепление фенильного (1a) и п-толильного (1b) радикала, подобно тому, как описано в [1]. Аналогичные катионы обнаруживаются в масс-спектрах 3-ацетил-2-[β-(2-тионил)-β-(фенилгидразино)]-ацетилбензимидазола и 2-[(2-тионил)ацетил)]-бензимидазола [2].
В результате одновременного разрыва связей N–C1 и С1–С2 от молекулы исходного бензопирролоимидазолона (путь C+A) отщепляется молекула CO, давая катион-радикалы 1a-арил-1a,2-дигидро-1H-азирино[1,2-a]бензо[d]имидазол-1-она с m/z 222 (1a) и m/z 237 (1b). Изобарный катион-радикал 2a-арил-1,2,2a,3-тетрагидроазето[1,2-a]бензо[d]имидазола образуется при диссоциации связей С1–С2 и С3а–С3. Сигналы данных ионов на спектре также характеризуются низкой интенсивностью. В результате группировки данных осколков с исходной молекулой образуются изобарные катион-радикалы с m/z 472 (1a) и m/z 500 (1b), интенсивность сигнала которых достаточно высокая.
Следует отметить характерную особенность, что в условиях ЛДИ бензимидазольный фрагмент сохраняется, аналогично ионизации электрораспылением, а пути распада А, B и C включают в себя фотодиссоциацию более лабильных связей С1–С2, N–C1, C3a–C3 в пирролоновом фрагменте, а также связи C3a–C(R), что в целом коррелирует с известной “мягкостью” лазерного излучения в качестве способа ионизации, а наблюдаемая фрагментация происходит внутри ионного источника масс-спектрометра.
О природе взаимодействий молекул и их фрагментов, благодаря чему возникают и остаются устойчивыми в условиях ЛДИ различные димерные ионы и продукты перегруппировок исходной молекулы с образующимися в результате распада фрагментами, можно предположить, что значительную роль играют π–π-стэкинг-взаимодействия сэндвичевого типа или “плоскость к плоскости”, а также межмолекулярная водородная связь [6]. Таким образом, водородные связи объединяют молекулы в протяженные одномерные структуры, которые удерживаются между собой стэкинговыми взаимодействиями бензольных колец, которые, вероятно, частично сохраняются при переходе из твердой фазы в газообразную в условиях ЛДИ, что обусловливают способность молекул 3a-арилбензопирролоимидазолонов к димеризации, а также к образованию кластерных ионов. В результате в масс-спектре полученного соединения наблюдается группа пиков, которые отвечают ионам, полученным в результате перегруппировок образующихся в ходе распада фрагментов с исходными молекулами. В пользу этого, говорит и тот факт, что интенсивности ионов с массами 444–583 значительно ниже (приблизительно 5–7% от интенсивности пика с m/z 209) таковых для пиков фрагментов, образующихся в результате распада отдельной молекулы 3a-(4-метилфенил)-2,3,3a,4-тетрагидро-1H-бензо[d]пирроло[1,2-a]имидазол-1-она.
Таким образом, нами показано, что в условиях ЛДИ 3a-фенил- и 3а-(4-метилфенил)-2,3,3a,4-тетрагидро-1H-бензо[d]пирроло[1,2-a]имидазол-1-оны образуют при ионизации лазером при небольших его мощностях относительно небольшое количество фрагментов с массами не более 300 а.е.м., что может быть полезно при использовании данных соединений в качестве матриц МАЛДИ для исследования низкомолекулярной области биополимеров. Отмечено, что при увеличении мощности лазера происходит ионизация более крупных фрагментов молекул, включая димеры и сложные ионы, которые могут рассматриваться как фрагменты димеров, либо являющиеся результатом перегруппировок образующихся в ходе распада низкомолекулярных фрагментов и исходных молекул, что характеризуется появлением в масс-спектрах второй группы сигналов более низкой интенсивности с m/z от 300 до 555 а.е.м. Ранее эта особенность в литературе не обсуждалась. Склонность к димеризации данных молекул может быть объяснена наличием в кристаллах 3a-арилбензопирролоимидазолонов межмолекулярных водородных связей и π–π-стэкинговых взаимодействий сэндвичевого типа.
Список литературы
Анисимова О.С., Шейнкер Ю.Н., Палей Ю.Н. и др. // Химия гетероциклических соединений. 1975. Т. 11. № 8. С. 1124. https://doi.org/10.1007/BF00470505
Ibrahim H.K., El-Tamany S.H., El-Shaarawy R.F., El-Deen I.M. // Maced. J. Chem. Chem. Eng. 2008. V. 27. Iss. 1. P. 65–79. https://doi.org/10.20450/mjcce.2008.248
Cvilink V., Szotakova B., Vokral I., et al. // Rapid Commun. Mass Spectrom. 2009. V. 23. P. 2679–2684. https://doi.org/10.1002/rcm.4170
Musharraf S.G., Bibi A., Shahid N. et al. // Chem. Central J. 2013. V. 7. 77. https://doi.org/10.1186/1752-153X-7-77
Гринёв В.С., Амальчиева О.А., Егорова А.Ю., Любунь Е.В. // Журн. орган. химии. 2010. Т. 46. Вып. 9. С. 1376https://doi.org/10.1134/S1070428010090198
Grinev V.S., Egorova A.Y. // Acta Cryst. Sect. C. 2013. V. 69. Part 7. P. 880−883. https://doi.org/10.1107/S0108270113016119
Shiromaru H., Achiba Y., Kimura K., Lee Y.T. // J. Phys. Chem. 1987. V. 91. Iss. 1. P. 17–19. https://doi.org/10.1021/j100285a007
Obayes H.R., Alwan G.H., Alobaidy A.H.M.J. et al. // Chem. Central J. 2014. V. 8. 21. https://doi.org/10.1186/1752-153X-8-21
Knochenmuss R., Zenobi R. // Chem. Rev. 2003. V. 103. P. 441−452. https://doi.org/10.1021/cr0103773
Фаткуллина А.Ф., Яныбин В.М., Асфандиаров Н.Л. и др. // Журн. физ. химии. 2018. Т. 92. № 7. С. 1106. https://doi.org/10.1134/S0036024418070105
Burrow P.D., Jordan K.D. // Chem. Phys. Lett. 1975. V. 36. № 5. P. 594−598. https://doi.org/10.1016/0009-2614(75)85346-2
Rempt R.D. // Phys. Rev. Lett. 1969. V. 22. № 20. P. 1034−1036. https://doi.org/10.1103/PhysRevLett.22.1034
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии