Журнал физической химии, 2019, T. 93, № 12, стр. 1860-1864
Модель привитой обращенной фазы на основе силикагеля
В. И. Дейнека a, Ань Ван Нгуен a, Л. А. Дейнека a, *
a Белгородский государственный национальный исследовательский университет
308015 Белгород, Россия
* E-mail: deineka@bsu.edu.ru
Поступила в редакцию 11.02.2019
После доработки 11.02.2019
Принята к публикации 14.05.2019
Аннотация
Предложена модель строения поверхности обращенно-фазовых сорбентов, полученных химической модификацией силикагеля алкилдиметилхлорсиланами. Структура поверхности согласована с известными данными по свойствам силикагеля и н-алканов. В модели обращается внимание на то, что сочленение кремнекислородных тетраэдров (структурных единиц силикагеля) таково, что тетраэдры чередуются в порядке: вершиной вверх – вершиной вниз. При этом на модельной поверхности, которая может быть получена для орторомбической структуры кристобалита, число поверхностных силанольных групп близко к экспериментальному значению (немногим менее 5 групп на нм2). Сравнивая параметры такой поверхности с параметрами упаковки алканов в твердой фазе, получен вывод о том, что все поверхностные силанольные группы могут подвергнуться дериватизации по гидридной схеме. Однако, при силилировании поверхности силикагеля алкилдиметилхлорсиланом из-за стерических причин (присутствия двух метильных групп в якорной группе) заместиться могут только половина поверхностных групп. При этом в привитую фазу могут легко внедряться алкильные группы сорбатов или плоские молекулы без необходимости конформационной перестройки привитых алкильных радикалов.
Обращенно-фазовая высокоэффективная жидкостная хроматография (ОФ ВЭЖХ) относится к числу наиболее востребованных методов жидкостной хроматографии [1] благодаря ее универсальности – способности к разделению как липофильных, так и гидрофильных соединений. К настоящему времени для данного вида хроматографии производителями предложено несколько существенно структурно различающихся типов стационарных фаз. Их создание продиктовано расширением возможностей метода в различных направлениях: повышение устойчивости к высоким и низким рН [2, 3], снижение роли остаточных силанольных групп для повышения симметричности хроматографических пиков [4], изменение селективности разделения изомеров [5], повышение устойчивости к коллапсу фаз [6, 7] и т.д.
При кажущейся очевидности закономерностей разделения сорбатов (роста удерживания с ростом по липофильности) существуют необычные факты, требующие учета особенностей сорбции в зависимости от строения сорбатов. Так, например, при гидрировании двойной связи в молекулах высших жирных кислот удерживание существенно возрастет, тогда как при таком же изменении строения, – при замене кверцетина на дигидрокверцетин, – удерживание, наоборот, резко падает [8]. Очевидно, что причиной такого поведения могут быть особенности сорбции веществ на обращенно-фазовых сорбентах или их сольватации в подвижной фазе. Для понимания закономерностей удерживания веществ в зависимости от их строения следует особое внимание обратить на структуру обращенно-фазовых сорбентов. Обычно под обращенно-фазовыми сорбентами понимают силикагели с привитыми алкильными радикалами. При этом такую прививку осуществляют по силанольным группам поверхности силикагеля при действии алкилдиметилхлорсиланов [9] в среде пиридина (или иного, способного связывать выделяющийся хлороводород растворителя). Многие вопросы по этому процессу рассмотрены в цитируемой монографии, из которой для задач данного исследования важно то, что, в лучшем случае, дериватизации подвергается лишь примерно половина поверхностных силанольных групп, концентрация которых изначально составляет немногим менее 5 групп на нм2 для полностью гидроксилированной поверхности силикагеля [9, 10].
Настоящая работа посвящена построению модели поверхностной структуры привитой фазы с учетом геометрии поверхности силикагеля и строения твердых фаз алканов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Построение и обоснование модели
Несмотря на то, что поверхность структуры аморфного силикагеля может отличаться (и, очевидно, отличается) от поверхности кристаллических модификаций (кварца, кристобалита или тридимита), определенные закономерности в целом должны соблюдаться. Так, силанольная группа появляется на одной или нескольких вершинах кремнекислородного тетраэдра {SiO4}, как основного структурного звена всех кристаллических и аморфной модификаций SiO2. При этом следует учитывать, что для химии силикатов смежные тетраэдры направлены вершинами в одну и ту же сторону только в особых случаях, например, в кристаллической структуре монтмориллонита [11]. Это обусловлено тем, что в данном минерале все вершины двух тетраэдрических (кремнекислородных) слоев совмещены сверху и снизу с частью атомов кислорода октаэдрического (алюминий-гидроксидного) слоя.
В случае аморфного силикагеля нет причин для одинаковой направленности кремнекислородных тетраэдров (кроме случайных флуктуаций в аморфной структуре), поэтому наиболее вероятно чередование кремнекислородных тетраэдров в порядке: “… вершиной вверх – вершиной вниз …”. Это принципиально отличается от часто используемых схематических рисунков с одинаковой ориентацией соседних кремнекислородных тетраэдров [12, 13].
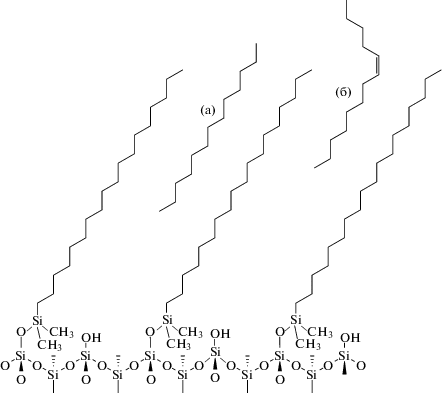
Удобной идеализированной моделью реальной структуры поверхности может служить упаковка тетраэдров {SiO4}, представленная на рис. 1, для орторомбической структуры кристобалита [13]. При среднем размере ребра тетраэдра {SiO4}⋅0.263 нм [14] на 1 нм2 поверхности содержатся 4.2 силанольные группы, а для произвольно ориентированной поверхности – 4.6 групп [9], что близко к экспериментальному значению (4.9) для силикагеля. Если учесть, что в лучшем случае (для силилирования поверхности триметилхлорсиланом) удается привить лишь 2.33 группы на нм2 [9], то примерно половина силанольных групп остается немодифицированной. В этом случае корректным изображением привитой поверхности должен быть рисунок, на котором остается незамещенной каждая вторая силанольная группа, рис. 2. Таким образом, химически модифицируется только один из четырех последовательно соединенных кремнекислородных тетраэдров. Отметим, что полученные предложенным способом результаты согласуются с выводами работы [15] по компьютерному моделированию поверхности силикагеля, химически модифицированного алкилдиметоксихлорсиланом.
Рис. 1.
Сетка связанных друг с другом кремнекислородных тетраэдров с чередующейся ориентацией вверх (a) – вниз (б) со свободной силанольной группой на вершине тетраэдра, ориентированного вершиной вверх.
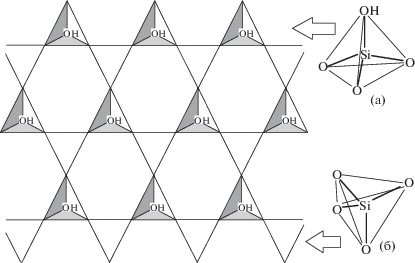
Рис. 2.
Схематическое строение поверхности обращенно-фазового сорбента – силикагеля с химически привитыми алкилдиметилсилильными группами.
При регулярной (как на рис. 2) структуре привитой фазы закрытие остаточных силанольных групп за счет эндкеппинга триметилхлорсиланом маловероятно, поскольку проекция триметилсилильной и алкилтриметилсилильной групп (при ориентации алкильного радикала вверх от поверхности сорбента) одинаковы. Впрочем, эндкеппинг возможен вследствие кривизны реальной поверхности силикагеля, при которой соответствующие стерические напряжения могут быть уменьшены. При статистическом силилировании силанольных групп не исключена вероятность появления двух силанольных групп между привитыми радикалами. В данном случае дополнительное силилирование одной из этих двух групп молекулой триметилхлорсилана может оказаться предпочтительным из-за меньших пространственных напряжений в месте прививки, поскольку для длинных алкильных цепей свобода конформационных изменений будет существенно уменьшенной. Наконец, силилирование триметилхлорсиланом более вероятно в узких местах порового пространства силикагеля.
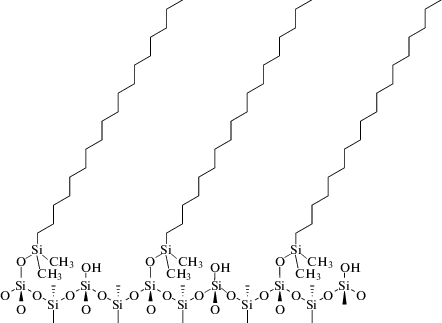
С другой стороны, в кристаллической фазе алканов молекулы с полностью транс-конформацией укладываются параллельно друг другу, образуя элементарную кристаллическую решетку от моноклинной до орторомбической (в зависимости от взаимной ориентации метиленовых групп соседних молекул [16]). При этом расстояние между центрами молекул алканов в проекции перпендикулярной длинной оси с, вдоль которой укладываются цепи атомов углерода, равно от 0.450 до 0.490 нм, что лишь немногим меньше расстояния между соседними силанольными группами на поверхности силикагеля. Следовательно, существует теоретическая возможность химической модификации силикагеля по всем силанольным группам поверхности, например, по гидридной схеме [17], рис. 3. Правда, в таком случае внедрение молекул сорбатов внутрь привитой фазы было бы практически исключено и сорбционная емкость стационарной фазы была бы существенно сниженной для веществ, удерживающихся по распределительному механизму.
При химическом модифицировании алкилдиметилхлорсиланом из-за стерических препятствий, связанных с наличием в якорной группировке двух метильных групп, замещению подвергается лишь половина силанольных групп. Следовательно, идеализированная модель химически модифицированного силикагеля такова, что между привитыми алкильными группами могут, во-первых, поместиться алкильные радикалы молекул-сорбатов, и, во-вторых, эти пустоты могут располагаться так, что в них возможно внедрение плоских структур. Это объясняет особенности сорбции плоских молекул по сравнению с неплоскими. Понятно, что при распределительном механизме удерживания такой способ модифицирования силикагеля приводит к росту сорбционной емкости с ростом плотности привитых групп до практического максимума около 2.4 групп на нм2 [18].
Предложенная схема объясняет экспериментально обнаруженные закономерности, например, в удерживании триацилглицеринов [19]. Экспериментально установлено (что и согласуется с предложенной моделью), что сильнее удерживаются изомеры, у которых первая цис-двойная связь находится возможно дальше от конца углеводородного радикала, способного проникать в указанные выше пустоты, рис. 4, в то время как для проникновения в привитой слой алкенов с транс-двойной связью стерические затруднения минимальны.
Список литературы
Dorsey J.G., Dill K.A. // Chem. Rev. 1989. V. 89. P. 331. https://doi.org/10.1021/cr00092a005
Kirkland J.J. // J. Chromat. Sci. 1996. V. 34. P. 309.
Kirkland J.J., Adams J.B. Jr., van Straten M.A. et al. // Anal. Chem. 1998. V. 70. P. 4344.
O’Sullivan G.P., Scully N.M., Glennon J.D. // Anal. Lett. 2010. V. 43. P. 1609.
Okusa K., Iwasaki Y., Kuroda I. et al. // J. Chromat. A. 2014. V. 1339. P. 86.
Wang H., Chen L., Tang X. et al. // Ibid. 2013. V. 1271. P. 153.
Giaginis C., Tsantili-Kakoulidou A. // J. Liquid Chromat. Rel. Technol. 2008. V. 31. P. 79.
Дейнека В.И., Дейнека Л.А., Блинова И.П. и др. // Сорбционные и хроматографические процессы. 2016. Т. 16. Вып. 3. С. 377.
Химия привитых поверхностных соединений. Под. ред. Г.В. Лисичкина. М.: Физматлит, 2003. 592 с.
Zhuravlev L.T. // Langmuir. 1987. V. 3. P. 316.
Clem A.G., Doehler R.W. // Clays Clay Minerals. 1961. V. 10. P. 272.
Lesellier E., West C., Tchapla A. // J. Chromat. A. 2006. V. 1111. P. 62.
Takada A., Glaser K.J., Bell R.G. et al // Intern. Union Cryst. J. 2018. V. 5. P. 325.
Dove M.T., Keen D.A., Hannon A.C. et al. // Phys. Chem. Minerals. 1997. V. 24. P. 311.
Hanai T. // J. Chromat. A. 2004. V. 1027. P. 279.
Wentzel N., Milner S.T. // J. Chem. Phys. 2010. V. 132. 044901.
Pesek J.J., Boysen R.I., Hearn M.T.W. et al. // Anal. Methods. 2014. V. 6. P. 4496.
Buszewski B., Suprunowicz Z., Staszczuk P. et al. // J. Chromat. 1990. V. 499. P. 305.
Nguyen A.V., Deineka V., Deineka L. et al. // Separations. 2017. V. 4. P. 37.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии