Журнал физической химии, 2019, T. 93, № 12, стр. 1851-1859
Адсорбция и хроматографическое разделение производных тиофена на графитированной термической саже
С. Н. Яшкин a, b, *, Е. А. Яшкина a, Д. А. Светлов c, **, Б. А. Мурашов d, ***
a Самарский государственный технический университет
443100 Самара, Россия
b Самарский национальный исследовательский университет имени академика С.П. Королева
443086 Самара, Россия
c Испытательная лаборатория по Самарской области ФГБУ “ЦЛАТИ по ПФО”
443093 Самара, Россия
d ООО “Газпромнефть НТЦ”
190000 Санкт-Петербург, Россия
* E-mail: snyashkin@mail.ru
** E-mail: dasvetlov@mail.ru
*** E-mail: borismurashov@rambler.ru
Поступила в редакцию 05.02.2019
После доработки 12.02.2019
Принята к публикации 12.02.2019
Аннотация
В условиях равновесной газо-адсорбционной хроматографии (ГАХ) на колонках с графитированной термической сажей (ГТС) марки Carbopack C НТ определены термодинамические характеристики адсорбции (ТХА) тиофена и его производных. Показано, что значения ТХА существенно зависят от числа и природы заместителей в основном структурном фрагменте. Установлено, что поверхность ГТС характеризуется низкой структурной селективностью в отношении изомеров положения в ряду производных тиофена. Впервые установлен и исследован эффект полярного удерживания на графите из газовой фазы, обусловленный реализацией дополнительных к дисперсионным специфических межмолекулярных взаимодействий полярных групп в адсорбате с легкополяризуемой поверхностью базисной грани графита. Сделан вывод о применимости модели двумерного идеального газа для описания подвижности сильнополярных молекул производных тиофена на поверхности графита и о существенных ограничениях этой модели применительно к адсорбции молекул тиофена, а также его метил- и галогенпроизводных.
Адсорбция тиофена и некоторых его производных на поверхности графитоподобных материалов не раз становилась предметом исследований методом равновесной газо-адсорбционной хроматографии (ГАХ) на колонках с графитированной термической сажей (ГТС) [1–7]. Интерес к этой группе соединений обусловлен их относительно широким распространением среди других гетероциклических соединений, большим числом функциональных производных, а также проявлением разнообразных свойств, в том числе и различных видов биологической активности. Термодинамические характеристики адсорбции (ТХА) в условиях равновесной ГАХ на колонках с ГТС были определены для тиофена [1, 2], алкил- и галогентиофенов [3, 4], арилтиофенов [5] и некоторых других соединений [6]. Кроме того, были рассчитаны параметры потенциальной функции межмолекулярного взаимодействия атомов S с атомами С базисной грани графита, позволившие выполнить априорный расчет равновесных величин ТХА, а также осуществить хроматоструктурный анализ геометрии ряда тиофенсодержащих соединений, адсорбированных на плоской поверхности графита [5]. Среди серосодержащих соединений не тиофенового ряда, исследованных методом ГАХ на ГТС, следует отметить стереоизомерные пергидротиоксантены и пергидро-4-тиа-s-индацены [8, 9]. С помощью ГАХ и молекулярно-статистических расчетов показаны уникальные возможности микронасадочных колонок с ГТС для полного разделения и идентификации отдельных изомеров этой группы соединений. В дополнение к экспериментальным исследованиям также были выполнены молекулярно-статистические расчеты равновесных ТХА, которые позволили не только однозначно идентифицировать отдельные изомеры, но и определить вклад различных по устойчивости конформаций отдельных изомеров в суммарную энергию адсорбции.
Вместе с тем, несмотря на уникальные 2D-селективные характеристики графитоподобных адсорбентов, их высокую химическую инертность и термическую стабильность, количество работ по применению этой группы материалов в газовой хроматографии в настоящее время невелико. Значительный прогресс в этом направлении наметился после создания аналогов ГТС для ВЭЖХ – пористого графитоподобного материала Hypercarb. Колонки с этим адсорбентом широко применяются для разделения близких по свойствам структурных и пространственных изомеров разных классов органических соединений, включая и производные тиофена [10]. Как и в случае адсорбции из газовой фазы, при сорбции из водно-органических растворов ключевую роль играет способность молекул адсорбата к планарному расположению на плоской поверхности графита, что позволяет сделать вывод о доминировании 2D-структурной селективности несмотря на активную роль подвижной фазы при сорбции из среды жидких элюентов.
Цель настоящей работы – газохроматографическое определение равновесных значений ТХА молекул тиофена и его различных функциональных производных на поверхности ГТС. Представляла интерес оценка селективности и возможности разделения изомерных соединений производных тиофена на колонках с ГТС, а также исследование способности сильнополярных молекул замещенных тиофенов к специфическим межмолекулярным взаимодействиям с легко поляризуемой поверхностью графита.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экспериментальное определение удельных удерживаемых объемов (VA,1, см3/м2) для исследованных в работе адсорбатов проводили на газовом хроматографе “Кристалл-4000” с пламенно-ионизационным детектором. Газом-носителем служил гелий (объемная скорость 18–25 cм3/мин). В качестве несорбирующегося вещества использовали метан. Пробы веществ вводили не менее 5 раз в виде разбавленных паровоздушных смесей или сильно разбавленных растворов в этаноле и диэтиловом эфире. Разделение проводили на стеклянной микронабивной колонке, размером 1.00 м × 1.5 мм. В качестве адсорбента применяли Carbopack C НТ (Supelco) с удельной поверхностью 10 м2/г [11]. Масса адсорбента в колонке 2.08 г. Размер зерен адсорбента составлял 60–80 меш. Относительные времена удерживания адсорбатов во всем исследованном интервале температур не зависели от концентрации адсорбата в газовой фазе, что свидетельствовало о достижении линейного участка изотермы адсорбции (область Генри). В пользу этого также свидетельствовали симметричные пики сорбатов на хроматограммах (рис. 1). Расчет основных ТХА осуществляли по стандартной методике, в соответствии с основным постулатом равновесной хроматографии: VA,1 [12–15]. Для обработки первичных хроматографических данных применяли уравнение:
(1)
$\begin{gathered} {{K}_{{1,{\text{c}}}}} = \mathop {\lim }\limits_{{\text{Г}}_{{\text{i}}}^{{{\text{gas}}}},{\text{c}}_{{\text{i}}}^{{{\text{gas}}}} \to 0} \left( {\frac{{{\text{Г}}_{{\text{i}}}^{{{\text{ads}}}}{\text{/Г}}_{{{\text{i,st}}}}^{{{\text{ads}}}}}}{{c_{{\text{i}}}^{{{\text{gas}}}}{\text{/}}c_{{{\text{i,st}}}}^{{{\text{gas}}}}}}} \right) \equiv {{V}_{{{\text{A}},{\text{1}}}}} = \\ = \;\frac{{\left( {{{t}_{{\text{R}}}} - {{t}_{{\text{M}}}}} \right){{F}_{{{{{\text{p}}}_{{\text{a}}}}{\text{,}}{{{\text{T}}}_{{\text{a}}}}}}}}}{{{{m}_{{\text{A}}}}{{S}_{{{{{\text{N}}}_{{\text{2}}}}}}}}}\frac{T}{{{{T}_{{\text{a}}}}}}\frac{{3{{{\left( {p{}_{{\text{i}}}/{{p}_{{\text{a}}}}} \right)}}^{2}} - 1}}{{2{{{\left( {{{p}_{{\text{i}}}}{\text{/}}{{p}_{{\text{a}}}}} \right)}}^{3}} - 1}}\frac{{{{p}_{{\text{a}}}} - {{p}_{{\text{w}}}}}}{{{{p}_{{\text{a}}}}}}, \\ \end{gathered} $Рис. 1.
Хроматограмма разделения смеси монозамещенных тиофенов (Т = 393 К, ${{F}_{{{{{\text{P}}}_{{\text{i}}}}{\text{,}}{{{\text{T}}}_{{\text{a}}}}}}}$ = 25 см3/мин) на колонке с Carbopak C НТ.

Для определения значений мольных дифференциальных стандартных теплот ${{\bar {q}}_{{{\text{dif,1}}}}}$ (Дж/моль) и изменения энтропии $\Delta {{(\bar {S}_{{{\text{1,с}}}}^{{\text{o}}})}^{{\text{s}}}}$ (Дж/(моль К)) адсорбции использовали два известных приближения, основанных на зависимостях ln K1,с от 1/Т [16]:
– $\Delta \bar {C}_{{1,{\text{v}}}}^{{\text{s}}} \approx 0{\text{:}}$
(2)
$\ln {{K}_{{{\text{1}},}}}_{{\text{с}}} = \frac{{{{{(\Delta \bar {S}_{{{\text{1,c}}}}^{{\text{o}}})}}^{{\text{s}}}} + R}}{R} + \frac{{{{{\bar {q}}}_{{{\text{dif,1}}}}}}}{{RT}} = {{A}_{1}} + {{B}_{1}}{\text{/}}T,$– $\Delta \bar {C}_{{1,{\text{v}}}}^{{\text{s}}} = {\text{const}} \ne 0{\text{:}}$
(3)
$\begin{gathered} \ln {{K}_{{{\text{1}},}}}_{{\text{с}}} = \frac{{{{{(\Delta \bar {S}_{{1,{\text{с}}}}^{{\text{o}}})}}^{{\text{s}}}} - \Delta \bar {C}_{{1,{\text{v}}}}^{{\text{s}}}(\ln {{T}_{{{\text{av}}}}} + 1) + R}}{R} + \\ + \;\frac{{{{{\bar {q}}}_{{{\text{dif,1}}}}} + {{T}_{{{\text{av}}}}}\Delta \bar {C}_{{1,{\text{v}}}}^{{\text{s}}}}}{{RT}} + \frac{{\Delta \bar {C}_{{1,{\text{v}}}}^{{\text{s}}}}}{R}\ln T = \\ = {{A}_{2}} + {{B}_{2}}T + C\ln T, \\ \end{gathered} $Таблица 1.
Экспериментальные значения ТХА молекул тиофена и его функциональных производных на поверхности Carbopack C НТ (${{\bar {q}}_{{{\text{dif,1}}}}}$, кДж/моль; $ - \Delta {{(\bar {S}_{{{\text{1,с}}}}^{{\text{o}}})}^{{\text{s}}}}$ и $\Delta {\bar {С}}_{{1,{\text{v}}}}^{s}$, Дж/(моль К))
| Адсорбат | ΔТ, К | ln K1,с [см3/м2 ] | По уравнению (2) | По уравнению (3) | ||||
|---|---|---|---|---|---|---|---|---|
| Тav | Т = 373 К | ${{\bar {q}}_{{{\text{dif,1}}}}}$ | $ - \Delta {{(\bar {S}_{{{\text{1,с}}}}^{{\text{o}}})}^{{\text{s}}}}$ | ${{\bar {q}}_{{{\text{dif,1}}}}}$ | $ - \Delta {{(\bar {S}_{{{\text{1,с}}}}^{{\text{o}}})}^{{\text{s}}}}$ | $\Delta {\bar {С}}_{{1,{\text{v}}}}^{s}$ | ||
| Тиофен (1) | 333–373 | 0.401 | –0.305 | 30.8 | 93.5 | 30.8 | 93.4 | 109.0 |
| 2-Метилтиофен (2) | 353–413 | 1.080 | 1.395 | 37.4 | 96.9 | 37.3 | 96.9 | 48.0 |
| 3-Метилтиофен (3) | 353–413 | 1.025 | 1.338 | 37.0 | 96.4 | 37.0 | 96.4 | 38.8 |
| 2-Хлортиофен (4) | 353–433 | 1.035 | 1.677 | 39.1 | 99.4 | 39.0 | 99.1 | 65.4 |
| 2-Бромтиофен (5) | 353–433 | 1.709 | 2.392 | 41.4 | 99.4 | 41.3 | 99.2 | 62.9 |
| 3-Бромтиофен (6) | 353–433 | 1.706 | 2.393 | 41.4 | 99.5 | 41.3 | 99.3 | 47.5 |
| 2-Иодтиофен (7) | 373–433 | 2.251 | 3.324 | 44.5 | 100.1 | 44.5 | 100.1 | 24.6 |
| 2.4-Динитро-5-иодотиофен (8) | 470–530 | 2.055 | 6.773 | 57.6 | 106.4 | 57.6 | 106.5 | 88.3 |
| 2.2'-Битиофен (9) | 440–520 | 3.144 | 7.601 | 61.9 | 111.3 | 61.9 | 111.2 | 70.2 |
| 2-Нитротиофен (10) | 393–483 | 1.527 | 3.364 | 46.7 | 102.2 | 46.4 | 101.6 | 35.6 |
| 2-Ацетилтиофен (11) | 413–493 | 1.612 | 4.354 | 48.1 | 101.2 | 48.1 | 101.0 | 47.0 |
| 2-Ацетамидотиофен (12) | 443–503 | 2.329 | 6.449 | 60.4 | 116.5 | 60.5 | 116.9 | 78.6 |
| 2.4-Динитротиофен (13) | 443–513 | 3.052 | 7.246 | 59.2 | 106.8 | 59.1 | 106.7 | 96.4 |
| 2.5-Динитротиофен (14) | 443–513 | 3.062 | 7.272 | 59.4 | 107.2 | 59.1 | 106.7 | 174.6 |
| 2-Нитро-3-бромтиофен (15) | 433–493 | 2.687 | 6.305 | 57.6 | 110.4 | 57.6 | 110.4 | 54.2 |
| 2-Ацето-5-нитротиофен (16) | 443–503 | 2.796 | 6.776 | 58.3 | 108.3 | 57.3 | 106.2 | 41.2 |
| 2-Иодо-5-нитротиофен (17) | 443–503 | 3.364 | 7.423 | 59.5 | 106.0 | 59.6 | 106.2 | 59.8 |
| Бензол (18) | 333–373 | 1.124 | –0.279 | 34.4 | 96.3 | 34.3 | 96.2 | 68.7 |
| Толуол (19) | 353–433 | 1.582 | 2.233 | 40.4 | 98.1 | 40.5 | 98.3 | 38.0 |
| Хлорбензол (20) | 353–433 | 1.758 | 2.460 | 42.2 | 101.1 | 42.2 | 101.1 | 23.2 |
| Бромбензол (21) | 373–463 | 1.600 | 3.142 | 43.9 | 100.0 | 43.3 | 98.6 | 26.7 |
| Иодбензол (22) | 373–473 | 2.289 | 4.105 | 46.5 | 99.2 | 46.4 | 99.1 | 41.6 |
| Нитробензол (23) | 373–463 | 2.654 | 4.339 | 47.6 | 100.0 | 47.5 | 99.9 | 54.1 |
Таблица 2.
Некоторые физико-химические параметры и теплоты адсорбции исследованных производных тиофена на Carbopack C НТ
| Адсорбат | αМ, ${{{\AA}}^{3}}$ | μ, D | Tc, К | Pc, бар | ${{{{T}_{{\text{c}}}}} \mathord{\left/ {\vphantom {{{{T}_{{\text{c}}}}} {\sqrt {{{P}_{{\text{c}}}}} }}} \right. \kern-0em} {\sqrt {{{P}_{{\text{c}}}}} }}$, К/бар0.5 | ${{\bar {q}}_{{{\text{dif,1}}}}}$, кДж/моль | $\delta {{\bar {q}}_{{{\text{dif,1}}}}}$ | |||
|---|---|---|---|---|---|---|---|---|---|---|
| эксп. | расчет по | (4) | (5) | |||||||
| (4) | (5) | |||||||||
| 1 | 9.8 | 0.54 | 580 | 59.6 | 75.1 | 30.8 | 32.7 | 33.5 | –1.9 | –2.6 |
| 2 | 11.7 | 0.67 | 609 | 49.0 | 86.9 | 37.4 | 37.4 | 38.8 | 0.0 | –1.4 |
| 3 | 11.7 | 0.82 | 613 | 49.0 | 87.5 | 37.0 | 37.4 | 39.0 | –0.4 | –2.0 |
| 4 | 11.7 | 1.48 | 636 | 52.3 | 87.9 | 39.2 | 37.4 | 39.2 | 1.8 | 0.0 |
| 5 | 12.8 | 1.35 | 677 | 57.4 | 89.3 | 41.4 | 40.2 | 39.8 | 1.2 | 1.6 |
| 6 | 12.8 | 1.13 | 690 | 57.4 | 91.0 | 41.4 | 40.2 | 40.6 | 1.2 | 0.8 |
| 7 | 14.9 | 1.20 | 725 | 51.8 | 100.8 | 44.6 | 45.2 | 44.9 | –0.6 | –0.4 |
| 8 | 18.4 | 5.23 | − | 37.0 | − | 57.6 | 53.7 | − | 3.9 | − |
| 9 | 18.9 | 0.96 | 807 | 40.2 | 127.4 | 62.0 | 54.9 | 56.8 | 7.1 | 5.2 |
| 10 | 12.4 | 4.22 | 751 | 50.1 | 106.1 | 46.7 | 39.1 | 47.3 | 7.6 | –0.6 |
| 11 | 13.7 | 3.37 | 729 | 43.6 | 110.4 | 48.1 | 42.4 | 49.2 | 5.7 | –1.1 |
| 12 | 15.4 | 2.69 | 874 | 44.0 | 131.7 | 60.4 | 46.5 | 58.7 | 13.9 | 1.6 |
| 13 | 15.0 | 3.70 | 833 | 42.6 | 127.7 | 59.2 | 45.4 | 56.9 | 13.8 | 2.3 |
| 14 | 15.0 | 2.17 | 801 | 42.6 | 122.8 | 59.4 | 45.4 | 54.8 | 14.0 | 4.7 |
| 15 | 15.4 | 5.36 | 748 | 47.1 | 109.1 | 57.6 | 46.5 | 54.6 | 11.1 | 3.0 |
| 16 | 15.0 | 3.03 | 817 | 42.0 | 126.0 | 58.3 | 45.6 | 56.2 | 12.7 | 2.1 |
| 17 | 17.5 | 5.96 | 828 | 43.2 | 126.0 | 59.5 | 51.5 | 56.2 | 8.0 | 3.3 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В табл. 1 приведены полученные в настоящей работе значения ТХА тиофена, бензола и их функциональных производных. Из представленных данных видно, что значения ln K1,с и ${{\bar {q}}_{{{\text{dif,1}}}}}$ для производных тиофена заметно ниже соответствующих величин для производных бензола. Так, различие в величинах ${{\bar {q}}_{{{\text{dif,1}}}}}$ для бензола и тиофена составляет 3.5 кДж/моль, что превышает величину экспериментальной погрешности определения ${{\bar {q}}_{{{\text{dif,1}}}}}$. В ряду метил-, хлор-, бром- и иодпроизводных бензола и тиофена различие в величинах ${{\bar {q}}_{{{\text{dif,1}}}}}$ уменьшается от 3.2 до 1.9 кДж/моль соответственно. Причина наблюдаемых особенностей, вероятно, связана с тем, что значение ван-дер-ваальсова радиуса атома S, равное 0.185 нм [22], больше полутолщины бензольного кольца (0.177 нм) [23]. В связи с этим СН-группы в молекуле тиофена, находящиеся в непосредственной близости к атому S (2 и 5 положения кольца) оказываются приподнятыми над плоской поверхностью графита, что приводит к ослаблению их взаимодействия с адсорбентом и, как следствие, к уменьшению величин ln K1,с и ${{\bar {q}}_{{{\text{dif,1}}}}}$. Вывод о том, что атом серы “приподнимает” плоскость тиофенового кольца над поверхностью графита подтверждает наличие двух отдельных зависимостей ${{\bar {q}}_{{{\text{dif,1}}}}}$ = f(αМ) для монопроизводных бензола и тиофена (рис. 2): зависимость для производных тиофена в координатах графика ${{\bar {q}}_{{{\text{dif,1}}}}}$ = f(αМ) располагается ниже соответствующей зависимости для производных бензола. Аналогичные эффекты наблюдались и ранее [24, 25], при изучении адсорбции других ароматических соединений с объемными заместителями на поверхности графита. Различия в адсорбции основных структурных фрагментов (бензольного и тиофенового колец) оказывают влияние и на вклады функциональных групп в величину ${{\bar {q}}_{{{\text{dif,1}}}}}$. Из табл. 3 видно, что величины $\delta {{\bar {q}}_{{{\text{dif,1}}}}}$, равные вкладу различных заместителей в теплоту адсорбции, в ряду производных тиофена выше по сравнению с соответствующими производными бензола.
Рис. 2.
Зависимости теплот адсорбции (${{\bar {q}}_{{{\text{dif,1}}}}}$, кДж/моль) от молекулярной поляризуемости (αМ, ${{{\AA}}^{3}}$) в ряду монопроизводных тиофена ($\bigcirc $) и бензола ( ).
).

Таблица 3.
Вклады различных функциональных групп в величины теплот адсорбции ($\delta {{\bar {q}}_{{{\text{dif,1}}}}}$, кДж/моль) монопроизводных тиофена и бензола на поверхности Carbopack C НТ
| Производные | СН3- | Cl- | Br- | I- | NO2- |
|---|---|---|---|---|---|
| Тиофена | 6.5 | 8.2 | 10.5 | 13.7 | 15.6 |
| Бензола | 6.2 | 7.5 | 9.0 | 12.1 | 13.2 |
В отличие от монозамещенных бензола, в ряду монозамещенных тиофена возможна изомерия положения, обусловленная различием в относительном расположении атома S и заместителя в кольце (2- и 3-изомеры соответственно). Из данных табл. 1 следует, что 2- и 3-изомеры характеризуются близкими значениями ТХА, что не позволяет добиться их удовлетворительного разделения на использованных в данной работе микронасадочных колонках с ГТС. Несмотря на это, значения ln K1,с для 2-изомера немного выше величин ln K1,с для 3-изомера (например, 2- и 3-метилтиофены). Однако увеличение ван-дер-ваальсова радиуса заместителя приводит к тому, что различие в величинах ln K1,с для 2-/3-изомеров практически исчезает (например, 2- и 3-бромтиофены). В случае дизамещенных производных тиофена величины ТХА практически неразличимы, в чем легко убедиться, сопоставив величины ТХА для молекул 2,4- и 2,5-динитротиофенов.
Анализ величин ln K1,с показывает (табл. 1), что ГТС может быть использована для эффективного разделения рассмотренных производных тиофена с различными функциональными группами. Приведенная на рис. 1 хроматограмма разделения модельной смеси подтверждает этот вывод. Вместе с тем, соединения с близкими величинами молекулярной поляризуемости (метил- и хлортиофены, а также изомеры положения 2-; 5-; 13-14) характеризуются практически одинаковыми значения ТХА, и поэтому смеси этих соединений не могут быть разделены на использованных в работе микронасадочных колонках с Carbopack C НТ. Таким образом, поверхность ГТС характеризуется низкой структурной селективностью в отношении изомеров положения в ряду моно- и дизамещенных производных тиофена, что хорошо согласуется с низкой орто-/мета-/пара-селективностью в ряду соответствующих производных бензола [24].
При переходе к производным, содержащим несколько различных заместителей (в частности, молекулы 2-иод-5-нитротиофен, 2-нитро-3-бромтиофен, 2-ацето-5-нитротиофен) наблюдается аддитивность вкладов заместителей в величину ${{\bar {q}}_{{{\text{dif,1}}}}}$ (незначительное различие между экспериментальными и рассчитанными по вкладам значениями ${{\bar {q}}_{{{\text{dif,1}}}}}$ укладывается в рамки погрешности ее газохроматографического определения). Исключение из этой закономерности – молекула 2,4-динитро-5-йодтиофена, для которой рассчитанная по вкладам величина ${{\bar {q}}_{{{\text{dif,1}}}}}$ (∼76 кДж/моль) оказывается существенно выше экспериментальной величины, равной 57.6 кДж/моль. Объяснением этого факта, по-видимому, может быть большой ван-дер-ваальсов размер атома I (0.215 нм [22]), приподнимающий плоское тиофеновое кольцо с двумя сопряженными NO2-группами над поверхностью графита, в результате чего энергия межмолекулярного взаимодействия “адсорбат–графит” резко уменьшается.
Особый интерес в свете поставленной в настоящей работе задачи, представляет изучение характера межмолекулярных взаимодействий различных по полярности производных тиофена с поверхностью графита. Известно, что по классификации А.В. Киселева, ГТС принадлежит к адсорбентам I типа [24], на поверхности которых могут реализовываться только дисперсионные межмолекулярные взаимодействия. Надежным критерием реализации преимущественно дисперсионных межмолекулярных взаимодействий в адсорбции служит наличие корреляции между величинами ${{\bar {q}}_{{{\text{dif,1}}}}}$ адсорбатов и их молекулярной поляризуемостью (αМ). Действительно, в случае молекул тиофена, метилтиофенов, галогентиофенов (группа слабополярных соединений, для которых величина μ ≤ 1.5 D), а также н-алканов корреляция экспериментальных значений ${{\bar {q}}_{{{\text{dif,1}}}}}$ (рис. 3) с величинами αМ характеризуется высоким коэффициентом детерминации (r2 = 0.98). При этом отклонения величин ${{\bar {q}}_{{{\text{dif,1}}}}}$ этих соединений от зависимости ${{\bar {q}}_{{{\text{dif,1}}}}}$ = f(αМ) для н-алканов невелики. Все это свидетельствует о доминирующем вкладе дисперсионных межмолекулярных взаимодействий молекул тиофена, метилтиофенов и галогентиофенов с поверхностью базисной грани графита.
Рис. 3.
Зависимость теплоты адсорбции (${{\bar {q}}_{{{\text{dif,1}}}}}$, кДж/моль) от молекулярной поляризуемости (αМ, ${{{\AA}}^{3}}$) исследованных производных тиофена.

Совершенно иная картина наблюдается в случае адсорбции молекул, содержащих сильнополярные функциональные группы (нитро-, ацетил-, ацетамидо- и др. (группа сильно полярных соединений, для которых μ ≥ 2.5 D)). Как видно из рис. 3 значения ${{\bar {q}}_{{{\text{dif,1}}}}}$ этих соединений плохо коррелируют с величиной αМ. Соответствующие им точки в координатной плоскости ${{\bar {q}}_{{{\text{dif,1}}}}}$ = f(αМ) лежат значительно выше прямой, соответствующей н-алканам и малополярным производным тиофена. Столь неожиданное адсорбционное поведение нитро-, ацетил- и других сильнополярных производных тиофена свидетельствует о проявлении дополнительных к дисперсионным специфических межмолекулярных взаимодействий. Наиболее вероятным объяснением наблюдаемой особенности может быть тот факт, что полярные (NO2-, СН3СО- и др.) группы наряду с дисперсионными взаимодействиями способны вступать в специфическое индукционное взаимодействие с легко поляризуемой системой π-электронов поверхности графита. Подобное взаимодействие относительно недавно было обнаружено при исследовании адсорбции сильнополярных адсорбатов на графитоподобной поверхности в условиях ВЭЖХ [26–28]. Такое взаимодействие получило название “эффект полярного удерживания на графите” (обнаружен на графитоподобном адсорбенте Hypercarb для ВЭЖХ) [28]. На рис. 4 схематично показана деформация делокализованной системы р-электронов под действием сильнополярной группы.
Рис. 4.
Схематичное изображение недеформированной поверхности графита в случае неспецифической адсорбции (а) и деформации делокализованной системы р-электронов под действием сильнополярной группы (б).

В настоящей работе предпринята попытка количественной оценки эффекта полярного удерживания. С помощью зависимости ${{\bar {q}}_{{{\text{dif,1}}}}}$ = f(αМ), полученной для н-алканов:
(4)
${{\bar {q}}_{{{\text{dif,1}}}}} = {\text{2}}.{\text{4383}}{{\alpha }_{{\text{М}}}}{\text{ }} + {\text{ 8}}.{\text{9158}},$Наряду с величиной αМ в корреляциях “свойство–удерживание” широкое распространение получил параметр ${{{{T}_{c}}} \mathord{\left/ {\vphantom {{{{T}_{c}}} {\sqrt {{{P}_{c}}} }}} \right. \kern-0em} {\sqrt {{{P}_{c}}} }}$, где Тс и Рс – критические константы веществ. Уравнение, связывающее ${{{{T}_{c}}} \mathord{\left/ {\vphantom {{{{T}_{c}}} {\sqrt {{{P}_{c}}} }}} \right. \kern-0em} {\sqrt {{{P}_{c}}} }}$ и ${{\bar {q}}_{{{\text{dif,1}}}}}$ получено в работе [29]:
(5)
${{\bar {q}}_{{{\text{dif,1}}}}} = D{{{{T}_{{\text{c}}}}} \mathord{\left/ {\vphantom {{{{T}_{{\text{c}}}}} {\sqrt {{{P}_{{\text{c}}}}} }}} \right. \kern-0em} {\sqrt {{{P}_{{\text{c}}}}} }},$Рис. 5.
Зависимость теплоты адсорбции (${{\bar {q}}_{{{\text{dif,1}}}}}$, кДж/моль) от критических параметров (${{Т}_{{\text{с}}}}{\text{/}}\sqrt {{{P}_{{\text{c}}}}} $, К/бар0.5) исследованных производных тиофена (светлые точки – эксперимент; темные – расчет (уравнение (5))).

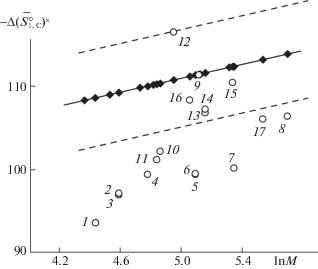
Подвижность молекул исследованных производных тиофена на поверхности Carbopack C НТ оценена в рамках модели двумерного идеального газа с помощью величин $\Delta {{(\bar {S}_{{{\text{1,с}}}}^{{\text{o}}})}^{{\text{s}}}}$ (теор.), рассчитанных по формуле [30]:
(6)
$\Delta {{(\bar {S}_{{{\text{1,с}}}}^{{\text{o}}})}^{{\text{s}}}}({\text{теор}}.) = R{\text{ln}}{{(M{{Т}_{{{\text{av}}}}})}^{{0.{\text{5}}}}} + {\text{56}}.{\text{95}} + R.$Таблица 4.
Сравнение значений $\Delta {{(\bar {S}_{{{\text{1,с}}}}^{{\text{o}}})}^{{\text{s}}}}$ (эксп. и теор.) для исследованных производных тиофена
| Адсорбат | M | Тav, К | $ - \Delta {{(\bar {S}_{{{\text{1,с}}}}^{{\text{o}}})}^{{\text{s}}}}$ | $\delta \Delta {{(\bar {S}_{{{\text{1,с}}}}^{{\text{o}}})}^{{\text{s}}}}$ | |
|---|---|---|---|---|---|
| эксп. | теор. | ||||
| 1 | 84.1 | 353.0 | 93.5 | 108.0 | –14.5 |
| 2 | 98.0 | 383.0 | 96.9 | 109.1 | –12.2 |
| 3 | 98.0 | 383.0 | 96.4 | 109.1 | –12.7 |
| 4 | 118.6 | 393.0 | 99.4 | 110.0 | –10.6 |
| 5 | 163.0 | 393.0 | 99.4 | 111.3 | –11.9 |
| 6 | 163.0 | 393.0 | 99.5 | 111.3 | –11.8 |
| 7 | 210.0 | 403.0 | 100.1 | 111.7 | –11.6 |
| 8 | 300.0 | 500.0 | 106.4 | 114.8 | –8.4 |
| 9 | 167.0 | 480.0 | 111.3 | 112.2 | –0.9 |
| 10 | 129.1 | 438.0 | 102.2 | 110.8 | –8.6 |
| 11 | 126.2 | 453.0 | 101.2 | 110.8 | –9.6 |
| 12 | 141.2 | 473.0 | 116.5 | 111.4 | 5.1 |
| 13 | 174.1 | 478.0 | 106.8 | 112.4 | –5.6 |
| 14 | 174.1 | 478.0 | 107.2 | 112.4 | –5.2 |
| 15 | 208.0 | 463.0 | 110.4 | 113.0 | –2.6 |
| 16 | 157.2 | 473.0 | 108.3 | 111.9 | –3.6 |
| 17 | 255.0 | 473.0 | 106.2 | 113.9 | –7.7 |
Рис. 6.
Зависимость величин $\Delta {{(\bar {S}_{{{\text{1,с}}}}^{{\text{o}}})}^{{\text{s}}}}$ (светлые точки – эксперимент; темные – расчет (уравнение (6))) от молекулярной массы исследованных производных тиофена.
ЗАКЛЮЧЕНИЕ
В условиях равновесной ГАХ на ГТС марки Carbopack C НТ в широком интервале температур впервые определены значения ТХА молекул тиофена и его различных производных; показано, что значения ТХА существенно зависят от числа и природы заместителей в основном структурном фрагменте. Установлено, что поверхность ГТС характеризуется низкой структурной селективностью в отношении изомеров положения в ряду производных тиофена.
Изоструктурные исследованным производным тиофена и близкие по физико-химическим характеристикам замещенные бензолы характеризуются более высокими значениями ТХА, что обусловлено меньшей площадью контакта производных тиофена с графитоподобной поверхностью вследствие больших ван-дер-ваальсовых размеров атома S. На основании хроматографически определенных теплот адсорбции нитро-, ацето- и ацетамидотиофенов впервые установлен и исследован эффект полярного удерживания на графите из газовой фазы, обусловленный реализацией дополнительных к дисперсионным специфических межмолекулярных взаимодействий полярных групп в адсорбате с легкополяризуемой поверхностью базисной грани графита; определен количественный вклад этого эффекта в значения теплот адсорбции.
Показано, что модель двумерного идеального газа удовлетворительно описывает экспериментальные значения $\Delta {{(\bar {S}_{{{\text{1,с}}}}^{{\text{o}}})}^{{\text{s}}}}$ в случае адсорбции полярных молекул производных тиофена на поверхности Carbopack C НТ, однако для описания подвижности молекул тиофена и его метил- и галогенпроизводных эта модель имеет серьезные ограничения и не может быть использована для априорного расчета величин $\Delta {{(\bar {S}_{{{\text{1,с}}}}^{{\text{o}}})}^{{\text{s}}}}$.
Авторы выражают искреннюю признательность А.В. Юдашкину и В.В. Мешковой за предоставленные для исследования образцы некоторых изученных производных тиофена.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 16-43-630634 p_а) и Министерства науки и высшей школы РФ в рамках базовой части государственного задания ФГБОУ ВО “СамГТУ” (“Термодинамика межмолекулярных взаимодействий в системах с 2D- и 3D-типами структурной селективности” № 4.6328.2017/8.9).
Список литературы
Киселев А.В., Мигунова И.А., Яшин Я.И. // Журн. физ. химии. 1968. Т. 42. № 5. С. 1235.
Elkington P.A., Curthoys G. // J. Phys. Chem. 1969. V. 78. № 7. P. 2321.
Буряк А.К., Даллакян П.Б., Киселев А.В. // Докл. АН СССР. 1985. Т. 282. № 2. С. 350.
Даллакян П.Б. Связь структуры некоторых гетероциклических соединениий с их адсорбцией на графитированной термической саже: Автореф. дис…. канд. хим. наук. М.: МГУ, 1986. 22 с.
Даллакян П.Б., Киселев А.В. // Журн. физ. химии. 1985. Т. 59. № 5. С. 1277.
Даллакян П.Б., Киселев А.В. // Там же. 1985. Т.59. № 5. С. 1278.
Лопаткин А.А., Даллакян П.Б. // Там же. 1997. Т. 71. № 7. С. 1333.
Adeeva V.G., Bobyleva M.S., Kulikov N.S., Kharchenko V.G. // J. Chem. Soc., Perkin Trans. 2. 1992. № 6. P. 965.
Kulikov N.S., Bobyleva M.S. // J. Chem. Soc., Perkin Trans. 2. 2000. № 3. P. 571.
Емельянова Н.С. Адсорбция тиофенсодержащих гетероциклов из растворов на пористом графитированном углероде и гексадецилсиликагеле в условиях жидкостной хроматографии: Автореф. дис…. канд. хим. наук. Саратов: СГУ, 2013. 21 с.
Bernes S., Davila-Jimenez M.M., Elizalde-Gonzalez M.P. et al. // Materials Chemistry and Physics. 2004. V. 85. P. 347.
Экспериментальные методы в адсорбции и молекулярной хроматографии / Под ред. Ю.С. Никитина и Р.С. Петровой. М.: Изд-во МГУ, 1990. 318 с.
Яшкин С.Н., Светлов Д.А., Новоселова О.В., Яшкина Е.А. // Изв. АН. Сер. хим. 2008. Т. 57. № 12. С. 2422.
Лопаткин А.А. // Рос. хим. журн. 1997. Т. 41. № 3. С. 85.
Яшкин С.Н. // Изв. АН. Сер. хим. 2014. Т. 63. № 3. С. 582.
Яшкин С.Н., Светлов Д.А., Мурашов Б.А. // Журн. прикл. химии. 2013. Т. 86. № 3. С. 463.
The Chemistry of Heterocyclic Compounds. V. 44. Thiophene and Its Derivatives / Ed. by S. Gronowitz. New-York: John Wiley & Sons, Inc, 1991. P. 1–294.
Thermophysical Properties of Chemicals and Hydrocarbons / Ed. by C.L. Yaws. Amsterdam: Elsevier, 2014. 991 p.
Айвазов Б.В., Петров С.М., Хайруллина В.Р., Япрынцева В.Г. Физико-химические константы сераорганических соединений. М.: Химия, 1964. 280 с.
Todeschini R., Consonni V. Handbook of Molecular Descriptors. Weinheim: Wiley-VCH, 2000. 667 p.
http://www.chemspider.com
Зефиров Ю.В. // Кристаллография. 1997. Т. 42. № 1. С. 122.
Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. Ч. 1. М.: Изд-во МГУ, 1999. С. 78.
Киселев А.В., Яшин Я.И. Адсорбционная газовая и жидкостная хроматография. М.: Химия, 1979. 288 с.
Яшкин С.Н., Мурашов Б.А., Климочкин Ю.Н. // Журн. физ. химии. 2011. Т. 85. № 4. С. 758.
West C., Elfakir C., Lafosse M. // J. Chromatogr. A. 2010. V. 1217. № 19. P. 3201.
Pereira L. // Journal of Liquid Chromatography & Related Technologies. 2008. V. 31. № 11. P. 1687.
Knox J.H., Ross P. // Advances in Chromatogr. 1997. V. 37. P. 73.
Березин Г.И. // Докл. АH. 1974. Т. 217. № 4. С. 843.
Лопаткин А.А. // Росс. хим. журн. 1996. Т. 40. № 2. С. 5.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


