Журнал физической химии, 2019, T. 93, № 12, стр. 1780-1789
Физико-химические свойства промотированных калием Fe-содержащих катализаторов гидрирования СО на алюмомагниевых шпинелях: ИК-спектроскопия
А. Н. Харланов a, *, Г. В. Панкина a, В. В. Лунин a
a Московский государственный университет имени М.В. Ломоносова,
Химический факультет
Москва, Россия
* E-mail: kharl@kge.msu.ru
Поступила в редакцию 16.02.2019
После доработки 16.02.2019
Принята к публикации 12.03.2019
Аннотация
Изучено влияние структурных свойств носителя алюмомагниевой шпинели с различными структурными характеристиками на физико-химические свойства Fe–K-содержащих катализаторов процесса гидрирования СО. Показано, что основной фазой в Fe-содержащих катализаторах является – гематит. При бимодальном распределении мезопор носителя формируется высокодисперсное распределение оксида железа по поверхности. Методом ИК-спектроскопии показано, что основными центрами адсорбции являются катионы Fe2+ и металлическое железо. Введение калия снижает поверхностную концентрацию кластеров, включающих Fe2+ в различном координационном окружении. Установлено увеличение вклада суб-карбонильных форм адсорбции в спектр полос поглощения и снижение количества окисленного железа на поверхности металлических частиц железа.
Железосодержащие катализаторы, нанесенные на оксидный носитель, традиционно применяются в процессе гидрирования СО или синтезе Фишера–Тропша (СФТ). Промотирование катализаторов металлами (K, Cu) позволяет достигать высокой активности и селективности по отношению к олефинам и С5+-углеводородам [1–3]. Активной фазой Fe-содержащих катализаторов считаются карбиды различного химического состава [1, 4, 5]. Высокодисперсные карбиды железа могут образовываться в процессе активации железных катализаторов в токе СО или синтез-газа и оставаться стабильными в широком диапазоне условий проведения реакции [6]. Роли активного компонента на носителе отводится значительное место, поскольку именно на нем происходит адсорбция. А от того, каким образом осуществляется стадия адсорбции, в значительной степени зависят каталитические свойства катализатора. Оксид алюминия является традиционным носителем, как для железных, так и кобальтовых катализаторов СФТ. Однако, на таких катализаторах при высокой степени конверсии в процессе СФТ происходит образование железо- и кобальт-алюмомагниевых шпинелей с достаточно малым размером кристаллитов металла, которые в дальнейшем поддаются восстановлению только при высоких температурах и неактивны в СФТ [7, 8]. Чтобы исключить оксид-оксидное взаимодействие с активным компонентом, его модифицируют металлами и другими химическими соединениями, например, оксидом магния или силикагелем [3, 9]. Стабилизация носителя Al2O3 5% силикагеля позволяет достигать в стандартных условиях СФТ скоростей порядка 49 ммоль СО/(гкт ч), в то время как при использовании традиционных коммерческих носителей оксида алюминия скорость ниже и составляет 26–39 ммоль СО/(гкт ч) [10]. Объяснением этому, по мнению авторов, служит образование термически стабильной бимодальной пористой структуры, которая позволяет достигать высокой дисперсности нанесенного пропиткой металла [10]. По мнению авторов [11] добавка малых количеств силикагеля к оксиду алюминия может предотвратить образование неактивных алюминатов кобальта и, следовательно, предотвратить дезактивацию катализатора в СФТ. Особо отмечено, что свойства пористого носителя, его удельная поверхность, средний размер пор и распределение пор по размерам существенно влияют на адсорбционные и каталитические свойства приготовленного катализатора.
Как уже было упомянуто, калий, как промотор Fe-содержащего катализатора, влияет на физико-химические свойства катализаторов, активность и селективность в каталитической реакции гидрирования СО (СФТ). Авторами [12] показано, что добавление небольшого количества калия стабилизирует поверхность нанесенного на поверхность оксида железа и препятствует в дальнейшем спеканию частиц при прокаливании. При высокой концентрации калия активные центры катализатора могут закрываться катионами калия, что снижает каталитическую активность.
Настоящая работа посвящена изучению влияния структурных свойств носителя и метода приготовления на физико-химические свойства и формы адсорбции монооксида углерода на поверхности промотированных калием железосодержащих катализаторов гидрирования СО на основе алюмомагниевых шпинелей различной текстуры. Для исключения влияния процессов, протекающих в ходе активации, объектами исследования взяты нетренированные (свежеприготовленные) катализаторы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализаторов
Катализаторы готовили методом последовательной и совместной пропитки носителя – алюмомагниевой шпинели – растворами Fe(NO3)2 · 9Н2О и КNO3 с концентрацией калия 2 мас. % и при постоянной концентрации железа 15 мас. %. В качестве носителей использовали алюмомагниевые шпинели вида AlxMgyOz фирмы “SASOL Germany GmbH” марки Puralox MG 30: Spinel(S) и Spinel Precursor (SP). Эти шпинели обозначены нами как MA-S и MA-SP соответственно, их технические характеристики приведены в табл. 1. Катализаторы сушили при 80°C в течение 1 ч в роторном испарителе, а затем прокаливали в токе азота в программируемом режиме в течение 3 ч при 450°C (объемная скорость потока азота 1200 ч–1, скорость нагрева 8 K/мин). Процедуру сушки и отжига повторяли после каждого акта пропитки солями нитратов соответствующих металлов. В дальнейшем полученные катализаторы обозначили как Fe/MA, Fe/K/MA, K/Fe/MA и (FeК)/MA c обозначением носителей – алюмомагниевой шпинели, как MA-S – c низкой удельной поверхностью – и MA-SP – с высокой удельной поверхностью.
ФИЗИКО-ХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ
Низкотемпературная адсорбция азота
Пористая структура носителя и железосодержащих катализаторов на основе алюмомагниевой шпинели (удельная поверхность, удельный объем микропор, средний размер пор в образцах) исследованы методом низкотемпературной адсорбции азота на сорбтометре Micrometrics ASAP 2000. Непосредственно перед проведением эксперимента образцы в количестве 0.2–0.3 г дегазировали в вакууме (P < 10 мм. рт. ст.) при 300°C в течение 4 ч. Измерения проводили с интервалом 5 с. Полученные результаты приведены в табл. 2.
Таблица 2.
Результаты исследования поверхности катализаторов методом низкотемпературной адсорбции азота
| Образец | Sуд БЭТ, м2/г | Vпор (BJH), см3/г | dср, (BJH) нм | D, нм Fe2O3 (РФА) |
|---|---|---|---|---|
| МА-S | 15 | 0.09 | 32 | – |
| Fe/МА-S | 21 | 0.11 | 23 | 8.1 |
| Fe/K/МА-S | 13 | 0.09 | 25 | 7.7 |
| K/Fe/МА-S | 15 | 0.1 | 25.5 | 6.5 |
| (FeK)/МА-S | 18 | 0.1 | 32 | 7.5 |
| МА-SP | 163 | 0.47 | 10 | – |
| Fe/МА-SP | 125 | 0.34 | 9 | – |
| Fe/K/МА-SP | 112 | 0.3 | 9 | – |
| K/Fe/МА-SP | 101 | 0.33 | 10 | – |
| (FeK)/МА-SP | 118 | 0.3 | 9 | – |
Рентгенофазовый анализ
Рентгенофазовый анализ (РФА) проводили с помощью дифрактометра ДРОН-3 с CuKα-излучением и графитовым монохроматором. Измерения проводили в диапазоне 2θ = 20°–70° в режиме пошагового сканирования с шагом 0.1° и временем экспозиции на точку 3 с. Для оценки размеров кристаллитов съемку проводили с шагом 0.02° и временем на точку 10 с. Средний размер частиц гематита DHKL оценивали по формуле Шеррера [13]:
где λ – длина волны равная 1.54 Å, β – интегральная полуширина линии, равная площади пика, деленной на интенсивность в максимуме, θ – угол отражения.ИК-спектральное исследование
Инфракрасные спектры диффузного отражения регистрировали на ИК-фурье-спектрометре EQUINOX 55/S (Bruker). Порошкообразную фракцию исследуемого образца помещали в кварцевую ампулу с окошком из CaF2 и прокаливали при температуре 400°С (1 ч на воздухе и 2 ч под вакуумом не хуже 5 × 10–5 Торр). Газообразный СО очищали перепусканием через ловушку с жидким азотом и длительным выдерживанием над прокаленным цеолитом. Дифференциальные спектры адсорбированного СО получали вычитанием фонового спектра из экспериментального спектра образца, содержащего адсорбированный СО, с последующей коррекцией базовой линии в программе OPUS 6.0 (Bruker). Для малоинтенсивных спектров проведена процедура цифрового вычитания шума.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В качестве носителей Fe-, K-нанесенных катализаторов выбраны две пористые алюмомагниевые шпинели, представляющие собой белые порошкообразные вещества фракции 0.05÷0.1 мм. В табл. 2 приведены значения основных структурных параметров шпинелей и катализаторов на их основе по данным, полученным методом низкотемпературной адсорбции азота. Удельная поверхность шпинели МА-SP на порядок больше поверхности МА-S, при этом средний объем пор в МА-SP в 5 раз больше, а средний диаметр пор в 3 раза меньше, чем в МА-S. Подобная закономерность сохраняется также для катализаторов на основе этих шпинелей. Исключением является образец Fe/МА-S, у которого удельная поверхность заметно больше, чем у исходного носителя.
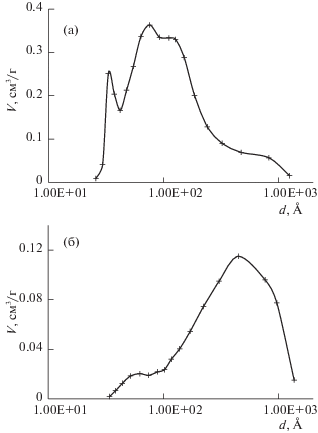
На рис. 1 приведена зависимость объема пор от их диаметра для катализаторов (FeK)/МА-SP и (FeK)/МА-S. Как видно из рис. 1 для образца на основе шпинели МА-SP наблюдается бимодальная зависимость объема пор от диаметра с максимумами при значениях 33 и 75 Ǻ. При этом основной объем пор составляют мезопоры. Для образца на основе шпинели МА-S зависимость имеет практически одномодальный характер с максимумом при 620 Å, при этом вклад мезопор и макропор соизмерим. Для других образцов на основе шпинелей МА-SP и МА-S распределение пор по размерам аналогично системам (FeK)/МА-SP и (FeK)/МА-S соответственно.
Рис. 1.
Зависимость объема пор (V) от диаметра пор (d) для катализатора: (FeK)/МА-SP (а), (FeK)/МА-S (б).
Из данных рентгенофазового анализа катализаторов следует, что основными фазами являются алюмомагниевая шпинель и гематит. В качестве примера на рис. 2 приведены дифрактограммы для образцов Fe/MA-S и Fe/MA-SP. Дифрактограмма образца Fe/MA-S (рис. 2а) образована относительно узкими рефлексами кристаллической фазы, соответствующими алюмомагниевой шпинели (отмечены как Ш) и гематиту (отмечены как О). Дифрактограмма Fe/MA-SP соответствует системе с довольно значительным вкладом аморфной фазы (рис. 2б). Интересно отметить, что несмотря на идентичную методику введения активной фазы в катализатор, в данном случае рефлексы, соответствующие гематиту не прослеживаются. На дифрактограмме присутствуют довольно уширенные пики, соответствующие алюмомагниевой шпинели на фоне аморфной фазы. Этот эффект обусловлен влиянием текстуры носителя на состояние нанесенной фазы; при бимодальном распределении мезопор носителя формируется высокодисперсное распределение оксида железа по поверхности. Полученный результат согласуется с данными работы [10], полученными для модифицированного силикагелем оксида алюминия. Частицы оксида железа при этом достаточно малы, поэтому рефлексы от них сильно уширены. Дифрактограммы катализаторов на основе одной и той же шпинели, как MA-SP, так и MA-S, практически совпадают с приведенными на рис. 2. Рентгенофазовый анализ синтезированных образцов показал отсутствие фаз, содержащих калий, что связано с низкой концентрацией калия в катализаторе и низкой степенью кристалличности.
Рис. 2.
Дифрактограммы РФА: Fe/MA-S (а), и Fe/MA-SР (б): ш – рефлексы шпинели, о – оксида железа (гематит).
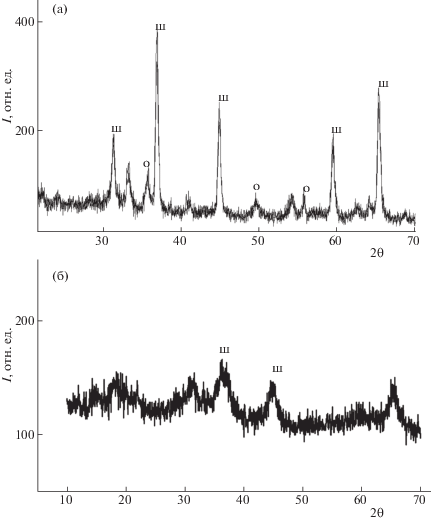
Наряду с определением фазового состава катализаторов на основании результатов РФА (рис. 2а) с использованием уравнения Шеррера [13] оценен средний размер области когерентного рассеяния (ОКР) для гематита в катализаторах на основе шпинели MA-S (табл. 2). В предположении однородных частиц размер ОКР позволяет оценить средний размер частиц. Согласно полученным оценочным данным средний размер частиц гематита для катализатора Fe/MA-S составляет 8 нм и уменьшается в присутствии калия до 6.5 нм для катализатора К/Fe/MA-S.
Монооксид углерода является эффективным спектральным зондом для определения природы центров адсорбции. Использование СО в качестве молекулы-зонда позволяет дифференцировать катионы в различной степени окисления, определять их электроноакцепторные свойства и оценивать их координационное окружение. Кроме того, СО является одним из реагентов в реакции СФТ, поэтому изучение форм адсорбции СО на поверхности наших систем представляет значительный интерес.
Исследование адсорбции монооксида углерода на поверхности представленных образцов проведено методом ИК-спектроскопии диффузного отражения. На рис. 3 и 4 приведены разностные ИК-спектры СО, адсорбированного при комнатной температуре на катализаторах на основе MA-S и МА-SР соответственно. Спектры образованы суперпозицией нескольких полос поглощения (ПП), при этом хорошо различаются две группы перекрывающихся полос поглощения. По данным РФА основной железосодержащей фазой является гематит Fe2O3. Однако, согласно данным литературных источников [14–16], катионы Fe3+ не образуют карбонильных комплексов, так как эти катионы находятся в координационно-насыщенном состоянии и не способны образовывать устойчивых при комнатной температуре комплексов с молекулами со слабыми электроно-донорными свойствами. Поэтому наблюдаемые в высокочастотной области спектра полосы поглощения относят к карбонильным комплексам с катионами Fe2+. Согласно данным [17], уточненным квантово химическими расчетами с помощью метода DFT [18], полосы поглощения при 2185–2188 см–1 и 2175–2180 см–1 (рис. 3а–3г) относятся к адсорбции СО в линейной форме на центрах типа [FeOFe]2+ и [FeO]2+ соответственно. Есть мнение, что при этом ПП 2175 см–1 отвечает дикарбонильной форме адсорбции [14], в то время как авторы [19] полагают наличие трикарбонильной формы адсорбции. Вклад полосы поглощения, соответствующий комплексам СО с изолированными катионами Fe2+ (2205–2218 см–1), незначителен и данная полоса может быть выделена только при малых степенях заполнения поверхности молекулами СО (рис. 3в, 3г спектры 1, рис. 3б спектры 2, 3).
Рис. 3.
Разностные ИК-спектры СО, адсорбированного при комнатной температуре на катализаторах: Fe/MA-S (а), (KFe)/MA-S (б), Fe/K/MA-S (в), K/Fe/MA-S (г). Давление СО: 5 (1), 20 (2), 50 Торр (3); F(R) – функция Кубелки−Мунка.
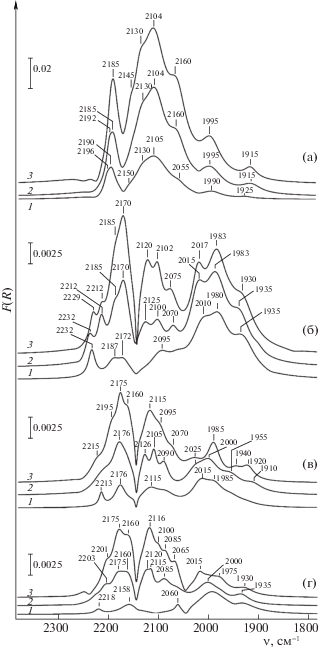
Рис. 4
. Разностные ИК-спектры СО, адсорбированного при комнатной температуре на катализаторах: Fe/MA-SP (а), (KFe)/MA-SP (б), Fe/K/MA-SP (в), K/Fe/MA-SP (г). Давление СО: 5 (1), 20 (2), 50 Торр (3).
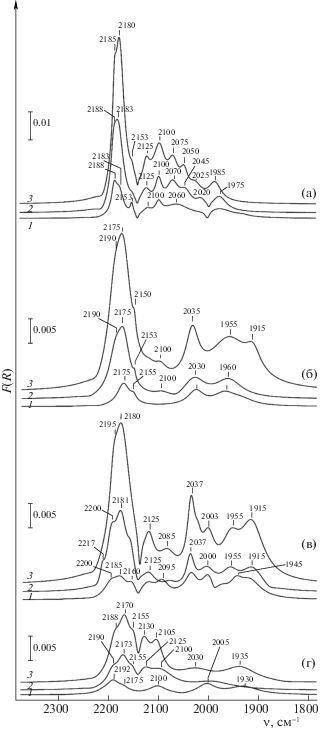
Полоса поглощения при 2150–2160 см–1 (рис. 3в, 3г; рис. 4а–4г) появляется в спектре при взаимодействии железа и алюмосодержащего носителя и соответствует адсорбции СО на катионах Fe2+ на поверхности алюмината железа, образующегося в месте контакта железа и шпинели [17, 20]. Методом изотопного сдвига показано, что данная форма адсорбции соответствует трикарбонилам Fe2+(CO)3 [19].
Наиболее интенсивные ПП в низкочастотной группе полос 2090–2115 см–1 и 2070–2075 см–1 (рис. 3а–3г, спектры 2, 3; рис. 4а–4г) могут быть отнесены к карбонильным комплексам с катионами Fe2+. При этом авторы [20] полагают, что эти две структуры отличаются ближайшим окружением катиона. Так, если ПП при 2070 см–1 соответствует карбонильному комплексу с катионом Fe2+ в окружении атомов металлического железа Fe0 на поверхности частиц металлического железа, то ПП при 2100 см–1 – комплексу с катионом Fe2+, в координационную сферу которого входят атомы кислорода или углерода [20]. Такие центры адсорбции возникают на поверхности оксида или карбида железа и в результате окисления или карбидизации поверхности металлического железа.
Согласно данным [19], малоинтенсивная ПП при 2123–2137 см–1 (рис. 3а, 3б–3г спектры 2, 3; рис. 4а, 4в, 4г) соответствует поликарбонилам. Авторы полагают, что данная ПП отвечает тетракарбонилам на катионах Fe+. Данная степень окисления не характерна для железа, но она может быть стабилизирована карбонильным окружением. Возможность существования карбонильных комплексов с Fe+ не опровергается квантово химическими расчетами [18].
Низкочастотные ПП 2050–2065 и 2000–2015 см–1 (рис. 3б, 3в, 4г; рис. 4а, 4г) соответствуют линейной форме адсорбции СО на атомах металлического железа Fe0, различающихся координационным окружением. Если ПП при 2015 см–1 отвечает карбонильным комплексам на атомах Fe0, находящимся в окружении таких же атомов Fe0, то ПП при 2050 см–1 – комплексу с Fe0, в координационную сферу которого входят атомы кислорода или углерода [20]. Полосы с частотами 1995 см–1 и ниже соответствуют суб-карбонильным формам адсорбции Fe$_{n}^{0}$(CO)m [14].
Мы полагаем, что предшественниками частиц металлического железа являются небольшие, в несколько атомных слоев, островки оксида железа на поверхности шпинели. Формирование частиц металлического железа происходит в результате восстановления оксида железа в процессе термовакуумной обработки или непосредственно в атмосфере СО. Наличие в спектре ПП карбонильных комплексов с катионом Fe2+, в координационную сферу которых входят атомы кислорода (2100 см–1), позволяет рассматривать неполное восстановление оксида железа в этих островках.
Сравнивая спектры для образца Fe/MA-S (рис. 3а) со спектрами промотированных калием образцов можно заметить, что введение калия в состав катализатора приводит к существенному (в 5–7 раз) снижению интенсивности всех полос поглощения для образцов на шпинели MA-S, при этом существенно меняется соотношение их интенсивностей. Так, если для образца Fe/MA-S доминирующей является ПП 2185 см–1, отнесенная нами к карбонильным комплексам с [FeO]2+ (рис. 3а), то для калийсодержащих образцов на той же шпинели центральной полосой является 2175–2180 см–1, относимая нами к комплексам [FeOFe]2+ (рис. 3б–3г). Соответственно, снижается относительный вклад ПП 2100 и 2072 см–1 карбонильных комплексов с катионами Fe2+ на поверхности оксида или металлической фазы и возрастает относительный вклад ПП 2050 и 2015 см–1, соответствующих комплексам с металлическим железом. Одновременно существенно возрастает относительная интенсивность ПП ниже 2000 см–1, соответствующая суб-карбонильным комплексам типа Fe$_{n}^{0}$(CO)m. Такие формы характерны для частиц металлического железа. Для образца (KFe)/MA-S отмечается существенно большая интенсивность полос поглощения при 2020 см–1 и ниже – полос, соответствующих карбонильным комплексам на Fe0 и ПП суб-карбонильных комплексов (рис. 3б).
В группе образцов на основе шпинели MA-SР введение калия также приводит к подавлению высокочастотных полос в спектре, однако, в этом случае оно не столь значительное (в 2–4 раза), как для предыдущей группы. Для калийсодержащих образцов становится заметен вклад полосы поглощения 2200–2215 см–1 (рис. 4б–4г), соответствующий комплексам с изолированными катионами Fe2+. Аналогично наблюдавшемуся эффекту для образцов на MA-S, введение калия подавляет центры адсорбции, связанные с катионами Fe2+ на поверхности оксида или металлической фазы. Однако, интенсивность ПП при 2050 и при 2020 см–1, отвечающих карбонильным комплексам с Fe0 на поверхности металлической фазы и ПП суб-карбонильных комплексов для образцов (KFe)/MA-SР, K/Fe/MA-SР и Fe/K/MA-SР (рис. 4б–4г) возрастает по отношению к образцу Fe/MA-SР (рис. 4а). Для образца K/Fe/MA-SР отмечено существенно большее (в 4 раза) подавление большинства центров адсорбции СО, но при этом интенсивность ПП суб-карбонильных комплексов даже выше, чем для Fe/MA-SР (рис. 4г).
На этом фоне выделяются системы, полученные совместным нанесением компонентов – (KFe)/MA-SР и (KFe)/MA-S. При таком методе нанесения на фоне уменьшения концентрации центров адсорбции, связанных с Fe2+, максимально возрастает относительный вклад центров адсорбции, связанных с металлическим железом (рис. 3б, рис. 4б).
Нанесение компонентов в последовательности “сначала Fe, затем K” приводит к максимальному подавлению центров адсорбции (рис. 3г, рис. 4г). Нанесение в обратной последовательности дает разнонаправленный эффект. Если в системе Fe/K/MA-S (рис. 3в) отмечается подавление центров адсорбции, аналогичное наблюдаемому в системе K/Fe/MA-S (рис. 3г), то для системы Fe/K/MA-SР (рис. 4в) состав и относительные концентрации центров адсорбции близки к системе (KFe)/MA-SР (рис. 4б). Можно предположить, что в данном случае играет роль локальная концентрация калия, на поверхности MA-SР она будет в 10 раз меньше.
Одновременно с появлением полосы поглощения карбонильных комплексов при адсорбции СО появляются новые ПП в области ниже 1700 см–1. Эти ПП характеризуют колебания связей в поверхностных карбонатно-карбоксилатных соединениях, которые формируются в результате реакции адсорбированного на поверхности СО при комнатной температуре (рис. 5). Согласно литературным данным [17], возможно несколько путей образования карбонатоподобных структур на поверхности: через диссоциацию СО на небольших частицах Fe0, через реакцию СО с гидроксильными группами с образованием СО2 [CO + OHads → CO2 + (1/2)H2] или через образование формиата [CO + OHads → HCOOads] [21]. Формирование карбонатов, как правило, не влияет на спектр карбонильных комплексов [17].
Рис. 5
. Разностные ИК-спектры карбонатоподобных структур возникающих в атмосфере СО: а – Fe/MA-S, б – K/Fe/MA-S, в – (FeK)/MA-S, г – Fe/K/MA-S. Давление СО: 50 Торр.

При взаимодействии СО с поверхностью Fe/MA-S (рис. 5а) в спектре появляются ПП 1563 и 1328 см–1, которые могут быть отнесены к бидентатным карбонатам (табл. 3). Введение калия в состав образцов на основе шпинели MA-S способствует значительному увеличению образования карбонатов в атмосфере СО при комнатной температуре. Наибольшая концентрация карбонатов наблюдается на образце (KFe)/MA-S (рис. 5в). Мы полагаем, что основным путем образования карбонатов является образование карбоксилат-иона на частицах металлического железа с последующей его миграцией на поверхность носителя. Образование карбонатоподобных структур происходит с участием основного кислорода на поверхности алюмомагниевой шпинели, табл. 3. В результате этого формируются следующие карбонаты: мондентатный Δν ∼ 150 см–1 и бидентатные карбонаты трех типов, характеризующиеся расщеплением между компонентами: Δν ∼ 290, 370, 420 см–1 (табл. 3). Заметим, что количество типов карбонатоподобных структур и расстояния между компонентами дублета в спектре близки к карбонатам на поверхности MgO [22], что дает нам возможность полагать, что наблюдаемые карбонаты формируются с участием кислорода, входящего в координационную сферу катионов Mg2+. Введение калия способствует повышению окислительной способности катализаторов.
Таблица 3.
Спектральные проявления и типы карбонатных соединений, образующихся на поверхности катализаторов (ν – положение полос дублета, Δν – расщепление)
| Катализатор | ν, см–1 | Δν, см–1 | Интерпретация |
|---|---|---|---|
| Fe/MA-S | 1565, 1320 | 245 | бидентатный |
| 1655, ??? | » | ||
| (KFe)/MA-S | 1595, 1290 | 305 | бидентатный |
| 1640, 1250 | 390 | » | |
| исчезают | |||
| 1485, 1370 | 115 | монодентатный | |
| 1445 | симметричный | ||
| K/Fe/MA-S | 1550, 1390 | 160 | монодентатный |
| 1595, 1300 | 295 | бидентатный | |
| 1620, 1240 | 380 | » | |
| Fe/K/MA-S | 1550, 1400 | 150 | монодентатный |
| 1585, 1300 | 285 | бидентатный | |
| 1620, 1245 | 375 | » | |
| исчезают | |||
| 1475, ??? | ? | монодентатный | |
| 1450 | симметричный | ||
| Fe/MA-SP | 1590, ??? | ? | бидентатный |
| 1650, ??? | ? | » | |
| 1675, ??? | ? | » | |
| исчезают | |||
| 1440, 1385 | 55 | монодентатный | |
| 1525, 1260 | 265 | бидентатный | |
| (FeK)/MA-SP | 1630, 1265 | 365 | бидентатный |
| 1665, 1240 | 425 | » | |
| исчезают | |||
| 1480, 1335 | 144 | монодентатный | |
| K/Fe/MA-SP | 1625, 1250 | 145 | бидентатный |
| 1660, ??? | » | ||
| исчезают | |||
| 1495, 1365 | 130 | монодентатный | |
| ???, 1315 | |||
| Fe/K/MA-S | 1568, ??? | бидентатный | |
| 1615, 1270 | 345 | » | |
| 1655, 1230 | 425 | » | |
| исчезают | |||
| 1495, 1325 | 170 | монодентатный | |
| 1450 | симметричный |
На образцах шпинели MA-SP концентрация карбонатов существенно ниже. Характерной особенностью этих разностных спектров является наличие интенсивных отрицательных пиков в области 1200–1500 см–1 (рис. 6). Это указывает на разложение или эволюцию в атмосфере СО некоторых карбонатоподобных структур, которые были на поверхности после термовакуумной обработки образца. Уменьшается количество преимущественно монодентатных с Δν ∼ 120–170 см–1 и симметричных карбонатов (свободных ионов). Поскольку эти структуры оказались устойчивы в вакууме при 400°С, но изменились при комнатной температуре в атмосфере СО, мы полагаем, что эти структуры не разрушились, а эволюционировали к бидентатным карбонатам с большим расщеплением дублета, вероятно, вследствие уменьшения основности кислорода поверхности при адсорбции СО.
Рис. 6.
Разностные ИК-спектры карбонатоподобных структур возникающих в атмосфере СО: а – Fe/MA-SP, б – K/Fe/MA-SP, в – (FeK)/MA-SP, г – Fe/K/MA-SP. Давление СО 50 Торр.

Резюмируя полученные результаты, следует сделать вывод, что основной фазой в железо-содержащих катализаторах является – гематит, но поскольку адсорбции СО на Fe3+ не происходит, основными центрами адсорбции являются катионы Fe2+ и металлическое железо. Изучены влияние промотирования калием на адсорбционные свойства поверхности и возможные типы адсорбционных центров на катализаторах, различающихся способом введения промотора. Введение калия снижает поверхностную концентрацию кластеров, включающих Fe2+ в различном координационном окружении и, по нашему мнению, способствует укрупнению частиц металлического железа на поверхности. Предположительно, происходит изменение распределения железа от смешанного состояния “кластеры-частицы” к преимущественно частицам металлического железа. Это объясняет увеличение вклада в спектр полос поглощения суб-карбонильных форм адсорбции и снижение количества окисленного железа на поверхности этих металлических частиц. Введение калия способствует повышению окислительной способности поверхности катализаторов и образованию карбонатоподобных структур при комнатной температуре.
Авторы выражают глубокую благодарность проф. Чернавскому П.А. за постоянное внимание к работе и ценные замечания и Малышеву А.A. (г. Гамбург) за любезно предоставленные алюмомагниевые шпинели.
Список литературы
Dry M.E. Studies in Surface Science and Catalysis. Amsterdam: Elsevier, 2004. 533 p.
Chernavskii P.A., Pankina G.V., Lunin V.V. // Catal. Lett. 2000. V. 66. P. 121.
Панкина Г.В., Чернавский П.А., Крылова Ю.А., Лунин В.В. // Кинетика и катализ. 2007. Т. 48. № 4. С. 1.
Chernavskii P.A., Pankina G.V., Kazantsev R.V., Eliseev O.L. // ChemCatChem. 2018. V. 10. P. 1.
Gracia J.M., Prinsloo F.F., Niemantsverdriet J.W. // Catal. Lett. 2009. V. 133. P. 257.
de Smit E., Cinquini F., Beale A.M. et al. // J. Am. Chem. Soc. 2010. V. 132. P. 14928.
Girardon J.-S., Lermontov A.S., Gengembre L. et al. // J. Catal. 2005. V. 230. P. 339.
Jalama K., Coville N.J., Xiong H. et al. //Appl. Catal. A. 2011. V. 395. P. 1.
Панкина Г.В., Чернавский П.А., Лермонтов А.С., Лунин В.В. // Нефтехимия. 2002. Т. 42. № 4. С. 243.
Rahmati M., Huang B., Mortensen M.K. et al. // J. Catal. 2018. V. 359. P. 92.
Barradas S., Caricato E.A., van Berge P.J., van de Loosdrecht J. //Stud. Surf. Sci. Catal. 2000. V. 143. P. 55.
Kolbel H., Ralek M. // Catal. Rev. Eng. 1980. V. 21. P. 225.
Тейлор А. Рентгеновская металлография. М.: Металлургия. 1965. С. 310.
Davydov A. Molecular spectroscopy of oxide catalyst surfaces. Willey, 2003. 668 p.
Angell C., Schaffer P.C. // J. Phys. Chem. 1966. V. 70. P. 1413.
Ballivet-Tkatchenko D., Coudurier G. // Inorg. Chem. 1979. V. 18. P. 558.
Couble J., Bianchi D. // Applied Catalysis A: Gen. 2011. V. 409–410. P. 28.
Fellah M.F. // J. Phys. Chem. C. 2011. V. 115. P. 1940.
Mihaylov M., Ivanova E., Chakarova K. et al. // Appl. Catal. A: Gen. 2011. V. 391. P. 3.
Wielers A.F.H., Kock A.J.H.M., Hop C.E.C.A. et al. // J. Catal. 1989. V. 117. P. l.
Bianchi D., Chafik T., Khalfallah M., Teichner S.J. // Appl. Catal. A: Gen. 1993. V. 105. P. 223.
Давыдов А.А., Шепотько М.Л., Будиева А.А. // Кинетика и катализ. 1994. Т. 35. № 2. С. 299.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


