Журнал физической химии, 2019, T. 93, № 12, стр. 1773-1779
Окислительная деструкция азокрасителей в комбинированных фентон-подобных окислительных системах
М. Р. Сизых a, А. А. Батоева a, *
a Российская академия наук, Сибирское отделение, Байкальский институт природопользования
Улан-Удэ, Россия
* E-mail: abat@binm.ru
Поступила в редакцию 21.12.2018
После доработки 06.03.2019
Принята к публикации 12.03.2019
Аннотация
Изучены кинетические закономерности деструкции красителя метилового оранжевого (МО) под действием персульфата (PS) и квазимонохроматического УФ-излучения (безртутного источника – KrCl-эксилампы, 222 нм, далее – UV) в присутствии и в отсутствие ионов железа. По эффективности и скорости деструкции красителя окислительные системы можно выстроить в следующий ряд: {PS/UV/Fe2+} > {PS/UV} > {PS/Fe2+} > UV > PS. Установлено, что лишь в комбинированной системе {PS/UV/Fe2+} происходит не только полное превращение МО, но и его глубокая минерализация в водном растворе, при этом снижение содержания общего органического углерода достигает 77%. С использованием ингибиторов радикальных реакций доказано, что в комбинированных системах {PS/UV/Fe2+} и {PS/Fe2+} в окислительной деструкции принимают участие как гидроксильные, так и сульфатные анион-радикалы, причем роль сульфатных анион-радикалов является доминирующей. Таким образом, экспериментально подтверждена возможность использования квазимонохроматического УФ-излучения для активации персульфата в процессах окислительной деструкции азокрасителей.
Фотоинициированные комбинированные окислительные процессы (Advanced Oxidation Processes – AOP) являются наиболее эффективными для удаления трудноокисляемых органических соединений из водных растворов и в перспективе должны применяться при разработке инновационных технологий водоочистки [1–3]. В качестве источников УФ-излучения, как правило, используются ртутные лампы. Однако, в связи с общей тенденцией сокращения использования ртути в быту и на производствах, закрепленной в Минаматской конвенции [4], наблюдается рост интереса к разработке современных безртутных источников УФ-излучения и изучению возможности их применения в процессах водоочистки.
В последние годы в качестве источников УФ-излучения все более широкое применение находят современные газоразрядные эксимерные и эксиплексные лампы (эксилампы), работающие на переходах эксимерных (возбужденных димеров инертных газов ${\text{R}}_{2}^{*}$ или галогенов ${\text{X}}_{2}^{*}$) или эксиплексных молекул (возбужденных галогенидов инертных газов RX*) с возбуждением емкостным или барьерным разрядами. Главным отличием эксиламп от других источников спонтанного излучения является их спектр, представляющий собой узкую полосу (не более 10 нм на полувысоте) излучения соответствующей молекулы, в которой сосредоточено 80% и более от общего излучения. Другими достоинствами эксиламп являются большая энергия фотона (3.5–10 эВ), относительно высокая удельная мощность излучения, возможность масштабирования и выбора геометрии излучающей поверхности, безопасность в эксплуатации для оператора (по сравнению, например, с высоковольтными источниками питания лазеров и импульсных ламп), умеренные рабочие температуры [5].
Доказана высокая эффективность применения эксиламп для фотохимического окисления в присутствии пероксида водорода хлорированных фенолов, красителей конго красного, метилового зеленого, 2,4-дифеноксиуксусной кислоты, 5-метоксипсоралена и инактивации микроорганизмов [6–11]. Проведена сравнительная оценка эффективности применения эксиплексных (XeCl и KrCl) и ртутной (254 нм) ламп для обесцвечивания растворов красителей Methylene Blue и Eliamine Blue в присутствии пероксида водорода, с учетом удельного энергопотребления [8]. Наилучшие результаты для красителя Methylene Blue были достигнуты при использовании KrCl-эксилампы, что позволило сделать вывод о том, что она может являться альтернативой ртутным лампам низкого давления, широко применяемым в практике водоочистки. При этом отмечалось, что необходимо учитывать тип красителя, входящего в состав обрабатываемых вод [6].
Все больше исследований направлено на изучение возможности применения комбинированных методов, основанных на формировании в растворе сульфатных анион-радикалов (Sulfate Radical Based Advanced Oxidation Processes – SR-AOPs), для обезвреживания микрополлютантов, содержащихся в сточных водах [12–15]. Имея высокий окислительный потенциал (2.6–3.1 В) сульфатные анион-радикалы, по сравнению с гидроксильными радикалами, менее чувствительны к изменению реакции среды и присутствию анионов, характерных для природных и сточных вод (хлоридам, сульфатам, гидрокарбонатам) [16, 17]. Кроме того, прекурсоры сульфатных анион-радикалов – персульфаты, являются стабильными твердыми веществами, не требующими специальных условий хранения, что обеспечивает простоту и технологичность их применения. Известно [18, 19], что при воздействии ультрафиолетового излучения происходит гомолитический распад персульфатов с образованием двух сульфатных анион-радикалов
(1)
${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{8}^{{2 - }} + h\nu \to {\text{2SO}}_{4}^{{ - \bullet }}.$При реакции сульфатных анион-радикалов с водой, или в щелочных растворах с гидроксид-ионами в растворе могут формироваться также и гидроксильные радикалы
(2)
${\text{SO}}_{4}^{{ - \bullet }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{SO}}_{4}^{{2 - }} + {{{\text{H}}}^{ + }} + {\text{H}}{{{\text{O}}}^{ \bullet }},$(3)
${\text{SO}}_{4}^{{ - \bullet }} + {\text{O}}{{{\text{H}}}^{ - }} \to {\text{SO}}_{4}^{{2 - }} + {\text{H}}{{{\text{O}}}^{ \bullet }}.$Установлено, что для фотоактивации персульфатов наиболее целесообразно и эффективно использовать источники света, излучающие на длинах волн менее 300 нм [20]. Анализ спектров поглощения персульфата калия и спектра излучения KrCl-эксилампы [21, 22] свидетельствует о принципиальной возможности использования данного источника УФ-излучения для реализации SR-AOPs процессов.
Настоящая работа посвящена изучению закономерностей комбинированных процессов фотохимической деструкции азокрасителей с применением KrCl-эксилампы и персульфатов, на примере метилового оранжевого (МО).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
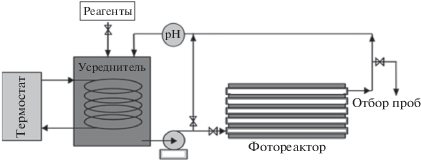
Исследования проводили на растворах красителя метилового оранжевого ([4-(4-диметиламинофенилазо) бензолсульфонат натрия]) с концентрацией 30 мкМ, приготовленных на дистиллированной воде (рН 5.7 ± 0.2). Экспериментальная установка включала последовательно расположенные по направлению движения обрабатываемой воды термостатированную емкость-усреднитель, в которой поддерживалась постоянная температура раствора (25°С), химический перистальтический насос и фотореактор для облучения воды в потоке (рис. 1). Фотореактор состоял из трубчатого реактора (изготовленного из кварцевого стекла) максимально приближенного к источнику излучения – KrCl-эксилампе (λизл = = 222 нм, 23 Вт, KrCl-BD-P model, Институт сильноточной электроники СО РАН, г. Томск) и отражателя. Объем обрабатываемого раствора составлял 0.4 л, скорость циркуляции 0.5 л/мин. Интенсивность поглощенного излучения, измеренная методом химической актинометрии с использованием атразина [23], составила 0.76 мВт/см2.
В работе использовали метиловый оранжевый (МО) (99.9%, Merck, Germany), персульфат калия (>99%, Sigma–Aldrich, USA), сульфат железа (II) (100%, Scharlab, Spain). Для измерения реакции среды применяли портативный прибор Multi 3410 с электродом SenTix®940(WTW). Изменение концентрации красителя в растворе контролировали методом ВЭЖХ (Agilent 1260 Infinity с диодно-матричным УФ-детектором, колонка Zorbax SB-C18 4.6 × 150 мм). Объем пробы 50 мкл, температура 35°С, элюент – ацетонитрил : 75 мМ раствор уксусной кислоты (40 : 60). Скорость потока 0.5 мл/мин. Перед анализом пробы доводили до рН 7–8 0.1% раствором NaOH и фильтровали через мембранные фильтры ФМПТФЭ-0.45 мкм (“Владисарт”).
Степень минерализации органических субстратов оценивали по изменению содержания общего органического углерода (ООУ), определяемого на приборе Shimadzu TOC-L CSN (предел обнаружения 50 мкг/л). Калибровку прибора проводили по стандартным образцам бифталата калия и двууглекислого натрия.
Эффективность процесса окисления оценивали по изменению концентрации МО и растворенного органического углерода (минерализации) в обрабатываемом растворе по формуле:
где Со и Сτ – исходная и в момент времени τ (мин) концентрация МО или растворенного органического углерода, соответственно.Степень обесцвечивания раствора оценивали по изменению оптической плотности, измеренной на характеристической длине волны красителя МО (463 нм) до и после обработки.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Экспериментально установлено, что при прямом фотолизе происходит частичное фотолитическое разложение молекул МО в водном растворе. Однако за 60 мин экспозиции степень превращения красителя не превышала 30%.
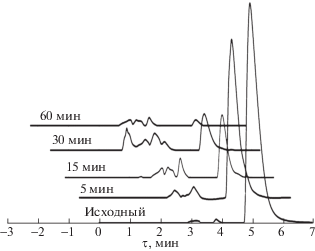
Окисление МО персульфатом калия (PS) происходило медленно. При мольном соотношении [PS] : [MO] = 6 : 1 концентрация красителя снизилась лишь на 12% после 60 минут взаимодействия, а обесцвечивание раствора не наблюдалось. Однако при одновременном воздействии УФ-излучением, т.е. в фотоактивированной окислительной системе (PS/UV) удалось достичь полного превращения красителя через 60 мин обработки. При увеличении концентрации персульфата в два раза произошло резкое увеличение скорости реакции окисления МО, что привело к повышению степени обесцвечивания раствора до 95% и сокращению времени полного превращения красителя в 4 раза (с 60 до 15 мин) (рис. 2, табл. 1). В то же время необходимо отметить, что изменения концентрации растворенного органического углерода – минерализации МО не наблюдалось. Анализ хроматографических данных (рис. 3) позволяет предположить, что при окислении МО активными формами кислорода, образующимися в растворе при фотоактивации персульфата УФ-излучением эксилампы, на первом этапе происходит разрыв азо-связи (–N=N–) и образование окрашенных ароматических нитросоединений. Далее в растворе накапливаются трудноокисляемые и фотоустойчивые продукты реакции.
Рис. 2.
Изменение концентрации красителя метилового оранжевого (1, 2) и обесцвечивание раствора (3, 4) при окислении в системе {PS/UV}; 1, 3 – [PS] = = 180 мкМ; 2, 4 – [PS] = 360 мкМ.
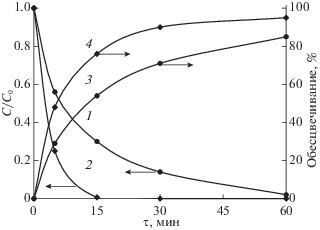
Таблица 1.
Окисление МО в различных окислительных системах
| [PS], мкM | [Fe], мкМ | PS/UV/Fe2+ | PS/Fe2+ | ||||||
|---|---|---|---|---|---|---|---|---|---|
| W0, мкМ/мин | τ1/2, мин | α*, % | Э*, % | W0, мкМ/мин | τ1/2, мин | α*, % | Э*, % | ||
| 180 | 0 | 2.43 | 6.6 | 100 | 85 | 0.06 | >60 | 12 | 0 |
| 360 | 0 | 3.98 | 2.8 | 100 | 95 | 0.09 | >60 | 14 | 0 |
| 180 | 45 | 2.87 | 3.3 | 100 | 92 | 2.51 | 5.0 | 49 | 26 |
| 180 | 90 | 4.20 | 2.3 | 100 | 92 | 2.96 | 3.4 | 63 | 35 |
| 180 | 180 | 4.30 | 2.1 | 100 | 100 | 3.87 | 2.8 | 80 | 51 |
| 180 | 360 | 4.50 | 2.1 | 100 | 98 | 3.20 | 3.1 | 71 | 29 |
| 360 | 180 | 5.10 | 2.0 | 100 | 100 | 4.19 | 2.5 | 85 | 55 |
| 540 | 180 | 5.20 | 2.0 | 100 | 100 | 4.21 | 2.4 | 88 | 63 |
Рис. 3.
Хроматограммы раствора красителя до и после обработки в окислительной системе {PS/UV}; [PS] = = 180 мкМ.
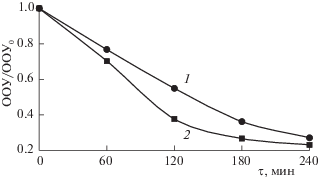
При комбинированной активации персульфата УФ-излучением эксилампы и ионами Fe2+, т.е. в окислительной системе {PS/UV/Fe2+}, наряду с полным окислением МО и обесцвечиванием раствора достигается высокая, до 77%, минерализации органического вещества (рис. 4, 5, табл. 1).
Рис. 4.
Изменение концентраций красителя метилового оранжевого (1–3) и растворенного органического углерода (4–6) в разных окислительных системах: 1, 4 – {PS/UV}; 2, 5 – {PS/Fe2+}; 3, 6 – {PS/UV/Fe2+}. [Fe2+] = 180 мкМ, [PS] : [MO] = 6 : 1.

Рис. 5.
Изменение содержания общего органического углерода в растворе МО при окислении в комбинированной системе {PS/UV/Fe2+}; 1 – [PS] = [Fe] = = 180 мкМ, 2 – [PS] = [Fe] = 360 мкМ.
Fe2+ применяется наиболее часто для активации персульфата [24, 25]. При этом лимитирующими являются реакции (4), (5). В то же время, конкурирующая реакция 6 протекает достаточно быстро, поэтому концентрации Fe2+ и окислителя являются факторами, определяющими эффективность протекания процесса деструкции органических соединений сульфатными анион-радикалами
(4)
$\begin{gathered} {\text{F}}{{{\text{e}}}^{{{\text{2}} + }}} + {{{\text{S}}}_{{\text{2}}}}{\text{O}}_{8}^{{2 - }} \to {\text{SO}}_{4}^{{ - \bullet }} + {\text{SO}}_{4}^{{2 - }} + {\text{F}}{{{\text{e}}}^{{{\text{3}} + }}}, \\ k = {\text{27}}\;{{{\text{М}}}^{{ - {\text{1}}}}}\;{{{\text{с}}}^{{ - {\text{1}}}}}, \\ \end{gathered} $(5)
$\begin{gathered} {\text{F}}{{{\text{e}}}^{{{\text{3}} + }}} + {{{\text{S}}}_{{\text{2}}}}{\text{O}}_{8}^{{2 - }} \to {\text{2SO}}_{4}^{{ - \bullet }} + {\text{F}}{{{\text{e}}}^{{{\text{2}} + }}}, \\ k = {\text{22}}\;{{{\text{М}}}^{{ - {\text{1}}}}}\;{{{\text{с}}}^{{ - {\text{1}}}}}, \\ \end{gathered} $(6)
$\begin{gathered} {\text{F}}{{{\text{e}}}^{{{\text{2}} + }}} + {\text{SO}}_{4}^{{ - \bullet }} \to {\text{SO}}_{4}^{{2 - }} + {\text{F}}{{{\text{e}}}^{{{\text{3}} + }}}, \\ k = {\text{4}}.{\text{6}} \times {\text{1}}{{0}^{{\text{9}}}}\;{{{\text{М}}}^{{ - {\text{1}}}}}\;{{{\text{с}}}^{{ - {\text{1}}}}}. \\ \end{gathered} $Оптимальные условия для деструкции красителя в комбинированной системе {PS/UV/Fe2+} реализуются при мольном соотношении [Fe2+]/[PS] равном 0.5–1 (табл. 1). Дальнейшее увеличение концентрации железа не оказывает существенного влияния на скорость окислительного процесса. Увеличение концентрации персульфата в 3 раза (с 180 мкМ до 540 мкМ) привело к росту начальной скорости реакции окисления красителя в 1.2 раза (с 4.3 до 5.2 мкМ/мин). Однако характер кинетических кривых минерализации органического вещества при увеличении концентрации железа и окислителя меняется незначительно (рис. 5).
Для оценки вклада “Фентон-подобной” окислительной системы {PS/Fe2+} в комбинированный процесс проведены “темновые” эксперименты. Несмотря на достаточно высокую начальную скорость реакции окисления метилового оранжевого в “темновых” экспериментах, цветность раствора, обусловленная присутствием окрашенных продуктов реакции, о наличии которых свидетельствуют данные хроматографического анализа раствора после обработки (рис. 6), оставалась все же достаточно высокой и содержание общего органического углерода в растворе не снизилось (рис. 4). Через 5 минут обработки процесс окисления красителя практически останавливается и степень его превращения не превышает 80% вследствие расходования Fe2+ по реакциям 4, 6 и дезактивации Fe3+ за счет образования гидроксо- и органических комплексов
(7)
${\text{F}}{{{\text{e}}}^{{{\text{3}} + }}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{FeO}}{{{\text{H}}}^{{{\text{2}} + }}} + {{{\text{H}}}^{ + }},$(8)
${\text{F}}{{{\text{e}}}^{{{\text{3}} + }}} + {{({\text{OOCR}})}^{ - }} \to {\text{Fe(OOCR}}{{{\text{)}}}^{{{\text{2}} + }}},$Рис. 6.
Хроматограммы водного раствора красителя МО до и после окисления в системах {PS/Fe2+} (а) и {PS/UV/Fe2+} (б). [PS]= [Fe] = 180 мкМ.
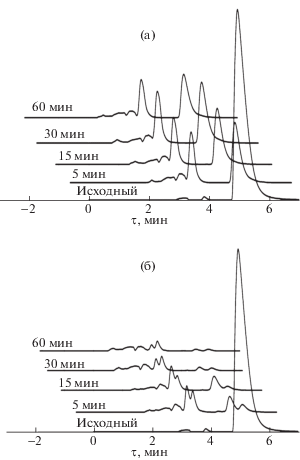
Увеличение концентрации персульфата привело к незначительному росту начальной скорости реакции окисления красителя (с 3.87 до 4.21 мкМ/мин) и эффективности обесцвечивания раствора (на 12%) (табл. 1). Влияние концентрации Fe2+ в “темновых” экспериментах более существенно, при мольном соотношении [Fe]/[PS] > 1 происходит замедление окислительного процесса и снижение степени обесцвечивания раствора. Вероятно, в этом случае реализуются условия для нецелевого расходования образующихся в растворе сульфатных анион-радикалов (реакция 6). Аналогичные результаты были получены исследователями при окислении пропахлора и метилового оранжевого персульфатом, активированным железосодержащими катализаторами и оксидом цинка, соответственно [26, 27].
Для выявления роли сульфатных анион-радикалов при окислительной деструкции красителя метилового оранжевого в комбинированных системах {PS/UV/Fe2+} и {PS/Fe2+} проведены эксперименты с добавлением ингибиторов радикальных реакций – метилового и трет-бутилового спиртов. Константа взаимодействия метанола с гидроксильными радикалами составляет 1.2 × 108–2.8 × 108 л моль–1 c–1, с сульфатными анион-радикалами – 1.6 × 107–7.7 × 107 л моль–1 c–1 [28]. Константа взаимодействия трет-бутанола с ${\text{O}}{{{\text{H}}}^{ \bullet }}$-радикалами составляет 3.8 × 108–7.6 × 108 л ⋅ моль–1 c–1, с ${\text{SO}}_{4}^{{ - \bullet }}$ сульфатными анион-радикалами 4.0 × 105–9.1 × 105 л ⋅ моль–1 c–1 [28]. Таким образом, метанол будет одновременно реагировать как с гидроксильными радикалами, так и сульфатными анион-радикалами, в то время как трет-бутанол в первую очередь с гидроксильными радикалами.
Установлено, что в окислительной системе {PS/Fe2+} при добавлении метанола степень превращения МО снизилась на 28% (с 80% до 52%), начальная скорость реакции окисления красителя уменьшилась в 2.2 раза (с 3.87 до 1.8 мкМ/мин). Добавление трет-бутанола практически не повлияло на эффективность и скорость окисления метилового оранжевого (рис. 7а).
Рис. 7.
Влияние ингибиторов радикальных реакций на окисление красителя МО в комбинированных системах PS/Fe2+ (а) и PS/UV/Fe2+ (б). [PS] = 180 мкМ, [Fe] = 180 мкМ; [MeOH] = [BtOH] = 90 мМ.

В комбинированной окислительной системе {PS/UV/Fe2+} при добавлении метанола начальная скорость реакции окисления красителя снизилась в 1.8 раза (с 4.3 до 2.4 мкМ/мин), а степень превращения метилового оранжевого уменьшилась на 13% после 60 мин обработки (рис. 7б). При добавлении трет-бутанола начальная скорость реакции окисления МО снизилась в 1.1 раза (до 3.84 мкМ/мин), при этом достигнуто полное окисление красителя. Полученные результаты однозначно свидетельствуют о том, что в рассмотренных окислительных системах {PS/UV/Fe2+} и {PS/Fe2+} окисляющими агентами являются как гидроксильные радикалы, так и сульфатные анион-радикалы, однако вклад сульфатных анион-радикалов является доминирующим.
Гипотетическое уравнение реакции полного окисления МО сульфатными анион-радикалами можно представить следующим образом:
(9)
$\begin{gathered} {{{\text{C}}}_{{{\text{14}}}}}{{{\text{H}}}_{{{\text{14}}}}}{{{\text{N}}}_{{\text{3}}}}{\text{S}}{{{\text{O}}}_{{\text{3}}}}{\text{Na}} + {\text{86SO}}_{4}^{{ - \bullet }} + {\text{38}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to \\ \to \;{\text{14C}}{{{\text{O}}}_{{\text{2}}}} + {\text{3NO}}_{3}^{ - } + {\text{87SO}}_{4}^{{2 - }} + {\text{9}}0{{{\text{H}}}^{ + }} + {\text{N}}{{{\text{a}}}^{ + }}. \\ \end{gathered} $Вероятно, при окислении МО в системе {PS/UV/Fe2+} реализуется сопряженный радикально-цепной механизм, включающий процессы активации персульфата Fe2+ и УФ–С излучением (1)–(6), фотовосстановление Fe3+ из гидроксо- и органических комплексов, образование гидроксильных радикалов и других активных форм кислорода [29–31]:
(10)
${\text{FeO}}{{{\text{H}}}^{{{\text{2}} + }}}\;\xrightarrow{{h\nu }}\;{\text{F}}{{{\text{e}}}^{{{\text{2}} + }}} + {{\;}^{ \bullet }}{\text{OH}},$(11)
${\text{Fe(OOCR}}{{{\text{)}}}^{{{\text{2}} + }}}\;\xrightarrow{{h\nu }}\;{\text{F}}{{{\text{e}}}^{{{\text{2}} + }}} + {\text{C}}{{{\text{O}}}_{{\text{2}}}} + {{{\text{R}}}^{ \bullet }},$(12)
$\begin{gathered} {{{\text{S}}}_{{\text{2}}}}{\text{O}}_{8}^{{2 - }} + {\text{SO}}_{4}^{{ - \bullet }} \to {{{\text{S}}}_{{\text{2}}}}{\text{O}}_{8}^{{ - \bullet }} + {\text{SO}}_{4}^{{2 - }}, \\ k = {\text{6}}.{\text{62}} \times {\text{1}}{{0}^{{\text{5}}}}\;{{{\text{М}}}^{{ - {\text{1}}}}}\;{{{\text{с}}}^{{ - {\text{1}}}}}, \\ \end{gathered} $(13)
$\begin{gathered} {\text{SO}}_{4}^{{ - \bullet }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {{\;}^{ \bullet }}{\text{OH}} + {\text{HSO}}_{4}^{ - }, \\ k = 9.4 \times {{10}^{3}}\;{{{\text{М}}}^{{ - 1}}}\;{{{\text{с}}}^{{ - 1}}}, \\ \end{gathered} $(14)
$\begin{gathered} {\text{SO}}_{4}^{{ - \bullet }} + {\text{SO}}_{4}^{{ - \bullet }} \to {{{\text{S}}}_{{\text{2}}}}{\text{O}}_{8}^{{2 - }}, \\ k = {\text{8}}.{\text{1}} \times {\text{1}}{{0}^{{\text{8}}}}\;{{{\text{М}}}^{{ - {\text{1}}}}}\;{{{\text{с}}}^{{ - {\text{1}}}}}, \\ \end{gathered} $(15)
$\begin{gathered} {{{\text{S}}}_{{\text{2}}}}{\text{O}}_{8}^{{2 - }} + {{\;}^{ \bullet }}{\text{OH}} \to {\text{HSO}}_{4}^{ - } + {\text{SO}}_{4}^{{ - \bullet }} + 0.{\text{5}}{{{\text{O}}}_{{\text{2}}}}, \\ k = {\text{1}}.{\text{2}} \times {\text{1}}{{0}^{{\text{7}}}}\;{{{\text{М}}}^{{ - {\text{1}}}}}\;{{{\text{с}}}^{{ - {\mathbf{1}}}}}, \\ \end{gathered} $(16)
$\begin{gathered} {\text{SO}}_{4}^{{ - \bullet }} + {{\;}^{ \bullet }}{\text{OH}} \to {\text{HSO}}_{4}^{ - } + 0.{\text{5}}{{{\text{O}}}_{{\text{2}}}}, \\ k = {\text{1}}.0 \times {\text{1}}{{0}^{{{\text{1}}0}}}\;{{{\text{М}}}^{{ - {\text{1}}}}}\;{{{\text{с}}}^{{ - {\text{1}}}}}. \\ \end{gathered} $Таким образом, по эффективности окислительной деструкции красителя метилового оранжевого рассмотренные окислительные системы могут быть расположены в следующий ряд: {PS/UV/Fe2+} > {PS/UV} > {PS/Fe2+} > UV > PS. Однако лишь в комбинированной фотокаталитической системе {PS/UV/Fe2+} происходит существенное снижение содержания общего органического углерода в растворе. Это является неоспоримым преимуществом системы {PS/UV/Fe2+} и свидетельствует о перспективности ее применения в процессах очистки сточных вод от трудноокисляемых органических соединений, в частности от азокрасителей.
Работа выполнена в рамках государственного задания БИП СО РАН № 0339-2016-0005.
Список литературы
Serpone N., Artemev Y.M., Ryabchuk V.K. et al. // Current Opinion in Green and Sustainable Chemistry. 2017. V. 6. P. 33.
Miklos D.B., Remy Ch., Jekel M. et al. // Water Res. 2018. V. 139. P. 118.
Wang W.-L., Wu Q.-Y., Huang N. et al. // Water Res. 2018. V. 141. P. 105.
MinamataConventiononMercury. [Электронный ресурс] – Режим доступа: URL: http://www.mercuryconvention.org/Convention/tabid/3426/language/en-US/Default.aspx – Загл.сэкрана. – Яз. англ.
Бойченко А.М., Ломаев М.И., Панченко А.Н. и др. Ультрафиолетовые и вакуумно-ультрафиолетовые эксилампы: физика, техника и применения. Томск: STT, 2011. 512 с.
Murcia M.D., Vershinin N.O., Briantceva N. // Chem. Eng. J. 2015. V. 266. P. 356.
Kang J.-W., Kim S.-S., Kang D.-H. // Food Res. Inter. V. 109. P. 325.
Aristizábal A., Perilla G., Lara-Borrero J.A., Diez R. // Environ. Technol. 2018. https://doi.org/10.1080/09593330.2018.1494755
Gomez M., Murcia M.D., Gomez J.L. et al. // Chem. Eng. Process. 2010. V. 49. P. 113.
Matafonova G., Batoev V. // Chemosphere. 2012. V. 89. P. 637.
Tchaikovskaya O.N., Bryantseva N.G., Carrasco J.L.G. et al. // Russ. Phys. J. 2016. V. 59. P. 552. https://doi.org/10.1007/s11182-016-0805-9
Wang J., Wang Sh. // Chem. Eng. J. 2018. V. 334. P. 1502.
Wacławek S., Lutze H.V., Grübel K. et al. // Chem. Eng. J. 2017. V. 330. P. 44.
Khandarkhaeva M., Batoeva A., Aseev D. et al. // Ecotoxicol. and Environ. Safety. 2017. V. 137. № 3. P. 35.
Aseev D.G., Sizykh M.R., Batoeva A.A. // Russ. J. of Phys. Chem. A. 2017. V. 91. P. 2327.
Tsitonaki A., Petry B., Crimi M. et al. // Crit. Rev. Environ. Sci. Technol. 2010. V. 40. № 1. P. 55.
Khandarkhaeva M., Aseev D., Sizykh M.R., Batoeva A.A. // Russ. J. of Phys. Chem. A. 2016. V. 90. № 11. P. 2177.
Herrmann H. // Phys. Chem. Chem. Phys. 2007. V. 9. P. 3935.
Criquet J., Karpel N., Leitner V. // Chemosphere. 2009. V. 77. P. 194.
Shih Y.-J., Putra W.N., Huang Y.-H., Tsai J.-Ch. // Chemosphere. 2012. V. 89. P. 1262.
Anipsitakis G.P., Dionysiou D.D. // Appl. Catal., B: Environ. 2004. V. 54. P. 155.
Sosnin E.A, Oppenländer T., Tarasenko V.F. // J. Photochem. Photobiol., C: Photochem. Rev. 2006. V. 7. P. 145.
Canonica S., Meunier L., Gunten U. // Water Res. 2008. V. 42. P. 121.
Epold I., Trapido M., Dulova N. // Chem. Eng. J. 2015. V. 279. P. 452.
Ji Y., Ferronato C., Salvador A. et al. // Sci. Total Environ. 2014. V. 472. P. 800.
Liu C.S., Shih K., Sun C.X., WangF. // Sci. Total Environ. 2012. V. 416. P. 507.
Li H., Guo J., Yang L., Lan Y. // Sep. Purif. Technol. 2014. V. 132. P. 168.
Liang H.Y., Zhang Y.-G., Huang S.-B., Hussain I. // Chem. Eng. J. 2013. V. 218. P. 384.
Kusic H., Peternel I., Ukic S. et al. // Chem. Eng. J. 2011. V. 172. P. 109.
Brillas E., Martínez C.A. // Appl. Catal. B: Environ. 2015. V. 166–167. P. 603.
Moreira F.C., Garcia-Segura S., Vilar V.J.P. et al. // Appl. Catal. B Environ. 2013. V. 142–143. P. 877.
Ahmed M.M., Chiron S. // Water Res. 2014. V. 48. P. 229.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии