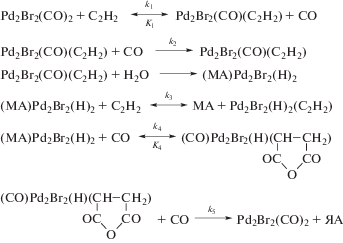Журнал физической химии, 2019, T. 93, № 2, стр. 199-207
Состояние комплексов палладия в каталитической системе PdBr2–LiBr–CH3CN–H2O, используемой для получения янтарного ангидрида
А. Ю. Путин a, *, Е. А. Кацман a, Л. Г. Брук a
a Московский технологический университет
Москва, Россия
* E-mail: putinalekse@yandex.ru
Поступила в редакцию 20.02.2018
Аннотация
Методами UV-Vis-спектроскопии исследована система PdBr2–LiBr–CH3CN при различных концентрациях бромидов палладия и лития. Проведена математическая обработка полученных данных с использованием гипотез, включающих образование мономерных и димерных комплексов палладия. Вычислены константы равновесия стадий комплексообразования мономеров и димеров, а также коэффициенты экстинкции комплексов палладия. В рамках модели, учитывающей образование четырех мономерных и трех димерных комплексов, восстановлены спектры индивидуальных мономерных и димерных комплексов палладия. Методами UV-Vis и инфракрасной спектроскопии изучено состояние комплексов палладия в системе PdBr2–LiBr–CH3CN после контакта с СО и непосредственно в ходе процесса карбонилирования ацетилена в янтарный ангидрид.
Янтарный ангидрид – продукт органического синтеза, имеющий применение в промышленности и медицине. Его используют для получения различных медицинских, фармацевтических препаратов (в том числе витаминов А, В6 и Е); как интермедиат при производстве инсектицидов, агрохимикатов, красителей, эфиров янтарной кислоты, поверхностно-активных веществ; в качестве сшивающего агента при получении ионоактивных мембран, отвердитель эпоксидных смол; как модификатор крахмала [1].
Ранее был разработан способ получения янтарного ангидрида (ЯА) карбонилированием ацетилена в каталитической системе PdHal2–MHal, где Hal–Br или J; M–Li или Na, растворенной в органическом растворителе (ацетон, ацетонитрил, бензонитрил, ацетилацетон, метилбутилкетон, метилэтилкетон) [2].
В работах [3, 4] исследована кинетика и предложен механизм карбонилирования ацетилена в каталитической системе PdBr2–LiBr–CH3CN–H2O. Наиболее вероятный механизм процесса представлен на схеме 1 [3]. Малеиновый ангидрид образуется по механизму, включающему внедрение ацетилена и монооксида углерода по связи Pd–Pd карбонильного кластера Pd(I). Получение янтарного ангидрида идет через образование малеинового ангидрида, координированного гидридным комплексом палладия [3].
Однако, оставалось неизвестным распределение комплексов палладия в исходном растворе и изменения в этом распределении при протекании процесса. Ответы на эти вопросы очень важны для углубления представлений о механизме этого сопряженного процесса.
В связи с этим в данной работе проведено систематическое изучение состояния комплексов палладия в модельных системах PdBr2–LiBr–CH3CN, PdBr2–LiBr–CH3CN + СО и в реакционной системе PdBr2–LiBr–CH3CN–H2O + СО, С2Н2 методами UV–Vis и инфракрасной спектроскопии. Информация о равновесии комплексообразования палладия позволит уточнить механизм этого процесса (cхема 1).
Комплексообразование Pd(II) с галогенидами щелочных металлов в водных растворах изучено достаточно подробно. Установлено образование комплексов PdX$_{n}^{{2 - n}}$ в водных растворах солей Pd(II) в присутствии галогенид-ионов (n = 1–4). Определены общие и ступенчатые константы устойчивости этих комплексов [5–21].
В водных растворах PdBr$_{4}^{{2 - }}$ происходит замещение ионов Br– водой, причем в равновесии находится набор аквакомплексов состава [PdBrn(H2O)4 – n]2 – n, где n = 1–4 [22, 23]. В работах [14, 21] были проведены количественная обработка данных по равновесию образования данных комплексов (вычисление констант устойчивости и коэффициентов экстинкции) и восстановление спектров индивидуальных комплексов палладия по вычисленным коэффициентам экстинкции [14, 21].
В органических растворителях получены, в основном, качественные результаты о состоянии комплексов палладия. Авторы [24, 25] полагают, что в системе PdBr2–LiBr–н-С4H9OH присутствуют комплексы PdBr$_{3}^{ - }$ и PdBr$_{4}^{{2 - }}$. Имеются предложения о возможности образования димерных галогенидных комплексов палладия [26–30].
В работе [30] исследована система PdCl2–LiCl–CH3CN. Установлено, что хлорид палладия в растворе существует в виде двуядерного комплекса с мостиковыми атомами хлора. Это было доказано результатами измерения спектра комбинационного рассеяния света в области 400–200 см–1. В спектре ацетонитрильного раствора хлорида палладия ([PdCl2] = 0.01 M) зафиксированы полосы с частотой 380–350 см–1, соответствующие валентным колебаниям концевой группы Pd–Cl, а также полосы с частотой 310–300 см–1, 270–250 см–1, соответствующие валентным колебаниям мостиковой группы Pd–Cl [30]. В присутствии ионов хлора разрушению двуядерного комплекса предшествует процесс комплексообразования с хлорид-ионом [30]. Таким образом показано, что в этой системе могут присутствовать димерные комплексы палладия Pd2Cl2(CH3CN)$_{4}^{{2 + }}$, Pd2Cl4(CH3CN)2, Pd2Cl$_{6}^{{2 - }}$ [30].
Количественное исследование равновесия комплексообразования в системе PdBr2–LiBr–ТГФ методом UV–Vis-спектроскопии проведено нами в работе [31]. Для математической обработки полученных данных использованы различные модели (табл. 1). Наилучшее описание равновесий получено в рамках модели, учитывающей образование четырех мономерных (PdBr+, PdBr2, PdBr$_{3}^{ - }$, PdBr$_{4}^{{2 - }}$) итрех димерных (Pd2Br$_{2}^{{2 + }}$, Pd2Br4, Pd2Br$_{6}^{{2 - }}$) комплексов палладия (табл. 1, стадии 2, 3, 4, 5, 6). По результатам расчетов при [PdBr2]Σ = = 0.005 M и [LiBr] ~ 0.048 М), преобладают комплексы PdBr+ (∼1.94 × 10–3 моль/л), PdBr2 (∼1.40 × 10–3 моль/л) [31]. Полученные результаты показывают, что в исходной каталитической системе PdBr2–CuBr2–ТГФ, используемой в сопряженном процессе гидрокарбоксилирования алкенов [32, 33], преобладающие комплексы палладия – это PdBr+ и PdBr2.
Таблица 1.
Рассмотренные модели комплексообразования
| Стадии комплексообразования | Модели комплексообразования |
|---|---|
| (1) Pd2+ + Br– ⇆ PdBr+ | “0, 1, 2, 3, 4”* – стадии 1, 2, 3, 4 |
| (2) PdBr+ + Br– ⇆ PdBr2 | “1, 2, 3, 4” – стадии 2, 3, 4 |
| (3) PdBr2 + Br– ⇆ PdBr$_{3}^{ - }$ | “2, 3, 4” – стадии 3, 4 |
| (4) PdBr$_{3}^{ - }$ + Br– ⇆ PdBr$_{4}^{{2 - }}$ | “3, 4” – стадия 4 |
| (5) 2PdBr$_{3}^{ - }$ ⇆ Pd2Br$_{6}^{{2 - }}$ | Модель с Pd2Br$_{6}^{{2 - }}$ – стадии 2, 3, 4, 5 |
| (6) PdBr2 ⇆ Pd2Br4 | Модель с Pd2Br4 – стадии 2, 3, 4, 6 |
| (7) 2PdBr+ ⇆ Pd2Br$_{2}^{{2 + }}$ | Модель с Pd2Br4, Pd2Br$_{6}^{{2 - }}$ стадии 2, 3, 4, 5, 6 |
| Модель с Pd2Br$_{2}^{{2 + }}$, Pd2Br4, Pd2Br$_{6}^{{2 - }}$ стадии 2, 3, 4, 5, 6, 7 |
Данная статья содержит результаты количественного исследования комплексообразования в исходной каталитической системе карбонилирования ацетилена PdBr2–LiBr–CH3CN, а также информацию о состоянии комплексов палладия в этой системе после контакта с СО и в ходе процесса карбонилирования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали: PdBr2 – дибромид палладия, квалификации “ч”, LiBr – бромид лития, квалификации “х. ч.”, ацетонитрил, квалификации “HPLC” 99.9% (“Lab-scan analytical sciences”, Польша).
Исследуемые растворы готовили следующим образом. Необходимые навески бромида палладия и предварительно осушенного бромида лития загружали в колбу, затем добавляли необходимый объем ацетонитрила, далее содержимое в закрытой колбе тщательно перемешивали около 30 мин до полного растворения веществ. Готовили две серии растворов с концентрациями бромида палладия 5 × 10–3 и 5 × 10–4 моль/л. Концентрацию бромида лития варьировали. Содержание воды в растворах не превышало ∼0.2 мас. %
Изучение растворов методом UV–Vis-спектроскопии проводили с помощью спектрофотометра Specord M-40. Спектры регистрировали относительно растворителя (ацетонитрила) при температуре 23 ± 2°С в кварцевых кюветах толщиной 0.01 см и 0.5 см. Погрешность измерения оптического поглощения составляет ±5%.
Математическую обработку спектральных данных (вычисление констант равновесия стадий комплексообразования мономеров и димеризации, коэффициентов экстинкции соответствующих комплексов) проводили с использованием пакета программ “Кинетика” [31, 34].
Для количественной оценки и сравнения качества моделей для каждой из них определены среднеквадратичные относительные погрешности описания результатов экспериментов, вычисленные с помощью пакета программ “Кинетика” [31, 34]
(1)
$\sigma = \sqrt {\frac{1}{N}\sum\limits_{i = 1}^N {{{{\left( {\frac{{{{A}_{{i{\text{э }}}}} - {{A}_{{i{\text{р }}}}}}}{{{{A}_{{i{\text{э }}}}}}}} \right)}}^{2}}} } \times 100\% ,$Эксперименты (с модельными и реакционными системами), в которых изучаемые растворы продували газами, проводили в проточном по газу термостатируемом реакторе с интенсивным перемешиванием газовой и жидкой фаз. Определенные навески веществ загружали в реактор, добавляли необходимый объем растворителя. Полученную смесь перемешивали в течение 15–20 мин. Далее реактор продували газами без перемешивания около 20 минут. За момент начала опыта принимали включение перемешивания во время продувки газами реактора с раствором. В ходе спектральных экспериментов отбирали несколько проб жидкой фазы для регистрации электронных и инфракрасных спектров.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Равновесие комплексообразования в системе PdBr2–LiBr–CH3CN
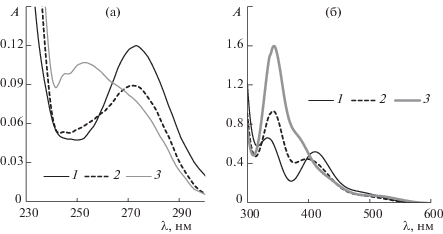
Систему PdBr2–LiBr–CH3CN ([PdBr2] = 5 × × 10–3 М) изучали при варьировании концентрации LiBr (от 0.01 до 2.6 М). С увеличением концентрации бромид-иона возрастает интенсивность полос поглощения в электронном спектре с максимумами при 253 и 340 нм (рис. 1). При увеличении [LiBr] происходит смещение полос поглощения в районе 340 нм (от 327 до 342 нм), и в районе 400–410 нм (от 410 до 400 нм).
Рис. 1.
Электронные спектры поглощения растворов PdBr2, LiBr в ацетонитриле ([PdBr2]Σ = 5 × 10–3 M). Толщина кюветы 0.01 см; [LiBr] = 0.01 M (1), 0.04 M (2), 0.15 М (3), 0.3 М (4), 0.54 М (5), 0.76 М (6), 1.04 М (7), 1.61 М (8), 2.6 М (9).

Для более широкого изменения состава комплексов сняты спектры поглощения трех растворов системы PdBr2–LiBr–CH3CN при [PdBr2]Σ = = 5 × 10–4 M при концентрациях бромида лития 0.014, 0.108 и 0.93 М (рис. 2а, 2б). Спектры поглощения регистрировали с использованием двух кварцевых кювет (толщиной 0.01, 0.5 см). Растворы имели оранжево-коричневый цвет, при этом с увеличением концентрации бромида лития в цвете раствора увеличивался оранжевый оттенок.
Рис. 2.
Электронные спектры поглощения системы PdBr2–LiBr–CH3CN при [PdBr2]Σ = 5 × 10–4 M. Ширина кюветы: 0.01 cм (а), 0.5 см (б); [LiBr] = 0.014 М (1), 0.108 М (2), 0.930 М (3).
Были рассмотрены различные модели комплексообразования в системе PdBr2–LiBr–CH3CN (табл. 1). Расчет констант равновесия стадий и коэффициентов экстинкции комплексов проводили с использованием экспериментальных данных (растворы с [PdBr2]Σ = 5 × 10–3 M – девять экспериментальных точек, рис. 1) и с [PdBr2]Σ = 5 × 10–4 M – 3 экспериментальные точки, рис. 2а, 2б). Одной экспериментальной точкой мы называем измеренное при выбранных пяти длинах волн оптическое поглощение ацетонитрильного раствора определенного состава.
С помощью пакета программ “Кинетика” [31, 34] с использованием экспериментальных данных (рис. 1, 2а, 2б) были вычислены константы равновесия соответствующих стадий и коэффициенты экстинкции отдельных комплексов при пяти длинах волн (253, 272, 340, 385, 410 нм). Верхний предел значений коэффициентов экстинкции полагали равным 1.5 × 105 л моль–1 см–1, так как в соответствии с положениями квантовой теории, значение ε не должно превышать 1.5 × × 105 л моль–1 см–1 [35].
В табл. 2 приведены среднеквадратичные погрешности описания результатов экспериментов для моделей, учитывающих образование мономерных и димерных комплексов. Все значения лежат в пределах погрешности эксперимента (<5%), таким образом все рассмотренные модели удовлетворительно описывают экспериментальные данные.
Таблица 2.
Среднеквадратичные погрешности описания результатов экспериментов для моделей, учитывающих образование мономерных и димерных комплексов
| Модель | “3,4” | “2,3,4” | “1,2,3,4” | “0,1,2,3,4” |
|---|---|---|---|---|
| Погрешность | 4.78% | 4.51% | 3.71% | 3.39% |
| Модель | с Pd2Br$_{6}^{{2 - }}$ | с Pd2Br4 | с Pd2Br4, Pd2Br$_{6}^{{2 - }}$ | с Pd2Br$_{2}^{{2 + }}$, Pd2Br4, Pd2Br$_{6}^{{2 - }}$ |
| Погрешность, % | 3.25% | 3.57% | 2.99% | 2.76% |
Исходя из литературных данных по системе PdCl2–LiCl–CH3CN [30] и величины среднеквадратичной погрешности описания результатов экспериментов (табл. 2), модель, учитывающая образование трех димерных комплексов Pd2Br$_{2}^{{2 + }}$, Pd2Br4, Pd2Br$_{6}^{{2 - }}$, предпочтительнее остальных для описания равновесия комплексообразования в системе PdBr2–LiBr–CH3CN.
В соответствии с этой моделью в системе присутствуют комплексы: Pd2Br$_{2}^{{2 + }}$, Pd2Br4, Pd2Br$_{6}^{{2 - }}$, PdBr+, PdBr2, PdBr$_{3}^{ - }$ и PdBr$_{4}^{{2 - }}$. Комплексообразование можно описать стадиями 2, 3, 4, 5, 6, 7 (табл. 2).
Десятичные логарифмы констант равновесия стадий 2, 3, 4, 5, 6, 7 (lg K2, lg K3, lg K4, lg K5, lg K6, lg K7) соответственно равны: 0.266 ± 0.397, 2.194 ± ± 0.147, 0.662 ± 0.088, 1.846 ± 0.692, 5.759, 2.465 ± ± 0.500. Точность определения константы образования димера Pd2Br4 (табл. 1, стадия 6) оценить не удалось, так как рассчитанная концентрация PdBr2 незначительна (близка к 0) на всем интервале [LiBr].
На рис. 3 и в табл. 3 приведены зависимости экспериментальных и расчетных величин оптического поглощения растворов в зависимости от концентрации бромида лития при пяти длинах волн и концентрациях [PdBr2]Σ = 5 × 10–3 M, [PdBr2]Σ = 5 × 10–4 M.
Рис. 3.
Зависимости экспериментальных и рассчитанных по модели, учитывающей образование Pd2Br$_{2}^{{2 + }}$, Pd2Br4 и Pd2Br$_{6}^{{2 - }}$, величин оптического поглощения растворов в зависимости от концентрации бромида лития на длинах волн 253, 272, 340 нм (а) и 385, 410 нм (б) ([PdBr2]Σ = 5 × 10–3 M): 253 нм (эксп.) – 1,1; 253 нм (расч.) – 1,2; 272 нм (эксп.) – 2,1; 272 нм (расч.) – 2,2; 340 нм (эксп.) – 3,1; 340 нм (расч.) – 3,2; 385 нм (эксп.) – 4,1; 385 нм (расч.) – 4,2; 410 нм (эксп.) – 5,1; 410 нм (расч.) – 5,2.
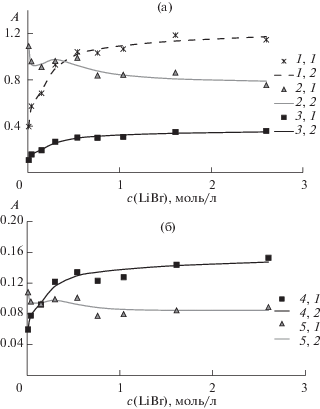
Таблица 3.
Экспериментальные и рассчитанные по модели, учитывающей образование Pd2Br$_{2}^{{2 + }}$, Pd2Br4 и Pd2Br$_{6}^{{2 - }}$, величины оптического поглощения растворов в зависимости от концентрации бромида лития, [PdBr2]Σ = 5 × 10–4 M (l – длина кюветы)
| l, см | λ, нм | С(LiBr), моль/л | ||
|---|---|---|---|---|
| 0.014 | 0.108 | 0.93 | ||
| Оптическое поглощение, А | ||||
| 0.01 | 253 (эксп) | 0.0486 | 0.0603 | 0.1069 |
| 253 (расч) | 0.0492 | 0.0602 | 0.1032 | |
| 0.01 | 272 (эксп) | 0.1187 | 0.0910 | 0.0797 |
| 272 (расч) | 0.1199 | 0.0913 | 0.0799 | |
| 0.5 | 340 (эксп) | 0.6234 | 0.9307 | 1.5706 |
| 340 (расч) | 0.6233 | 0.9311 | 1.5470 | |
| 0.5 | 385 (эксп) | 0.3080 | 0.4213 | 0.6631 |
| 385 (расч) | 0.3080 | 0.4215 | 0.6500 | |
| 0.5 | 410 (эксп) | 0.5188 | 0.4173 | 0.3907 |
| 410 (расч) | 0.5190 | 0.4173 | 0.3880 | |
В табл. 4 представлены десятичные логарифмы коэффициентов экстинкции lg ε (ε, л моль–1 см–1) отдельных комплексов.
Таблица 4.
Десятичные логарифмы коэффициентов экстинкции (lg ε) отдельных комплексов в модели, учитывающей образование Pd2Br$_{2}^{{2 + }}$, Pd2Br4 и Pd2Br$_{6}^{{2 - }}$
| λ, нм | PdBr+ | PdBr2 | PdBr$_{3}^{ - }$ | PdBr$_{4}^{{2 - }}$ | Pd2Br$_{2}^{{2 + }}$ | Pd2Br4 | Pd2Br$_{6}^{{2 - }}$ |
|---|---|---|---|---|---|---|---|
| 253 | 3.975 ± 0.141 | 4.972 ± 0.323 | – | 4.401 ± 0.012 | – | 4.377 ± 0.052 | 5.176 ± 0.559 |
| 272 | 4.432 ± 0.083 | – | 4.256 ± 0.080 | 4.186 ± 0.014 | 4.666 ± 0.080 | 4.523 ± 0.043 | 5.120 ± 0.552 |
| 340 | 3.212 ± 0.218 | 4.682 ± 0.186 | – | 3.877 ± 0.013 | 3.074 ± 0.359 | 3.784 ± 0.043 | 4.557 ± 0.540 |
| 385 | 2.898 ± 0.233 | 4.311 ± 0.204 | – | 3.500 ± 0.014 | 3.170 ± 0.246 | 3.499 ± 0.055 | 4.268 ± 0.556 |
| 410 | 3.245 ± 0.114 | 4.196 ± 0.310 | 2.682 ± 0.397 | 3.244 ± 0.034 | 3.748 ± 0.086 | 3.543 ± 0.057 | 4.291 ± 0.595 |
На рис. 4 представлены кривые распределения концентраций соответствующих комплексов при варьировании [LiBr] и [PdBr2]Σ = 5 × 10–3 M. В табл. 5 указаны концентрации комплексов при [PdBr2]Σ = 5 × 10–4 M и трех концентрациях бромида лития.
Рис. 4.
Кривые распределения концентраций комплексов в модели, учитывающей образование Pd2Br$_{2}^{{2 + }}$, Pd2Br4 и Pd2Br$_{6}^{{2 - }}$ ([PdBr2]Σ = 5 × 10–3 M). Комплексы: Pd2Br$_{2}^{{2 + }}$ (1), Pd2Br4 (2), Pd2Br$_{6}^{{2 - }}$ (3), PdBr+ (4), PdBr2 (5), PdBr$_{3}^{ - }$ (6), PdBr$_{4}^{{2 - }}$ (7).

Таблица 5.
Распределение концентраций комплексов в модели, учитывающей образование Pd2Br$_{2}^{{2 + }}$, Pd2Br4 и Pd2Br$_{6}^{{2 - }}$ ([PdBr2]Σ = 5 × 10–4 M)
| Комплекс | с(LiBr), моль/л | ||
|---|---|---|---|
| 0.014 | 0.108 | 0.93 | |
| Концентрации комплексов, моль/л | |||
| Pd2Br$_{2}^{{2 + }}$ | 3.07 × 10–5 | 0 | 0 |
| Pd2Br4 | 4.25 × 10–5 | 7.20 × 10–5 | 0 |
| Pd2Br$_{6}^{{2 - }}$ | 0 | 2.49 × 10–6 | 0 |
| PdBr+ | 3.24 × 10–4 | 5.64 × 10–5 | 0 |
| PdBr2 | 8.59 × 10–6 | 1.12 × 10–5 | 0 |
| PdBr$_{3}^{ - }$ | 1.93 × 10–5 | 1.88 × 10–4 | 9.43 × 10–5 |
| PdBr$_{4}^{{2 - }}$ | 1.28 × 10–6 | 9.33 × 10–5 | 4.03 × 10–4 |
Концентрации комплексов Pd2Br$_{2}^{{2 + }}$, PdBr+ уменьшается с увеличением [LiBr]. Кривые распределения комплексов Pd2Br4, Pd2Br$_{6}^{{2 - }}$, PdBr2, PdBr$_{3}^{ - }$ имеют максимум. Содержание комплексов PdBr2 и Pd2Br$_{6}^{{2 - }}$ незначительно на всем интервале [LiBr], что объясняет полученные большие значения коэффициентов экстинкции для этих комплексов (табл. 4). Концентрация PdBr$_{4}^{{2 - }}$ увеличивается с ростом [LiBr].
Для данной модели, предполагающей наличие трех димерных комплексов, были построены электронные спектры для индивидуальных соединений. С помощью пакета программ “Кинетика” [34], используя найденные константы равновесия стадий комплексообразования, были вычислены коэффициенты экстинкции комплексов при длинах волн в интервале от 230 до 470 нм. Полученные электронные спектры комплексов приведены на рис. 5.
Рис. 5.
Электронные спектры комплексов PdBr+ (1), PdBr$_{3}^{ - }$ (2), PdBr$_{4}^{{2 - }}$ (3), Pd2Br$_{2}^{{2 + }}$ (4), Pd2Br4 (5).

Электронный спектр PdBr+ имеет полосы поглощения с максимумом при 273 нм (27290 М–1 см–1), плечо небольшой интенсивности в районе 336 нм (1858 М–1 см–1) и слабую полосу поглощения с максимумом при 410 нм (1754 М–1 см–1).
В электронном спектре комплекса Pd2Br$_{2}^{{2 + }}$ присутствуют полосы поглощения с максимумами при 239 нм (12720 М–1 см–1), 276 нм (48070 М–1 см–1), 413 нм (5794 М–1 см–1), а также плечо в районе 327 нм (5437 М–1 см–1).
В электронном спектре комплекса Pd2Br4 присутствуют полосы поглощения с плечом в районе 247 нм (22130 М–1 см–1) и с максимумами при 272 нм (33360 М–1 см–1), 340 нм (6076 М–1 см–1), 400 нм (3525 М–1 см–1).
Электронный спектр PdBr$_{3}^{ - }$ имеет полосу поглощения с максимумом при 273 нм (18220 М–1 см–1).
Электронный спектр комплекса PdBr$_{4}^{{2 - }}$ имеет интенсивную широкую полосу поглощения с максимумом при 253 нм (22050 М–1 см–1) и полосу поглощения с максимумом при 342 нм (7630 М–1 см–1).
Электронные спектры комплексов PdBr2 и Pd2Br$_{6}^{{2 - }}$ восстановить не удалось из-за очень низких концентраций этих соединений, полученных в результате расчета.
Система PdBr2–LiBr–CH3CN до и после продувки СО
Инфракрасная спектроскопия (рис. 6). Во время продувки реактора с раствором монооксидом углерода цвет раствора приобретает светло-желтую окраску. После 15 минут продувки монооксидом углерода системы PdBr2–LiBr–CH3CN в ИК-спектре зарегистрирована полоса поглощения при 2120 см–1, соответствующая терминальной карбонильной группе, а после часа контакта с СО появляется полоса поглощения при ∼1908 см–1, соответствующая мостиковой карбонильной группе. Таким, образом в системе PdBr2–LiBr–CH3CN присутствуют карбонильные комплексы палладия(II) и палладия(I). Кроме того, в ИК-спектрах, полученных после контакта с СО, зарегистрирована полоса при 1632 см–1, вероятно, соответствующая деформационным колебаниям воды. Пары воды могут попадать в данную систему вместе с СО, который подается из газометра (его запорной жидкостью является водный солевой раствор).
Рис. 6.
ИК-спектры системы PdBr2–LiBr–CH3CN до и после продувки СО ([PdBr2] = 0.005 M, [LiBr] = = 0.01 M); 1 – PdBr2–LiBr–CH3CN; 2, 3 и 4 – СО в течение 15 мин, 1 ч и 2 ч соответственно.

UV–Vis-спектроскопия (рис. 7). В электронном спектре исходной смеси присутствуют следующие полосы поглощения: “плечо” в районе 230 нм, полоса с максимумом при 272 нм (в спектре самая интенсивная), полоса в районе 340 нм, полоса с максимумом при 410 нм. Согласно результатам исследования равновесия комплексообразования палладия в системе PdBr2–LiBr–CH3CN, в данной системе при [PdBr2]∑ = 0.005 моль/л, [LiBr] ∼ ~ 0.01 моль/л преобладают следующие комплексы: PdBr+, Pd2Br$_{2}^{{2 + }}$, Pd2Br4 (концентрация PdBr+ – наибольшая). Тогда (см. табл. 4) вклад в оптическое поглощение вышеуказанных полос вносят все эти комплексы.
Рис. 7.
Электронные спектры системы PdBr2–LiBr–CH3CN до и после продувки СО ([PdBr2] = 0.005 M, [LiBr] = 0.01 M); 1 – PdBr2–LiBr–CH3CN; 2, 3 и 4 – СО в течение 15 мин, 1 ч и 2 ч соответственно.

После 15 мин контакта с СО (при интенсивном перемешивании) полосы поглощения, относящиеся к бромидным комплексам палладия(II), практически исчезают, появляются новые полосы поглощения с максимумами при 240 и 390 нм, которые можно отнести к карбонильному комплексу палладия(II) (по аналогии с системой PdBr2–LiBr–ТГФ+СО [36]). Также при контакте с СО появляется полоса при 225 нм, также возрастает интенсивность полосы поглощения при 280 нм. Эти полосы можно отнести к карбонильному комплексу палладия(I).
Состояние комплексов палладия в каталитической системе PdBr2–LiBr–CH3CN–H2O в ходе карбонилирования ацетилена
Исходный раствор, содержащий ацетонитрил, PdBr2 0.05 M, LiBr 0.1 M, имел темно-коричневый цвет. Выбранные концентрации бромидов палладия и лития обусловлены высокой скоростью процесса при них.
Согласно расчетам в исходной системе карбонилирования ацетилена PdBr2–LiBr–CH3CN при [PdBr2]Σ = 0.05 M, [LiBr]Σ = 0.1 M концентрации комплексов палладия соответственно равны: [PdBr+] = 1.10 × 10–3 M, [PdBr2] = 1.93 × 10–4 M, [PdBr$_{3}^{ - }$] = 2.87 × 10–3 M, [PdBr$_{4}^{{2 - }}$] = 1.26 × 10–3 M, [Pd2Br$_{2}^{{2 + }}$] = 3.52 × 10–4 M, [Pd2Br4] = 2.14 × 10–2 M, [Pd2Br$_{6}^{{2 - }}$] = 5.79 × 10–4 M. Расчеты проводили в программе “Кинетика”, используя вычисленные константы равновесия и коэффициенты экстинкции данных комплексов в рамках модели, учитывающей образование трех димерных комплексов. Следует отметить, что экспериментальную точку [PdBr2]Σ = 0.05 M, [LiBr]Σ = 0.1 M не использовали вместе с спектральными данными при [PdBr2]Σ = 5 × 10–3 и 5 × 10–4 M для расчета констант равновесия и коэффициентов экстинкции комплексов, потому что высокая концентрация раствора может вызвать большое отклонение от закона Бугера–Ламберта–Бера [37]. Мы предполагаем, что при увеличении [PdBr2]Σ до 0.05 M качественный состав комплексов палладия в исследуемой системе не меняется.
Таким образом, в системе PdBr2–LiBr–CH3CN при [PdBr2]Σ = 0.05 M, [LiBr]Σ = 0.1 M преобладает димерный комплекс Pd2Br4.
После начала процесса карбонилирования ацетилена (t = 40°С, PCO : ${{P}_{{{{{\text{C}}}_{2}}{{{\text{H}}}_{2}}}}}$ ∼ 2.5) раствор приобрел светло-оранжевую окраску. В ходе процесса концентрацию воды поддерживали постоянной ([H2O] ∼ 0.1 М).
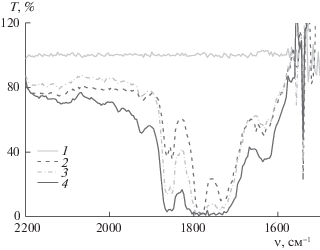
Инфракрасная спектроскопия (рис. 8). В ИК-спектре системы в ходе процесса карбонилирования ацетилена зарегистрирована полоса поглощения при 1924 см–1, соответствующая мостиковой карбонильной группе. Данная полоса относится к карбонильному комплексу палладия(I). Вероятно, в координационную сферу этого комплекса входит ацетилен, так как зарегистрированная полоса лежит в области более низких длин волн относительно полосы 1908 см–1, которая присутствует в ИК-спектре модельной системы PdBr2–LiBr–CH3CN + СО. Полос поглощения, соответствующих концевой карбонильной группе в ходе процесса зарегистрировано не было. Широкая полоса при ∼1632 см–1 соответствует деформационным колебаниям воды, и, вероятно, растворенному ацетилену. Зафиксировано образование продуктов карбонилирования ацетилена: янтарного ангидрида (полоса при 1864, 1780 см–1), малеинового ангидрида (полоса при 1852, 1780 см–1), карбоновых кислот (янтарной, малеиновой) (полоса при 1736 см–1). Образование этих продуктов было также подтверждено методом газовой хроматографии (методика хроматографического анализа приведена в [4]).
Рис. 8.
Эволюция ИК-спектров в ходе процесса карбонилирования ацетилена ([PdBr2] = 0.05 M, [LiBr] = = 0.1 M); 1 – PdBr2–LiBr–CH3CN; 2, 3 и 4 – С2Н2+СО в течение 25 мин, 1 ч и 2 ч соответственно.
UV–Vis спектроскопия (рис. 9). Электронные спектры в данной системе регистрировали в кварцевой кювете толщиной 0.001 см. В электронном спектре исходной смеси присутствуют следующие полосы поглощения: полоса в районе 240 нм, полоса с максимумом при 272 нм (в спектре самая интенсивная), полоса в районе 340 нм, полоса с максимумом при 410 нм. Согласно полученным результатам (см. выше) основной вклад в оптическое поглощение этих полос вносит комплекс Pd2Br4.
Рис. 9.
Эволюция электронных спектров в ходе процесса карбонилирования ацетилена ([PdBr2] = 0.05 M, [LiBr] = 0.1 M); 1 – PdBr2–LiBr–CH3CN; 2, 3 и 4 – С2Н2+СО в течение 25 мин, 1 ч и 2 ч соответственно.

В ходе карбонилирования ацетилена интенсивность полос поглощения при 272 и 410 нм уменьшается, а интенсивность полос в районе 220–230 нм и 340 нм увеличивается. Скорее всего этот факт связан с образованием комплекса палладия с малеиновым ангидридом.
Таким образом, в ходе процесса карбонилирования ацетилена палладий присутствует в форме карбонильного комплекса палладия(I), в координационную сферу которого, вероятно, входит ацетилен, и комплекса Pd(I) с малеиновым ангидридом.
Естественно, что наиболее простой путь образования карбонильного комплекса палладия(I) идет через восстановление димерных комплексов палладия(II), так как атомы палладия в них расположены достаточно близко для образования связи Pd–Pd в карбониле палладия(I). С учетом полученной информации можно предположить, что активный карбонил палладия(I) в ходе процесса преимущественно образуется из димерного комплекса Pd2Br4.
Ниже представлена схема 2 образования карбонила из Pd2Br4.
Таким образом, на основании полученных данных удалось уточнить механизм карбонилирования ацетилена (схема 1), а именно показать, что наиболее вероятный путь образования активного карбонильного комплекса палладия(I) связан с превращением димерного комплекса Pd2Br4 (схема 2), присутствующего в исходном растворе. Кроме того на основании спектральных данных удалось подтвердить существование карбонильного комплекса палладия(I) в каталитическом растворе в условиях процесса и обосновать предположение о координации его с ацетиленом (схема 1, комплекс Pd2Br2(CO)2(C2H2)), а также комплекса Pd(I) и малеинового ангидрида (схема 1, комплекс (МА)Pd2Br2(H)2).
Работа выполнена при поддержке Российского фонда фундаментальных исследований (код проекта № 16-33-00371).
Список литературы
Химическая энциклопедия // Большая Российская энциклопедия. М., 1998. Т. 5. С. 534.
Брук Л.Г., Гарбузюк И.А., Маркина С.В. и др. Способ получения янтарного ангидрида: пат. 2044731. Рос. Федерация.
Ошанина И.В. Одностадийный каталитический синтез янтарного ангидрида и янтарной кислоты карбонилированием ацетилена: автореф. дис. … канд. хим. наук. М.: МИТХТ им. М.В. Ломоносова, 1993. 23 с.
Oshanina I.V., Kozlova A.P., Vorontsov E.V. et al. // J. Mol. Catal. 1995. V. 104. P. 9.
Droll H.A., Block B.P., Fernelius W.C. // J. Phys. Chem. 1957. V. 61. P. 1000.
Щукарев С.А., Лобанева О.А., Иванова М.А., Кононова М.А. // Вестник ЛГУ. Сер. Физ.-хим. 1961. № 10. С. 152.
Burger K., Dyrssen D. // Acta Chem. Scand. 1963. V. 17. P. 1489–1501.
Burger K. // Acta Chim. Acad. Scient. Hung. 1964. V. 40. № 3. P. 261.
Burger K. // Magyar Kem. Folyoirat. 1964. V. 70. № 3. P. 179–184.
Бирюков А.А., Шленская В.И. // Журн. неорган. химии. 1964. Т. 9. Вып. 4. С. 813.
Weed E.D. A study of the palladium(II)-chloride complexes in aqueous solution: PhD thesis. Ohio State University, 1964.
Гельфман М.И., Киселева Н.В. // Журн. неорган. химии. 1969. Т. 14. Вып. 2. С. 502.
Rittner W.F., Gulko A., Schmukler G. // Talanta. 1970. V. 17. P. 807.
Elding L.I. // Inorg. Chim. Acta. 1972. V. 6. P. 647.
Tait C.D., Janecky D.R., Rogers P.S.Z. // Geochim. Cosmochim. Acta. 1991. V. 55. P. 1253.
Boily J.-F., Seward T.M. // Ibid. 2005. V. 69. P. 3773.
Cruywagen J.J., Kriek R.J. // J. Coord. Chem. 2007. V. 60. № 4. P. 439.
Щукарев С.А., Лобанева О.А., Иванова М.А., Кононова М.А. // Журн. неорган. химии. 1964. Т. 9. Вып. 12. С. 2791.
Бирюков А.А., Шленская В.И. // Вест. МГУ. Сер. Химия. 1964. Т. 19. Вып. 5. С. 81.
Шленская В.И., Бирюков А.А. // Журн. неорган. химии. 1966. Т. 11. № 1. С. 54.
Le Roux C.J., Kriek R.J. // Hydrometallurgy. 2017. V. 169. P. 447.
Гринберг А.А., Киселева Н.В. // Журн. неорган. химии. 1958. Т. 3. Вып. 8. С. 1804.
Кушников Ю.А., Воздвиженский В.Ф., Зиневич Л.Н., Фасман А.Б. // Там же. 1966. Т. 11. Вып. 10. С. 2193.
Ныркова А.Н. Исследование процессов комплексообразования и механизма формирования катализатора карбалкоксилирования ацетилена в системе PdBr2–P(OPh)3–н-С4Н9ОН: Дис. … канд. хим. наук. М.: МИТХТ им. М.В. Ломоносова, 1982. 141 с.
Ныркова А.Н., Калия О.Л., Темкин О.Н. и др. // Журн. неорган. химии. 1975. Т. 20. № 11. С. 3017–3021.
Harris C.M., Livingstone S.E., Reece I.H. // J. Chem. Soc. 1959. № 4. P. 1505.
Лобанева О.А., Кононова М.А., Давыдова М.К. // Докл. АН СССР. 1970. Т. 194. № 1. С. 133.
Лобанева О.А., Кононова М.А., Кунаева Н.Г., Давыдова М.К. // Журн. неорган. химии. 1972. Т. 17. Вып. 11. С. 3011.
Harris C.M., Livingstone S.E., Stephensone N.C. // J. Chem. Soc. 1958. № 10. P. 3697.
Волченскова И.И., Яцимирский К.Б. // Журн. неорган. химии. 1973. Т. 18. Вып. 7. С. 1875.
Путин А.Ю., Кацман Е.А., Темкин О.Н., Брук Л.Г. // Журн. физ. химии. 2017. Т. 91. № 4. С. 654.
Тимашова Е.А., Путин А.Ю., Бычкова Е.Ю. и др. // Вестник МИТХТ. 2014. Т. 9. № 3. С. 57.
Путин А.Ю., Бычкова Е.Ю., Трунилина К.В. и др. // Журн. физ. химии. 2015. Т. 89. № 3. С. 373.
Кацман Е.А., Беренблюм А.С. Пакет программ для построения и анализа кинетических моделей и его применение. М.: МИТХТ им. М.В. Ломоносова, 2010.
Марченко З., Бальцежак М. Методы спектрофотометрии в УФ- и видимой областях в неорганическом анализе. М.: БИНОМ. Лаборатория знаний, 2007. С. 51.
Путин А.Ю., Букина Е.Ю., Кацман Е.А. и др. // Журн. физ. химии. 2013. Т. 87. № 3. С. 480.
Пентин Ю.А., Вилков Л.В. Физические методы исследования в химии. М.: Мир, 2009. С. 353.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии