Журнал физической химии, 2019, T. 93, № 2, стр. 266-268
Твердотельный ЯМР аминокислотных производных фуллерена С60
О. В. Ямскова a, *, Ю. Г. Колягин b, В. С. Романова a, А. С. Егоров a, Д. В. Курилов c, И. А. Ямсков a, Н. Д. Зубарева c, Л. М. Кустов b, c
a Российская академия наук, Институт элементоорганических соединений им. А.Н. Несмеянова
Москва, Россия
b Московский государственный университет им. М.В. Ломоносова, Химический факультет
Москва, Россия
c Российская академия наук, Институт органической химии им. Н.Д. Зелинского
Москва, Россия
* E-mail: olga_yamskova@mail.ru
Поступила в редакцию 18.04.2018
Аннотация
Методом твердотельного ЯМР исследованы аминокислотные производные фуллерена С60. Сделан вывод, что рассматриваемые соединения представляют собой производные фуллерена С60 и соответствующих аминокислот, причем присоединение к фуллереновому каркасу происходит по аминогруппе.
В настоящее время большое внимание уделяется производным фуллерена как потенциальным препаратам в биологии и медицине. Известно, что водорастворимые производные фуллеренов С60 имеют широкий спектр биологической активности и являются перспективными с точки зрения создания на их основе эффективных лекарственных средств [1, 2]. Ранее нами был разработан метод синтеза аминокислотных и пептидных производных фуллерена С60, а также показана их высокая биологическая активность [3–6]. Важное значение для понимания реакционной способности и молекулярных механизмов действия этих соединений имеет установление их молекулярной структуры. С помощью аминокислотного анализа удалось показать, что происходит присоединение только одного остатка аминокислоты или пептида к фуллереновому каркасу. Тот факт, что присоединение происходит по аминогруппе подтверждено исследованиями полученных аддуктов методами ИК-спектроскопии [7], данными электрофореза [3] и квантово-химическими расчетами [8]. Однако для получения ЯМР-спектров в растворе неожиданным препятствием оказалась значительная ассоциация этих соединений как в водных растворах, так и в органических растворителях [9–11], что приводило к сильному уширению линий в спектрах и невозможности однозначно показать появление ковалентной связи С–N в соответствующем производном С60 и аминокислоты или пептида. Поэтому в данной работе для получения ЯМР-спектров целесообразным представлялось использовать твердотельный ЯМР, который лишен выше упомянутых недостатков.
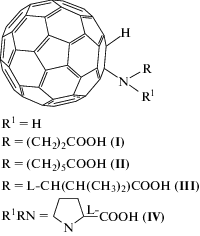
В качестве объектов исследования нами были выбраны следующие аминокислотные производные фуллерена С60, полученные по описанной ранее методике [3]: N-(моногидрофуллеренил)-β-аланин (I), N-(моногидро-фуллеренил)-6-аминогексановая кислота (II), N-(моногидрофуллеренил)-L-валин (III) и N-(моногидрофуллеренил)-L-пролин (IV) (схема 1).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР ВМУ (вращение под “магическим” углом) 13С были получены на спектрометре ЯМР AVANCE-II 400WB фирмы BRUKER с частотами 400.1 и 100.4 МГц для ядер 1Н и 13С соответственно (рисунок 1). Для регистрации спектров использовался двухканальный твердотельный датчик с системой ВМУ с внешним диаметром ротора 4 мм. Образец в виде порошка помещался в специальные ВМУ-роторы из оксида циркония. Во время регистрации спектров образец вращался со скоростью 12000 Гц. Спектры ЯМР ВМУ на ядрах 13С регистрировались с использованием методики переноса поляризации с линейно убывающим импульсом по ядрам 1Н во время переноса поляризации [12, 13] и высокомощной развязкой SW-TPPM (τ = 8 мкс, φ = 15°) по протонам во время регистрации спектра [14]. Время контакта составляло 2 мс, время между сканами – 2 с, время 90-градусного импульса по 1Н – 5 мкс. В качестве внешнего стандарта шкалы химических сдвигов использовался кристаллический адамантан [15, 16]. Спектры были обработаны с использованием программного пакета Topspin 2.3 фирмы Bruker.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Спектры 13С{1H} КП/ВМУ (КП – кросс-поляризация) для всех охарактеризованных образцов содержат несколько групп сигналов, из которых, в целом, можно выделить сигналы, относящиеся к углеродным атомам фуллеренового остова и присоединенной аминокислоты (β-аланин, 6‑аминогексановая (капроновая) кислота, а также L-пролин и L-валин). Интенсивные сигналы в области 120–160 м.д. соответствуют sp2-гибридным атомам углерода в фуллерене С60. Присоединение аминогруппы к фуллерену происходит с одновременным образованием связей C–N и С‒H, причем оба указанных атома углерода при образовании аддукта переходят в sp3-гибридное состояние со смещением сигналов в спектре в область с более низким значением химического сдвига. В спектрах наблюдаются характерные сигналы около 53 и 71 м.д., которые отвечают sp3‑гибридному состоянию атомов углерода фуллеренового остова, связанного с азотом [17] и водородом [18]. В случае L-пролина и L-валина сигнал в области 53 м.д. перекрывается с сигналами от аминокислоты.
Важно отметить, что фрагмент C–H, по-видимому, может подвергаться спонтанному окислению кислородом воздуха с образованием гидроксилированной формы соответствующего производного фуллерена, на что убедительно указывает сигнал в области 85 м.д. [19].
Обширная группа сигналов отвечает атомам углерода в остатках аминокислот (β-аланин – 38 и 175.5 м.д., 6-аминогексановая кислота – 19.4, 27.1, 31.6 и 178.9 м.д.; L-пролин – 22.4, 30.9, 52.9 и 175.1 м.д.; L-валин – 20.4, 31.2, 54.1 и 174.4 м.д.). На всех спектрах также имеется довольно интенсивный сигнал в районе 210 м.д., который, вероятно, может быть отнесен к остаточным количествам ацетона, используемого в качестве растворителя при выделении продуктов реакции присоединения аминокислот к фуллерену С60.
Методом туннельной сканирующей микроскопии ранее было установлено, что даже при высушивании происходит удерживание мицеллами молекул используемого растворителя [19]. В настоящей работе упомянутое выше обстоятельство подтверждено появлением в спектре сигналов остаточных количеств растворителя.
Таким образом, на основании результатов проведенных исследований с использованием метода твердотельного ЯМР однозначно подтверждено, что присоединение к фуллереновому каркасу происходит по аминогруппе с образованием ковалентной C–N-связи.
Работа выполнена при финансовой поддержке Российского научного фонда (грант № 14-50-00126).
Список литературы
Ros T.D. Medicinal Chemistry and Pharmacological Potential of Fullerenes and Carbon Nanotubes. Italy. Springer, 2008. 408 p.
Пиотровский Л.Б., Киселев О.И. Фуллерены в биологии. СПб.: “Росток”, 2006. 336 с.
Vol'pin M.E., Romanova V.S., Parnes Z.N. // Molecular crystals and liquid crystals science and technology. 1996. V. 7. P. 53.
Средство для ингибирования ВИЧ- и ЦМВ-инфекций и способ его использования. Миллер Г.Г., Кущ А.А., Романова В.С. Заявка № 2002101294 от 22.01.02. Пат. № 2196602. Б.И. № 2. 2003.
Фармацевтическая композиция для фотодинамической терапии и способ лечения онкологического заболевания с ее использованием. Лаптев В.П., Петров В.В., Андреев С.М., Романова В.С., Панферова Н.Г., Овчинников А.Е. Заявка № 2005140680 от 26.12.05. Пат. № 2323722 Б.И. № 13. 10.05.2008.
Полифункциональные производные фуллерена С60. Котельников А.И., Романова В.С., Богданов Г.Н., Коновалова Н.П., Писаренко О.И., Котельникова Р.А., Файнгольд И.И., Фрог Е.С., Бубнов Ю.Н., Давыдов М.И., Алдошин С.М. Заявка 2009140099. Пат. 2462473 от 19.06.2007.
Klemenkova Z.S., Romanova V.S., Tsyryapkin V.A. et al. // Mendeleev Commun. 1996. № 2. P. 60.
Долиниа Т.Ю., Лужков В.Б. // Изв. РАН. Сер. хим. 2012. № 8. С. 1614.
Белавцева E.M., Романова В.С., Кулешова Е.Ф и др. // Биофизика. 2000. Т. 45. № 2. С. 257.
Тимофеева Г.И., Романова В.С. // Изв. РАН. Сер. хим. 2007. № 12. С. 2307.
Тимофеева Г.И., Тепанов А.А., Лопанов В.А., Романова В.С. // Изв. РАН. Сер. хим. 2012. № 8. С. 1618.
Cook R.L. // Anal. Bioanal. Chem. 2004. V. 378. № 6. P. 1484.
Metz G., Wu X.L., Smith S.O. // J. Magn. Reson. Ser. A. 1994. V. 110. I. 2. P. 219.
Thakur R.S., Kurur N.D., Madhu P.K. // Chem. Phys. Lett. 2006. V. 426. P. 459.
Earl W.L., Vanderhart D.L. // J. Magn. Reson. 1982. V. 48. P. 35.
Morcombe C.R., Zilm K.W. // Ibid. 2003. V. 162. P. 479.
Kumar A. and Menon S.K. // Fullerenes, Nanotubes, and Carbon Nanostructures. 2010. V. 18. P. 126.
Meier M.S., Spielmann H.P., Bergosh R.G., Haddon R.C. // J. Am. Chem. Soc. 2002. V. 124. № 27. P. 8090.
Белавцева Е.М., Киченко Е.В., Романова В.С. и др. // Изв. РАН. сер. хим. 1996. № 4. С. 876.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии