Журнал физической химии, 2019, T. 93, № 3, стр. 414-419
Адсорбционные свойства гибридных металл-мезогенных наносистем серебро–холестерин и серебро–тиохолестерин
Я. А. Громова a, *, Б. А. Сарвин a, Т. И. Шабатина a
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: chemyaninka@mail.ru
Поступила в редакцию 05.07.2018
Аннотация
Получены наночастицы серебра (НЧС) методом боргидридного восстановления из нитрата серебра с последующей стабилизацией холестерином и тиохолестерином в различных мольных соотношениях. По результатам ПЭМ средний размер НЧС, стабилизированных холестерином, составил 5.5 ± 0.8 нм, а тиохолестерином – 2.5 ± 0.4 нм. Расчет энергии модельной реакции взаимодействия серебра с лигандами показал, что тиохолестерин является более сильным стабилизатором НЧС. Полученные НЧС, стабилизированные тиохолестерином, использованы, как модификаторы поверхности силикагеля. Построены изотермы адсорбции и определены количественные характеристики адсорбции НЧС на силикагеле. Лучшие количественные показатели адсорбции получены для мольного соотношения НЧС : тиохолестерин = 1 : 2. Гибридные металл-мезогенные наносистемы “НЧС–тиохолестерин” использованы как хиральные матрицы для разделения ряда тестовых оптически активных веществ методом ТСХ с коэффициентом селективности 1.6.
В последние годы внимание исследователей все больше привлекают физико-химические свойства наночастиц различных металлов [1]. Серебро – один из металлов, чьи свойства, а также способы получения наночастиц, хорошо изучены и описаны в литературе [2]. Однако, наночастицы серебра (НЧС) в чистом виде нестабильны. В связи с этим в настоящее время исследователи изучают возможность использования НЧС совместно с различными органическими лигандами, лекарственными препаратами и полимерами [3]. Представители класса холестерических жидких кристаллов (ХЖК) – холестерин и тиохолестерин – также вызывают интерес исследователей ввиду своих уникальных физико-химических и оптических свойств [2]. Стабилизация НЧС такими лигандами приводит к образованию самоупорядоченных и самоорганизованных матриц, обладающих оптической активностью. Модифицирование подобными матрицами поверхностей силикагелей позволяет описать процесс адсорбции, а также открывает новые пути для исследований в области хиральной хроматографии [4]. Таким образом, изучение физико-химических свойств гибридных металл-мезогенных систем на основе “НЧС–ХЖК” является актуальным. Цель настоящей работы – получение гибридных наносистем серебро–холестерин и серебро–тиохолестерин и изучение их структурных и физико-химических свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез НЧС, стабилизированных холестерином и тиохолестерином, проводили модифицированным методом боргидридного восстановления ионов серебра в двухфазной водно-органической среде с межфазным переносчиком тетра-н-октиламмония бромидом в присутствии стабилизирующего мезогенного лиганда холестерина и тиохолестерина (99.99% (Merk, Германия)) [5]. Для синтеза использовали следующие реагенты: AgNO3 (“Merk”, 99.99%), NaBH4 (“Merk”, 99.99%), C27H46S (“Merk”, 99.99%), тетра-н-октиламмония бромид (“Merk”, 99.99%), толуол (“ч.д.а.”). Варьируя концентрации исходных реагентов, синтезировали гибридные наносистемы НЧС–холестерин (мольное соотношение 1 : 25, образец 1) и НЧС–иохолестерин (образец 2) с мольным соотношением 1 : 5, 1 : 2 и 1 : 1.
Для оценки состава исследуемых образцов использовали метод атомной абсорбции и спектрофотометрии с экстракцией серебра из водного раствора органическим реагентом дитизоном в четыреххлористом углероде. Для удаления органической матрицы проводили мокрую минерализацию образцов, основанную на их растворении в концентрированной азотной кислоте. Для метода атомной абсорбции стандартные водные растворы серебра готовили путем растворения 20 мг серебряной фольги в 2 мл азотной кислоты (“ос.ч. 18-4”, ГОСТ 11125-84) с последующим разбавлением дистиллированной водой до 100 мл. Исходный раствор с концентрацией 0.2 мг/мл использовали для приготовления серии стандартных растворов серебра с концентрациями в диапазоне 0.00005–0.002 мг/мл. Растворы фотометрировали в одинаковых условиях при длине волны 321.8 нм на двухлучевом атомно-абсорбционном спектрометре THERMO FISHER SCIENTIFIC серии iCE 3000 с пламенной атомизацией в воздушно-ацетиленовом пламени и программным обеспечением SOLAAR. Далее проводили фотометрирование растворов образца 2. Измерения проводили 3 раза для статистической обработки данных, на основании полученных результатов строили градуировочный график.
Для проведения спектрофотометрического определения серебра с экстракцией предварительно очищенным дитизоном (“Химмед”, “ч.д.а.”, ГОСТ 10165-79) в четыреххлористом углероде (“Экос”, “ч.д.а.”) в 5 мерных колб емкостью 100 мл добавляли по 1 мл водного раствора серебра с концентрациями в диапазоне 0.01–0.05 мг/мл. Далее к растворам добавляли по 1 мл раствора 4М HNO3 и 5 мл раствора дитизона, встряхивали в течение 5–10 мин до появления оранжево-желтой окраски. После отстаивания и разделения фаз органическую фазу отбирали и переносили в кювету для фотометрирования, регистрировали пики поглощения дитизоната серебра при 461 нм на спектрофотометре Jasco V-770 (Jasco, Япония) в интервале длин волн 200–800 нм. Далее проводили фотометрирование растворов образца 2. Измерения проводили 3 раза для статистической обработки данных, на основании полученных результатов строили градуировочный график.
Для оценки структурно-морфологических характеристик были получены микрофотографии НЧС образцов 1 и 2. Для этого использовали просвечивающий электронный микроскоп (ПЭМ) “LEO912 AB OMEGA”, ускоряющее напряжение 100 кВ (“Carl Zeiss SMT AG Oberckochen”, Германия). Образцы готовили нанесением 1–2 мкл золя на покрытую формваром медную сетку (d = = 3.05 мм), затем сушили на воздухе. На основе микрофотографий ПЭМ были получены средние размеры НЧС и построена гистограмма распределения НЧС по размерам.
Для проведения адсорбции поверхность силикагеля марки “BP-SIL Zorbax Bulk Packing 7μ” (Agilent Technologies, США) модифицировали образцом 2. Приготовление стандартных растворов НЧС в толуоле проводили последовательным разбавлением исходного раствора с концентрацией 2.0 мг/мл в диапазоне 0.2–2.0 мг/мл с шагом в 0.2 мг/мл, после чего строили градуировочную зависимость. Адсорбционное равновесие в системе НЧС–силикагель изучали при температуре 295 ± 2 K в статистических условиях методом переменных концентраций. Навеску силикагеля массой 0.01 ± 0.002 г в воздушно-сухом состоянии приводили в контакт с 6.0 мл раствора НЧС известной концентрации и выдерживали при заданной температуре и постоянном перемешивании в течение 1 ч на механической мешалке C-MAGHS 7 (IKA, Германия). Адсорбцию проводили из растворов НЧС в толуоле в интервале концентраций. Равновесные фазы отделяли центрифугированием в течение 15 мин при 6000 об/мин (центрифуга “С50” (Elmi, Латвия)). Надосадочную жидкость анализировали на спектрофотометре “LIFESCIENCE” (JENWAY, Великобритания) при длине волны 470 нм.
Для построения изотермы адсорбции снимали спектры диффузионного отражения в видимой области модифицированных гибридными НЧС силикагелевых пластин для ТСХ Полисорб (SiO2, 10 мкм) на спектрофотометре с приставкой диффузионного отражения “SHIMADZU CS-9001PC” (Япония).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Состав и структурно-морфологические характеристики образцов
В качестве органических лигандов для стабилизации НЧС использовали представителей класса ХЖК – холестерин и его серосодержащий аналог тиохолестерин [2]. Синтез гибридных НЧС, стабилизированных мезогенными лигандами (холестерином и тиохолестерином), проводили модифицированным борогидридным методом, предусматривающим восстановление ионов серебра из нитрата серебра с помощью боргидрида натрия в двухфазной водно-органической системе с межфазным переносчиком тетра-н-октиламмония бромидом в присутствии стабилизирующего мезогенного лиганда. Данный метод химического восстановления выбран как наиболее простой, экспрессный и не требующий оборудования [5]. В процессе стабилизации образующиеся НЧС связываются с атомом –О из холестерина и атомом –S из тиохолестерина, образуя гибридные наносистемы [6]. Важными параметрами таких систем являются размер и форма образующихся НЧС, влияние на которые оказывает природа лиганда и его количество по отношению к НЧС, а также концентрация и массовая доля серебра в образцах. Для определения среднего размера и формы НЧС были получены электронные микрофотографии методом ПЭМ.
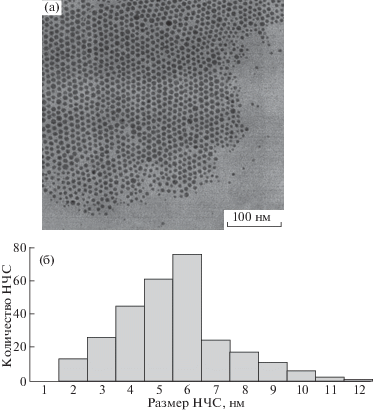
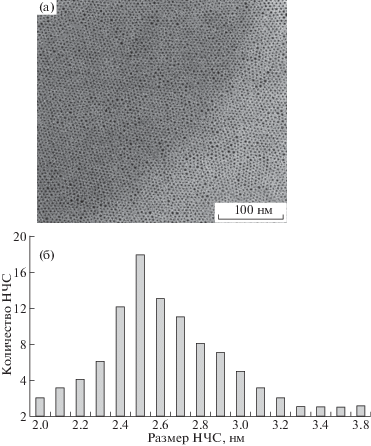
На рис. 1 представлены электронная микрофотография (а) и гистограмма распределения (б) НЧС по размерам для образца 1. Видно, что НЧС образуют плотноупакованный слой и имеют сферическую форму. На основании статистической обработки данных выявлено, что средний размер НЧС, стабилизированных холестерином (образец 1) составил 5.5 ± 0.8 нм. На рис. 2 приведены микрофотография НЧС для образца 2, а также гистограмма распределения (б) НЧС по размерам. НЧС имеют сферическую форму, однако их размер оказался меньше и составил 2.5 ± 0.4 нм (мольное соотношение НЧС : тиохолестерин = = 1 : 5). Размеры НЧС для соотношения НЧС : тиохолестерин = 1 : 2 и 1 : 1 составили 2.2 ± ± 0.4 и 2.1 ± 0.4 нм соответственно. С увеличением содержания стабилизирующего мезогенного лиганда тиохолестерина размер НЧС закономерно уменьшается, однако сильного размерного эффекта не выявлено, доверительные интервалы средних значений перекрываются [7].
Рис. 2.
Микрофотография ПЭМ (а) и гистограмма распределения НЧС по размерам (б) для образца 2 (мольное соотношение НЧС : тиохолестерин = 1 : 5).
Таким образом, размеры НЧС в образце 1 оказались больше, чем в образце 2. Для объяснения полученных результатов ранее в лаборатории были проведены квантово-химические расчеты, которые позволили оценить прочность связывания НЧС с холестерином и тиохолестерином по энергии модельных реакций. В работе [8] представлены результаты, показывающие, что тиохолестерин – более сильный стабилизатор НЧС, чем холестерин. Эти результаты хорошо согласуются с теоретическими представлениями о том, что ковалентная связь S–Ag в тиохолестерине более прочная, чем связь O–Ag в холестерине. Дальнейшие результаты исследования представлены для мезогенного лиганда тиохолестерина.
Для оценки состава образцов (концентрации и массовой доли серебра в гибридных матрицах) использовали два метода анализа. Метод атомной абсорбции (ААС) – чувствительный и точный одноэлементный метод анализа. В качестве второго метода определения серебра в гибридных матрицах использовали метод спектрофотометрии с экстракцией серебра из водного раствора органическим реагентом – дитизоном в четыреххлористом углероде. Дитизоновый метод основан на поглощении комплекса дитизоната серебра при длине волны 461 нм. Спектрофотометрия – универсальный и широко используемый на практике количественный метод определения серебра ввиду доступности реагентов и оборудования. По результатам ААС концентрации (с, мг/мл) и массовые доли серебра (w, %) в образце 2 составили: (0.0286 ± 0.006) × 10–3 мг/мл и 2.39 ± 0.03% для соотношения НЧС : тиохолестерин = 1 : 2 и (0.0235 ± ± 0.0004) × 10–3 мг/мл и 1.96 ± 0.04% для соотношения НЧС : тиохолестерин = 1 : 5; определенные методом спектрофотометрии данные параметры составили (38.8 ± 0.2) мг/мл, 2.36 ± 0.04% и (35.3 ± 0.1) мг/мл, 1.98 ± 0.04% соответственно. С увеличением содержания мезогенного лиганда тиохолестерина происходит более сильная стабилизация НЧС и наблюдается закономерное уменьшение концентрации и массовой доли серебра при переходе от мольного соотношения 1 : 5 к 1 : 2. Количественные показатели метода спектрофотометрии, такие как чувствительность и точность, а также предел обнаружения серебра уступают данным показателям в методе ААС.
Адсорбция НЧС на поверхности силикагеля
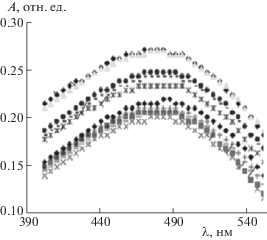
Для построения изотермы адсорбции НЧС на силикагеле в первую очередь необходимо определить длину волны, при которой наблюдается максимальное поглощение. Для растворов НЧС в толуоле в диапазоне концентраций от 0.2–2.0 мг/мл были сняты спектры плазмонного поглощения растворов НЧС и спектры диффузионного отражения в видимой области модифицированного гибридными НЧС поверхности силикагелевой пластины (рис. 3). Как видно из приведенной зависимости, максимум поглощения соответствует длине волны 470 нм, что хорошо согласуется с литературными данными. Увеличение концентрации НЧС в растворе приводит к росту значений оптической плотности, что свидетельствует о выполнении закона Бугера–Ламберта–Бера.
Рис. 3.
Спектры диффузионного отражения в видимой области модифицированных гибридными НЧС силикагелевых пластин.
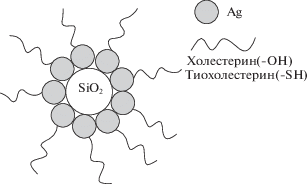
В качестве адсорбента в работе использовали силикагель [9], предварительно активированный раствором щелочи для образования на его поверхности отрицательно заряженных силанольных групп [10]. Адсорбцию проводили из растворов НЧС, стаблизированных тиохолестерином (образец 2) с разным мольным соотношением НЧС : тиохолестерин (1 : 1, 1 : 2 и 1 : 5) для выявления закономерностей и описания механизма адсорбции, а также для сравнения количественных характеристик адсорбции во всех трех случаях. На рис. 4–6 представлены изотермы адсорбции НЧС на силикагеле для разных мольных соотношений. Как видно, характер зависимостей, а также механизмы адсорбции различны. Для соотношений 1 : 1 (рис. 4) и 1 : 2 (рис. 5) изотерма адсорбции имеет вид изотермы БЭТ, т.е. адсорбция полимолекулярна. На начальных линейных участках виден вклад взаимодействий адсорбат–адсорбат, НЧС образуют агрегаты. В случае соотношения 1 : 5 (рис. 6) адсорбция мономолекулярна. Для количественного описания равновесия адсорбции в интервале концентраций, отвечающих образованию монослоя НЧС, использована модель Ленгмюра. Для определения значений констант, входящих в уравнение изотермы Ленгмюра, использовали начальные линеаризованные участки уравнения данных моделей. Полученные значения параметров, входящие в уравнение модели Ленгмюра рассчитаны на основании изотерм адсорбции для всех мольных соотношений НЧС : тиохолестерин. В табл. 1 представлены количественные характеристики адсорбции: количество адcорбируемых НЧС на 1 г поверхности силикагеля (Q, мг/г) и оптимальная концентрация (с, мг/мл) НЧС, которая необходима для образования монослоя на поверхности адсорбента. Как показали результаты, оптимальные количественные характеристики получены для соотношения НЧС : тиохолестерин = 1 : 2. Эта гибридная система, иммобилизованная на поверхность силикагеля, гидрофобна, так как единственный полярный заместитель (–SH группа тиохолестерина) эффективно взаимодействует с поверхностными центрами НЧС и мало смещает электронную плотность с холестеринового цикла. Серебро является хорошей якорной группой, которая, как показано в более ранних исследованиях, имеет частично положительный заряд [11]. Таким образом, адсорбция гибридных НЧС может быть обусловлена электростатическим взаимодействием между положительно заряженными частицами серебра и отрицательно заряженными силанольными группами на поверхности силикагеля [12]. На рис. 7 представлено схематическое изображение поверхности силикагеля, модифицированного НЧС, стабилизированных жидкокристаллическим лигандом.
Рис. 4.
Изотерма адсорбции, полученная после модифицирования поверхности силикагеля раствором НЧС для образца 2 (мольное соотношение НЧС : тиохолестерин = 1 : 1).
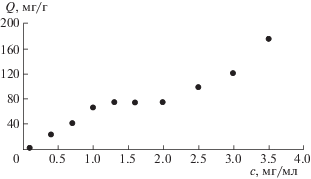
Рис. 5.
Изотерма адсорбции, полученная после модифицирования поверхности силикагеля раствором НЧС для образца 2 (мольное соотношение НЧС : тиохолестерин = 1 : 2).
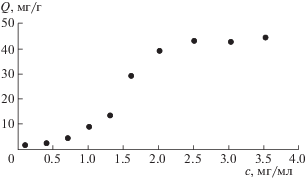
Рис. 6.
Изотерма адсорбции, полученная после модифицирования поверхности силикагеля раствором НЧС для образца 2 (мольное соотношение НЧС : тиохолестерин = 1 : 5).
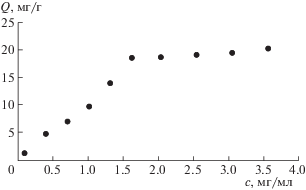
Таблица 1.
Количественные характеристики адсорбции НЧС на поверхности силикагеля для различных мольных соотношений серебро : тиохолестерин (α)
| α | c, мг/мл | Q, мг/г |
|---|---|---|
| 1 : 1 | 2.5 | 45 |
| 1 : 2 | 1.2 | 80 |
| 1 : 5 | 1.5 | 20 |
Рис. 7.
Изображение поверхности силикагеля, модифицированного НЧС, стабилизированных жидкокристаллическим лигандом.
Гибридные металл-мезогенные системы серебро–тиохолестерин являются перспективными материалами, позволяющими разделять смеси энантиомеров различными хроматографическими методами анализа. Тиохолестерин – оптически активная молекула и обладает хиральностью, образуя пространственно упорядоченные спиральные жидкокристаллические структуры – холестерические мезофазы. Известно, что эффект “гость–хозяин” имеет большое значение для практического использования жидкокристаллических систем, включающих гостевые молекулы органических и неорганических соединений [13]. Таким образом, подобные гибридные металл-мезогенные системы можно использовать в качестве хиральных матриц для модифицирования поверхности различных силикагелей с целью разделения оптически активных веществ. В работе [14] показано, что применение хиральной матрицы на основе силикагеля, модифицированного НЧС, стабилизированных тиохолестрином, приводит к разделению тестовых оптически активных веществ методом тонкослойной хроматографии (ТСХ). В качестве подложки для получения хиральных матриц использовали силикагелевые пластинки для ТСХ, импрегнирование пластинок проводили путем двукратного нанесения раствора НЧС в толуоле с помощью распылителя. В качестве подвижной фазы (ПФ) в работе использовали смесь ацетонитрил : вода в объемном соотношении 1 : 1. Обработку полученных хроматограмм проводили методом видеоденситометрии. Гибридные наносистемы на основе НЧС, стабилизированных тиохолестерином, проявляют энантиоселективность по отношению к изомерам 2,2'-диамино-1,1'-бинафтола и трифтор-1-(9-антранил)этанола (ТФАЭ), коэффициент селективности составил α = 1.6 [14].
Работа выполнена при финансовой поддержке гранта РНФ № 16–13–10365а.
Список литературы
Sergeev G.B. Nanochemistry. Elsevier B.V. Amsterdam, 2006. P. 249.
Блинов Л.М. Жидкие кристаллы. Структура и свойства. М., 2013.
Klabunde K.J., Richards R.M. Nanoscale Materials in Chemistry. 2-nd ed. N.Y., 2009. P. 778.
Алленмарк С. Хроматографическое определение энантиомеров. Пер. с англ. М., 1991.
Belyaev A.A., Shabatina T.I., Sergeev G.B. // Moscow. Univ. Chem. Bull. 2009. V. 50. № 4. P. 228.
Shabatina T.I., Vovk E.V., Ozhegova N.V., Morosov Yu.N., Nemukhin A.V., Sergeev G.B. // Materials Science and Engineering C. 1999. V. 40. № 2. P. 129.
Shabatina T.I., Belyaev A.A., Sergeev G.B. // Molecular Crystals and Liquid Crystals. 2011. V. 540. P. 169.
Ермилов А. Ю., Лукьянова Е.С., Громова Я.А., Шабатина Т.И. // Вестн. Моск. ун-та. 2018. № 5 (в печати).
Модифицированные кремнеземы в сорбции, катализе и хроматографии / Под ред. Г.В. Лисичкина. М., 1986. С. 286.
Pesek J.J., Matyska M.T., Dawson G.B. et al. // J. Chromatogr. A. 2003. V. 986. P. 253.
Shabatina T.I., Belyaev A.A., Sergeev G.B. // BioNanoScience, 2013. V. 3. № 3. P. 289.
Shabatina T.I., Belyaev A.A., Morozov Yu.N. // Molecular Crystals and Liquid Crystals. 2016. V. 688. P. 55.
Shabatina T.I., Gromova Ya.A., Anistratova E.S., Belyaev A.A. // Ibid. 2016. V. 632. P. 64.
Gromova Ya.A., Anistratova E.S., Shabatina T.I. et al. // Moscow. Univ. Chem. Bull. 2016. V. 71. № 1. P. 16.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии