Журнал физической химии, 2019, T. 93, № 3, стр. 343-346
Температурная зависимость теплоемкости моноэтаноламина
А. В. Тюрин a, И. А. Солонина a, М. Н. Родникова a, *
a Российская академия наук, Институт общей и неорганической химии им. Н.С. Курнакова
Москва, Россия
* E-mail: rodnikova@igic.ras.ru
Поступила в редакцию 10.05.2018
Аннотация
Измерена теплоемкость моноэтаноламина (МЭА) в области температур 120–345 К и рассчитаны изменения энтальпии, энтропии и приведенной энергии Гиббса в данном температурном интервале. Показан значительный скачок теплоемкости и рассчитанных термодинамических величин при 283 К, указывающий на процесс плавления. Получен скачок теплоемкости при 160 К, связанный с процессом расстекловывания МЭА. Зафиксировано изменение температурной зависимости теплоемкости в районе 200–220 К, что коррелирует с изменением диэлектрических характеристик стекла МЭА в этой области температур.
Моноэтаноламин (МЭА) – простейший представитель класса аминоспиртов. Наличие в молекуле аминной и гидроксильной групп позволяет предположить существование пространственной сетки водородных связей в конденсированных фазах этого вещества. Конформации его молекулы в газообразном, жидком и твердом состоянии были исследованы методами квантовой химии [1], колебательной спектроскопии [2] и рентгеноструктурного анализа [3]. Было показано: предпочтительность гош-конформации [1] в газовой фазе, легкость конформационного перехода при переходе в жидкую фазу [4] и превалирование транс-конформации в кристаллическом состоянии МЭА [3].
Наличие в молекуле аминной и гидроксильной групп позволяет образовать пространственную сетку водородных связей в конденсированных фазах МЭА. Физико-химические свойства этого вещества представлены в табл. 1.
Наличие пространственной сетки в жидком МЭА обусловливает сильное переохлаждение, трудность кристаллизации и легкость стеклообразования этого вещества [5]. С этими свойствами связано его применение в криобиологии [11].
Теплоемкость – одно из важнейших физико-химических свойств вещества. Его температурная зависимость является характеристикой процессов, происходящих в нем. В настоящей работе мы исследовали теплоемкость МЭА в широком температурном интервале от 120 до 345 К с целью выявить процессы, происходящие в МЭА в указанном температурном интервале.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
МЭА марки АСROS чистоты 99% применялся без дополнительной очистки. Все процедуры по заполнению кювет проводились в сухой камере в токе сухого азота. Для измерения теплоемкости МЭА в интервале температур 120–345 К использовали адиабатический вакуумный калориметр БКТ-3 (АБК), сконструированный и изготовленный в АОЗТ “Термис” (г. Менделеево Московской обл.). Измерения проводились автоматически и контролировались компьютерно-измерительной системой. Калориметрическая ампула представляла собой тонкостенный цилиндрический титановый сосуд с внутренним объемом 1 см3 и массой 1.6 г. с завинчивающейся бронзовой крышкой с индиевым уплотнением для герметизации. Температура измерялась железо-родиевым термометром сопротивления (R ≈ 100 Ом). Чувствительность термометрической схемы 1 × × 10–3 К, абсолютная погрешность измерений температуры ±5 × 10–3 К в соответствии с МТШ-90. Конструкция и принцип работы калориметра описаны в [12]. Надежность измерительной процедуры проверена путем измерения теплоемкости меди марки особой чистоты, стандартного синтетического корунда и бензойной кислоты марки К-2, приготовленных в метрологических учреждениях Госстандарта России. Установлено, что погрешность измерений теплоемкости веществ в области температур 40–350 К составляет 0.2%. Измерения проводились в режиме ступенчатого нагревания с шагом 3 К. Необходимо отметить, что изменение регулярного хода теплоемкости (скачки, перегибы, пики) хорошо коррелирует с экстремумами на зависимости дрейфа температуры с течением времени при выравнивании температуры в калориметре после выключения нагрева в каждом калориметрическом опыте, что косвенно свидетельствует об изменении теплообмена в образце в случае превращения в этих интервалах температур.
Экспериментальные значения теплоемкости МЭА в интервале температур 120–345 К представлены в табл. 2 и на рисунке 1. Из данных по температурной зависимости теплоемкости МЭА рассчитаны изменения энтальпии Н°(Т) – Н°(125 K), энтропии S°(T) – S°(125) и приведенных энергий Гиббса Ф°(Т) – Ф°(125) в интервале температур 120–345 К (табл. 3).
Таблица 2.
Теплоемкость МЭА в интервале температур 120–345 К
| T, К | $C_{p}^{^\circ }$(МЭА), Дж/(К моль) | T, К | $C_{p}^{^\circ }$(МЭА), Дж/(К моль) |
|---|---|---|---|
| 121.41 | 53.26 | 240.84 | 94.73 |
| 131.37 | 56.02 | 251.53 | 101.04 |
| 141.31 | 58.75 | 260.80 | 113.58 |
| 151.27 | 61.43 | 271.58 | 181.58 |
| 161.19 | 65.18 | 282.79 | 7582.52 |
| 171.12 | 68.16 | 290.11 | 165.69 |
| 181.07 | 70.69 | 301.43 | 168.26 |
| 191.04 | 73.24 | 311.93 | 170.76 |
| 201.07 | 76.27 | 320.19 | 172.79 |
| 211.26 | 79.04 | 330.46 | 175.39 |
| 221.26 | 84.37 | 340.54 | 178.07 |
| 231.03 | 89.73 | 344.59 | 179.23 |
Рис. 1.
Теплоемкость МЭА в интервале температур 120–345 К; а – общий вид, б – увеличение участка теплоемкости от 50 до 200 Дж/(моль К).
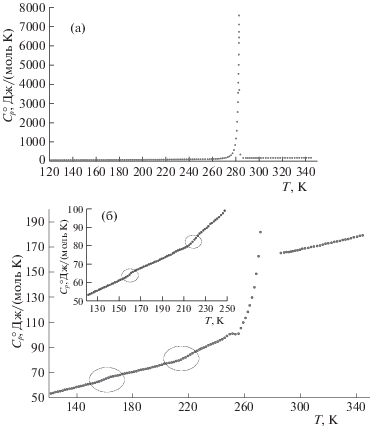
Таблица 3.
Изменение энтальпии, энтропии и приведенной энергии Гиббса МЭА в интервале температур 120–345 К
| T, К | Н°(Т) – – Н°(125 K), Дж/моль | S°(Т) – – S°(125 K), Дж/(К моль) | Ф°(Т) – – Ф°(125 K), Дж/(К моль) |
|---|---|---|---|
| 125 | 0 | 0 | 0 |
| 130 | 275.7 | 2.16 | 0.04 |
| 140 | 848.3 | 6.40 | 0.35 |
| 150 | 1449 | 10.54 | 0.89 |
| 160 | 2076 | 14.60 | 1.62 |
| 170 | 2732 | 18.57 | 2.50 |
| 180 | 3417 | 22.49 | 3.50 |
| 190 | 4133 | 26.35 | 4.60 |
| 200 | 4882 | 30.19 | 5.79 |
| 210 | 5666 | 34.02 | 7.04 |
| 220 | 6490 | 37.85 | 8.35 |
| 230 | 7357 | 41.71 | 9.72 |
| 240 | 8272 | 45.60 | 11.13 |
| 250 | 9240 | 49.55 | 12.59 |
| 260 | 10 270 | 53.58 | 14.09 |
| 270 | 11 550 | 58.41 | 15.63 |
| 280 | 25 000 | 106.7 | 17.41 |
| 290 | 68 600 | 261.5 | 24.95 |
| 298.15 | 69 960 | 266.1 | 31.48 |
| 300 | 70 270 | 267.2 | 32.93 |
| 310 | 71 960 | 272.7 | 40.58 |
| 320 | 73 680 | 278.2 | 47.92 |
| 330 | 75 420 | 283.5 | 54.98 |
| 340 | 77 190 | 288.8 | 61.78 |
Для расчета стандартных термодинамических функций в широком интервале температур были проведены анализ и обработка экспериментальных данных по низкотемпературной теплоемкости. Эта задача выполнена с использованием сплайн-аппроксимации по программе, являющейся частью математического обеспечения банка данных ИВТАНТЕРМО [13].
Расчет весов для сплайна проводился с помощью кусочно-полиномиальной аппроксимации с выбором оптимальной степени полинома на каждом отрезке, и погрешность каждой точки вычислялась как разность между экспериментальным и сглаженным значением. Погрешность термодинамических функций рассчитывалась из среднеквадратичного отклонения экспериментальных точек от сглаженной кривой.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В табл. 2 и на рисунке 1а виден скачок теплоемкости при температуре 282.79 К указывающий на процесс плавления МЭА. Эта температура соответствует справочным данным. Термодинамические характеристики процесса плавления – изменение энтальпии, энтропии и приведенной энергии Гиббса, рассчитанные из полученных экспериментальных данных по теплоемкости и приведенных в табл. 3, характеризуют этот процесс. Видно сильное поглощение тепла, увеличение энтропии и приведенной энергии Гиббса. На рисунке 1б показано изменение хода температурной зависимости теплоемкости МЭА в областях ~160 К и 200–220 К. При температуре ~160 К происходит расстеклование МЭА, что подтверждается данными работ [5, 14]. Изменение хода температурной кривой теплоемкости в области 200–220 К коррелирует с процессом 2, отмеченным в работе [14], посвященной исследованию диэлектрической спектроскопии аминокислот в области низких температур. Физический смысл этого процесса пока не установлен. Сделано предположение о наличие твердофазового перехода в однокомпонентной системе – cвязанного возможно с изменением конформации молекул в этой области температур.
Таким образом, измерена теплоемкость чистого моноаминоэтанола в интервале температур 120–345 К. Показан скачок теплоемкости при 282.79 К регистрирующий процесс плавления МЭА, что подтверждено расчетом изменения энтальпий, энтропий и приведенных энергий Гиббса. Процесс расстекловывания зафиксирован в районе 160 К. Зарегистрировано изменение хода температурной зависимости теплоемкости в области 200–220 К. Сделано предположение о процессе ликвации в однокомпонентной системе, связанным, возможно, с изменением конформаций молекул МЭА в этой области температур.
Исследование температурной зависимости теплоемкости подтверждает, сделанный ранее вывод о сильном переохлаждении жидкой фазы МЭА, о легкости стеклообразовании и трудности кристаллизации – о физико-химических свойствах, характерных для жидкостей с пространственной сеткой водородной связи.
Работа выполнена в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований при финансовой поддержке Российского фонда фундаментальных исследований (грант № 16-03-00897).
Список литературы
Новаковская Ю.В., Родникова М.Н. // Журн. неорган. химии. 2014. Т. 59. № 11. С. 1534. DOI: 10.7868/S0044457X14110178
Харитонов Ю.Я., Хошабова Э.Г., Родникова М.Н. и др. // Докл. АН СССР. 1989. Т. 304. № 4. С. 917.
Родникова М.Н., Солонина И.А., Соловей А.Б., Усачева Т.М. // Журн. неорган. химии. 2013. Т. 58. № 12. С. 1628. DOI: 10.7868/S0044457X13120180
Новаковская Ю.В., Родникова М.Н. // Докл. Академии наук. 2016. Т. 467. № 6. С. 679. DOI: 10.7868/S0869565216120148
Солонина И.А., Родникова М.Н., Киселев М.Р., Хорошилов А.В. // Журн. физ. химии. 2015. Т. 89. № 5. С. 882. DOI: 10.1134/S0036024415050301
Handbook of Phys. Chem. Properties and Environmental Fate for Organic Chem. 2006. LLC V. IV. P. 3236.
Осипов О.А., Минкин В.И. Справочник по дипольным моментам. Издательство: Высш. школа, 1965.
Разумова А.Б. // Особенности физико-химических свойств аминоспиртов и их водных растворов. Автореф. … канд. хим наук. 1994. Ярославль.
Ахадов Я.Ю. Диэлектрические свойства чистых жидкостей М.: Изд-во МАИ, 1999.
Карцев В.Н., Родникова М.Н., Цепулин В.В. и др. // Журн. структур. химии. 1986. Т. 27. С. 187.
Грищенко В.И. // Проблемы криобиологии. 2005. Т. 15. № 3. С. 231.
Малышев В.В., Мильнер Г.А., Соркин Е.Л., Шибакин В.Ф. // Приборы и техника эксперимента. 1985. № 6. С. 195.
Иориш В.С., Толмач П.И. // Журн. физ. химии. 1986. Т. 60. № 10. С. 2583.
Солонина И.А., Васильева М.А., Гринбаум (Гутина) А. и др. // Журн. физ. химии. 2016. Т. 90. № 1. С. 83. DOI: . doi 10.1134/S0036024416010283
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


