Журнал физической химии, 2019, T. 93, № 3, стр. 347-357
Химические и фазовые превращения в W-Mn-содержащих катализаторах окислительной конденсации метана
Ю. А. Гордиенко a, *, В. И. Ломоносов a, Е. А. Пономарева a, М. Ю. Синев a, А. В. Бухтияров b, З. С. Винокуров b
a Российская академия наук, Институт химической физики им. Н.Н. Семенова
Москва, Россия
b Российская академия наук, Сибирское отделение, Институт катализа им. Г.К. Борескова
Новосибирск, Россия
* E-mail: yuagordienko@gmail.com
Поступила в редакцию 08.06.2018
Аннотация
NaWMn-содержащие оксидные системы, нанесенные на SiO2 и Al2O3, исследованы методами термодесорбции кислорода, рентгеновской фотоэлектронной спектроскопии, рентгенофазового анализа in-situ, а также сканирующей электронной микроскопии совместно с энергодисперсионной рентгеновской спектроскопией. Установлены корреляции между химическим и фазовым составом образцов и условиями их предварительной обработки (десорбция кислорода, реокисление). Проанализированы факторы, определяющие эффективность каталитического действия оксидных NaWMn систем в процессе окислительной конденсации метана.
Процесс окислительной конденсации метана (ОКМ) рассматривается в качестве альтернативного способа прямой переработки природного газа с получением этилена наиболее крупнотоннажного полупродукта органического и нефтехимического синтеза. Одним из ключевых этапов на пути создания промышленной технологии на его основе является разработка эффективного катализатора. Детальный обзор и анализ работ, посвященный подбору и исследованию катализаторов ОКМ, представлен в [1, 2]. Предметом исследования в настоящей работе является смешанный оксидный катализатор NaWMn/SiO2, впервые описанный в работах сотрудников Института химической физики (г. Ланьчжоу, КНР) [3, 4]. Согласно имеющимся литературным данным (см., например, [5]), он является наиболее эффективным из известных катализаторов ОКМ с точки зрения максимально достигаемого выхода С2-углевородов. Несмотря на многочисленные исследования, механизм его каталитического действия, а также роль его отдельных компонентов до сих пор являются предметом дискуссий. Так, S.-B. Li с соавт. [6, 7] предполагают, что активность системы NaWMn/SiO2 обусловлена наличием в ее составе полиэдров WO4 тетрагональной структуры, содержащей связи W=O и W–O–Si. Авторы работы [8] полагают, что помимо тетрагональной структуры WO4, необходимой для активации метана, важную роль играет октаэдрическая структура MnO6, обеспечивающая быстрый перенос кислорода в решетке оксида, тогда как в работе [9] делается вывод, что активными в реакции ОКМ являются как центры типа Na–O–Mn, так и Na–O–W. Дж. Лансофрд с соавт. [10] полагает, что активация метана протекает на центрах Na–O–Mn, а присутствие в катализаторе вольфрама обеспечивает стабильность его работы.
Хотя мнения различных авторов относительно механизма каталитического действия различаются, на данный момент можно считать убедительно доказанным, что лишь при наличии в составе катализатора одновременно трех нанесенных компонентов (Mn, W, Na или иного щелочного металла) достигаются высокие активность и селективность в реакции ОКМ. Кроме того, оксид кремния, по-видимому, не может рассматриваться в качестве “инертной подложки”, поскольку хорошо известно, что смешанный NaWMn-оксид – как сам по себе (без носителя), так и будучи нанесенным на другие материалы с развитой поверхностью, заметно уступает в каталитических свойствах системе на основе SiO2 [11].
В работах [12–17] сообщается о том, что оксидная система NaWMn/SiO2 содержит в своем составе кислород, который может быть обратимо удален из нее в потоке инертного газа или в вакууме при температурах выше 650°С. При этом, как было показано в работе [17], присутствие именно этой формы кислорода определяет высокую активность рассматриваемой оксидной системы в реакции ОКМ. Данные, полученные методом дифференциальной сканирующей калориметрии (ДСК) in situ [18], показывают, что обратимое выделение/поглощение кислорода связано с окислительно-восстановительными переходами в ионах марганца. Однако только по данным ДСК не представляется возможным сделать вывод о том, каким именно переходам и изменениям структуры отвечает удаление и присоединение этой формы реакционноспособного кислорода и какова роль других элементов в ходе превращения. При этом вопрос о механизме “оборота” кислорода (его обратимого выделения – поглощения) для системы NaWMn/SiO2 тесно связан с эффективностью ее каталитического действия и не может рассматриваться в отрыве от подробного анализа химического и фазового состава нанесенного компонента и их изменения в ходе цикла восстановления-окисления. По этой причине в данной работе поставлена задача проследить изменения химического состава и структуры (фазового состава и морфологии) компонентов нанесенных NaWMn-катализаторов в процессе обратимого выделения-поглощения кислорода, моделирующего оксилительно-восстановительные превращения в ходе катализа.
Для выявления роли носителя и щелочного компонента были исследованы образцы смешанного NaWMn-оксида, нанесенного на силикагель и α-Al2O3, а также не содержащий натрия образец WMn/α-Al2O3. Для системы на основе SiO2 подобное сравнение затруднительно, поскольку в отсутствие щелочного компонента носитель не образует фазу кристобалита, присутствие и морфология которой обеспечивают оптимальное каталитическое действие (см., например, [5, 17, 19]).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление образцов
В качестве носителей использовались силикагель марки Aldrich Davisil grade 646 и α-Al2O3, полученный прокаливанием γ-Al2O3 (Sorbis Group) при 1200°С в течение 12 ч.
Образцы, содержащие три нанесенных компонента (расчетная концентрация – 0.8% Na, 3.2% W и 2.0% Mn), готовили методом пропитки носителей по влагоемкости последовательно растворами вольфрамата натрия и нитрата марганца (вольфрамата аммония и нитрата марганца – для получения образца WMn/α-Al2O3) с промежуточной сушкой при 120°С в течение 3 ч; образцы прокаливали при 600°С в течение 2 ч, и еще в течение 6 ч при 900°С.
Образцы на основе SiO2 и α-Al2O3 имеют близкие величины удельной поверхности (4.3 и 3.5 м2/г соответственно), что позволяет сравнивать их каталитические свойства в аналогичных условиях.
Определение каталитических свойств в реакции ОКМ
Эксперименты по изучению каталитических свойств проводили в кварцевом реакторе проточного типа с внутренним диаметром 4 мм; в его центральной части имеется уширение (8 мм) с внутренним карманом для подвижной термопары. Образец катализатора (50 мг, фракция 0.25–0.5 мм) помещали в кольцевой зазор между стенкой реактора и карманом для термопары. Реакционная смесь на выходе из реактора продувалась через стеклянную ловушку, помещенную в охлаждающую смесь (лед с насыщенным раствором поваренной соли), в которой конденсировались жидкие продукты окисления метана, после чего газообразные продукты реакции анализировались хроматографически. Эксперименты вели при 860°С, варьируя скорость подачи исходной метан-кислородной смеси (соотношение CH4 : O2 = = 85 : 15) в диапазоне 25–100 мл/мин. Подробное описание экспериментальной установки и методики хроматографического анализа приведено в [20].
Помимо свежеприготовленных оксидных систем в работе также исследованы образцы после десорбции кислорода и после последующего реокисления.
Термопрограммированная десорбция кислорода (ТПД)
В кварцевый проточный реактор (внутренний диаметр 5 мм), соединенный с детектором по теплопроводности (ДТП) газового хроматографа “Хроматэк Кристалл 5000.2”, загружали навеску образца (50 мг) и нагревали в потоке гелия (20 мл/мин) до 500°С. После производили программируемый нагрев со скоростью 10 К/мин до 900°C с последующей изотермической выдержкой до выхода сигнала ДТП на горизонтальную базовую линию.
Повторные эксперименты по ТПД кислорода проводили после реокисления образцов в потоке смеси 5% O2/He при 600°C в течение 30 мин с последующим охлаждением до 500°C и дополнительной выдержкой при этой температуре в течение 30 мин в потоке гелия. Образцы проходили аналогичную окислительную обработку перед исследованиями другими методами (см. ниже).
Рентгеновская фотоэлектронная спектроскопия (РФЭС)
Образцы, прошедшие различную предварительную обработку, исследовали на фотоэлектронном спектрометре SPECS (Германия) с использованием излучения AlKα (1486.6 эВ, 150 Вт). Шкала энергий связи спектрометра (Есв) была предварительно откалибрована по положению пиков остовных уровней золота и меди: Au4f7/2 (84.0 эВ) и Cu2p3/2 (932.67 эВ). Давление остаточных газов в ходе записи спектров не превышало 8 × 10–9 мбар. Образцы закреплялись на стандартном держателе с помощью двухсторонней проводящей медной липкой ленты (Scotch 3M©). Обработка полученной спектральной информации проводилась с использованием программы XPSPeak 4.1. Для определения химического (зарядового) состояния и соотношения атомных концентраций элементов на поверхности образцов были использованы регионы W4f, Al2p, Si2p, C1s, O1s, Mn2p и Na1s. Для калибровки спектров в качестве внутреннего стандарта использовались линии от кремния Si2p (Есв = 103.3 эВ) и алюминия Al2p (Есв = 74.5 эВ) в составе носителей SiO2 или Al2O3, и соответственно [21]. Интегральные интенсивности линий определялись по площадям пиков в регионах, соответствующих (W4f, Si2p, C1s, O1s, Mn2p и Na1s). Соотношение сигналов линий различных элементов в фотоэлектронном спектре определяли по их интегральным интенсивностям, откорректированным на соответствующие коэффициенты атомной чувствительности [21].
Рентгенофазовый анализ (РФА)
Исследования методом рентгенофазового анализа (РФА) in situ (в режиме нагрева в контролируемой атмосфере) проводили на дифрактометре Bruker D8 Advance (Германия) с использованием CuKα излучения. Регистрация дифрактограмм производилась полупроводниковым однокоординатным детектором LynxEye в конфигурации θ/θ. Для фильтрации CuKβ компоненты использовался никелевый фильтр. Нагрев образца проводился в высокотемпературной проточной камере-реакторе XRK-900 производства Anton Paar (Австрия). Образец (~0.22 см3) загружали в открытый держатель, позволяющий газовой смеси проходить через объем образца, и помещали в камеру-реактор. Рентгенограммы регистрировались при изотермической выдержке в ходе ступенчатого нагрева со скоростью 12К/мин до 850°С в диапазоне углов 15–50° с шагом 0.03° и временем накопления в точке 2 с. Расход газа (100 мл/мин воздуха или аргона) устанавливался с помощью регуляторов DFC-26 (Aalborg, USA). Рентгенограммы, полученные в аргоне, дополнительно нормированы для учета поглощения излучения газом при различных температурах.
Сканирующая электронная микроскопия совместно с энергодисперсионной рентгеновской спектроскопией (СЭМ/ЭДС)
Изучение образцов методом сканирующей электронной микроскопии выполняли на электронном микроскопе Tescan Mira 3 LMU, оснащенном энергодисперсионным детектором X-Max, что позволило проводить локальный рентгеноспектральный микроанализ. Микрофотографии были получены при ускоряющем напряжении 5 кВт, используя детектор отраженных электронов (BSE), который дает информацию как о топографии поверхности образца, так и первичные данные относительно локального состава компонентов за счет контраста (яркости) по среднему атомному номеру присутствующих в данной области образца элементов. Для снижения заряжения поверхности образцы помещали на проводящую подложку и на их поверхность напылением наносили пленку углерода.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Каталитические свойства в реакции ОКМ
В табл. 1 приведены результаты испытаний систем NaWMn/SiO2 и (Na)WMn/α-Al2O3 в реакции ОКМ, которые показывают существенные различия каталитических свойств образцов на двух носителях: суммарное содержание С2-углеводоров, образующихся при окислении метана при одинаковом составе нанесенного компонента, различается более чем в полтора раза. При отсутствии натрия в составе образца снижается величина конверсии метана и в еще большей степени – селективность по целевым продуктам (этан и этилен).
Таблица 1.
Результаты испытания образцов катализаторов в реакции ОКМ (50 мг катализатора, 860°C, CH4/O2 = 85/15)
| $\text{v}$, мл/мин | σ, % | S, % | τ, % | ΣC2, об. % |
|---|---|---|---|---|
| NaWMn/SiO2 | ||||
| 25 | 28.7 | 60.0 | 17.2 | 9.1 |
| 35 | 28.6 | 61.4 | 17.5 | 9.2 |
| 50 | 26.3 | 63.4 | 16.7 | 8.4 |
| 75 | 20.0 | 67.5 | 13.5 | 6.2 |
| 100 | 12.8 | 71.8 | 9.2 | 3.9 |
| NaWMn/Al2O3 | ||||
| 25 | 21.4 | 49.0 | 10.5 | 5.4 |
| 35 | 19.7 | 48.3 | 9.5 | 4.8 |
| 50 | 19.1 | 49.7 | 9.5 | 4.6 |
| 75 | 16.1 | 50.4 | 8.1 | 3.8 |
| 100 | 13.7 | 51.1 | 7.0 | 3.2 |
| WMn/Al2O3 | ||||
| 25 | 18.2 | 29.4 | 5.3 | 2.7 |
| 35 | 16.5 | 25.1 | 4.1 | 2.0 |
| 50 | 16.4 | 30.9 | 5.1 | 2.4 |
| 75 | 13.7 | 33.3 | 4.6 | 2.1 |
| 100 | 11.6 | 34.7 | 4.0 | 1.8 |
Полученный результат еще раз подтверждает влияние типа носителя и наличия ионов щелочного металла в составе нанесенного компонента на эффективность протекания каталитического процесса.
Рентгеновская фотоэлектронная спектроскопия
В обзорных спектрах образцов NaWMn/SiO2 присутствуют линии, характерные для вольфрама, кремния, углерода, кислорода, марганца и натрия. Независимо от условий предварительной обработки, положение и форма линий натрия остаются неизменными и соответствуют состоянию Na+. В спектрах свежеприготовленного образца NaWMn/SiO2, а также после ТПД кислорода в потоке инертного газа энергия связи электрона для пика W4f составляет 35.5 эВ, что типично для вольфрама в степени окисления 6+ [22]. В случае реокислинного образца линия W4f сдвинута в сторону меньших энергий связи (~35.1 эВ). Такой сдвиг описан ранее [23] для частично восстановленного вольфрама в составе нестехиометрического оксида WO3 – x. Однако его образование в условиях окислительной обработки выглядит крайне маловероятным. Более вероятно то, что смещение линии W4f обусловлено изменением стехиометрии присутствующих в системе соединений и, соответственно, катионного окружения ионов ${\text{WO}}_{4}^{{2 - }}$. Так, например, в работе [24] отмечается, что после обработки образца NaWMn/SiO2 в потоке кислорода при температуре 800°С, часть исходной фазы Na2WO4 переходит в Na4WO5. Таким образом, скорее всего, изменения степени окисления вольфрама при обработке в указанных режимах не происходит.
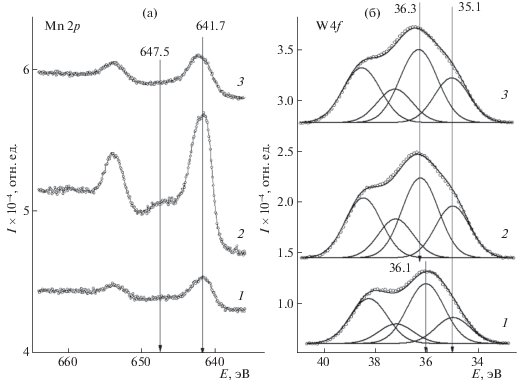
Анализ линии Mn2p показывает, что в исходном и реокисленном образцах марганец находится в состоянии Mn3+; в спектре образца после ТПД кислорода присутствует сателлитная компонента (Eсв = 647.5 эВ, см. рис. 1а), которая указывает на то, что марганец преимущественно находится в состоянии Mn2+ [25]. О появлении сателлита, характерного для Mn2+, после прогрева образца в потоке инертного газа при температуре 620°C сообщается в [8, 26]. По данным авторов [8], это состояние остается стабильным при охлаждении образца до комнатной температуры; обратный переход из Mn2+ в Mn3+ наблюдается лишь после того, как образец был выдержан на воздухе в течение 36 ч.
Рис. 1.
Рентгеновские фотоэлектронные спектры в области Mn2p для образца NaWMn/SiO2 (а) и в области W4f для образца NaWMn/α-Al2O3 в зависимости от условий предобработки: 1 – свежеприготовленный, 2 – после прогрева в токе инертного газа, 3 – после реокисления.
В обзорных спектрах образцов NaWMn/α-Al2O3 присутствуют линии, характерные для вольфрама, алюминия, углерода, кислорода, марганца и натрия. В этом случае состояние натрия также соответствует Na+.
Форма и положение спектральной линии W4f7/2 указывает на присутствие в образце двух различных состояний вольфрама – со значениями энергий связи электрона 34.9 и 36.1–36.3 эВ (рис. 1б). Первое из них обычно относят к частично восстановленному вольфраму в составе нестехиометрического оксида WO3 – x [23]. Значение 35.9–36.3 эВ являются типичным для вольфрама в степени окисления 6+, предположительно находящемуся в составе Na2WO4 или WO3. Важно отметить, что это значение несколько отличается от определенного для образцов NaWMn/SiO2 (35.5 эВ), что может быть, например, связано с различным взаимодействием между нанесенным компонентом и носителем.
Анализ линии Mn2p показал, что для всех образцов, в том числе и прогретого в токе аргона, марганец преимущественно находится в состоянии Mn3+, на что указывает отсутствие сателлитной компоненты в районе 647.5 эВ, характерной для Mn2+.
Таким образом, по данным РФЭС главные качественные отличия для NaWMn-образцов на разных носителях заключаются в следующем:
1. состояние вольфрама указывает на различия во взаимодействии нанесенного компонента с носителем;
2. при прогреве образца NaWMn/α-Al2O3 в токе аргона не происходит его восстановления (не появляется сателлитная линия, характерная для Mn2+), в отличие от образца NaWMn/SiO2, в котором происходит обратимый переход Mn3+ ↔ Mn2+.
В табл. 2 приведены отношения интенсивности линий элементов в фотоэлектронных спектрах, которые дают представление о соотношении их атомных концентраций на поверхности исследуемых образцов.
Таблица 2.
Соотношения атомных концентраций элементов на поверхности исследуемых образцов, рассчитанные на основании интенсивности линий в фотоэлектронных спектрах, в зависимости от условий предварительной обработки
| Условия обработки | Образец | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| NaWMn/SiO2 | NaWMn/α-Al2O3 | |||||||||
| Mn/Si | W/Si | Na/Si | Mn/W | Na/W | Mn/Al | W/Al | Na/Al | Mn/W | Na/W | |
| Свежеприготовленный | 0.03 | 0.019 | 0.12 | 1.4 | 6.4 | 0.047 | 0.042 | 0.22 | 1.1 | 5.3 |
| Прогрев в аргоне | 0.13 | 0.077 | 0.39 | 1.7 | 5.1 | 0.051 | 0.060 | 0.25 | 0.9 | 4.1 |
| Реокисление | 0.06 | 0.027 | 0.16 | 2.2 | 5.9 | 0.055 | 0.062 | 0.25 | 0.9 | 4.1 |
Прогрев образца NaWMn/SiO2 в токе аргона приводит к значительному росту относительной интенсивности сигналов нанесенных компонентов в спектре. В наибольшей степени возрастает отношение Mn : Si – в 4.3 раза (по сравнению с 4.0 и 3.2 для отношений W : Si и Na : Si, соответственно). Последующее реокисление образца в потоке кислорода приводит к некоторому снижению относительной интенсивности сигналов составляющих нанесенного компонента, однако оно по-прежнему остается более высоким по сравнению со свежеприготовленным образом.
Об относительном увеличении сигналов нанесенных компонентов в спектрах после десорбции кислорода, а также после обработки в условиях реакции ОКМ сообщается в работах [26–28].
В случае системы NaWMn/α-Al2O3 предварительная обработка оказывает слабое влияние на интенсивности сигналов нанесенных элементов в фотоэлектронных спектрах. После прогрева в потоке аргона наблюдается увеличение относительной интенсивности сигнала W в 1.5 раза по сравнению со свежеприготовленным образцом. При этом последующее реокисление не приводит к какому-либо заметному изменению интенсивности сигнала. То есть окислительно-восстановительная обработка в гораздо меньшей степени влияет на состояние нанесенного компонента, чем в образце NaWMn/SiO2.
Как видно из представленных данных, для обоих свежеприготовленных образцов атомное отношение Na : W > 2, т.е. выше стехиометрического для Na2WO4, что хорошо согласуется с литературой [8–10, 28–30]. Это может указывать на присутствие натрия на поверхности не только в форме данного вольфрамата. В образце NaWMn/SiO2 после десорбции кислорода наблюдается некоторое снижение отношения интенсивности сигналов Na : W, но при последующем реокислении оно вновь возрастает.
Образец NaWMn/SiO2
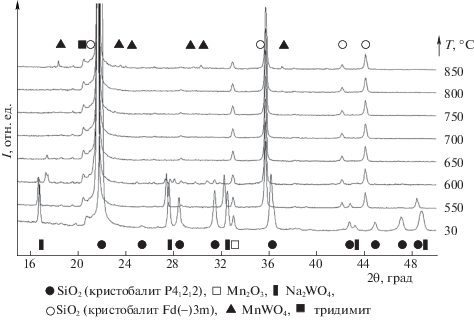
По данным РФА, основной фазой в свежеприготовленном образце NaWMn/SiO2 является оксид кремния со структурой α-кристобалита. Также на рентгенограмме присутствуют рефлексы, отвечающие фазам Na2WO4 и Mn2O3. Полученный результат хорошо согласуется как с имеющимися литературными данными [8–10, 26, 28–31], так и с результатами РФЭС исследования, описанными выше. Как показано ранее [26], нагрев образца в потоке инертного газа до 850°С и последующее охлаждение до комнатной температуры (скорость охлаждения 12 К/мин) приводит к образованию в нем фазы вольфрамата марганца и исчезновению рефлекса, относящегося к фазе Na2WO4; реокисление на воздухе приводит к восстановлению исходного фазового состава.
В данной работе изменения фазового состава, происходящие при прогреве образцов, более подробно прослежены с использованием методики РФА in situ. На рис. 2 приведена серия рентгенограмм, полученных при ступенчатом нагреве образца NaWMn/SiO2 в потоке воздуха. При нагреве образца до температуры 550°С наблюдается незначительное смещение рефлексов, относящихся к фазе кристобалита, обусловленное его переходом из тетрагональной модификации в кубическую, что хорошо согласуется с литературными данными [24]. При дальнейшем нагреве в диапазоне 550–600°С наблюдается заметное снижение интенсивности рефлексов, соответствующих фазе Na2WO4, и при температурах выше 650°С данную фазу зафиксировать не удается.
Следует отметить, что исчезновение рефлекса вольфрамата натрия наблюдается при температурах существенно ниже температуры его плавления (698°С [32]). Это, по-видимому, обусловлено его взаимодействием с другими компонентами системы, в первую очередь – адгезии к носителю. При плавлении Na2WO4 должна возрастать площадь контакта (что соответствует растеканию расплава по поверхности и согласуется с данными РФЭС) и, соответственно, снижаться величина теплоты плавления (на величину энергии взаимодействия носителя с расплавом соли); поскольку температура плавления определяется выражением
Сильное взаимодействие с носителем должно также приводить к изменению локального окружения атомов и искажению структуры ионов, в частности, ${\text{WO}}_{4}^{{2 - }}$, что зафиксировано в работе [7].
Отдельный интерес представляет поведение (возникновение и исчезновение) фазы вольфрамата марганца при обработке на воздухе. Следует отметить, что некоторые авторы наблюдали фазу MnWO4 в свежеприготовленном образце NaWMn/SiO2 [9, 27], которая, по-видимому, образуется в ходе пропитки носителя. В нашем случае при последовательной пропитке носителя с промежуточной сушкой эта фаза в ходе приготовления NaWMn-образцов не образуется. При прогреве на воздухе появление рефлексов, соответствующих фазе MnWO4, наблюдается только при достижении 850°С и обусловлено, по-видимому, тем, что содержание кислорода в воздухе при этой температуре близко к равновесному его давлению в реакции:
(1)
$\begin{gathered} {\text{M}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{4N}}{{{\text{a}}}^{ + }} + {\text{2WO}}_{4}^{{2 - }} \Leftrightarrow \\ \Leftrightarrow {\text{2MnW}}{{{\text{O}}}_{{\text{4}}}} + \left\{ {{\text{2N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}}} \right\} + 0.{\text{5}}{{{\text{O}}}_{{\text{2}}}}. \\ \end{gathered} $Запись этого уравнения в ионной форме оправдана тем, что указанная температура заведомо выше температуры плавления вольфрамата натрия, следовательно взаимодействие происходит в присутствии ионного расплава. Важным также представляется то, в какой химической форме – условно представленной как {Na2O} в уравнении (1) – находится натрий после ухода из расплава иона вольфрамата: от того, насколько сильно он в этой форме связан, зависят параметры равновесия реакции (1) и, соответственно, условия ее возможного протекания.
При прогреве в инертном газе переход Mn3+ → → Mn2+ происходит при более низких температурах. Уже в диапазоне 550–600°С наблюдается заметное снижение интенсивности рефлексов, соответствующих фазам Na2WO4 и Mn2O3; одновременно появляются рефлексы характерные для MnWO4, и их интенсивность увеличивается с ростом температуры. То есть образование вольфрамата марганца и выделение кислорода в инертном газе начинается при взаимодействии твердых Na2WO4 и Mn2O3. Последний вывод подробно обсуждается ниже в связи с данными ТПД кислорода.
Образец NaWMn/α-Al2O3
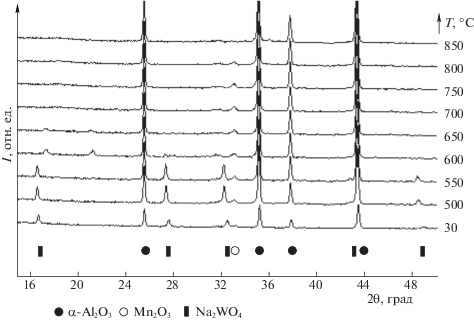
На рентгенограмме образца NaWMn/α-Al2O3 помимо основной фазы носителя (корунд) присутствуют рефлексы, соответствующие фазам Na2WO4 и Mn2O3. Как и в случае образца NaWMn/SiO2, при нагреве в потоке воздуха и аргона (рис. 3) начиная с 650°С (и выше) отсутствуют рефлексы, соответствующие фазе вольфрамата натрия. Однако при прогреве образца на основе оксида алюминия как на воздухе, так и в аргоне не удалось зафиксировать образования фазы вольфрамата марганца. Интенсивность рефлекса Mn2O3 снижается при температуре 850°C, но появление иных Mn-содержащих фаз зафиксировать не удалось.
Как было показано выше, каталитические свойства смешанной NaWMn-оксидной системы в реакции ОКМ существенно различаются при нанесении на оксиды кремния и алюминия. Данные, полученные методом РФА in situ, показывают, что эти системы различаются интенсивностью химического взаимодействия Mn2O3 как с твердым Na2WO4, так и с его расплавом с образованием MnWO4.
В свете полученных данных очевидно, что образование фазы MnWO4 в цикле оксиления-восстановления является необходимым условием для получения активной каталитической системы, поскольку протекание реакции (1) обеспечивает более быстрый переход Mn3+ ↔ Mn2+. При этом вольфрамат марганца является одним из двух состояний – восстановленным – активного компонента. В [26, 33] сообщается о присутствии фазы вольфрамата натрия в образце NaWMn/SiO2, отработанном в условиях реакции ОКМ. Авторы [31] исследовали ряд образцов NaWMn/SiO2 методом РФА в режиме in situ и показали, что в условиях реакции ОКМ (поток метан-кислородной смеси при 750°С) единственной фазой помимо кристобалита является вольфрамат марганца; по мере протекания реакции ОКМ наблюдалось снижение ее скорости и интенсивности рефлексов MnWO4.
Важно отметить при этом, что в системе WMn/α-Al2O3 по данным РФА исходно присутствует фаза MnWO4. Однако по активности и особенно селективности эта система заметно уступает даже образцу NaWMn/α-Al2O3, т.е. сам по себе вольфрамат марганца не обладает каталитической активностью в реакции ОКМ. Это может указывать на важную роль щелочного компонента в реокислении марганца, т.е. в протекании реакции (1) справа налево.
Интересно отметить, что, если образец WMn/α-Al2O3 дополнительно пропитать карбонатом натрия (в атомном отношении Na : W = 2), то прогрев до 850°С приводит к исчезновению рефлексов MnWO4, и появлению фаз Mn2O3 и Na2WO4. Как показано выше, прогрев образца NaWMn/SiO2 в инертном газе, наоборот, приводит к образованию вольфрамата марганца из Mn2O3 и Na2WO4. Это указывает на неустойчивость фазы MnWO4 на поверхности оксида алюминия (в отличие от SiO2) в присутствии ионов Na+.
Таким образом, наличие щелочного компонента обеспечивает “замыкание” окислительно-восстановительного цикла катализа, а характер взаимодействия нанесенных компонентов с носителем влияет на параметры равновесия реакции (1) и кинетику процессов окисления-восстановления.
Сканирующая электронная микроскопия
Микрофотографии участков образцов катализатора NaWMn/SiO2 приведены на рис. 4. Морфологически носитель представляет собой сросшиеся или контактирующие частицы округлой формы размером 0.5–2 мкм, которые образуют систему сообщающихся макропор. На поверхности носителя свежеприготовленного (рис. 4а) и реокисленного образцов (рис. 4б) наблюдаются две кристаллические структуры (фазы), различающиеся морфологией и составом. По данным ЭДС, фаза, которая выглядит более яркой, содержит натрий, вольфрам и кислород; вторая (менее “яркая”) фаза, представленная частицами размером от 100 нм до 1 мкм с более выраженными гранями, содержит марганец и кислород. Сопоставляя результаты с данными РФЭС и РФА, можно утверждать, что первая фаза представляет собой вольфрамат натрия, а вторая – Mn2O3.
Рис. 4.
Микрофотографии, полученные методом электронной сканирующей микроскопии: свежеприготовленный образец NaWMn/SiO2 (а), образец NaWMn/SiO2 после термодесорбции кислорода (б), образец NaWMn/SiO2 после реокисленния (в), свежеприготовленный образец NaWMn/α-Al2O3 (г), образец NaWMn/α-Al2O3 после термодесорбции кислорода (д).

После обработки в токе инертного газа, состав различимых структур меняется: яркие кристаллические области содержат марганец, вольфрам и кислород, а менее яркая аморфная фаза, располагающаяся тонким слоем между глобулами кристобалита, содержит преимущественно натрий, марганец и кислород. Полученные результаты аналогичны описанным ранее [26].
Следует обратить внимание на различия, наблюдаемые в окисленном состоянии до и после десорбции кислорода и реокисления (рис. 4а и в). Хотя по типу и составу наблюдаемых структур они практически идентичны, морфология частиц, присутствующих в образце фаз, различается. Частицы Na2WO4 и Mn2O3 после окислительно-восстановительной обработки становятся более мелкими и располагаются более равномерно на поверхности глобул носителя. С одной стороны, это может указывать на то, что такие частицы образуются из аморфной фазы (расплава), покрывающего частицы носителя при высокой температуре, и на высокую адгезию как аморфной, так и вновь образующихся кристаллических фаз к поверхности кристобалита. С другой стороны, эти наблюдения хорошо согласуются с данными РФЭС, указывающими на редиспергирование нанесенного компонента в ходе такой обработки.
Частицы носителя катализатора NaWMn/Al2O3 состоят из крупных хаотично расположенных агломератов, преимущественно сформированных из сросшихся параллельно упакованных округлых пластинчатых кристаллов размером до 3 мкм. В свежеприготовленном образце (рис. 4г) ярко выражено наличие нанесенных частиц округлой формы размером от 50 до 300 нм (более светлая фаза по сравнению с фазой носителя), тогда как в образце после десорбции кислорода оформленных кристаллических частиц этого типа не наблюдается (рис. 4д). В образцах также хорошо различима фаза, содержащая W (яркие белые участки). В то же время, судя по контрасту поверхности, в образце, обработанном в токе инертного газа частицы нанесенных фаз менее однородны по составу.
В отличие от образца NaWMn/SiO2, спектральный анализ участков поверхности свежеприготовленного NaWMn/α-Al2O3 (рис. 4г) не позволяет делать однозначный вывод об элементном составе нанесенных фаз. Учитывая данные РФА и РФЭС, определенно можно произвести лишь отнесение округлых частиц к фазе Mn2O3. В ярких белых областях преимущественно сконцентрированы Na и W, при этом соотношение этих элементов варьируется; в спектрах некоторых участков отмечается присутствие Mn, возможно – за счет фона, обусловленного присутствием марганца на носителе или ввиду близкого расположения содержащих марганец частиц к спектрально оцениваемой области.
В спектрах большинства исследованных участков образца NaWMn/α-Al2O3, прогретого в токе инертного газа, присутствуют линии Mn, Na и W. При этом области, содержащие главным образом марганец, представлены не сформированными частицами, а скорее аморфной фазой, покрывающей кристаллические пластинки носителя (см. рис. 4д). Возможно, именно с аморфизацией фазы, содержащей марганец, связано исчезновение рефлекса Mn2O3 на дифрактограмме, полученной при 850°С в атмосфере аргона.
После прогрева образца NaWMn/α-Al2O3 в токе инертного газа (рис. 4д), замечено, что в спектрах большинства областей, которые отличаются по контрасту от поверхности носителя, присутствуют Mn, Na и W. При этом участки, содержащие преимущественно марганец, в спектрах представлены не сформированными частицами, а скорее аморфной фазой, покрывающей кристаллические пластинки носителя.
Таким образом, в обоих состояниях (свежеприготовленном и после прогрева в инертном газе) в образце NaWMn/SiO2 марганец присутствует в виде хорошо окристаллизованных частиц – оксида (Mn2O3) и вольфрамата, соответственно. В случае же исходного образца NaWMn/α-Al2O3, фаза Mn2O3 хуже окристаллизована. После прогрева при 850°С в инертном газе (по данным РФА) содержащие марганец кристаллические фазы вообще отсутствуют в образце. Это может указывать на более сильное взаимодействие Mn-содержащих соединений (в первую очередь – оксида) с корундом по сравнению с кристобалитом.
Данные СЭМ наглядно показывают, что зафиксированное методами РФЭС и РФА разница в поведении образцов NaWMn-оксида на SiO2 и α-Al2O3 в ходе окислительно-восстановительной обработки обусловлена различиями во взаимодействии между нанесенными компонентами и носителями. По-видимому, оксидные соединения марганца имеют более высокое сродство к α-Al2O3, а ионы натрия – к SiO2, чем обусловлен сильный сдвиг равновесия реакции (1) на поверхности корунда влево по сравнению с кристобалитом, на котором оно близко к оптимальному для протекания процессов восстановления и окисления активного компонента.
Термопрограммированная десорбция кислорода
На рис. 5 представлены данные по ТПД кислорода с образца NaWMn/SiO2. В случае свежеприготовленного образца (кривая А) заметная десорбция кислорода начинается при ~640°С, и на кривой его выделения удается выделить лишь один выраженный пик.
Рис. 5.
Кривые термодесорбции кислорода с образца NaWMn/SiO2: свежеприготовленный образец (а), после термодесорбции кислорода и реокисления (б).
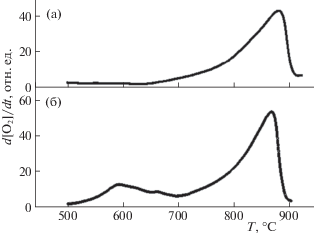
При повторном прогреве после реокисления наблюдается более сложная картина. Заметное выделение кислорода начинается уже при ~500°С; его скорость достигает максимума при ~590°С, после чего идет на спад, что характерно для процессов взаимодействия твердых реагентов. Такое увеличение скорости процесса при повторной десорбции объясняется изменением дисперсности и взаимного расположения частиц фаз Mn2O3 и Na2WO4, что зафиксировано методами РФЭС и СЭМ. Важно отметить, что в последующих циклах реокисления–десорбции характер кривых ТПД более не изменяется, что указывает на стабилизацию морфологии системы уже в ходе первого цикла восстановления-реокисления.
В районе 620–630°С на кривой Б наблюдается хорошо воспроизводимое ускорение десорбции, после которого (выше 700°С) происходит непрерывный рост скорости выделения кислорода, который заканчивается выше 850°С. Интересно, что при первой десорбции образец выделяет 54 мкмоль O2/г, то во втором цикле – 83.5 мкмоль O2/г. Исходя из количества марганца в образце и стехиометрии выделения кислорода при переходе Mn2+ → Mn3+, максимально возможно выделение 87.5 мкмоль O2/г. То есть во втором (и последующих) циклах восстановления–реокисления в процесс оказывается вовлечен практически весь содержащийся в образце марганец.
Важно также отметить, что всплеск на кривой ТПД наблюдается при той же температуре (между 600 и 650°С), при которой при прогреве на воздухе, когда еще не происходит восстановление и нет химических превращений в системе, исчезают рефлексы фазы вольфрамата натрия, что свидетельствует о его плавлении. А появление в системе расплава обеспечивает гораздо лучший контакт между Mn2O3 и Na2WO4. Возможен и частичный переход в расплав ионов марганца, что должно также увеличить скорость его окислительно-восстановительных превращений.
В случае образца NaWMn/α-Al2O3 выделения кислорода в режиме ТПД не наблюдалось. В сочетании с данными, полученными другими методами, это подтверждает прямую связь между выделением кислорода и возможностью образования MnWO4 на разных носителях.
Таким образом, данные, полученные физико-химическими методами (РФЭС, РФА in situ, СЭМ/ЭДС, ТПД кислорода), показывают, что на окислительно-восстановительные свойства смешанного NaWMn-оксида, нанесенного на SiO2 и α-Al2O3, существенное влияние оказывает характер и сила взаимодействия нанесенных компонентов с носителем. Это, в свою очередь, в значительной мере определяет различия в каталитических свойствах систем NaWMn/SiO2 и NaWMn/α-Al2O3 в реакции окислительной конденсации метана.
Работа выполнена в рамках государственного задания ИХФ РАН 0082-2014-0007, номер государственной регистрации АААА-А18-118020890105-3 и гранта Российского фонда фундаментальных исследований (код проекта 17-33-50066).
Список литературы
Крылов О.В., Арутюнов В.С. Окислительные превращения метана // М.: Наука, 1998. 350 с.
Zavyalova U., Holena M., Schlögl R., Baerns M. // CHEMCATCHEM. 2011. V. 3. № 12. P. 1935.
Fang X.P., Li S.B., Lin J.Z., Chu Y.L. // J. Molec. Catal. (China). 1992. V. 6. P. 255.
Fang X.P., Li S.B., Lin J.Z., Chu Y.L. // Ibid. 1992. V. 6. P. 427.
Arndt S., Otremba T., Simon U. et al. // Appl. Catal. A: General. 2012. V. 425–426. P. 53.
Jiang Z., Yu C., Fang X., Li S., Wang H. et al. // J. Phys. Chem. 1993. V. 97. P. @
Wu J., Li S. // J. Phys. Chem. 1995. V. 99. P. 4566.
Kou, Y. Zhang, B. Niu, J. et al. // J. Catal. 1998. V. 173. P. 339.
Ji S., Xiao T., Li S. et al. // Appl. Catal. A. 2002. V. 225. P. 271.
Wang D., Rosynek M.P., Lunsford J.H. // J. Catal. 1995. V. 155. P. 390.
Serres T., Aquino C., Mirodatos C., Schuurman Y. // Appl. Catal. A. 2015. V. 504. P. 509.
Wu J., Li S., Niu J., Fang X. // Appl. Catal. A General. 1995. V. 124. № 1. P. 9.
Liu Y., Hou R., Liu X. et al. // Stud. Surf. Sci. Catal. 1998. V. 119. P. 307.
Li S.-B. // Chinese J. Chem. 2001. V. 19. № 1. P. 16.
Beck B., Fleischer V., Arndt S. et al. // Catal. Tod. 2014. V. 228. P. 212.
Fleischer V., Steuer R., Parishan S., Schomäcker R. // J. Catal. 2016. V. 341. P. 91.
Gordienko Y., Usmanov T. Bychkov V. et al. // Catal. Tod. 2016. V. 278. № 1. P. 127.
Ломоносов В.И., Гордиенко Ю.А., Синев М.Ю. и др. // Журн. физ. химии. 2018. № 3. С. 386.
Palermo A., Vazquez J.P.H., Lee A.F. et al. // J. Catal. 1998. V. 177. P. 259.
Ломоносов В.И., Гордиенко Ю.А., Синев М.Ю. // Кинетика и катализ. 2013. Т. 54. № 4. С. 474.
Scofield J.H. // Electron Spectrosc. Relat. Phenom. 1976. V. 8. P. 129.
Bhosale N.Y., Mali S.S., Hong Ch.K., Kadam A.V. // Electrochimica Acta. 2017. V. 246. P. 1112.
Bussolotti F., Lozzi L., Passacantando M. et al. // Surface Science. 2003. V. 538. P. 113.
Hou S., Cao Y., Xiong W., Liu H., Kou Yu. // Ind. Eng. Chem. Res. 2006. V. 45. P. 7077.
Biesinger M.C., Payne B.P., Grosvenor A.P. et al. // Applied Surface Science. 2011. V. 257. P. 2717.
Sinev M., Ponomareva E., Sinev I. et al. // Catal. Today (in press).
Pak S., Lunsford J.H. // Appl. Catal. A. 1998. V. 168. P. 131.
Trenton W., Elkins Helena E. Hagelin-Weaver // Appl. Catal. A. 2011. V. 497. P. 96.
Wang J., Chou L., Zhang B. et al. // J. Mol. Catal. A. 2006. V. 245. P. 272–277.
Dedov A.G., Nipan G.D., Loktev A.S. et al. // Appl. Catal. A. 2011. V. 406. P. 1.
Yildiz M., Aksu Y., Simon U., Otremba T. et al. // Appl. Catal. A. 2016. V. 525. P. 168.
CRC Handbook Chemistry and Physics, in: David R. Lide (Ed.), 85th edition, CRC Press, 2004.
Simon U., Görke O., Berthold A., Arndt S. et al. // Chem. Eng. J. 2011. V. 168. P. 1352.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии