Журнал физической химии, 2019, T. 93, № 3, стр. 358-362
Фазовое и химическое равновесия в системе 2NaHCOO + Ca(NO3)2 $ \rightleftarrows $ Ca(HCOO)2 + 2NaNO3 – H2O при 25°С
А. М. Елохов a, b, *, Л. М. Лукманова a, О. С. Кудряшова b
a Пермский государственный национальный исследовательский университет
614990 Пермь, Россия
b Естественнонаучный институт Пермского государственного национального исследовательского университета
614990 Пермь, Россия
* E-mail: elhalex@yandex.ru
Поступила в редакцию 10.05.2018
Аннотация
Изучены фазовые и конверсионные равновесия в четырехкомпонентной взаимной водно-солевой системе 2NaHCOO + Ca(NO3)2$ \rightleftarrows $ Ca(HCOO)2 + 2NaNO3 – H2O при 25°С. Установлены оптимальные концентрационные параметры процесса получения формиата кальция из формиата натрия и нитрата кальция.
Формиаты металлов широко используются в различных отраслях промышленности: в строительстве в качестве противоморозной и пластифицирующей добавки (формиаты натрия, калия, кальция), в качестве компонентов антигололедных реагентов (формиаты натрия и калия), хладоносителей на основе органических солей (формиат калия) и минеральных удобрений (формиат кальция) [1–3]. Формиаты переходных и редкоземельных металлов применяются в качестве исходных компонентов для производства высокотемпературных сверхпроводников, высокодисперсных и наноразмерных оксидов, катализаторов гидрирования и окисления органических веществ [4, 5]. Формиат кальция используется в качестве консерванта и солезаменителя в пищевой промышленности, а также консерванта в косметологии, ветеринарии, текстильной и целлюлозно-бумажной промышленности [6].
Известен ряд способов синтеза формиата кальция из гидроксида или карбоната кальция и формальдегида, муравьиной кислоты или монооксида углерода [7–9]. Недостатками указанных способов является проведение процесса при повышенной температуре и давлении, а также необходимость упаривания реакционной смеси для получения кристаллического продукта и высокая скорость коррозии технологического оборудования вследствие использования кислот.
Наиболее экологически безопасным и простым способом получения водорастворимых солей является конверсионный [10, 11]. Из формиата натрия, являющегося побочным продуктом производства пентаэритрита или хлороформа [12–14], предложено получать формиат калия [15] или формиат кальция [16, 17] конверсией с сульфатом калия или хлоридом кальция.
С целью установления возможности получения кристаллического формиата кальция из формиата натрия и нитрата кальция конверсионным способом впервые изучена растворимость в четырехкомпонентной взаимной водно-солевой системе 2NaHCOO + Ca(NO3)2$ \rightleftarrows $ Ca(HCOO)2 + + 2NaNO3 – H2O при 25°С. Выбор температуры исследования обусловлен тем, что растворимость формиата кальция мало зависит от температуры. В интервале 0–100°C растворимость соли изменяется на 1.6 мас. %, поэтому кристаллизация соли при температурах близких к комнатным представляется наиболее целесообразной.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использованы формиаты натрия и кальция, нитрат натрия и тетрагидрат нитрата кальция квалификации “ч.д.а.”; дистиллированная вода ($n_{{\text{D}}}^{{25}}$ = 1.3325).
Для определения растворимости и составов твердых фаз в многокомпонентных водно-солевых системах использован изотермический метод сечений Р.В. Мерцлина [18, 19] и прогностический метод [20]. В качестве физического свойства исследован показатель преломления жидкой фазы, который измерялся на рефрактометре ИРФ-454Б. Растворимость индивидуальных солей и их смесей в воде определена с точностью 0.5 мас. %.
Процесс получения формиата кальция в лабораторных условиях осуществляли в стеклянном реакторе с рубашкой при постоянном перемешивании. Растворяли расчетное количество тетрагидрата нитрата кальция или формиата натрия в воде, после чего в реактор вводили эквивалентное количество второй соли. Окончание реакции и завершение процесса кристаллизации формиата кальция фиксировали по постоянству показателя преломления жидкой фазы. Продолжительность конверсии составляла 30–40 мин. Осадок отделяли фильтрованием под вакуумом и сушили до постоянной массы. Содержание формиата кальция в осадке вычисляли по результатам комплексонометрического определения кальция с эриохромом черным Т.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Соли образующие четырехкомпонентную взаимную систему в водных растворах связаны обратимой химической реакцией
Установлено, что трехкомпонентные оконтуривающие системы NaНСOO–Ca(HCOO)2–H2O [16] и NaNO3–Ca(NO3)2–H2O [22], NaНСOO–NaNO3–H2O, Ca(HCOO)2–Ca(NO3)2–H2O, являются системами простого эвтонического типа. При изученной температуре нитрат натрия, формиаты натрия и кальция кристаллизуются в виде безводных солей, нитрат кальция – в виде тетрагидрата. Состав эвтонических растворов указанных систем приведен в табл. 1. Области кристаллизации нитрата натрия и формиата кальция занимают большую часть диаграмм растворимости, за исключением системы NaНСOO–NaNO3–H2O, где области кристаллизации обеих солей имеют близкую площадь.
Таблица 1.
Состав насыщенных растворов четырехкомпонентной взаимной системы 2HCOONa + Ca(NO3)2$ \rightleftarrows $ $ \rightleftarrows $ (HCOO)2Ca + 2NaNO3 – H2O
| Состав насыщенного раствора, мас.% | Солевой состав раствора, мас.% | $n_{{\text{D}}}^{{{\text{25}}^\circ }}$ | Твердая фаза | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| HCOONa | (HCOO)2Сa | Ca(NO3)2 | NaNO3 | H2O | HCOONa | (HCOO)2Сa | Ca(NO3)2 | NaNO3 | ||
| 38.5 | 0.0 | 0.0 | 22.0 | 39.5 | 63.6 | 0.0 | 0.0 | 36.4 | 1.4070 | NaHCOO + NaNO3 |
| 0.0 | 4.0 | 55.5 | 0.0 | 40.5 | 0.0 | 6.7 | 93.3 | 0.0 | 1.4430 | Сa(HCOO)2 + Ca(NO3)2 · 4H2O |
| 49.0 | 1.3 | 0.0 | 0.0 | 49.7 | 97.4 | 2.6 | 0.0 | 0.0 | 1.3955 | NaHCOO + Сa(HCOO)2 |
| 47.6 | 1.0 | 0.0 | 1.3 | 50.1 | 95.3 | 2.1 | 0.0 | 2.6 | 1.3975 | NaHCOO + Сa(HCOO)2 |
| 39.2 | 1.8 | 0.0 | 21.1 | 37.9 | 63.1 | 2.9 | 0.0 | 34.0 | 1.406 | NaHCOO + Сa(HCOO)2 |
| 21.4 | 1.9 | 0.0 | 40.7 | 36.0 | 33.4 | 3.0 | 0.0 | 63.6 | 1.4070 | NaHCOO + Сa(HCOO)2 + NaNO3 |
| 0.0 | 5.0 | 0.0 | 44.0 | 51.0 | 0.0 | 10.2 | 0.0 | 89.8 | 1.3915 | NaNO3 + Сa(HCOO)2 |
| 14.6 | 2.0 | 0.0 | 34.0 | 49.5 | 28.8 | 4.0 | 0.0 | 67.2 | 1.396 | NaNO3 + Сa(HCOO)2 |
| 0.0 | 3.5 | 30.6 | 20.4 | 45.5 | 0.0 | 6.4 | 56.1 | 37.4 | 1.4145 | NaNO3 + Сa(HCOO)2 |
| 0.0 | 0.8 | 50.0 | 12.5 | 36.7 | 0.0 | 1.3 | 79.0 | 19.7 | 1.4555 | NaNO3 + Сa(HCOO)2 |
| 0.0 | 0.7 | 9.5 | 57.8 | 32.0 | 0.0 | 1.0 | 14.0 | 85.0 | 1.4600 | Сa(HCOO)2 + Ca(NO3)2 · 4H2O + NaNO3 |
| 0.0 | 2.5 | 56.7 | 6.3 | 34.5 | 0.0 | 3.8 | 86.6 | 9.6 | 1.4380 | Сa(HCOO)2 + Ca(NO3)2 · 4H2O |
| 0.0 | 2.9 | 52.4 | 3.8 | 41.0 | 0.0 | 4.9 | 88.7 | 6.4 | 1.4450 | Сa(HCOO)2 + Ca(NO3)2 · 4H2O |
| 0.0 | 0.0 | 51.6 | 10.5 | 38.0 | 0.0 | 0.0 | 83.1 | 16.9 | 1.4565 | NaNO3 + Ca(NO3)2 · 4H2O |
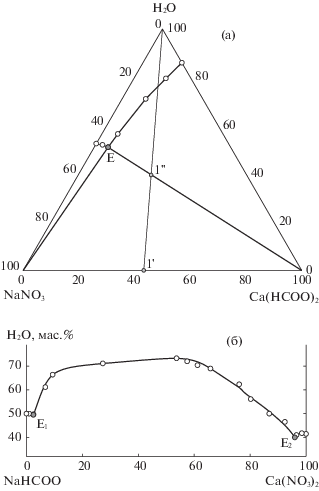
Растворимость в четырехкомпонентной системе изучена с помощью семи разрезов, два из которых соответствуют диагоналям солевого квадрата, а остальные проходят через точки, лежащие в вершинах формиата кальция, воды и на сторонах солевого квадрата. Диагональный разрез Ca(HCOO)2–NaNO3–H2O является системой простого эвтонического типа, что подтверждает теоретический расчет по определению стабильной пары солей (рис. 1а). Поле кристаллизации нитрата натрия значительно меньше, чем у формиата кальция, что указывает на высаливающий эффект нитрата натрия в отношении формиата кальция. В диагональном разрезе NaHCOO–Ca(NO3)2–H2O [21], кроме полей кристаллизации безводного формиата натрия и тетрагидрата нитрата кальция, присутствует поле кристаллизации безводного формиата кальция (рис. 1б). При изучении этого разреза уточнен состав эвтонического раствора, насыщенного относительно формиата и нитрата кальция (табл. 1).
Рис. 1.
Изотермы растворимости трехкомпонентных систем NaNO3−Ca(HCOO)2−H2O (а) и Ca(NO3)2− NaНСOO−H2O (б).
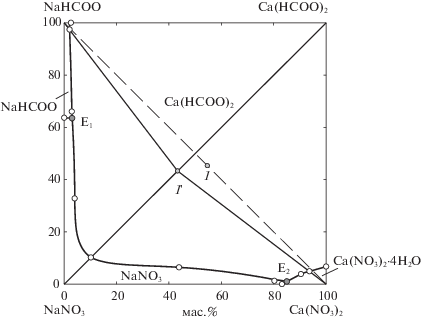
Большую часть диаграммы растворимости четырехкомпонентной взаимной системы занимают поля кристаллизации безводных формиата кальция, нитрата и формиата натрия; нитрат кальция кристаллизуется в виде тетрагидрата (рис. 2, табл. 1). Растворы, отвечающие составам эвтонических точек Е1 и Е2 являются конгруэнтно насыщенными. При изотермическом испарении смесей компонентов системы кристаллизация твердых фаз закончится в точке Е2, где выделяются нитраты натрия и кальция, формиат кальция.
Рис. 2.
Изотерма растворимости четырехкомпонентной взаимной системы 2NaHCOO + Ca(NO3)2$ \rightleftarrows $ Ca(HCOO)2 + 2NaNO3 – H2O.
В сравнении с системой 2NaHCOO + CaCl2$ \rightleftarrows $ $ \rightleftarrows $ Ca(HCOO)2 + 2NaNO3 – H2O [16] изученная четырехкомпонентная система характеризуется большим размером области кристаллизации безводного формиата натрия и меньшей областью кристаллизации нитрата натрия, что связано с различной растворимостью и высаливающей способностью хлорида и нитрата натрия. Обращает на себя внимание значительное увеличение размеров области кристаллизации тетрагидрата нитрата кальция в сравнении с областью кристаллизации гексагидрата хлорида кальция. Очевидно, хлорид кальция обладает большей высаливающей способностью, чем нитрат кальция.
Полученные экспериментальные данные позволили оптимизировать параметры процесса конверсии для получения максимального выхода формиата кальция. Исходя из перспективной проекции диаграммы растворимости системы 2NaHCOO + Ca(NO3)2$ \rightleftarrows $ Ca(HCOO)2 + 2NaNO3 – – H2O (рис. 2) установлено, что при 25°С максимальный выход формиата кальция получится, если солевой состав исходной смеси будет соответствовать т. 1, а конечный солевой состав смеси после протекания процесса конверсии будет отвечать т. 1', которая располагается на стабильной диагонали. Оптимальная концентрация воды в реакционной смеси определена по диаграмме растворимости стабильной диагонали Ca(HCOO)2–NaNO3–H2O (рис. 1а). Максимальному выходу формиата кальция соответствует точка 1'' отвечающая пересечению луча кристаллизации H2O-1' и предельной ноды области кристаллизации формиата кальция Ca(HCOO)2–Е.
Эксперименты показали, что в оптимальных условиях выход и чистота получаемого формиата кальция практически не зависит от порядка введения солей в раствор, при этом содержание примесей можно значительно снизить, промывая полученный осадок насыщенным раствором формиата кальция. Максимальный выход формиата кальция составил 76%, содержание основного вещества в продукте 97% (табл. 2).
Таблица 2.
Результаты лабораторных экспериментов по получению формиата кальция в системах 2NaHCOO + CaAn2$ \rightleftarrows $ Ca(HCOO)2 + 2NaAn – H2O
| Состав исходной смеси, мас. % | Выход Ca(HCOO)2 | Ca(HCOO)2 в осадке, % | Порядок введения солей | |||
|---|---|---|---|---|---|---|
| NaHCOO | CaAn2 | H2O | % (по Ca) | г/100 г исх. смеси | ||
| 24.75 | 20.25 | 55.00 | 79.04 | 18.76 | 99.24 | I – CaCl2, II – NaHCOO |
| 73.70 | 17.50 | 99.62 | I – NaHCOO, II – CaCl2 |
|||
| 27.20 | 32.80 | 40.00 | 65.70 | 17.48 | 96.86 | I – Ca(NO3)2, II – NaHCOO |
| 72.12 | 19.22 | 97.56 | I – NaHCOO, II – Ca(NO3)2 |
|||
Сравнивая оптимальные концентрационные параметры и чистоту получаемого продукта при синтезе формиата кальция из формиата натрия и солей кальция (нитрата или хлорида), следует отметить, что, несмотря на близкий выход целевого продукта, получение формиата кальция из хлорида натрия можно проводить из более разбавленных растворов, имеющих меньшую вязкость, что в итоге приводит к получению более чистого продукта. С другой стороны, основной примесью формиата кальция полученного из хлорида кальция является хлорид натрия, который не препятствует использованию формиата кальция в пищевой промышленности.
Основным недостатком предложенного метода является образование большого количества маточного раствора, представляющего собой насыщенный относительно нитрата или хлорида натрия и формиата кальция раствор. Изотермическое упаривание полученного раствора позволяет получить твердую смесь двух солей, которая может использоваться в качестве компонента противогололедных материалов.
Таким образом, выполненные исследования показали принципиальную возможность получения формиата кальция из формиата натрия и нитрата кальция конверсионным способом. Проведенные лабораторные эксперименты показали, что формиат кальция с содержанием основного вещества более 97% может быть получен как из хлорида, так и из нитрата кальция.
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации (задания 4.5947.2017/6.7 и 5.6881.2017/8.9).
Список литературы
Корчунов И.В., Свентская Н.В. // Успехи в химии и химической технологии. 2016. Т. 30. №. 7. С. 50.
Heikal M. // Cement and Concrete Research. 2004. V. 34. № 6. P. 1051.
Данилов В.П., Фролова Е.А., Кондаков Д.Ф. и др. // Химическая технология. 2011. Т. 12. № 3. С. 134.
Khimchenko Y.I., Khvorov M.M., Chirkov A.S., Kosorukov A.A. // Powder Metallurgy and Metal Ceramics. 1983. V. 22. № 5. P. 336.
Полир З., Хике М., Хинце Д. Получение Cu/Zn/Al-катализаторов формиатным способом. Пат. 2372987 (RU). Опубл. 20.11.2009. Бюл. № 32.
Сарафанова Л.А. Пищевые добавки: энциклопедия. СПб.: Гиорд, 2004. 808 с.
Вендило А.Г., Факеев А.А. Способ получения формиата кальция. Пат. 2564856 RU. Опубл. 10.10.15.
Вергунова Н.Г., Филиппова В.А., Блажин Ю.М. Способ получения формиата кальция. Пат. 1474157 SU. Опубл. 23.04.89, Бюл. № 15.
Абакова З.И., Агаркина Е.Н., Кранк Е.И. и др. Способ получения формиата кальция. Пат. 2057113 RU. Опубл. 27.03.1996.
Викторов М.М. Графические расчеты в технологии неорганических веществ. Л.: Химия, 1972. 462 с.
Кудряшова О.С. Круговые изогидрические процессы получения водорастворимых солей калия. Пермь: ПГНИУ, 2013. 120 с.
Berlow E., Barth R.H., Snow J.E. The pentaerythritols. N.Y.: Reinhold Publ. Corp., 1958. 387 p.
Андрейчатенко В.В., Боровнев Л.М., Голубев А.Н. и др. Способ одновременного получения хлороформа и соли муравьиной кислоты. Пат. 2076854 РФ. Опубл. 10.04.97. Бюл. № 10.
Абрамов О.Б., Андрейчатенко В.В., Боровнева Н.И. и др. Способ одновременного получения хлороформа и формиата натрия. Пат. 2222521 РФ. Опубл. 27.01.04, Бюл. № 3.
Кудряшова О.С., Матвеева К.Р., Бабченко Н.А., Глушанкова И.С. // Башкирский химический журнал. 2012. Т. 19. № 3. С. 29.
Горденчук А.Д., Кудряшова О.С. // Журн. неорган. химии. 2017. Т. 62. № 8. С. 1102.
Горденчук А.Д., Елохов А.М., Кудряшова О.С. // Вестн. Технологического ун-та. 2017. Т. 20. № 22. С. 9.
Никурашина Н.И., Мерцлин Р.В. Метод сечений. Приложение его к изучению многофазного состояния многокомпонентных систем. Саратов: Саратовск. ун-т, 1969. 120 с.
Журавлев Е.Ф., Шевелева А.Д. // Журн. неорган. химии. 1960. Т. 5. № 11. С. 2630.
Мазунин С.А. // Вестн. Пермского ун-та. Серия: Химия. 2012. № 2. С. 73.
Горденчук А.Д., Кудряшова О.С. // Химическая технология. 2017. № 7. С. 291.
Коган В.Б., Фридман В.Г., Кафаров В.В. Справочник по растворимости. М.-Л., 1969. Т. 3.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


