Журнал физической химии, 2019, T. 93, № 3, стр. 369-372
Коэффициенты самодиффузии кумаровой и кофейной кислот в смесях тетрахлорметан–ацетон-d6
В. А. Голубев a, *, Д. Л. Гурина a
a Российская академия наук, Институт химии растворов им. Г.А. Крестова
Иваново, Россия
* E-mail: vag@isc-ras.ru
Поступила в редакцию 22.05.2018
Аннотация
Методом спинового эха 1H ЯМР с импульсным градиентом магнитного поля исследована самодиффузия п-кумаровой и кофейной кислот в бинарном растворителе тетрахлорметан–ацетон-d6 при температурах 278, 298 К и малой концентрации растворенного вещества. Согласно полученным данным величина коэффициентов самодиффузии для кофейной кислоты ниже, чем для п-кумаровой кислоты. Рассчитанные из уравнения Стокса–Эйнштейна гидродинамические радиусы кислот ниже в тетрахлорметане, чем в ацетоне-d6. Данное поведение связано с увеличением степени гетероассоциации кислота–ацетон. Молекулярная ассоциация проявляет себя также в изменении химических сдвигов протонов карбоксильной и гидроксильной групп в молекулах исследуемых кислот.
Гидроксикоричные кислоты представляют собой большой класс фенольных соединений, включая кофейную, п-кумаровую, феруловую, синаповую кислоты. Данные соединения содержатся во многих видах растений и, обладая антиоксидантной, противовоспалительной, антимикробной, гепатопротекторной активностью, имеют большое значение для биомедицины [1–3]. Известно, что электронные взаимодействия и образование водородных связей гидроксильными и карбоксильными группами оказывают влияние на физико-химические свойства фенольных кислот [4–6]. Если в инертном растворителе, например, в сверхкритическом диоксиде углерода или тетрахлорметане гидроксикоричные кислоты имеют низкую растворимость (порядка 10–7 мол. доли), то при добавлении полярного сорастворителя (который может выступать в роли донора и/или акцептора протона, например, метанол или ацетон), растворимость резко возрастает, что связывают с сильными взаимодействиями между растворенным веществом и сорастворителем посредством образования водородной связи через карбоксильный и гидроксильный протоны [7–9]. В данной работе методами 1H ЯМР-спектроскопии впервые проведено исследование гетероассоциации п-кумаровой и кофейной кислот в смесях инертного (тетрахлорметан) и полярного (ацетон) растворителей, измерены химические сдвиги протонов и коэффициенты самодиффузии кислот.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовались тетрахлорметан (SIGMA-ALDRICH, anhydrous, >99.5%), ацетон-d6 (ALDRICH, 99.9% D, 0.03% TMS), кофейная и п-кумаровая кислоты (SIGMA ≥98%, HPLC) без дополнительной очистки. Растворы готовились гравиметрически на весах марки AND HR-150AZ с точностью 0.1 мг.
Измерения химических сдвигов и коэффициентов самодиффузии были выполнены на спектрометре Bruker Avance III 500 BioSpin с датчиком TBI при использовании 5 мм стандартных ампул. Данные по самодиффузии были получены при использовании программы Bruker dstegp3s для подавления возможной конвекции в образце [10, 11]. Время диффузии во всех измерениях составляло 0.1 с. Длительность градиентных импульсов варьировалась в зависимости от состава смеси и растворенного вещества. Температура калибровалась стандартными образцами метанола и этиленгликоля. Температурная стабильность контролировалась блоками Bruker BVT-3000 и BCU-05 с точностью поддержания ±0.1 K. Погрешность в воспроизводимости коэффициентов самодиффузии не превышала 3%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Коэффициенты самодиффузии и химические сдвиги протонов кофейной и п-кумаровой кислот были измерены в смешанном растворителе тетрахлорметан – ацетон-d6 при температурах 278, 298 K и малой концентрации растворенного вещества. Концентрация кислот во всех растворах не превышала 1 × 10–3 мольной доли. Коэффициенты самодиффузии и химические сдвиги протонов кислот в тетрахлорметане не были получены по причине их плохой растворимости в данном растворителе.
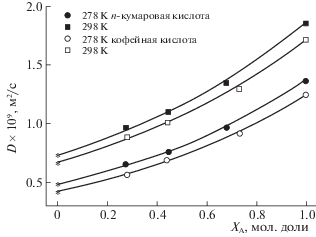
Согласно полученным данным коэффициенты самодиффузии увеличиваются с ростом температуры и концентрации ацетона-d6 (рис. 1). Следует отметить, что увеличение концентрации менее вязкого компонента не всегда приводит к увеличению коэффициента самодиффузии. Примером является система тетрахлорметан–метанол, для которой наблюдается минимум концентрационной зависимости коэффициентов самодиффузии [11, 12]. Величина коэффициентов самодиффузии кофейной кислоты ниже соответствующей величины для п-кумаровой кислоты (рис. 1).
Рис. 1.
Концентрационные зависимости коэффициентов самодиффузии п-кумаровой и кофейной кислот в смеси тетрахлорметан – ацетон-d6 (${{x}_{{\text{A}}}}$ – мольная доля ацетона, сплошная линия – уравнение (1)).
Концентрационные зависимости коэффициентов самодиффузии в пределах экспериментальной ошибки были описаны уравнением типа [13]:
где $D_{K}^{i}$ – коэффициент самодиффузии растворенного вещества $K$ в чистом растворителе $i$, $X_{K}^{i}$ мольная доля растворителя $i$ в бинарном растворителе. Величина коэффициента самодиффузии в тетрахлорметане, $D_{K}^{{{\text{CC}}{{{\text{l}}}_{{\text{4}}}}}}$, была получена путем минимизации функции(2)
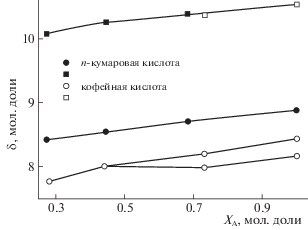
${{\Delta }_{D}} = {{[\sum {{{{(D_{K}^{{{\text{э к с п }}}} - D_{K}^{{{\text{р а с ч }}}})}}^{2}}{\text{/}}(m - n)} ]}^{{1/2}}},$Кофейная и п-кумаровая кислоты, имеющие в структуре молекулы карбоксильную и гидроксильные группы, способны образовывать гетероассоциаты с растворителем через атом кислорода в молекуле ацетона. Меньшее значение коэффициента самодиффузии кофейной кислоты может быть связано как с ее большими характеристическими размерами, так и большей склонностью к молекулярной ассоциации за счет дополнительной OH группы в бензольном кольце. На изменение степени молекулярной ассоциации кислот указывает изменение химических сдвигов протонов в молекулах растворенных веществ при увеличении концентрации ацетона-d6. Как видно из рис. 2 изменение степени молекулярной ассоциации и величина химического сдвига одинаковые для карбоксильной группы. Для протонов OH групп в бензольном кольце наблюдается разная зависимость и разная величина химических сдвигов, определяемая дополнительной OH группой в структуре молекулы кофейной кислоты. При концентрации ацетона-d6 больше 0.7 мольной доли наблюдаются отдельные сигналы протонов от двух гидроксильных групп в молекуле кофейной кислоты. Это может быть связано с наличием внутримолекулярной водородной связи между гидроксильными группами [6].
Рис. 2.
Концентрационные зависимости химических сдвигов протонов гидроксильной ($\bigcirc $и  ) и карбоксильной групп ($\square $ и $\blacksquare $) в молекулах исследуемых кислот при температуре 298 K (${{x}_{{\text{A}}}}$ – мольная доля ацетона-d6).
) и карбоксильной групп ($\square $ и $\blacksquare $) в молекулах исследуемых кислот при температуре 298 K (${{x}_{{\text{A}}}}$ – мольная доля ацетона-d6).
При наличии молекулярной ассоциации, во всех экспериментах наблюдался единственный коэффициент самодиффузии кислот, что в полидисперсных системах соответствует случаю быстрого обмена [10]. В данных условиях наблюдаемый коэффициент самодиффузии кислот (К) может быть представлен как среднее по коэффициентам самодиффузии их ассоциатов (самоассоциатов и гетероассоциатов с ацетоном-d6) различного вида [10, 11, 14, 15]:
где $x_{{{{K}_{i}}{{S}_{j}}}}^{K}$ – доля мономеров компонента $K$ в ассоциате ${{K}_{i}}{{S}_{j}}$, ${{D}_{{{{K}_{i}}{{S}_{j}}}}}$ – коэффициент самодиффузии ассоциата ${{K}_{i}}{{S}_{j}}$.Согласно уравнению Стокса–Эйнштейна (4), коэффициент диффузии частицы в жидкости равен:
где ${{k}_{{\text{B}}}}$ – постоянная Больцмана, $T$ – абсолютная температура, $R$ – гидродинамический радиус частицы, $\eta $ – вязкость растворителя. Если уравнение Стокса–Эйнштейна справедливо для диффузии ассоциата, тогда уравнение (3) можно переписать в виде:(5)
${{D}_{K}} = \frac{{{{k}_{{\text{B}}}}T}}{{6\pi \eta }}\sum {x_{{{{K}_{i}}{{S}_{j}}}}^{K}\frac{1}{{{{\sigma }_{{{{K}_{i}}{{S}_{j}}}}}}}} ,$В отсутствии данных по вязкости можно оценить относительную степень молекулярной ассоциации, если уравнение Стокса–Эйнштейна записать как [18]:
Относительные коэффициенты самодиффузии кислот линейно (${{{{D}_{{KK}}}} \mathord{\left/ {\vphantom {{{{D}_{{KK}}}} {{{D}_{{п - KK}}}}}} \right. \kern-0em} {{{D}_{{п - KK}}}}}$ = ${{{{\sigma }_{{п - KK}}}} \mathord{\left/ {\vphantom {{{{\sigma }_{{п - KK}}}} {{{\sigma }_{{KK}}}}}} \right. \kern-0em} {{{\sigma }_{{KK}}}}}$ = = $a{{x}_{{{\text{Ac}} - {\text{d}}6}}} + b$ c $R$ > 0.9999) увеличиваются с ростом мольной доли ацетона-d6 ($a$ = 0.036, $b$ = 0.874 при 278 K и $a$ = 0.006, $b$ = 0.912 при 298 K). Таким образом, увеличение концентрации ацетона-d6 приводит к более интенсивному росту гидродинамического радиуса п-кумаровой кислоты по сравнению с кофейной кислотой, что наиболее выражено при 278 K. Данное поведение также может быть связано с наличием внутримолекулярной водородной связи в молекуле кофейной кислоты.
Таким образом, согласно полученным данным увеличение концентрации ацетона-d6 приводит к монотонному увеличению коэффициентов самодиффузии исследуемых кислот в смешанном растворителе тетрахлорметан–ацетон-d6. Вместе с тем, наблюдается рост гидродинамического радиуса кислот при переходе от тетрахлорметана к ацетону-d6, что указывает на гетероассоциацию кислота–ацетон-d6. Наличие молекулярной ассоциации подтверждается изменением химических сдвигов протонов карбоксильной и гидроксильной групп в молекулах исследуемых соединений. Увеличение относительного коэффициента самодиффузии (или относительного гидродинамического радиуса) кислот, указывает на более интенсивное изменение степени гетероассоциации п-кумаровой кислоты при увеличении концентрации ацетона-d6.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (№ проекта 16-33-60060-мол_а_дк).
ЯМР-исследования выполнены на оборудовании центра коллективного пользования “Верхневолжский региональный центр физико-химических исследований”.
Список литературы
So-Hee P., Dong-Seok K., Seo-Hyoung P. et al. // Pharmazie. 2008. V. 63. P. 290.
Llorach R., Espín J.C., Tomás-Barberán F.A., Ferreres F. // J. Agric. Food Chem. 2002. V. 50. P. 3458.
Kumar N., Pruthi V. // Biotechnol. Rep. 2014. V. 4. P. 86.
Min J., Meng-Xia X., Dong Z. et al. // J. Mol. Struct. 2004. V. 692. P. 71.
Trabelsi S.K., Tahar N.B., Abdelhedi R. // Electrochimica Acta. 2004. V. 49. P. 1647.
Van Besien E., Marques M.P.M. // J. Mol. Struct.: THEOCHEM. 2003. V. 625. P. 265.
Le Floch F., Tena M.T., Rıos A., Valcarcel M. // Talanta. 1998. V. 46. P. 1123.
Murga R., Sanz M.T., Beltrán S., Cabezas J.L. // J. Supercritical Fluids. 2003. V. 27. P. 239.
Li H., Wu J., Rempel C.B., Thiyam U. // J. Am. Oil Chem. Soc. 2010. V. 87. P. 1081.
Price W.S. NMR Studies of Translational Motion: Principles and Applications. Cambridge University Press, Cambridge, 2009.
Golubev V.A., Kumeev R.S., Gurina D.L. et al. // J. Mol. Liq. 2017. V. 241. P. 922.
Oishi Y., Kamei Y., Sumie H. // J. Chem. Phys. 1974. V. 61. P. 2227.
Vignes A. // Ind. Eng. Chem. Fundam. 1966. V. 5. P. 189.
Golubev V.A., Kumeev R.S., Gurina D.L., Nikiforov M.Yu. // Rus. J. Phys. Chem. A. 2017. V. 91. № 5. P. 901.
Golubev V.A., Gurina D.L., Kumeev R.S. // Rus. J. Phys. Chem. A. 2018. V. 92. № 1. P. 75.
Крестов Г.А., Афанасьев В.Н., Ефремова Л.С. Физико-химические свойства бинарных растворителей. Л.: Химия, 1988. 688 с.
Holz M., Mao X., Seiferling D. // J. Chem. Phys. 1996. V. 104. P. 669.
Macchioni A., Ciancaleoni G., Zuccaccia C., Zuccaccia D. // Chem. Soc. Rev. 2008. V. 37. P. 479.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


