Журнал физической химии, 2019, T. 93, № 3, стр. 373-380
МОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ L-ФЕНИЛАЛАНИНА С УРАЦИЛОМ В ВОДНОМ БУФЕРНОМ РАСТВОРЕ ПРИ 293–323 K
Е. Ю. Тюнина *
Российская академия наук, Институт химии растворов им. Г.А. Крестова
153045 Иваново, Россия
* E-mail: tey@isc-ras.ru
Поступила в редакцию 25.05.2018
Аннотация
Исследованы взаимодействия L-фенилаланина (Phe) с урацилом (Ura) в водном буферном растворе (рН 7.35) методами денсиметрии и дифференциальной сканирующей калориметрии. Получены экспериментальные значения плотности и удельной теплоемкости систем Ura–буфер, Phe–буфер и Phe–Ura–буфер при T = (293.15, 303.15, 313.15 и 323.15) K при концентрациях Ura от 0.0040 до 0.0365 моль кг–1 и при постоянной концентрации Phe, равной 0.0120 моль кг–1. Показано, что взаимодействие Phe с Ura сопровождается образованием комплекса состава 1:2. Выявлено, что парциальные молярные свойства переноса Ura из буфера в буферный раствор Phe имеют положительные значения для объема и отрицательные – для теплоемкости в изученном интервале температур. Полученные результаты обсуждаются на основе использования модели Гэрни.
Возрастающий интерес к исследованию физико-химических свойств N-гетероциклических молекул объясняется, прежде всего, их биологическим и фармацевтическим значением. Основания нуклеиновых кислот и их производные могут использоваться в качестве противоопухолевых, антибактериальных и противовирусных препаратов [1, 2]. Особое значение имеет выявление характера взаимодействия между компонентами нуклеиновых кислот и молекул белков, поскольку эти взаимодействия обеспечивают выполнение ключевых биологических функций в организме, начиная от синтеза белка и восстанавливая ДНК [3–5]. Урацил (Ura) является структурным элементом широкого круга биологически значимых молекул (РНК, пиримидин, птеридин, фолиевая кислота, флавин и др.). Молекулы Ura содержат донорные и акцепторные группы, способные к образованию водородной связи [5, 6]. Молекулы ароматической аминокислоты – фенилаланина (Phe) обладают гидрофобным бензольным кольцом и гидрофильными группами (–NH2, ‒COOH). Специфическое взаимодействие между функциональными группами аминокислот и основаниями нуклеиновых кислот может быть использовано для селективного “узнавания” нуклеиновых кислот с помощью белков [7]. Исследования водных растворов белков, нуклеиновых кислот и их производных в присутствии различных добавок (электролитов, органических растворителей, ПАВ, др.) проводятся различными методами [4–11].
До сих пор недостаточно изучены взаимодействия модельных соединений белков и нуклеиновых оснований в условиях физиологических значений рН среды и при различных температурах. Аминокислотные остатки, входящие в состав белков плазмы крови, могут служить носителями лекарственных средств, образуя с ними комплексы и конъюгаты [2, 12]. Ранее [13] методами калориметрии растворения и УФ-спектроскопии было изучено образование молекулярных комплексов между ароматической аминокислотой Phe и Ura в водном растворе (pH 7.35). Как известно, такие термодинамические свойства, как объем и теплоемкость, чувствительны к структурным изменениям в растворах, происходящих на молекулярном уровне [10, 14]. Задачей настоящего исследования является использование методов денсиметрии и дифференциальной сканирующей калориметрии для идентификации образования и стехиометрии комплекса между Ura и Phe в водном буферном растворе (рН 7.35). Цель работы – обнаружение некоторых особенностей на изотермах и изоконцентратах объемных и теплоемкостных свойств растворов Ura и Phe при изменении концентрации Ura в температурном интервале (293.15–323.15) K, что может свидетельствовать о возможных структурных изменениях, соответствующих процессу комплексообразования в исследуемых системах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали L-фенилаланин (Sigma, CAS 63-91-2) и урацил (Sigma, CAS 66-22-8). Содержание основного вещества составляло 98–99%. Аминокислоту сушили в вакуумном шкафу при 343 K, а Urа – при 410.15 K в течение 48 ч непосредственно перед использованием. Исследования проводили в водных буферных растворах (рН 7.35), содержащих фосфат натрия одноосновный и фосфат натрия двухосновный, что приближает среду к условиям реальных биологических систем. Значения рН растворов фиксировали цифровым рН-метром Mettler Toledo, модель Five-Easy. Все растворы приготовлены весовым методом, используя весы Sartorius-ME215S (с точностью взвешивания 1 × 10–5 г). Концентрацию урацила варьировали в пределах (0.0041–0.0655) моль кг–1 при фиксированной концентрации аминокислоты (0.0120 ± 0.0002 моль кг–1).
Измерения плотности исследуемых растворов выполнены на высокоточном цифровом вибрационном денсиметре (model DMA-5000M, Anton Paar, Австрия) при температурах (293.15, 303.15, 313.15 и 323.15) K. Два встроенных платиновых термометра Pt100 в сочетании с элементами Пельтъе обеспечивали термостатирование образца внутри ячейки с погрешностью 5 × 10–3 K. Перед каждым измерением проводили калибровку по воздуху и бидистиллированной воде при атмосферном давлении. Стандартная погрешность измерения плотности растворов не превышала ±6 × × 10–3 кг м–3.
Для измерения удельной теплоемкости (Cp) растворов использовали дифференциальный сканирующий микрокалориметр SCAL-1 (“Биоприбор”, Пущино, Россия). Интегральная чувствительность детектора калориметра составляет 33.218 нВт/мВ, калибровочная мощность – 25 мкВт, скорость сканирования – 1 K/мин, постоянная времени – 20 с. Прибор, детальное описание которого приведено в [15], был протестирован по теплоемкости водных растворов хлорида натрия, рекомендованного в качестве стандарта для сканирующей калориметрии растворов [16]. Стандартная погрешность измерения удельной теплоемкости растворов находилась в пределах ±7 × 10–3 Дж K–1 г–1.
Полученные экспериментальные данные по плотности (ρ) и удельной теплоемкости (Сp) исследуемых растворов приведены в табл. 1 и 2. Как видно из таблиц, значения ρ уменьшаются с температурой и возрастают с концентрацией Ura, в то время как температурные и концентрационные изменения значений Сp носят противоположный характер.
Таблица 1.
Плотность (ρ) и удельная теплоемкость (Сp) водных буферных растворов урацила при разных концентрациях и температурах
| mUra, моль кг–1 | 293.15 K | 303.15 K | 313.15 K | 323.15 K | mUra, моль кг–1 | 293.15 K | 303.15 K | 313.15 K | 323.15 K |
|---|---|---|---|---|---|---|---|---|---|
| ρa, кг м–3 | Сpб, Дж K–1 г–1 | ||||||||
| 0 | 1027.920 | 1024.870 | 1021.020 | 1017.170 | 0 | 4.0189 | 4.0261 | 4.0349 | 4.0443 |
| 0.0041 | 1028.126 | 1025.066 | 1021.207 | 1017.350 | 0.00405 | 4.0150 | 4.0228 | 4.0318 | 4.0408 |
| 0.0071 | 1028.269 | 1025.205 | 1021.339 | 1017.479 | 0.00711 | 4.0135 | 4.0205 | 4.0281 | 4.0390 |
| 0.0099 | 1028.389 | 1025.314 | 1021.450 | 1017.590 | 0.00985 | 4.0119 | 4.0178 | 4.0249 | 4.0363 |
| 0.0160 | 1028.629 | 1025.550 | 1021.687 | 1017.820 | 0.01631 | 4.0095 | 4.0146 | 4.0214 | 4.0299 |
| 0.0206 | 1028.801 | 1025.721 | 1021.860 | 1017.989 | 0.02068 | 4.0083 | 4.0119 | 4.0182 | 4.0281 |
| 0.0247 | 1028.959 | 1025.874 | 1022.017 | 1018.141 | 0.03123 | 4.0059 | 4.0087 | 4.0114 | 4.0199 |
| 0.0317 | 1029.239 | 1026.128 | 1022.266 | 1018.383 | |||||
Таблица 2.
Плотность (ρ) и удельная теплоемкость (Cp) водных буферных растворов урацила, содержащих L-фенилаланин (mPhe = 0.0120 ± 0.0002 моль кг–1), при разных температурах
| mUra, моль кг–1 | 293.15 K | 303.15 K | 313.15 K | 323.15 K | mUra, моль кг–1 | 293.15 K | 303.15 K | 313.15 K | 323.15 K |
|---|---|---|---|---|---|---|---|---|---|
| ρa, кг м–3 | Сpб, Дж K–1 г–1 | ||||||||
| 0 | 1029.816 | 1026.716 | 1022.855 | 1018.308 | 0 | 4.0132 | 4.0207 | 4.0302 | 4.0404 |
| 0.0041 | 1030.025 | 1026.910 | 1023.033 | 1018.474 | 0.0037 | 4.0015 | 4.0098 | 4.0207 | 4.0328 |
| 0.0070 | 1030.181 | 1027.051 | 1023.161 | 1018.593 | 0.0068 | 4.0004 | 4.00858 | 4.0199 | 4.0320 |
| 0.0099 | 1030.304 | 1027.162 | 1023.264 | 1018.680 | 0.0100 | 3.9997 | 4.0078 | 4.0197 | 4.0319 |
| 0.0160 | 1030.536 | 1027.374 | 1023.466 | 1018.874 | 0.0158 | 3.9989 | 4.0072 | 4.0198 | 4.0321 |
| 0.0206 | 1030.669 | 1027.505 | 1023.600 | 1018.9582 | 0.0179 | 3.9987 | 4.0071 | 4.0198 | 4.0320 |
| 0.0247 | 1030.781 | 1027.618 | 1023.714 | 1019.088 | 0.0201 | 3.9987 | 4.0070 | 4.0199 | 4.0319 |
| 0.0317 | 1031.059 | 1027.891 | 1023.974 | 1019.318 | 0.0247 | 3.9982 | 4.0063 | 4.0194 | 4.0312 |
| 0.0365 | 1031.278 | 1028.098 | 1024.168 | 1019.516 | 0.0317 | 3.9970 | 4.0054 | 4.0178 | 4.0293 |
| 0.0361 | 3.9951 | 4.0047 | 4.0162 | 4.0268 | |||||
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
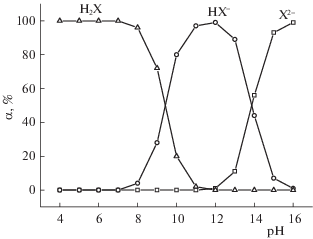
Как известно, в зависимости от рН среды аминокислота и урацил могут находиться в различных ионных состояниях. Ранее показано, что в водных растворах с рН 7.35 Phe существует, прежде всего, как цвиттерион [13]. Урацил представляет собой пиримидиновое основание, способное к таутомерии в виде лактамной или лактимной форм [17]. Установлено, что в нейтральной среде преобладает лактамная форма, которая переходит в моноанион при повышении pH (рН ≥ 9.52) [18, 19]. Для определения долевого распределения разных форм Ura в зависимости от рН среды была использована компьютерная программа RRSU [20], в основу которой заложен модифицированный метод Бринкли. Как видно из полученной нами диаграммы (рис. 1), в условиях выбранной буферной среды (рН 7.35) Ura находится в нейтральной молекулярной форме [21].
Объемные свойства растворов
Кажущийся мольный объем Ura (Vφ, Ura) был вычислен с использованием экспериментальных данных по плотности и уравнения
(1)
${{V}_{{\varphi ,{\text{Ura}}}}} = 1000({{\rho }_{0}}--\rho ){\text{/}}(\rho {{\rho }_{0}}m) + M{\text{/}}\rho ,$Рис. 2.
Концентрационные зависимости кажущихся мольных объемов урацила (φVUra) в водном буферном растворе L-фенилаланина при температурах: 1 – 293.15 K, 2 – 303.15 K, 3 – 313.15 K, 4 – 323.15 K (mPhe = = 0.0120 ± 0.002 моль кг–1).
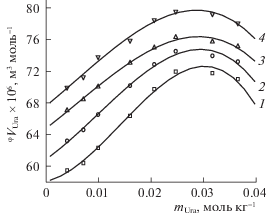
Парциальные мольные объемы при бесконечном разбавлении ($V_{{\varphi ,{\text{Ura}}}}^{0}$) получены путем описания концентрационных зависимостей кажущихся мольных объемов (Vφ, Ura) полиномами второй и третьей степени, соответственно, для бинарной (Ura–буфер) и тройной (Ura–Phe–буфер) систем:
(2)
$^{\varphi }{{V}_{{{\text{Ura}}}}} = {}^{\varphi }V_{{{\text{Ura}}}}^{{\text{0}}} + {{B}_{1}}{{m}_{{{\text{Ura}}}}} + {{B}_{2}}m_{{{\text{Ura}}}}^{{\text{2}}},$(3)
$^{\varphi }{{V}_{{{\text{Ura}}}}} = {}^{\varphi }V_{{{\text{Ura}}}}^{{\text{0}}} + B_{1}^{{\text{'}}}{{m}_{{{\text{Ura}}}}} + B_{2}^{'}m_{{{\text{Ura}}}}^{2} + B_{3}^{'}m_{{{\text{Ura}}}}^{{\text{3}}},$Таблица 3.
Предельные кажущиеся мольные объемы (${}^{\varphi }V_{{{\text{Ura}}}}^{0}$) урацила и значения его производной по температуре (∂φV0/∂T)p в водном буферном растворе и водном буферном растворе с аминокислотой (Phe) при разных температурах
| T, K | Ura–буфер | Ura–Phea–буфер | ||
|---|---|---|---|---|
| ${}^{\varphi }V_{{{\text{Ura}}}}^{0}$ × 106, м3 моль–1 | (∂φV0/∂T)p × 106b, м3 моль–1 K–1 | ${}^{\varphi }V_{{{\text{Ura}}}}^{0}$ × 106, м3 моль–1 | (∂φV0/∂T)p × 106b, м3 моль–1 K–1 | |
| 293.15 | 57.21 ± 0.19 | 0.340 ± 0.090 | 58.08 ± 0.10 | 0.320 ± 0.051 |
| 303.15 | 59.92 ± 0.20 | 0.295 ± 0.121 | 60.87 ± 0.12 | 0.325 ± 0.062 |
| 313.15 | 63.20 ± 0.14 | 0.250 ± 0.136 | 64.77 ± 0.14 | 0.328 ± 0.122 |
| 323.15 | 65.13 ± 0.13 | 0.205 ± 0.160 | 67.62 ± 0.14 | 0.331 ± 0.150 |
Величина парциального мольного объема Ura в водном буферном растворе, содержащем 0.0120 моль кг–1 Phe, больше, чем соответствующие значения ${}^{\varphi }V_{{{\text{Ura}}}}^{{\text{0}}}$ в буфере при каждой температуре. Изменения парциального мольного объема (Δtr$V_{\varphi }^{0}$) при переносе Ura из буфера в буферный раствор Phe вычислены по соотношению:
(4)
$\begin{gathered} {{\Delta }_{{{\text{tr}}}}}V_{\varphi }^{0} = V_{{\varphi ,{\text{Ura}}}}^{0}({\text{Ura}}{\kern 1pt} --{\kern 1pt} {\text{Phe}}{\kern 1pt} --{\kern 1pt} {\text{б у ф е р }}) - \\ - \;V_{{\varphi ,{\text{Ura}}}}^{0}({\text{Ura}}{\kern 1pt} --{\kern 1pt} {\text{б у ф е р }}). \\ \end{gathered} $Величины Δtr$V_{\varphi }^{0}$ чувствительны к сольватационным эффектам и могут быть интерпретированы на основе модели перекрывания гидратных сфер Гэрни [24]. Согласно этой модели, увеличение объема (Δtr$V_{\varphi }^{0}$ > 0) происходит, если взаимодействия обусловлены электростатическими силами, водородными связями и др. Понижение объема (Δtr$V_{\varphi }^{0}$ < 0) имеет место в случае участия во взаимодействии неполярных групп (гидрофобные силы) [22–26]. Между компонентами (Ura и Phe) исследуемой тройной системы возможны следующие взаимодействия: (1) цвиттерион-гидрофильные взаимодействия между зарядными группами ${\text{NH}}_{3}^{ + }$/COO– аминокислоты (АК) и гидрофильными группами (>C=O, >NH) нуклеиновых оснований (НО); (2) гидрофильно-гидрофильные взаимодействия между гидрофильными центрами АК и гидрофильными группами НО; (3) гидрофильно-гидрофобные взаимодействия между цвиттерионами АК и гидрофобными группами НО или между гидрофильными группами НО и неполярными фрагментами АК; (4) гидрофобно-гидрофобные взаимодействия между гидрофобными фрагментами АК и гидрофобными группами НО. Два первых типа взаимодействия дают положительные вклады в Δtr$V_{\varphi }^{0}$, а третий и четвертый типы приводят к отрицательным значениям Δtr$V_{\varphi }^{0}$ [14, 27, 28]. Полученные относительно небольшие положительные изменения объема $\Delta V_{{{\text{tr}}}}^{0}$ (от (0.87 до 2.49) см3 моль–1 при 293.15 и 323.15 K) свидетельствуют о том, что в буферных растворах Ura в присутствии Phe взаимодействия первых двух типов несколько доминируют в условиях существующей конкуренции между различными их типами. Таким образом, можно предположить, что комплексы Phe с молекулами Ura образованы за счет цвиттерион-гидрофильных взаимодействий, гидрофобных сил и образования водородной связи, что согласуется с литературными данными [13, 21, 29].
Температурная зависимость парциальных мольных объемов ${}^{\varphi }V_{{{\text{Ura}}}}^{0}$ в буфере и буферном растворе Phe описывается уравнением:
где α, β и γ – константы, T – температура. Значения (∂φV0/∂T)p и (∂2φV0/∂T2)p были получены путем дифференцирования уравнения (5). В табл. 3 приведены рассчитанные первые производные (∂φV0/∂T)p, положительные значения которых указывают на высвобождение электрострикционно сжатой воды из гидратных сфер Ura и Phe в раствор в процессе их связывания в комплекс, что сопровождается увеличением объема системы. В случае бинарной системы Ura–буфер наблюдается тенденция к понижению (∂φV0/∂T)p с температурой, тогда как для тройной системы Ura–Phe–буфер их значения слабо увеличиваются в изученном интервале температур.Согласно уравнению Хеплера [30]:
(6)
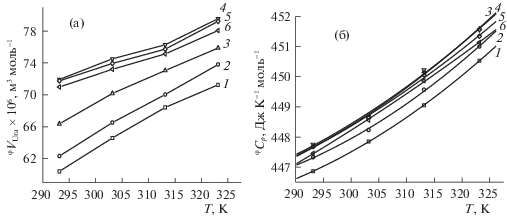
${{(\partial C_{p}^{0}{\text{/}}\partial P)}_{T}} = - T{{({{\partial }^{{2\varphi }}}{{V}^{0}}{\text{/}}\partial {{T}^{2}})}_{p}},$Изоконцентрационные зависимости кажущихся мольных объемов φVUra(T) урацила в буферном растворе аминокислоты от температуры приведены на рис. 3а. Выявлена инверсия последовательности кривых φVUra(T): изоконцентрата при 0.0247m расположена выше других, соответствующих более низким и более высоким концентрациям урацила. Это связано, по-видимому, с усилением взаимодействия Ura с Phe и образованием молекулярного комплекса в этой области концентраций, что сопровождается явлениями дегидратации молекул растворенных веществ, понижением электрострикции молекул воды при вытеснении из гидратных сфер и увеличением объема системы.
Рис. 3.
Температурные зависимости кажущихся мольных параметров урацила в водном буферном растворе Phe (mPhe = 0.0120 ± 0.002 моль⋅кг–1) при разных концентрациях Ura: а – объемов φVUra: 1 – 0.0071 m, 2 – 0.0099 m, 3 – 0.0160 m, 4 – 0.0247 m, 5 – 0.0316 m, 6 – 0.0365 m; б – теплоемкостей ϕCp: 1 – 0.0037 m, 2 – 0.0068 m, 3 – 0.0179 m, 4 – 0.0247 m , 5 – 0.0317 m, 6 – 0.0361 m.
Теплоемкостные свойства растворов
Кажущаяся молярная теплоемкость растворенного вещества (ϕCp) была определена из экспериментальных значений удельной теплоемкости по уравнению:
(7)
$^{\phi }{{C}_{p}} = {{M}_{{{\text{Ura}}}}}{{С }_{p}} + 1000({{С }_{p}}--С _{p}^{0}){\text{/}}{{m}_{{{\text{Ura}}}}},$(8)
$^{\phi }{{C}_{p}}(m) = {}^{\phi }C_{p}^{0} + A_{1}^{{\text{'}}}{{m}_{{{\text{Ura}}}}} + A_{2}^{{\text{'}}}m_{{{\text{Ura}}}}^{2}$Рис. 4.
Концентрационные зависимости кажущихся мольных теплоемкостей урацила (ϕCp) в водном буферном растворе L-фенилаланина при температурах (K): 1 – 293.15 , 2 – 303.15, 3 – 313.15, 4 – 323.15 (mPhe = = 0.0120 ± 0.002 моль кг–1).
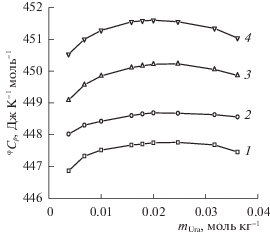
Таблица 4.
Предельные кажущиеся мольные теплоемкости (${}^{\phi }C_{p}^{0}$) урацила и значения его производной по температуре ($\partial {}^{\varphi }C_{p}^{0}$/∂T)p в водном буферном растворе и водном буферном растворе с аминокислотой (Phe) при разных температурах
| T, K | Ura–буфер | Ura–Phea–буфер | ||
|---|---|---|---|---|
| ${}^{\phi }C_{p}^{0}$, Дж K–1 моль–1 | ($\partial {}^{\varphi }C_{p}^{0}$/∂T)p, Дж K–2моль–1 | ${}^{\phi }C_{p}^{0}$, Дж K–1 моль–1 | ($\partial {}^{\phi }C_{p}^{0}$/∂T)p, Дж K–2 моль–1 | |
| 293.15 | 449.17 ± 0.03 | 0.0731 ± 0.006 | 446.62 ± 0.09 | 0.0813 ± 0.005 |
| 303.15 | 450.12 ± 0.11 | 0.0973 ± 0.005 | 447.64 ± 0.08 | 0.1055 ± 0.008 |
| 313.15 | 450.96 ± 0.13 | 0.1215 ± 0.016 | 448.65 ± 0.09 | 0.1297 ± 0.010 |
| 323.15 | 452.46 ± 0.10 | 0.1457 ± 0.016 | 450.16 ± 0.07 | 0.1539 ± 0.015 |
Обычно возрастание значений кажущейся молярной теплоемкости растворенного вещества отражает увеличение степеней свободы и интенсивности молекулярных движений, что ведет к разрушению структуры раствора, а их уменьшение свидетельствует об образовании более упорядоченных структур, если отсутствует воздействие других факторов, и прежде всего дегидратации молекул растворенных веществ [32]. По-видимому, в случае растворения Ura в водном буферном растворе, содержащем аминокислоту, можно говорить о преобладающем вкладе эффекта дегидратации молекул Ura и Phe при образовании молекулярного комплекса в общую теплоемкость раствора.
При изучении межмолекулярных взаимодействий в буферных растворах, содержащих два растворенных вещества (Ura и Phe), полезно рассмотреть изменение парциальной мольной теплоемкости (${{\Delta }_{{{\text{tr}}}}}C_{p}^{0}$) при переносе Ura из буфера в буферные растворы с аминокислотой:
(9)
$\begin{gathered} {{\Delta }_{{{\text{tr}}}}}C_{p}^{0} = {}^{\phi }C_{p}^{0}({\text{Ura}}{\kern 1pt} --{\kern 1pt} {\text{Phe}}{\kern 1pt} --{\kern 1pt} {\text{б у ф е р }}) - \\ - \;{}^{\phi }C_{p}^{0}({\text{Ura}}{\kern 1pt} --{\kern 1pt} {\text{б у ф е р }}). \\ \end{gathered} $Полученные отрицательные значения ${{\Delta }_{{{\text{tr}}}}}C_{p}^{0}$ (от ‒2.55 до –2.30 Дж K–1 г–1 в интервале от 293.15 до 323.15 K) обычно указывают на то, что в присутствии Ura водные буферные системы Phe более структурированы, чем буферный растворитель [14, 23, 28, 32, 33]. Структурные изменения, происходящие в растворе в процессе связывания Ura с Phe, можно объяснить на основе использования модели Гэрни о перекрывании ко-сфер молекул растворенных веществ, как это было показано выше при интерпретации объемных свойств [24, 34, 35]. Образование молекулярного комплекса между Ura и Phe приводит к потере некоторых степеней свободы, что дает отрицательный вклад в ${{\Delta }_{{{\text{tr}}}}}C_{p}^{0}$, при этом имеет место дегидратация молекул растворенных веществ, что вносит положительный вклад в ${{\Delta }_{{{\text{tr}}}}}C_{p}^{0}$ [34, 35]. В величине ${{\Delta }_{{{\text{tr}}}}}C_{p}^{0}$ также находит отражение положительный вклад, обусловленный гидрофильно-гидрофильными взаимодействиями цвиттерионных центров (COO–/${\text{NH}}_{3}^{ + }$) Phe с полярными группами Ura (>C=O, >NH) через перекрывание их гидратных сфер, а также отрицательный вклад, связанный с гидрофобно-гидрофильными и гидрофобно-гидрофобными силами, действующими между аполярными фрагментами молекул растворенных веществ [31, 36]. Гидратация Ura и Phe, а также их комплекса обеспечивает дополнительный источник отрицательного изменения теплоемкости [37]. Таким образом, относительно небольшие отрицательные значения ${{\Delta }_{{{\text{tr}}}}}C_{p}^{0}$ могут быть объяснены конкуренцией гидрофобно/гидрофильно-цвиттерионных взаимодействий при более низкой концентрации Ura и доминированием гидрофильно-цвиттерионных взаимодействий и образования водородных связей при более высокой его концентрации. Как и в случае $\Delta V_{{{\text{tr}}}}^{0}$, значения ${{\Delta }_{{{\text{tr}}}}}C_{p}^{0}$ проявляют тенденцию к возрастанию с повышением температуры.
Установлено, что температурные зависимости предельной кажущейся мольной теплоемкости (${}^{\phi }C_{p}^{0}$) описываются полиномом второй степени как для бинарной (Ura–буфер), так и тройной (Ura–Phe–буфер) систем (коэффициент корреляции R = 0.997):
где Т – температура (K), T = 273.15 K – температура сравнения, a, b1 и b2 – константы. Значения полученных первых производных ($\partial {}^{\phi }C_{p}^{0}$/∂T)p приведены в табл. 4.На рис. 3б представлены изоконцентраты, т.е. температурные зависимости кажущихся мольных теплоемкостей ϕCp(T) урацила в буферном растворе аминокислоты при разных концентрациях урацила. Порядок расположения изоконцентрат ϕCp(T) по мере увеличения m нарушается: изоконцентраты для 0.0317 m и 0.0361 m лежат ниже, чем таковая для 0.0247 m. По-видимому, это объясняется образованием комплекса Ura с Phe в области 0.0247 m и, соответственно, потерей степеней свободы. Однако при этом эффекты от разрушающего действия молекул растворенных веществ на растворитель и от их дегидратации в процессе связывания столь велики, что появление новых степеней свободы превалирует над их потерей при указанном выше процессе как результат конкуренции взаимодействий растворенное вещество–растворенное вещество, растворенное вещество–растворитель и растворитель–растворитель.
Таким образом методами денсиметрии и ДСК определены плотности и удельные теплоемкости буферных растворов, содержащих Ura и Phe в интервале концентраций 0.0040–0.0365 m Ura при температурах от 293 до 323 K. Вычислены кажущиеся и парциальные молярные свойства (φVUra, ϕCp) урацила, а также предельные кажущиеся молярные свойства его переноса из буфера в буферный раствор с Phe. Полученные данные позволили обнаружить структурные изменения в водных буферных растворах Ura с Phe, соответствующие образованию между ними молекулярного комплекса. Показано, что функции φVUra = f(mUra) и ϕCp = f(mUra) имеют максимумы в той области концентраций урацила, которая соответствует молярному соотношению Phe к Ura как ∼1:2. При этом не обнаружено явно выраженной зависимости стехиометрии комплекса от температуры.
Определены параметры (${{\partial }^{\phi }}C_{p}^{0}$/∂T)p, (∂φV0/∂T)p и (∂2φV0/∂T2)p для Ura в буфере и водном буферном растворе аминокислоты. Полученные результаты показывают, что Ura способствует укреплению структуры водного буферного раствора, содержащего аминокислоту, вследствие образования комплекса.
Наблюдаемые небольшие положительные ($\Delta V_{{{\text{tr}}}}^{0}$) и отрицательные (${{\Delta }_{{{\text{tr}}}}}C_{p}^{0}$) значения свойств переноса Ura из буфера в буферный раствор с Phe при всех изученных температурах являются результатом компенсации отрицательных и положительных вкладов в их величину, соответственно, от гидрофобных взаимодействий аполярных фрагментов молекул Ura с Phe и от цвиттерионных взаимодействий Phe с полярными группами Ura и образования водородных связей.
Измерения плотности и удельной теплоемкости выполнены на оборудовании центра коллективного пользования “Верхневолжский региональный центр физико-химических исследований” ИХР РАН (http://www.isc-ras.ru/ru/struktura/ckp).
Работа посвящена памяти старшего научного сотрудника ИХР РАН, кандидата химических наук Манина Николая Геннадьевича, чьи научные интересы находились в области термодинамики растворов, за его вклад в получение и обсуждение данных по теплоемкости исследуемых систем.
Список литературы
Wettergren Y., Carlsson G., Odin E., Gustavsson B. // Cancer. 2012. V. 6. P. 2935.
Bakkialakshmi S., Chandrakala D. // Spectrochim. Acta. Part A. 2012. V. 88. P. 2.
Nain A.K., Pal R., Neetu. // J. Chem. Thermodynamics. 2014. V. 68. P. 169.
Hunter K.C., Millen A.L., Wetmore S.D. // J. Phys. Chem. B. 2007. V. 111. P. 1858.
Cheng A.C., Frankel A.D. // J. Am. Chem. Soc. 2004. V. 126. P. 434.
Ribeiro R.F., Marenich A.V., Cramer Ch.J., Truhlar D.G. // Phys. Chem. Chem. Phys. 2011. V. 13. P. 10908.
Jones S., Daley D.T.A., Luscombe N.M., Berman H.M., Thornton J.M. // Nucleic Acids Rec. 2001. V. 29. P. 943.
Boeckx B., Maes G. // J. Phys. Chem. B. 2012. V. 116. P. 11890.
Banipal T.S., Kaur N., Banipal P.K. // J. Chem. Thermodynamics. 2016. V. 95. P. 149.
Bhat R., Ahluwalia J.C. // J. Phys. Chem. 1985. V. 89. P. 1099.
Smirnov V.I., Badelin V.G. // J. Mol. Liq. 2017. V. 229. P. 198.
Khalil M.M., Fazary A.E. // Monatshefte für Chemie. 2004. V. 135. P. 1455.
Tyunina E.Yu., Badelin V.G., Mezhevoi I.N., Tarasova G.N. // J. Mol. Liq. 2015. V. 211. P. 494.
Terekhova I.V., De Lisi R., Lazzara G., Milioto S., Muratore N. // J. Therm. Anal. Cal. 2008. V. 92. P. 285.
Tyunina E.Yu., Badelin V.G., Mezhevoi I.N. // J. Solution Chem. 2017. V. 46. P. 249
Clarke E.C.W., Glew D.N. // J. Phys. Chem. Ref. Data. 1985. V. 14. P. 490.
Тюкавкина Н.А., Бауков Ю.И., Зурабян С.Э. Биоорганическая химия. М.: Просвещение, 2010. 416 с.
Balodis E., Madekufamba M., Trevani L.N., Tremaine P.R. // Geochim. Cosmochim. Acta. 2012. V. 93. P. 182.
DeMember J.R., Wallace F.A. // J. Am. Chem. Soc. 1975. V. 97. P. 6240.
Васильев В.П., Бородин В.А., Козловский Е.В. Применение ЭВМ в химико-аналитических расчетах. М.: Высшая школа, 1993. 112 с.
Badeline V.G., Tyunina E.Yu., Mezhevoi I.N., Tarasova G.N. // Russ. J. Phys. Chem. A. 2015. V. 89. P. 2229.
Zielenkiewicz W., Pietraszkiewicz O., Wszelaka-Rylic M. et al. // J. Solution Chem. 1998. V. 27. P. 121.
Terekhova I.V., Kulikov O.V. // Mendeleev Comm. 2002. V. 3. P. 1.
Gurney R.W. Ionic processes in solution. New York: McGraw Hill, 1953.
Franks F. Water: A comprehensive treatise, vol. 3. New York: Plenum Press, 1973.
Lepori L., Gianni P. // J. Solution Chem. 2000. V. 29. P. 405.
Tyunina E.Yu., Badelin V.G. // J. Solution Chem. 2016. V. 45. P. 475.
Bhuiyan M.M.H., Hakin A.W., Liu J.L. // J. Solution Chem. 2010. V. 39. P. 877.
Tyunina E.Yu., Badelin V.G., Tarasova G.N. // Russ. J. Phys. Chem. A. 2015. V. 89. P. 1595.
Hepler L.G. // Can. J. Chem. 1969. V. 47. P. 4613.
Васильев В.П. Термодинамические свойства растворов электролитов. М.: Высш. школа, 1982.
Латышева В.А. // Успехи химии. 1973. Т. 42. С. 1757.
Madan B., Sharp K.A. // J. Phys. Chem. B. 2001. V. 105. P. 2256.
Banipal P.K., Banipal T.S., Ahluwalia J.C., Lark B.S. // J. Chem. Thermodynamics. 2002. V. 34. P. 1825.
Jasra R.V., Ahluwalia J.C. // J. Solution Chem. 1982. V. 11. P. 325.
Lark B.S., Patyar P., Banipal T.S., Kishore N. // J. Chem. Eng. Data. 2004. V. 49. P. 553.
Madan B., Sharp K.A. // Biophys. J. 2001. V. 81. P. 1881.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии