Журнал физической химии, 2019, T. 93, № 4, стр. 539-542
Влияние полярности среды на кинетику радикально-цепного окисления кумола в присутствии аскорбиновой кислоты
И. В. Ефимова a, *, О. В. Смирнова a, И. А. Опейда a
a Национальная академия наук Украины, Институт физико-органической химии и углехимии им. Л.М. Литвиненко
02160 Киев, Украина
* E-mail: anjuta.efimova@gmail.com
Поступила в редакцию 22.07.2018
Аннотация
Изучено ингибирование аскорбиновой кислотой процесса инициированного окисления кумола кислородом в гомофазных условиях, где в качестве растворителя использованы ацетонитрил и диметилсульфоксид. Кинетика процесса окисления исследована газоволюмометрическим методом при постоянной температуре 348 K и парциальном давлении кислорода 760 мм рт. ст. При исследовании процесса радикально-цепного окисления модельных систем при варьировании концентрации ингибитора показано, что замена растворителя заметно повлияла на величину периода индукции. Не выявлено существенного влияния среды на скорость процесса окисления после выхода из него. Получены концентрационные зависимости кинетических параметров ингибированного аскорбиновой кислотой окисления кумола в разных средах.
Радикально-цепное окисление органических веществ кислородом в жидкой фазе широко распространено в природе и имеет большое значение в химической промышленности. В то же время процессы жидкофазного окисления нежелательны по причине ухудшения свойств органических материалов при хранении и эксплуатации. В этом случае возникает задача предотвращения процессов окисления, решение которой сводится к введению антиоксидантов в состав органического материала. Кроме того, протекание многих процессов жизнедеятельности биологических объектов являются свободнорадикальным окислением, параллельно с которым вырабатываются обладающие антиоксидантным действием вещества.
Среди природных антиоксидантов наиболее активна аскорбиновая кислота (АК), способная обратимо окисляться в дегидроаскорбиновую кислоту (ДАК). Вместе они представляют эффективную, обладающую высокой витаминной активностью окислительно-восстановительную систему [1–3]. Доказано участие аскорбиновой кислоты во многих процессах, протекающих в биологических объектах (водный обмен, регуляция ферментативной активности, стимуляция реакций метаболизма) [4].
Возросший интерес к АК как к лекарственному препарату обусловлен противовирусным, антибактериальным и противоопухолевым действием аскорбиновой кислоты и ее производных [5, 6]. Но введение любых заместителей в структуру АК лишает ее уникальной способности обратимо окисляться до дегидроаскорбиновой кислоты [7, 8]. Обнаружение антиканцерогенного действия АК стало причиной показания ее приема онкологическими больными в дозах, более высоких, нежели физиологические [9]. Однако не доказана полная безопасность использования аскорбиновой кислоты в виде гипердоз (выше физиологических доз в 3–10 раз) и мегадоз (выше физиологических более чем в 10–100 раз). Более того, было обнаружено негативное действие сверх таких доз АК в терапии рака [10]. Подобное противоречие является следствием того, что природа процессов, протекающих в биообъектах, и полный механизм действия АК в них изучены не в полном объеме.
Поэтому для оценки роли АК необходимо одновременное исследование всей редокс-системы аскорбиновой кислоты, включающей ее ионные и дегидроформы, что может быть обеспечено варьированием растворителя.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В данной работе изучали инициированное азодиизобутиронитрилом (АИБН) жидкофазное окисление кумола (ИПБ), для которого механизм и все элементарные стадии хорошо изучены [11]. В качестве реакционной среды использовали ацетонитрил (АН) и диметилсульфоксид (ДМСО), в которых хорошо растворяются все компоненты изучаемой системы и тем самым обеспечивается возможность изучения процесса в гомофазных условиях.
В исследуемой системе использовали хорошо изученный инициатор окисления – АИБН. Скорость инициирования Wi при 348 K составляет 1.811 × 10–6 моль/(л с). Для приготовления модельной системы в реактор брали навески АИБН, АК, добавляли 1 мл ИПБ и 1 мл растворителя. Инициированное АИБН окисление ИПБ изучали при варьировании концентрации АК. Исследования проводили в гомогенных условиях в кинетической области, где скорость реакции перестает зависеть от скорости перемешивания. За кинетикой процесса окисления следили газоволюмометрически, измеряя количество поглощенного кислорода при постоянном парциальном давлении кислорода 760 мм рт. ст. и температуре 348 K на установке, описанной в [12]. Установка позволяет измерять скорость поглощения кислорода от ≥10–8 моль/(л с). Ошибка эксперимента составляет 5–7%.
Результаты кинетических исследований обрабатывали следующим образом. Из полученных кинетических кривых в координатах V(O2) = f(t) величину периода индукции определяли графически, путем экстраполирования прямолинейных участков на кинетической кривой до их пересечения, затем из точки пересечения опускали перпендикуляр на ось абсцисс и определяли значение периода индукции как отрезок, отсекаемый на оси времени. Скорость поглощения кислорода исследуемой системой определяли по тангенсу угла наклона кинетической кривой.
В работе использовали ИПБ, АН, ДМСО, очищенные согласно методике [13], и АК (ФС-42-2668-89). Определяли показатели качества АК: удельное вращение составило + 20.9 ± 0.4.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для установления механизма антиоксидантного действия АК была поставлена задача выяснить способность АК выполнять функции ингибитора в органической апротонной среде в процессах радикально-цепного окисления модельных субстратов и определить кинетические закономерности этих процессов. С этой целью изучали окисление ИПБ, инициированное АИБН в присутствии АК в разных растворителях. На полученных кинетических кривых, характеризующих процесс инициированного АИБН окисления ИПБ кислородом в присутствии АК в среде АН (рис. 1а) и ДМСО (рис. 1б), наблюдается ингибирующий эффект, величина периода индукции увеличивается с ростом концентрации АК в реакционных смесях. Замена растворителя приводит к значительному изменению величины периода индукции и практически не влияет на скорость реакции после выхода из него.
Рис. 1.
Кинетические кривые поглощения кислорода при окислении кумола в среде АН (а) и ДМСО (б) в присутствии различных концентраций аскорбиновой кислоты: 1 – 0, 2 – 1.00 × 10–3, 3 – 4.00 × 10–3, 4 – 5.00 × 10–3, 5 – 9.00 × 10–3 моль/л; [АИБН] = 2.00 × 10–2 моль/л, [ИПБ] = 3.59 моль/л, 348 K.
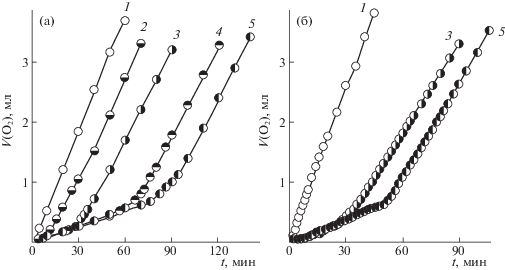
При исследовании процесса радикально-цепного окисления модельных систем АИБН–ИПБ–АН–АК и АИБН–ИПБ–ДМСО–АК при варьировании концентрации ингибитора не выявлено существенного влияния среды на скорость процесса окисления после выхода из периода индукции. Тем не менее, замена растворителя заметно повлияла на величину периода индукции (табл. 1). Увеличение концентрации АК в системе АИБН–ИПБ–ДМСО–АК приводит к росту периода индукции, но не к столь существенному, как в случае системы АИБН–ИПБ–АН–АК. Причиной такого различия характеристик данных систем стали значения полярностей обоих растворителей.
Таблица 1.
Величины периода индукции (τ) и скорости поглощения кислорода (W[O]) после выхода из него в зависимости от концентрации аскорбиновой кислоты ([АК]) при окислении кумола в разных средах
| [АК] × 103, моль/л | τ, мин | W[O] × 106, моль/(л с) | ||
|---|---|---|---|---|
| АН | ДМСО | АН | ДМСО | |
| 0 | – | – | 2.21 ± 0.10 | 2.76 ± 0.12 |
| 1.00 | 10 | 8 | 2.02 ± 0.09 | 2.09 ± 0.10 |
| 4.00 | 46 | 33 | 1.53 ± 0.06 | 1.99 ± 0.08 |
| 6.00 | 60 | 37 | 2.00 ± 0.09 | 2.00 ± 0.09 |
| 9.00 | 82 | 53 | 1.77 ± 0.07 | 1.79 ± 0.07 |
| 18.00 | – | – | 1.97 ± 0.08 | 2.03 ± 0.09 |
Как следует из табл. 2, увеличение периода индукции связано со снижением полярности среды в результате замены более полярного растворителя ДМСО на менее полярный АН. Таким образом, антиоксидантная активность АК в процессах радикально-цепного окисления зависит от полярности среды. Данный факт может служить подтверждением участия всей редокс-системы в процессах ингибирования. Варьируя среду, можно изменять равновесие в паре АК–ДАК для создания ингибирующих систем целенаправленного действия.
Таблица 2.
Величины периода индукции (τ), скорости поглощения кислорода (W[O]) после выхода из него и диэлектрической постоянной среды (ξ) для разных растворителей в процессе окисления кумола в присутствии аскорбиновой кислоты
| Растворитель | ξ | τ, мин | W[O] × 106, моль/(л с) |
|---|---|---|---|
| АН | 38 | 46 | 1.53 ± 0.06 |
| ДМСО | 45 | 33 | 1.99 ± 0.08 |
Зависимость величины периода индукции от концентрации АК в исследуемых системах АИБН–ИПБ–ДМСО–АК и АИБН–ИПБ–АН–АК представляет собой кривую с насыщением (рис. 2). Экспериментально установлено, что растворимость АК в АН составляет 0.01 моль/л. При использовании ДМСО в качестве растворителя показано, что АК растворима полностью во всем рабочем диапазоне концентраций (0.001–0.1 моль/л). Подобный характер зависимости периода индукции от концентрации АК в системе АИБН–ИПБ–АН–АК может быть вызван предельным значением растворимости АК в ней. Зависимость периода индукции от концентрации АК в системе АИБН–ИПБ–ДМСО–АК тоже представляет собой кривую с насыщением, которое наступает при концентрации АК 0.01 моль/л. При дальнейшем увеличении концентрации АК в системе с ДМСО период индукции не увеличивается, что предполагает расходование АК не только в качестве ингибитора, но и по другому параллельно протекающему процессу.
Рис. 2.
Зависимости периода индукции (τ) от концентрации аскорбиновой кислоты ([АК]) в процессе окисления кумола в апротонных средах: 1 – АН, 2 – ДМСО; [АИБН] = 2.00 × 10–2 моль/л, [ИПБ] = = 3.59 моль/л, 348 K.
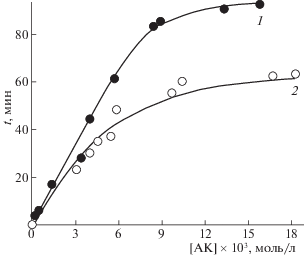
Прямолинейный участок зависимости периода индукции от концентрации АК в диапазоне 0.001–0.01 моль/л (рис. 2) хорошо описывается уравнениями:
для АН
для ДМСО
Зная величину периода индукции, можно рассчитать стехиометрический коэффициент ингибирования f по формуле:
где [InH]0 – начальная концентрация ингибитора, моль/л; Wi – скорость инициирования, 1.811 × × 10–6 моль/(л с); τ – экспериментально определяемая величина периода индукции, с. Зависимость коэффициента ингибирования f от концентрации АК носит линейный характер (рис. 3) и хорошо описывается уравнениями:Рис. 3.
Зависимости значений стехиометрического коэффициента ингибирования (f) от концентрации аскорбиновой кислоты ([АК]) в процессе окисления кумола в апротонных средах: 1 – АН, 2 – ДМСО; [АИБН] = 2.00 × 10–2 моль/л, [ИПБ] = 3.59 моль/л, 348 K.
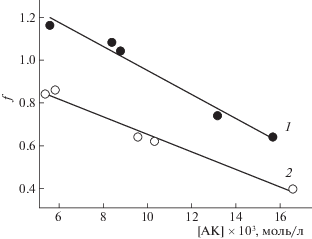
для АН
для ДМСО
Таким образом, изучено действие аскорбиновой кислоты в процессах радикально-цепного окисления кумола в гомофазных условиях в среде полярных апротонных растворителей ацетонитрила и диметилсульфоксида. Показано, что присутствием аскорбиновой кислоты обусловлено наличие индукционного эффекта в процессах инициированного окисления кумола. Величина периода индукции растет с ростом концентрации аскорбиновой кислоты в реакционной смеси. Кроме того, показано, что с увеличением полярности растворителя наблюдается уменьшение периода индукции при постоянной концентрации ингибитора. Установлена зависимость периода индукции от концентрации аскорбиновой кислоты в исследуемых системах. Получены концентрационные зависимости кинетических параметров ингибированного аскорбиновой кислотой окисления кумола в разных апротонных средах.
Список литературы
Sen C.K., Packer L., Hanninen O.O.P. Handbook of Oxidants and Antioxidants in Exercise. Elsevier Science B.V., 2000. 1207 p.
Uluata S., McClements D.J., Decker E.A. // J. Agric. Food Chem. 2015. V. 63. P. 1819.
Jayasinghe C., Gotoh N., Wada S. // Food Chem. 2013. V. 141. P. 3077.
Toth I., Roger J.T., McPhee J.A. et al. // J. Biol. Chem. 1995. V. 270. P. 2846.
Plummer M., Vivas J., Lopez G. et al. // J. Natl. Cancer. Inst. 2007. V. 99. P. 101.
Kikas T., Ishida H., Janata J. // Anal. Chem. 2002. V. 74. P. 3605.
Yamamoto I., Tai A., Fujinami Y., Sasaki K., Okazaki S. // J. Med. Chem. 2002. V. 45. P. 462.
Nielsen J.H., Kristiansen G.H., Andersen H.J. // J. Agric. Food Chem. 2000. V. 48. P. 1564.
Fenoglio I., Martra G., Coluccia S., Fubini B. / Chem. Res. Toxicol. 2000. V. 13. P. 971.
Patil B.S., Jayaprakasha G.K., Murthy K.N.C., Vikram A. // J. Agric. Food. Chem. 2009. V. 57. P. 8142.
Денисов Е.Т. Кинетика гомогенных химических реакций. М.: Высшая школа, 1988. 390 с.
Эмануэль Н.М., Заиков Г.Е., Майзус З.К. Роль среды в радикально-цепных реакциях окисления органических соединений. М.: Наука, 1973. 297 с.
Armarego W.L.F., Chai Ch.L.L. Purification of Laboratory Chemicals. Elsevier Science, 2003. 608 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


